胶质母细胞瘤(glioblastoma,GBM)患者5年生存率低于10%[1]。几乎所有的GBM患者在接受标准的手术切除、放疗和替莫唑胺化疗后均出现复发[2],复发胶质母细胞瘤(recurrent glioblastoma,rGBM) 对药物敏感性降低,预后更差。GBM的肿瘤大小被证实和预后相关[3]。然而,GBM的增强模式与其高度异质性的血管结构相关,肿瘤对血脑屏障的破坏程度不同,导致肿瘤强化不均匀,尤其是接受抗血管生成治疗的患者,血脑屏障完整性的改善降低了肿瘤强化程度,而与肿瘤负荷的变化无关,使肿瘤边界的界定更为困难[4]。
T1加权成像(T1-weighted imaging,T1WI)增强减影技术可高效获得注入对比剂前后的图像差异部分信息。在不同治疗模式下,T1WI减影图均可提高显示肿瘤负荷的能力,识别确切的肿瘤边界,一定程度上解决了肿瘤分割的困难[5-6]。改良版神经肿瘤反应评估(modified response assessment in Neuro-Oncology, mRANO)的标准之一为评估肿瘤增强体积大小的变化,也建议使用T1增强减影技术更好地识别肿瘤边界[7]。T1WI增强减影明显提升了肿瘤反应评估效能[8-9]。基于增强减影获得的基线肿瘤体积被证明是rGBM中OS的预后预测因素[10-11],但既往研究只探索了包括坏死部分的肿瘤总体积,而本研究增加了rGBM的单纯肿瘤强化体积等指标。另外,由于rGBM周围还存在广泛的血管源性水肿,本研究还纳入了肿瘤相对非增强体积比值(relative nonenhancing tumor ratio,rNTR)作为客观评价指标评估肿瘤周围水肿,旨在更全面比较基于增强减影技术测量的各指标对rGBM患者预后的评估效能。
1 资料与方法 1.1 研究对象回顾性分析2012年7月至2022年12月在陆军特色医学中心诊治的复发胶质母细胞瘤患者。纳入标准:①年龄≥18岁;②初诊手术病理证实为胶质母细胞瘤,IDH野生型(根据2021年第五版WHO中枢神经系统肿瘤分类);③根据二次手术病理证实或mRANO标准(即至少2次连续随访MR扫描间隔≥4周的总增强体积较之前≥40%)判定为复发[8];④经过GBM标准一线治疗:最大范围手术安全切除肿瘤及术后同步放化疗;⑤在二线治疗前有完整的常规序列MRI。排除标准:图像质量不佳,有伪影导致图像无法分析。最终纳入85例,男性43例,女性42例,年龄20~83(52.81±13.39)岁。本研究经陆军特色医学中心伦理委员会批准[医研伦理(2023)第158号]。
1.2 检查方法采用德国Siemens Verio 3.0T超导性磁共振成像仪行常规T1WI、T2加权成像(T2-weighted imaging,T2WI)、液体衰减反转恢复序列(fluid attenuated inversion recovery,FLAIR)及T1增强(T1WI contrasted-enhanced,T1CE) 扫描。
T1WI序列:脉冲重复时间(repetiton time,TR)=268 ms,回波时间(time of echo,TE)=2.67 ms,矩阵320×320,层厚=3 mm,视野(field of view,FOV)=230 mm×230 mm;T2WI序列:TR=3 800 ms,TE=96 ms, 矩阵320×320,层厚=3 mm,FOV=240 mm×240 mm;FLAIR序列:TR=6 500 ms, TE=102 ms,矩阵256×256,层厚=3 mm,FOV=240 mm×240 mm,反转时间2 130 ms;T1CE序列:扫描参数同T1WI一致,使用高压注射器经肘静脉团注对比剂(钆喷酸葡胺,北京北陆药业),剂量0.2 mL/kg,速率为3 mL/s。
1.3 随访及指标定义随访截止时间为2023年6月,采用电话随访结合病历系统所记录的复诊资料。随访的内容为患者的基本信息、术后病理结果、初诊时和复发后二线治疗前最后一次MR图像以及术后首次MR图像,患者复发后的治疗方式以及患者的生存时间。切除程度由首次术后72 h内的MR图像确定为完全切除/次全切除。总生存时间(overall survival,OS)定义为初诊确诊为肿瘤到患者死亡或失访时间,复发后生存期(post-recurrence survival,PRS)定义为确认复发后二线治疗前最后一次MR检查到患者死亡或失访时间。复发后的治疗方式:二次手术、放化疗和靶向治疗。二线治疗方式记录为等级资料,0为未继续治疗,1为采用1种治疗方式,2为采用2种治疗方式,3为采用3种治疗方式。
1.4 T1WI增强减影将增强前的T1WI与T1CE进行刚体配准后生成reg-T1WI。配准后的增强前后T1WI图像进行逐个体素相减生成增强减影图(图 1),通过阈值半自动方法(选取的阈值范围为80~100)在减影图中勾画标记肿瘤增强范围(即肿瘤增强体积V)感兴趣区域(region of interest,ROI)及含中央坏死(Necrosis)或囊变部分的肿瘤范围(即肿瘤总体积Vn)ROI(Vn=V+ Necrosis)。中心坏死定义为被强化区域完全或部分包围的区域。在FLAIR上勾画异常高信号,即水肿范围VF ROI,肿瘤体积勾画限制在VF区域内,更好地排除肿瘤实体以外的血管影及其他非肿瘤组织高信号的干扰。rNTR为FLAIR高信号体积(VF)和增强体积(V)之比,即rNTR= VF/V。由2名5年以上经验的神经影像医师采用相同的阈值分别勾画ROI,包括VF、V和Vn。以上过程均用开源软件3D slicer v5.0.3(https://www.slicer.org)完成。
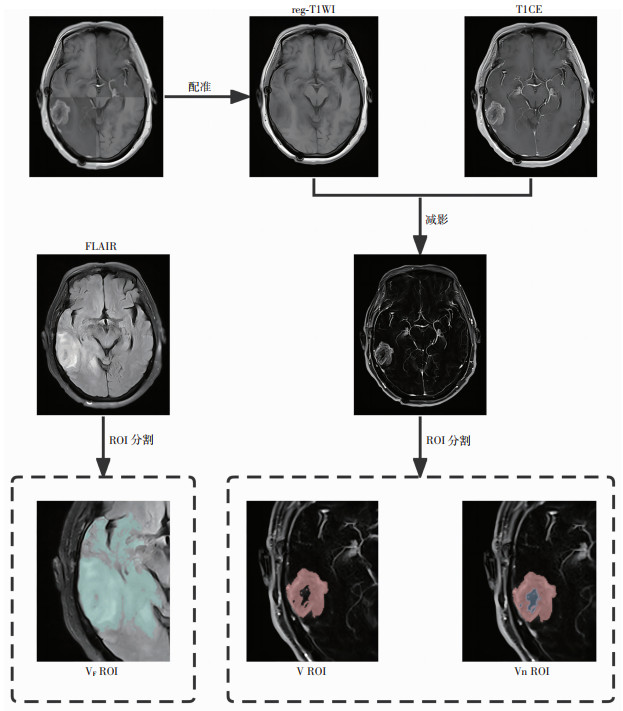
|
| 经过与T1CE配准后的reg-T1WI与TICE进行减影后生成T1WI增强减影图,基于T1WI增强减影图勾画V以及Vn ROI,基于FLAIR勾画VF ROI 图 1 T1WI增强减影流程示意图 |
1.5 统计学分析
使用SPSS 26.0和R语言4.3.0进行统计学分析。计数资料采用卡方检验;使用组间相关系数(intraclass correlation coefficients,ICC)以评估ROI提取时观测者间的一致性。当ICC<0.5时,为可靠性差;0.5≤ICC<0.75时,为可靠性中等;0.75≤ICC≤0.9时,为可靠性好;ICC>0.9时,为可靠性优异。根据中位数分别将连续性变量V、Vn和rNTR转换为二分类变量,将≥中位数者归入高水平组,<中位数者归入低水平组,以Kaplan-Meier生存曲线和log-rank检验分析各指标的高、低水平组间预后差异;采用Cox比例风险回归模型进行单因素、多因素预后分析:以V、Vn和rNTR 3个主要暴露因素分别为2个结局指标PRS和OS构建6个多因素Cox回归分析模型(根据V、Vn和rNTR值分别与其他临床指标进行组合),分别是V-PRS模型,Vn-PRS模型、rNTR-PRS模型、V-OS模型,Vn-OS模型以及rNTR-OS模型,通过-2倍对数似然值(-2 log likelihood, -2LL)对各个多因素COX回归分析模型的效果进行总体评价,比较暴露因素预测结局指标的效能,模型的-2 LL越小,效能越好。P < 0.05为差异有统计学意义。
2 结果 2.1 生存情况本研究共纳入85例患者,其中21例失访,随访率75.3%,患者中位PRS为238 d(95%CI:197.472~ 278.528),中位OS为449 d (95%CI:348.755~549.245)。
2.2 T1WI增强减影效果增强减影图准确反映了肿瘤负荷,在T1CE中出血信号常常和肿瘤实性成分的强化信号相混淆,在增强减影图中出血信号被消除。部分病变摄取对比剂之后在T1CE中依然不明显,导致低估活性肿瘤的范围,而增强减影图显著提升了病变和周围组织的对比度,细微强化区域显示更为清晰(图 2)。VF、V和Vn的组间ICC值分别为0.995(95%CI:0.821~0.999)、0.991(95%CI:0.984~0.995)和0.984(95%CI:0.804~0.995)。均ICC>0.9,可靠性优异。最终的VF、V和Vn值取2次测量的平均值。
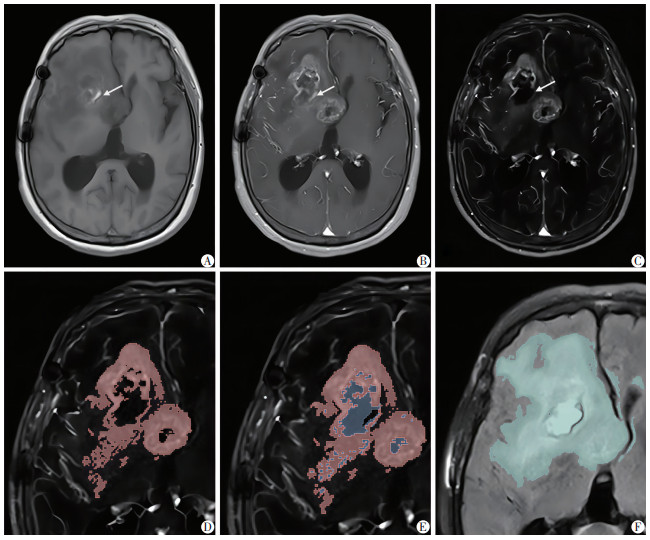
|
| A:常规T1WI ↑:示出血信号;B:T1CE ↑:示出血信号;C:T1WI增强减影图 ↑:示经减影后出血信号被消除;D:在增强减影图中标记的肿瘤增强体积V(红色区域);E:在增强减影图中标记的包括坏死囊变(蓝色区域)的肿瘤总体积Vn;F:在FLAIR中标记的异常信号体积VF(绿色区域) 图 2 rGBM患者二线治疗前增强前后T1WI、T1WI增强减影及FLAIR图像 |
2.3 rGBM患者的预后影响因素分析
根据V、Vn和rNTR的中位值34.44、45.74、3.61转换为二分类变量后,Kaplan-Meier曲线和log-rank检验显示V、Vn和rNTR高、低水平组的PRS和OS差异有统计学意义(P均 < 0.05,图 3、4)。单因素分析结果显示,切除程度、二线治疗方式、V、Vn以及rNTR是PRS的影响因素,年龄、切除程度、二线治疗方式、V、Vn以及rNTR是OS的影响因素(P均 < 0.05,表 1)。将单因素中P < 0.02的指标纳入多因素分析结果显示,V(HR=1.019,95%CI:1.010~1.028,P < 0.001)、Vn(HR=1.019, 95%CI:1.011~1.027,P < 0.001)是PRS的独立危险因素,rNTR(HR=0.873,95%CI:0.767~0.993,P=0.038)是PRS的保护因素。Vn(HR= 1.008,95%CI:1.000~1.015,P=0.042)是OS的独立危险因素,切除程度和二线治疗方式均是影响患者PRS和OS的独立影响因素(P均 < 0.05),在OS的多因素分析中未发现V值及rNTR统计学意义(表 2)。
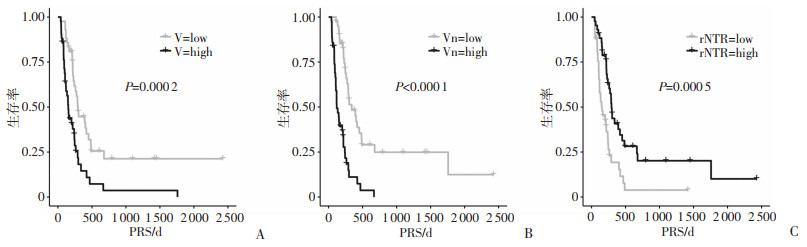
|
| 图 3 V(A)、Vn(B)、rNTR(C)与患者PRS的Kaplan-Meier生存曲线 |
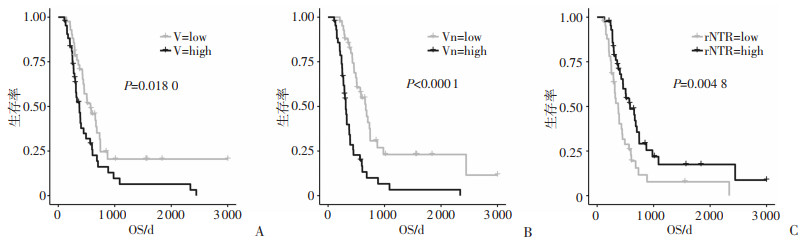
|
| 图 4 V(A)、Vn(B)、rNTR(C)与患者OS的Kaplan-Meier生存曲线 |
| 变量 | PRS | OS | |||
| HR (95%CI) | P值 | HR (95%CI) | P值 | ||
| 年龄 | 1.013(0.992~1.034) | 0.223 | 1.023(1.002~1.045) | 0.031 | |
| 性别 | 0.699(0.426~1.147) | 0.156 | 0.720(0.438~1.183) | 0.195 | |
| 切除程度 | 4.538(2.575~7.998) | < 0.001 | 3.840(2.204~6.688) | < 0.001 | |
| 二线治疗情况 | 0.477(0.339~0.672) | < 0.001 | 0.457(0.326~0.640) | < 0.001 | |
| V | 1.018(1.011~1.025) | < 0.001 | 1.011(1.004~1.018) | 0.002 | |
| Vn | 1.017(1.011~1.023) | < 0.001 | 1.011(1.005~1.017) | < 0.001 | |
| rNTR | 0.826(0.732~0.933) | 0.002 | 0.868(0.774~0.972) | 0.014 | |
| V:复发后二线治疗前的肿瘤增强体积;Vn:复发后二线治疗前包括坏死的肿瘤总体积;rNTR:复发后的肿瘤相对非增强体积比值 | |||||
| 变量 | PRS | OS | |||
| HR (95%CI) | P值 | HR (95%CI) | P值 | ||
| 年龄 | — | — | 0.994(0.972~1.016) | 0.574 | |
| 性别 | 0.601(0.357~1.011) | 0.055 | 0.635(0.373~1.083) | 0.096 | |
| 切除程度 | 2.890(1.567~5.331) | 0.001 | 2.911(1.521~5.569) | 0.001 | |
| 二线治疗情况 | 0.437(0.302~0.634) | < 0.001 | 0.427(0.286~0.639) | < 0.001 | |
| V | 1.019(1.010~1.028) | < 0.001 | 1.006(0.997~1.014) | 0.197 | |
| Vn | 1.019(1.011~1.027) | < 0.001 | 1.008(1.000~1.015) | 0.042 | |
| rNTR | 0.873(0.767~0.993) | 0.038 | 0.893(0.792~1.008) | 0.067 | |
| V:复发后二线治疗前的肿瘤增强体积,Vn:复发后二线治疗前包括坏死的肿瘤总体积;rNTR:复发后的肿瘤相对非增强体积比值 | |||||
2.4 T1WI增强减影对rGBM患者预后评估的效能
多因素COX回归分析模型的-2LL如下:V-PRS模型为407.073、Vn-PRS模型为401.317、rNTR-PRS模型为417.093、V-OS模型为414.792、Vn-OS模型为412.424以及rNTR-OS模型为412.764。Vn-PRS模型在所有模型中-2 LL值最小。
3 讨论本研究基于T1WI减影技术预测rGBM患者的预后,研究显示,基于T1WI减影技术得到的参数(V、Vn以及rNTR)均是PRS的独立预后因素,Vn是OS的独立危险因素。在多因素Cox回归分析中,Vn-PRS的回归模型预测效能最佳。
T1WI增强减影技术通过对比剂增强前后的两组T1WI图像体素相减,改善了微弱血脑屏障破坏的可视化和肿瘤体积量化的准确性,有助于真实反映肿瘤负荷和早期发现肿瘤的进展和微小病灶[12-13]。基于T1WI增强减影的体积分割比标准T1CE图分割的方差系数更低,变异更小[10]。部分研究将基于T1减影图获取的肿瘤ROI进行直方图或组学分析,更准确地预测肿瘤分级和复发风险[14-16],表明T1增强减影的优势已经被逐渐认可。既往研究只探索了包括坏死部分的肿瘤总体积与预后OS的关系[11, 17-18],而本研究增加了rGBM的单纯肿瘤强化体积,尤其探索了V和Vn预测复发后生存期PRS的价值。本研究发现V和Vn均是PRS的独立影响因素,但Vn-PRS和Vn-OS的预测效能均优于V-PRS,V在V-OS模型中没有统计学差异。Vn优于V的预测效能可能是由于将中央坏死作为肿瘤负荷更能反映肿瘤的全貌。肿瘤坏死一般由内而外,由于肿瘤早期的增殖速度快,导致中心乏血供缺氧而液化坏死,瘤内缺氧选择了能在缺氧条件下存活的细胞,使其即使在凋亡诱导治疗下也能增殖,导致GBM耐药性和复发[19-20],坏死部分被活性肿瘤所包绕,有一定的占位效应,导致肿瘤负荷增大。一些学者同样认为术前肿瘤坏死部分是预测预后的变量,坏死体积增大常常伴随OS缩短[3, 21]。因此,本研究得出Vn在预测OS和PRS的回归模型中有一定优势。笔者认为Vn比V测量更准确也存在人为因素,测量的可重复性更高。由于坏死的阶段不同表现为强化程度不同,例如未完全坏死有缓慢且较弱的强化,因此坏死部分的体积,也取决于增强减影时对增强肿瘤选择的阈值,当测量者选取肿瘤的阈值较低时,未完全坏死部分划分到肿瘤实体区域,而当选取阈值较高时,未完全坏死部分将划分到肿瘤的坏死区域。因此,V及坏死区域测值存在更多的主观差异,而Vn减少了这部分人为因素的影响。
在预测OS的生存分析模型中,Vn每增加1个单位则增加0.8%的死亡风险,与既往研究[11-12]结果相似。而V与rGBM患者OS无相关性,与部分研究[5, 22]仍存在争议,造成上述结果差异的原因一方面可能是对肿瘤强化体积测量的差异会掺杂主观因素而产生偏倚。另一方面,虽然总生存期OS是公认最佳的疗效终点,即从随机化开始到死亡终点事件的间隔,但在研究以复发后的肿瘤体积为基线和预后的关系时,OS可能不是一个最佳的研究终点。为了克服OS评价rGBM预后的局限性,排除rGBM复发前的治疗以及其他因素对生存时间的影响,本研究以复发后基线体积的时间为起点,将复发后生存期PRS作为主要终点,Vn一定程度上通过影响PRS而影响OS。
rNTR为复发后水肿相对于肿瘤增强实体的比值,作为一种评估复发时非增强肿瘤负荷的方法,高rNTR的肿瘤表示每单位肿瘤体积有更多的水肿。瘤周水肿主要由两部分构成:大部分是实体肿瘤产生的占位效应导致非肿瘤性的血管源性水肿(反应性水肿);另外,瘤周水肿还包括含有干细胞样的GBM肿瘤细胞的浸润性水肿[23-24],这也是非增强肿瘤的部分。广泛的血管源性水肿具有更高的VEGF水平,这是抗血管源性药物的靶点[25],在经过抗血管治疗后瘤周水肿体积会显著减少,这可能抑制了非增强肿瘤的生长。研究发现肿瘤复发进展后接受抗血管治疗,在一定程度上延迟了晚期患者的生存时间[26]。本研究显示治疗前较高的rNTR水平是rGBM患者PRS的保护因素,提示对于广泛瘤周水肿的rGBM患者,抗血管治疗可能是一个合理的选择。
本研究具有一定局限性。首先,本研究为回顾性、单中心研究,时间跨度大,前期病人随访率较低,造成删失数据较多,一定程度影响了统计结果,以后可结合前瞻性研究减少删失数据的比例。其次,本研究的样本量较小,有以下影响:①由于一部分患者仅有较小的坏死体积或者无坏死,因此V-PRS和Vn-PRS这2种生存模型预测效能未能充分体现差距,尽管Vn的检验效能优于V,但研究结果尚需在更广泛的人群中验证。②目前尚无针对复发后脑胶质瘤的标准治疗方案[27],复发后的治疗方案选择复杂多变,根据二线治疗方式分层验证各个生存模型的检验效能需要多中心,大样本的前瞻性研究。最后,本研究尽管针对了肿瘤恶性程度最高的增强部分进行评估,但由于胶质瘤的高度异质性,rGBM其他区域可能包含部分无强化的较低级别肿瘤,这部分需要结合其他方式进行综合评估。未来的前瞻性随机研究旨在确认较大的复发肿瘤患者是否能在以减小肿瘤体积为目的的手术中获益,进一步评估此指标测量的可靠性。
综上,基于MRI增强减影的体积评估技术可推广性和可重复性高,是一种不受特定成像限制的成像技术。本研究结果显示,PRS可能是评估rGBM预后更好的研究终点;Vn和V都是rGBM患者预后的独立影响因素,但Vn的生存预测效果更好。基于增强减影技术测量的rGBM肿瘤大小有助于临床医师更准确评估患者生存时间。rGBM患者治疗前的高rNTR水平可能和生存获益相关。
| [1] |
WELLER M, VAN DEN BENT M, TONN J C, et al. European Association for Neuro-Oncology (EANO) guideline on the diagnosis and treatment of adult astrocytic and oligodendroglial gliomas[J]. Lancet Oncol, 2017, 18(6): e315-e329. |
| [2] |
REARDON D A, BRANDES A A, OMURO A, et al. Effect of nivolumab vs bevacizumab in patients with recurrent glioblastoma: the CheckMate 143 phase 3 randomized clinical trial[J]. JAMA Oncol, 2020, 6(7): 1003-1010. |
| [3] |
HENKER C, KRIESEN T, GLASS Ä, et al. Volumetric quantification of glioblastoma: experiences with different measurement techniques and impact on survival[J]. J Neurooncol, 2017, 135(2): 391-402. |
| [4] |
CHELLIAH S S, PAUL E A L, KAMARUDIN M N A, et al. Challenges and perspectives of standard therapy and drug development in high-grade gliomas[J]. Molecules, 2021, 26(4): 1169. |
| [5] |
HENKER C, HIEPEL M C, KRIESEN T, et al. Volumetric assessment of glioblastoma and its predictive value for survival[J]. Acta Neurochir (Wien), 2019, 161(8): 1723-1732. |
| [6] |
BENZAKOUN J, ROBERT C, LEGRAND L, et al. Anatomical and functional MR imaging to define tumoral boundaries and characterize lesions in neuro-oncology[J]. Cancer Radiother, 2020, 24(5): 453-462. |
| [7] |
ELLINGSON B M, WEN P Y, CLOUGHESY T F. Modified criteria for radiographic response assessment in glioblastoma clinical trials[J]. Neurotherapeutics, 2017, 14(2): 307-320. |
| [8] |
SAUER S T, CHRISTNER S A, SCHLAIẞ T, et al. Diffusion-weighted breast MRI at 3 tesla: improved lesion visibility and image quality with a combination of water-excitation and spectral fat saturation[J]. Acad Radiol, 2023, 30(9): 1773-1783. |
| [9] |
ELLINGSON B M, BENDSZUS M, BOXERMAN J, et al. Consensus recommendations for a standardized Brain Tumor Imaging Protocol in clinical trials[J]. Neuro Oncol, 2015, 17(9): 1188-1198. |
| [10] |
ELLINGSON B M, KIM H J, WOODWORTH D C, et al. Recurrent glioblastoma treated with bevacizumab: contrast-enhanced T1-weighted subtraction maps improve tumor delineation and aid prediction of survival in a multicenter clinical trial[J]. Radiology, 2014, 271(1): 200-210. |
| [11] |
ELLINGSON B M, HARRIS R J, WOODWORTH D C, et al. Baseline pretreatment contrast enhancing tumor volume including central necrosis is a prognostic factor in recurrent glioblastoma: evidence from single and multicenter trials[J]. Neuro Oncol, 2017, 19(1): 89-98. |
| [12] |
ELLINGSON B M, AFTAB D T, SCHWAB G M, et al. Volumetric response quantified using T1 subtraction predicts long-term survival benefit from cabozantinib monotherapy in recurrent glioblastoma[J]. Neuro Oncol, 2018, 20(10): 1411-1418. |
| [13] |
SOLLMANN N, GUTBROD-FERNANDEZ M, BURIAN E, et al. Subtraction maps derived from longitudinal magnetic resonance imaging in patients with glioma facilitate early detection of tumor progression[J]. Cancers (Basel), 2020, 12(11): 3111. |
| [14] |
PATEL K S, EVERSON R G, YAO J W, et al. Diffusion magnetic resonance imaging phenotypes predict overall survival benefit from bevacizumab or surgery in recurrent glioblastoma with large tumor burden[J]. Neurosurgery, 2020, 87(5): 931-938. |
| [15] |
LAUKAMP K R, SHAKIRIN G, BAEẞLER B, et al. Accuracy of radiomics-based feature analysis on multiparametric magnetic resonance images for noninvasive meningioma grading[J]. World Neurosurg, 2019, 132: e366-e390. |
| [16] |
PARK G E, KIM S H, LEE E B, et al. Ipsilateral recurrence of DCIS in relation to radiomics features on contrast enhanced breast MRI[J]. Tomography, 2022, 8(2): 596-606. |
| [17] |
ELLINGSON B M, KIM E, WOODWORTH D C, et al. Diffusion MRI quality control and functional diffusion map results in ACRIN 6677/RTOG 0625: a multicenter, randomized, phase Ⅱ trial of bevacizumab and chemotherapy in recurrent glioblastoma[J]. Int J Oncol, 2015, 46(5): 1883-1892. |
| [18] |
ELLINGSON B M, HAGIWARA A, MORRIS C J, et al. Depth of radiographic response (DpR) and time to tumor regrowth (TTG) predicts overall survival following anti-VEGF therapy in recurrent glioblastoma[J]. Clin Cancer Res, 2023, CCR-C23-1235. |
| [19] |
HE W S, EDNEY M K, PAINE S M L, et al. Untargeted metabolomic characterization of glioblastoma intra-tumor heterogeneity using OrbiSIMS[J]. Anal Chem, 2023, 95(14): 5994-6001. |
| [20] |
STADLBAUER A, KINFE T M, EYÜPOGLU I, et al. Tissue hypoxia and alterations in microvascular architecture predict glioblastoma recurrence in humans[J]. Clin Cancer Res, 2021, 27(6): 1641-1649. |
| [21] |
BABACIC H, GALARDI S, UMER H M, et al. Glioblastoma stem cells express non-canonical proteins and exclusive mesenchymal-like or non-mesenchymal-like protein signatures[J]. Mol Oncol, 2023, 17(2): 238-260. |
| [22] |
HUANG S L, MICHALEK J E, REARDON D A, et al. Assessment of tumor hypoxia and perfusion in recurrent glioblastoma following bevacizumab failure using MRI and 18F-FMISO PET[J]. Sci Rep, 2021, 11(1): 7632. |
| [23] |
BISEROVA K, JAKOVLEVS A, ULJANOVS R, et al. Cancer stem cells: significance in origin, pathogenesis and treatment of glioblastoma[J]. Cells, 2021, 10(3): 621. |
| [24] |
SOLAR P, HENDRYCH M, BARAK M, et al. Blood-brain barrier alterations and edema formation in different brain mass lesions[J]. Front Cell Neurosci, 2022, 16: 922181. |
| [25] |
TU Z W, WANG C, HU Q, et al. Protein disulfide-isomerase A4 confers glioblastoma angiogenesis promotion capacity and resistance to anti-angiogenic therapy[J]. J Exp Clin Cancer Res, 2023, 42(1): 77. |
| [26] |
FAZZARI F G T, ROSE F, PAULS M, et al. The Current landscape of systemic therapy for recurrent glioblastoma: a systematic review of randomized-controlled trials[J]. Crit Rev Oncol Hematol, 2022, 169: 103540. |
| [27] |
JIANG T, NAM D H, RAM Z, et al. Clinical practice guidelines for the management of adult diffuse gliomas[J]. Cancer Lett, 2021, 499: 60-72. |




