2. 400038 重庆,陆军军医大学(第三军医大学):军事预防医学系复合伤研究所
2. State Key Laboratory of Trauma, Burns and Combined Injury, Institute of Combined Injury, Faculty of Military Preventive Medicine; Army Medical University (Third Military Medical University), Chongqing, 400038, China
炎症性肠病(inflammatory bowel disease,IBD)是克罗恩病(Crohn’s disease,CD)和溃疡性结肠炎(ulcer colitis,UC)的总称,该病具有慢性、复发性及难治性的特点,严重影响患者的生活质量,已成为世界性的健康挑战[1-2]。许多研究表明,遗传因素、免疫调节障碍和环境因素可能是IBD的主要致病因素[3],甚至年龄与IBD的发生也有着潜在的联系[4],然而IBD的发病机制尚不清楚,这使得开发有效的诊断和治疗策略更具挑战性[5]。
IL22是众所周知的上皮稳态调节剂,被认为是理想的IBD治疗靶点,因其通过激活(磷酸化)上皮Jak/Stat3通路,从而维持肠道稳态并促进上皮屏障修复[6]。IL22是白介素10(IL10)细胞因子家族中的一员,可由多种免疫细胞分泌,主要包括先天性淋巴细胞3群(ILC3)、辅助性T细胞17(Th17)、辅助性T细胞22(Th22)、调节性T细胞(Treg)等[7]。IL22受体(IL22R)由异源二聚体的IL22R1和IL10R2构成,IL10R2为组织非特异性受体,而IL22R1多表达于肺、胃肠道、胸腺、皮肤、胰腺、肝脏和肾脏等具有上皮组织特异性的器官,在免疫细胞不表达,从而提供了从免疫系统到上皮组织的信号传导方向性[8]。目前相关研究多采用腹腔注射重组IL22蛋白(rIL22)的给药方式。这种治疗方式能够起到较好的治疗作用,但存在着治疗时效短、单价高等缺点[9]。HSUEH等[10]探明了重组IL22腺相关病毒(adreno-associated virus-IL22,AAV-IL22)在2-辛炔酸(2-octynoic acid)诱发的小鼠原发性胆汁性胆管炎(primary biliary cirrhosis, PBC)模型中,可以减低炎症反应并减少肝脏纤维化的产生。这一研究提示在较长的时间窗内提高IL22表达水平,有助于探讨葡聚糖硫酸钠(dextran sulfate sodium salt, DSS)诱导肠炎的治疗新策略。
腺相关病毒(adeno-associated virus,AAV)是一种复制缺陷型单链DNA细小病毒,对分裂细胞和非分裂细胞均具有感染能力,并已证明在用于具有免疫活性细胞的基因表达时,AAV载体效果更好[11]。目前使用AAV作为载体的基因治疗已经成为一种新的治疗模式出现,并已获得美国食品药品监督管理局(FDA)授权许可。KUZMIN等[12]对广泛开展的AAV基因治疗的临床试验进行了充分评估,认为AAV基因治疗是一种安全、耐受性良好的有效方式。本研究基于AAV具有表达时间长、安全性高、免疫原性低和高稳定性的特性,将目的基因IL22的蛋白编码区(coding sequence,CDS)插入AAV表达质粒中,并在小鼠体内稳定转染,构成了一种较为理想的基因治疗方式,从而初步探究AAV-IL22转染小鼠在DSS结肠炎动物模型中的作用及机制,为探讨IBD的发病机制及其潜在的治疗方法提供新的思路。
1 材料与方法 1.1 实验动物采用8周龄SPF级C57BL/6雄性小鼠,体质量23~25 g,由成都集萃药康生物科技有限公司提供[SCXK(川)2020-034]。饲养环境为陆军军医大学动物实验中心SPF级动物房,环境温度和湿度为中央空调统一控制[室温(22±2)℃,湿度60%~70%,12 h昼夜交替照明],每笼5只,自由摄食饮水。
1.2 试剂与仪器AAV-IL22/mock购自吉凯基因公司,DSS购自MP Biomedical公司;RT-qPCR采用SYBR Green染料法PCR试剂盒(日本TaKaRa公司);抗体:IL22(Bioss)、stat3(Bioss)、p-stat3(CST)、IL1α(CST)、IL1β(CST)、cleaved-IL1β(CST)、IL6(Bioworld)、TNFα(Bioworld)。Western blot仪器(美国Bio-Rad公司);电泳凝胶试剂盒、电泳液(上海雅酶生物医药公司);化学发光成像仪(美国acuronBio公司);PCR仪(荧光定量CFX connect,美国Bio-rad公司)。
1.3 小鼠实验模型构建 1.3.1 IL22-/-基因敲除鼠DSS模型构建IL22+/-小鼠由欧阳文军(美国南圣弗朗西斯科大学免疫系)提供,将8~10周龄基因型为IL22+/-小鼠按1雄2雌合笼,新生小鼠10 d左右剪脚趾行琼脂糖凝胶电泳鉴定小鼠基因型,鼠龄4周时雌雄分笼饲养,鼠龄8~10周时选用同笼出生基因型为IL22-/-、IL22+/+雄性小鼠各3只,体质量在23~25 g之间,给予2.5%DSS溶液(质量/体积,g/L)自由饮水6 d,换正常饮水2 d,行小鼠肠道内窥镜检查后麻醉取材,造模期间记录小鼠体质量、粪便性状、血便情况以确定DAI评分(评分标准见表 1)。行2次重复实验。
| 评分项目 | 0分 | 1分 | 2分 | 3分 | 4分 |
| 体质量下降率 | 0%~1% | >1%~5% | >5%~10% | >10%~18% | >18% |
| 粪便粘稠度 | 正常 | 软 | 粘液便 | 稀便 | 稀水样便 |
| 粪便潜血 | 阴性 | 浅蓝 | 蓝色 | 深蓝 | 肉眼血便 |
1.3.2 AAV-IL22/mock转染小鼠1个月模型构建
选取15只SPF级8周龄雄性C57BL/6小鼠,适应性饲养7 d,依据随机数字表法分为PBS组(n=5)、AAV-mock组(n=5)、AAV-IL22组(n=5)。AAV-mock组和AAV-IL22组均采用尾静脉注射,无菌PBS溶液稀释病毒原液至200 μL/只,AAV滴度为1×1011 v.g/只,PBS对照组采用等体积无菌PBS尾静脉注射。观察1个月并记录体质量变化。
1.3.3 AAV-IL22/mock转染小鼠2个月模型构建选取25只SPF级8周龄雄性C57BL/6小鼠,适应性饲养7 d,采用随机数字表法分为PBS组(n=5)、低剂量AAV-mock组(滴度=1×1011 v.g/只,n=5)、低剂量AAV-IL22组(滴度=1×1011 v.g/只,n=5)、高剂量AAV-mock组(滴度=2×1011 v.g/只,n=5)、高剂量AAV-IL22组(滴度=2×1011 v.g/只,n=5)。观察并记录原始体质量和AAV转染2个月后体质量。
1.3.4 AAV-IL22/mock转染小鼠DSS模型构建选取15只SPF级8周龄雄性C57BL/6小鼠,适应性饲养7 d,采用随机数字表法分为AAV-mock+DSS组(n=5)、AAV-IL22+DSS组(n=5),在AAV-IL22/mock(1×1011 v.g/只)转染小鼠1个月模型基础上给予2.5%DSS溶液自由饮水6 d,换正常饮水2 d,行小鼠肠道内窥镜检查后麻醉取材,造模期间记录小鼠体质量、粪便性状、血便情况。PBS空白对照组(n=5)予以正常饮水,与造模小鼠同时取材。
1.4 小鼠肠道内窥镜隔夜禁食12 h后使用高分辨率小鼠视频内窥镜系统(Karl STORZ,Tuttlingen,德国)对实验小鼠进行肠道内窥镜检查。2.5%异氟烷诱导麻醉,1.5%异氟烷维持麻醉,生理盐水冲洗肠腔后适量空气充气显示近端结直肠。根据内窥镜结果评分,评分标准见表 2。
| 评分项目 | 0分 | 3分 |
| 肠壁透明情况 | 不透明 | 透明 |
| 肠壁附着纤维蛋白 | 无 | 大量 |
| 黏膜颗粒状态 | 无 | 明显 |
| 血管形态 | 不可见 | 透见 |
| 粪便特征 | 正常 | 稀便 |
| 管腔内有血液 | 无 | 大量 |
1.5 动物标本采集及处理
所有小鼠麻醉后脱颈椎处死,摘取肝、肾、脾,滤纸吸干多余水分后称重,分离及结肠组织,测量结肠长度,剪取部分结肠组织迅速放入液氮速冻后于-80 ℃冰箱保存,其余肠段于zinc溶液中固定24 h。
1.6 实验方法 1.6.1 HE染色结肠组织常规固定、脱水,包埋制成石蜡标本,3 μm切片脱蜡后苏木精染色3 min,1%盐酸-酒精分化5 s,自来水冲洗反蓝10 min,伊红染色10 s,透明后中性树脂封片,光镜下拍照并评分。结肠组织病理学评分见表 3。
| 评分 | 溃疡(个) | 上皮细胞变化 | 炎症浸润 | 淋巴结(个) |
| 0 | 0 | 正常 | 无 | 无 |
| 1 | 1 | 杯状细胞缺失 | 隐窝周围浸润 | 1 |
| 2 | 2 | 杯状细胞大面积缺失 | 黏膜肌层出现浸润 | 2 |
| 3 | 3 | 隐窝缺失 | 黏膜肌层普遍浸润,黏膜增厚 | 3 |
| 4 | >3 | 隐窝大面积缺失或息肉状再生 | 黏膜下层浸润 | >3 |
1.6.2 免疫组化及免疫荧光
将石蜡切片脱蜡后于1×柠檬酸盐中煮沸抗原修复15 min,3%过氧化氢阻断15 min、5%山羊血清+0.5%PBST封闭后一抗4 ℃孵育过夜,0.1%PBST洗片5次,每次5 min,2抗孵育1.5 h,光镜下DAB显色,苏木精染色2 min,二甲苯透明后中性树脂封片。免疫荧光步骤基本同上,注意避光孵育荧光二抗,DAPI染色后防荧光淬灭封片剂封片。
1.6.3 RNA提取及定量逆转录PCR(RT-qPCR)使用TRIzol(Thermo Fisher Scientific,USA)从远端结肠组织中提取总mRNA,并使用Nanodrop 2000测定mRNA浓度,采用cDNA反转录试剂盒[Rneasy Mini kit(TaKaRa)]逆转录合成cDNA,RT-qPCR反应体系:引物1 μL,cDNA 2 μL,ddH2O 2 μL,Master Mix 5 μL,总体积10 μL。反应条件预变性:95 ℃ 5 min,共40个循环:95 ℃ 5 s,59 ℃ 15 s,72 ℃ 20 s,65~95 ℃,得到各组样品扩增反应的Ct值,以GAPDH作为内参基因,采用2-ΔΔCt计算相对表达量。引物序列:IL22上游引物5′-ATGAGTTTTTCCCTTATGGGGAC-3′,下游引物5′-GCTGGAAGTTGGACACCTCAA-3′。
1.6.4 蛋白质免疫印迹(Western blot)将冷冻组织加入含蛋白酶和磷酸酶抑制剂cocktail的蛋白裂解液(RIPA),电动匀浆机研磨离心(15 000 r/min,4 ℃,20 min)后取蛋白上清液,BCA法测定浓度后于SDS-PAGE凝胶进行电泳分离,湿转法转至PVDF膜上,5%脱脂奶粉封闭2 h,一抗4 ℃摇床孵育过夜,次日洗膜缓冲液(TBST)洗涤3次后加入二抗孵育1 h,TBST洗涤3次后加入发光液曝光。所测目标蛋白的灰度值/GAPDH的灰度值作为所测蛋白的相对表达。
1.7 统计学分析采用GraphPad Prism 9.3统计软件进行数据分析,计量资料以 x±s表示,多组间比较采用单因素方差分析,组间比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果 2.1 IL22-/-小鼠DSS诱导结肠炎表型为明确IL22对DSS诱导的结肠炎作用,选取IL22敲除小鼠(IL22-/-)建立DSS诱导的结肠炎模型,并选用同窝IL22+/+作为对照组(图 1A)。首先使用琼脂糖凝胶电泳法对IL22敲除小鼠的基因型进行鉴定,为明确IL22敲除效率,取结肠组织行RT-qPCR检测IL22的mRNA相对表达水平,与IL22+/+相比,IL22-/-小鼠结肠IL22 mRNA表达水平明显降低(P<0.01,图 1B),表明IL22敲除小鼠模型构建无误。在此基础上,同时给予2组小鼠2.5%DSS自由饮水,造模前期2组体质量下降情况、粪便性状及便血情况均未出现统计学差异,DSS造模6 d换用正常饮水后,IL22-/-组相较IL22+/+组腹泻和便血程度进一步加重,体质量降低比例(P<0.05, 图 1C)、DAI评分较对照组出现统计学差异(P<0.05,图 1D)。造模第8天,IL22-/-组小鼠出现不喜活动、弓背及体温减低等情况。为防止小鼠死亡,对2组小鼠行肠道内窥镜检查并取材,肠镜结果显示IL22-/-组肠道病变更为明显,肠道内窥镜评分较IL22+/+组明显增高(P<0.01,图 1E)。DSS诱导结肠炎同时可以引起其他免疫相关器官的变化,因此在取材时观察了小鼠肝、肾、脾的大体形态变化,并对其质量进行称量。虽未观察到IL22-/-组肝脏指数有明显升高,但其肝脏大体观颜色晦暗,而其他免疫相关脏器(肾、脾)出现炎症反应性水肿增大、脏器指数升高(P<0.05,图 1F),提示IL22缺陷加重了DSS诱导结肠炎症。
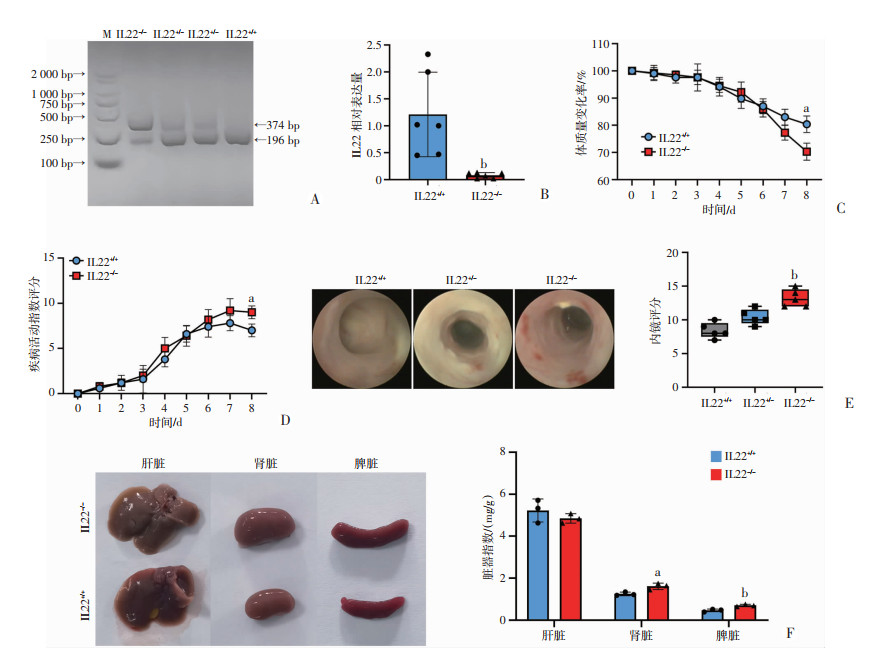
|
|
M:标准;a:P<0.05,b:P<0.01,与IL22+/+组比较 A:琼脂糖凝胶电泳法鉴定IL22-/-和IL22+/+基因型;B:RT-qPCR检测小鼠结肠IL22 mRNA水平;C:2.5%DSS饮水6 d、正常饮水2 d各组小鼠体质量变化率;D:疾病活动指数(DAI)评分;E:DSS诱导后小鼠肠镜及内镜评分统计;F:小鼠肝、肾、脾脏器大体及脏器指数 图 1 IL22-/-小鼠增加DSS所致结肠炎的严重程度 |
2.2 IL22-/-小鼠DSS诱导结肠炎炎症水平
根据上述结果,IL22敲除小鼠可能在DSS诱导的结肠炎模型中具有更高的炎症水平表达,进一步从微观病理和炎症因子蛋白水平进行验证。HE染色结果显示IL22-/-组小鼠结肠壁整体增厚,黏膜下固有层大量炎性细胞浸润,黏膜受损明显,隐窝结构紊乱,有大面积溃疡形成,提示IL22缺乏进一步破坏了肠组织完整性,并加重炎症水平。Ki67免疫组化结果提示IL22敲除小鼠结肠隐窝增殖细胞数量明显减少,提示其修复能力减弱。通过Western blot检测结肠组织中促炎细胞因子IL1α、IL1β、cleaved-IL1β、IL6、TNFα的表达水平,结果显示IL22纯合子敲除小鼠较杂合子小鼠在DSS模型中肠道炎症因子蛋白表达水平升高(P < 0.05),且均高于野生型小鼠,表明IL22缺失加剧炎症反应。见图 2。
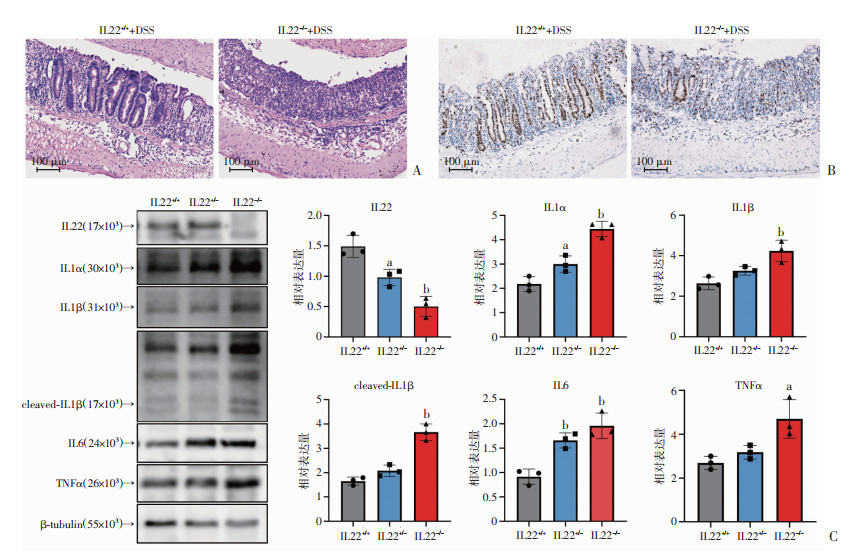
|
| A: 结肠HE染色;B:免疫组化Ki67染色;C:Western blot检测IL22、IL1α、IL1β、cleaved-IL1β、IL6、TNFα表达水平及统计结果;a:P<0.05,b:P<0.01,与IL22+/+比较 图 2 IL22-/-加重DSS诱导的结肠炎炎症水平 |
2.3 在体转染AAV9-IL22建立IL22高表达模型
为进一步明确IL22在DSS模型中的保护作用,通过对质粒载体插入IL22目的基因片段(图 3A),检测目的基因和转化子的表达(图 3B、C),并检测病毒滴度后实现了AAV-IL22的构建。在明确AAV转染效能之前,先对AAV的安全性进行了验证。在分别对小鼠行PBS以及不同剂量AAV-mock和AAV-IL22尾静脉注射之后,对小鼠体质量变化进行追踪,结果显示AAV-mock组与AAV-IL22组小鼠体质量变化与PBS组无明显差异(图 3D),小鼠毛色黑亮,活动度好。为进一步明确病毒的致损剂量和长期效应,以不同的浓度梯度AAV尾静脉注射转染小鼠,并在转染后对小鼠进行连续性观察,结果显示转染AAV后2个月,高剂量组AAV-mock组与AAV-IL22组小鼠体质量增长均受滞(P<0.01,图 3E),毛色及活动度稍差于对照组,而低剂量组体质量稍低于PBS对照组,但二者间无统计学差异。这一结果提示高表达IL22本身并非导致上述现象的原因,而过高空载病毒颗粒的毒性积蓄效应可能是产生全身性不良反应的“元凶”。根据上述结果,将低剂量组小鼠在病毒转染后1个月进行取材,并将小鼠的组织学形态和主要脏器(肝、肾、脾)的脏器指数与正常对照组进行比较,结果显示低剂量AAV-mock组、AAV-IL22组与正常对照组间无统计学差异,表明转染病毒颗粒数在1×1011 v.g/只为安全剂量。
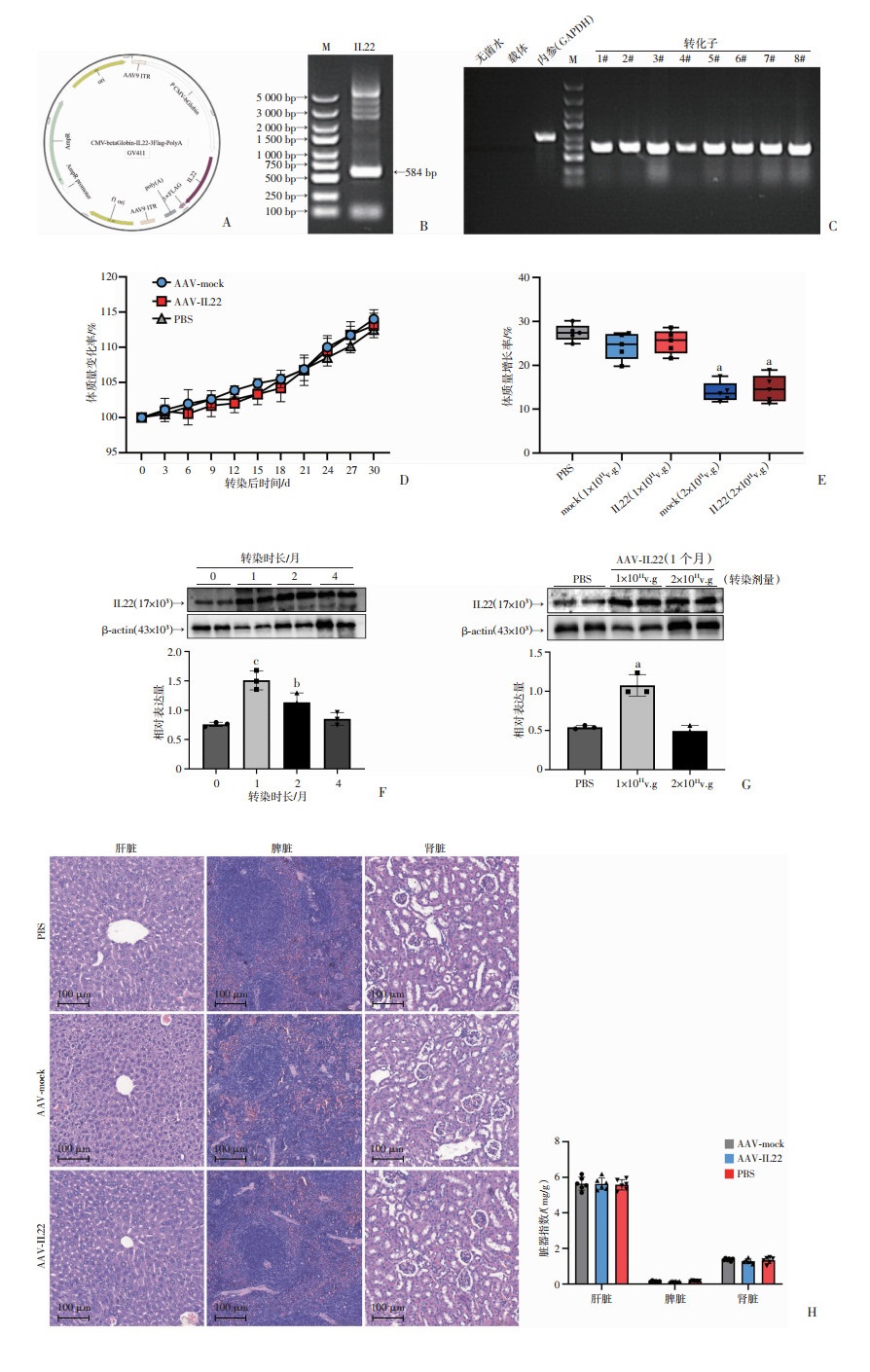
|
|
a:P<0.01,与PBS比较;b:P<0.05,c:P<0.01,与转染0个月比较 A:腺相关病毒载体构建图谱;B:目的基因琼脂糖凝胶电泳;C:阳性转化子琼脂糖凝胶电泳;D:在体AAV转染30 d内小鼠体质量变化(滴度=1×1011 v.g/只);E:不同剂量AAV转染后2个月体质量增长率;F: Western blot验证AAV(滴度=1×1011 v.g/只)转染后0、1、2、4个月结肠IL22蛋白表达水平;G:低剂量AAV(滴度=1×1011 v.g/只) 及高剂量AAV(滴度=2×1011 v.g/只)转染后1个月结肠IL22表达 H:转染腺相关病毒1个月后肝、肾、脾HE染色及肝、脾、肾脏器指数统计 图 3 AAV-IL22转染小鼠表型验证 |
在安全效能研究的基础上,为进一步明确AAV在结肠的转染效能,在分别检测转染AAV后0、1、2、4个月检测结肠组织IL22蛋白表达水平,结果显示AAV-IL22转染1个月后可在结肠组织实现长期稳定的IL22高表达(P<0.01, 图 3F)。另外,转染不同剂量AAV的结肠组织行Western blot验证IL22蛋白水平表达,结果表明低剂量AAV转染即可引起结肠IL22表达明显增高,而高剂量组IL22表达低于低剂量组表达,这一现象可能是由于高剂量病毒损伤IL22分泌细胞所致(P<0.01, 图 3G)。综合安全性及经济性因素,本研究选用低剂量组作为进一步研究的治疗剂量。
2.4 AAV-IL22缓解DSS诱导性结肠炎为明确IL22过表达背景下对于DSS肠炎的影响,分别对小鼠尾静脉注射低剂量(1×1011 v.g/只)的AAV-mock和AAV-IL22,并设置PBS对照组用以排除空载病毒的影响。为保持与IL22敲除小鼠的DSS模型一致,待AAV稳定转染1个月后再次按原方案建立了DSS模型(图 4A)。研究发现AAV-IL22转染小鼠仍能在DSS刺激下保持结肠长度(P<0.01,图 4B),并逆转疾病活动指数(P<0.01,图 4C),内镜评估黏膜破损、肠道出血情况也较对照组明显减轻(P<0.05,图 4D)。DSS可引起小鼠结肠形态学严重损害,而IL22可明显缓解DSS所致的结肠组织学改变,评估HE染色病理结果表明AAV-IL22治疗组可更大程度减少杯状细胞的损失,保存隐窝细胞存活并减少炎性细胞浸润(P<0.05,图 4E)。考虑到盲肠临近结肠,DSS可能同样具有损伤作用,通过HE染色病理结果显示相较AAV-IL22组,AAV-mock组在盲肠亦可发生较为严重的黏膜损伤。通过AAV实现基因靶向治疗,提高本底IL22水平可以对DSS诱导的结肠炎起保护作用。
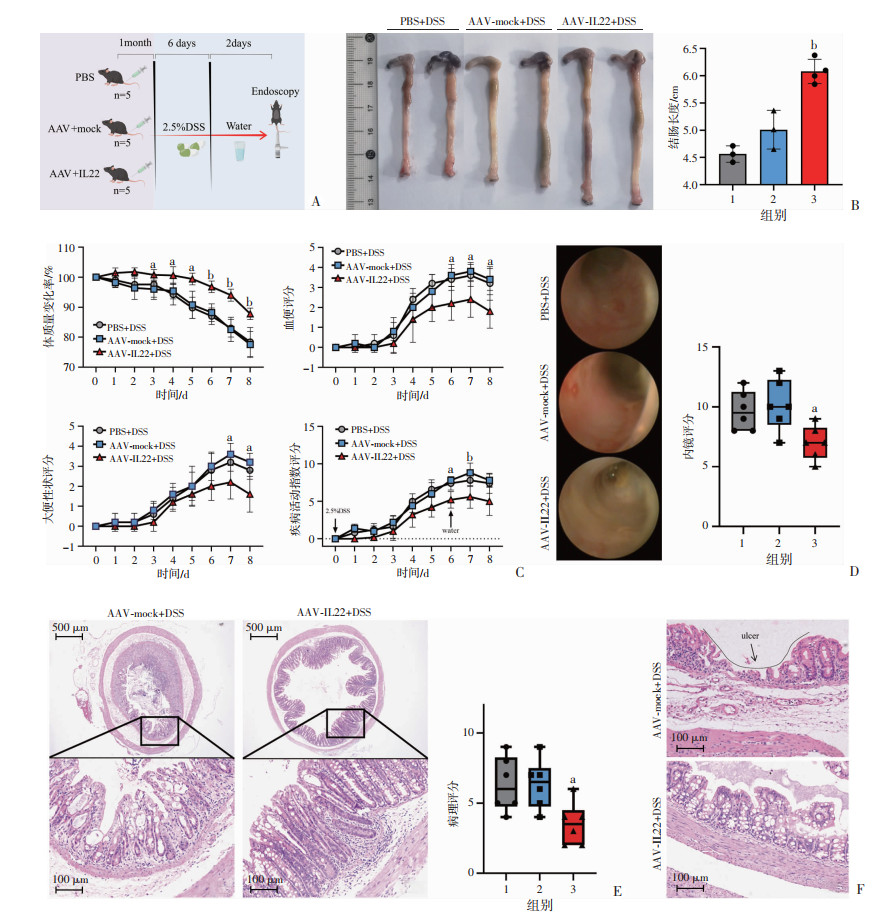
|
|
1:PBS+DSS;2:AAV-mock+DSS;3:AAV-IL22+DSS;a:P<0.05,b:P<0.01,与AAV-mock+DSS组比较 A:DSS肠炎建模示意图;B:结肠长度及统计;C:体质量变化率、粪便性状评分、血便评分、DAI;D:结肠内窥镜及评分;E:结肠HE染色;F:盲肠HE染色 图 4 AAV-IL22可降低DSS所致结肠炎的病情严重程度 |
2.5 IL22保护肠屏障完整性
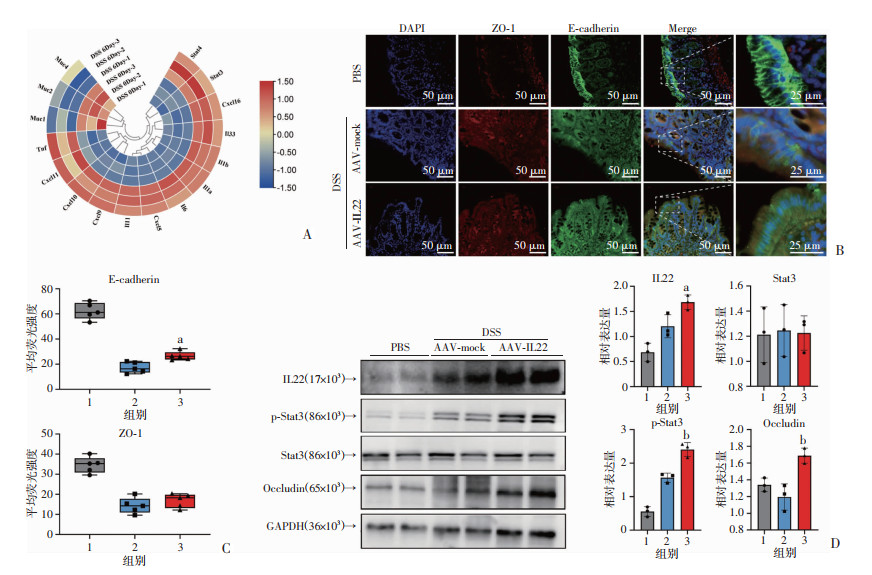
为进一步了解DSS肠炎中肠化学屏障损伤情况,从GEO数据库中挖掘出DSS诱导小鼠结肠炎模型第0天和第6天结肠测序结果,并挑选出相关基因进行比对,结果显示,DSS诱导作用下,结肠总体黏蛋白基因水平表达明显降低,而趋化因子和部分炎症因子表达水平升高(图 5A)。由于紧密连接蛋白在维持肠道平衡和上皮物理屏障功能中起着至关重要的作用,本研究通过IF检测IL22治疗后的ZO-1和E-cadherin表达情况,并通过Western blot再次验证Occludin蛋白表达水平,结果显示IL22虽难以逆转ZO-1在DSS肠炎中的损伤,但可在结肠上皮刷状缘缓解E-cadherin损伤(P<0.05,图 5B、C),同时提高Occludin表达水平(P<0.01,图 5D)。而IL22可以激活(磷酸化)Stat3,从而促使信使分子p-Stat3入核并启动下游转录因子。通过Western blot验证了AAV基因靶向提高IL22本底水平,可以在DSS肠炎模型中激活Jak/Stat3通路(P<0.01,图 5D),从而提高肠屏障相关分子的表达来保护受损的结肠组织,减轻DSS所致损伤。据此,本研究通过AAV转染在体小鼠,实现了IL22在体稳定长期表达,在DSS诱导的结肠炎模型中,IL22过表达小鼠可以明显缓解肠上皮黏膜损伤,减少炎症细胞浸润,具有保护作用,而这一作用产生可能是由于IL22高激活Jak/Stat3通路,从而稳定肠上皮完整性所致。
|
|
1:PBS;2:AAV-mock+DSS;3:AAV-IL22+DSS;a:P<0.05,b:P<0.01,与AAV-mock+DSS比较 A:GEO数据库DSS诱导0/6 d相关目的基因热图分析;B:免疫荧光染色显示ZO-1、E-cadherin表达;C:ZO-1、E-cadherin平均荧光强度统计;D:Western blot检测IL22、p-Stat3、Stat3、Occludin蛋白表达水平及统计结果 图 5 IL22通过激活Jak/Stat3通路维持肠上皮屏障功能 |
3 讨论 3.1 免疫调节障碍是IBD的致病因素之一
IBD的免疫调节障碍主要表现为促炎症介质和抗炎介质之间的平衡受损,宿主免疫应答过度激活,先天性免疫细胞大量浸润肠道固有层,从而诱导促炎细胞因子的自发释放,如肿瘤坏死因子α(TNFα)、干扰素γ(IFNγ)、IL1β、IL6、IL8和IL12等,所有这些细胞因子都可能诱导以效应T细胞调节失衡为特征的炎症级联反应,从而导致肠道黏膜屏障损伤[13]。许多研究报道了Th17细胞和IBD发病机理之间的密切关系,并从IBD患者结肠中发现了Th17相关性细胞因子,如IL17A、IL17F、IL22和IL26的过表达[14]。尽管IBD患者IL22表达上调,但屏障功能损伤和疾病发生发展仍然存在,这可能是由于生理水平的IL22不足以充分发挥损伤愈合作用,同时伴随着自然拮抗剂IL22BP的升高而阻碍了IL22潜在保护作用则是另一种可能的因素[15]。因此,稳定调节机体IL22水平升高成为了一种具有可行性的IBD治疗新策略[16]。
3.2 IL22具有炎症调节作用IL22是一种具有争议性的细胞因子,常被称为“披着狼皮的羊”[17]或“双面细胞因子”[18],在不同疾病模型中由于组织微环境的改变,IL22扮演的促炎和抑炎角色亦不明晰。然而更多证据表明,IL22可以降低机体对外界病原体的易感性和致病性[6],如IL22缺陷小鼠在流感病毒感染中炎症加重,而IL22-BP缺陷小鼠中炎症减轻[19]。在DSS肠炎模型中,IL22和IL6本身都存在反应性升高,且二者都可以激活Jak/Stat3通路,不同的是IL22通过激活上述通路起到增强肠道屏障、促进组织再生修复的作用;而通过抑制IL6/Jak2/Stat3通路则可以调节Th17/Treg细胞稳态,从而缓解DSS诱导的肠炎[20]。因此,靶向IL22激活的Jak/Stat3通路是明确IL22对于炎症调节的首要条件。据此,本研究利用IL22敲除小鼠并通过AAV过表达IL22,在急性结肠炎模型中验证了IL22对炎症的调节作用,结果表明IL22缺乏可导致DSS结肠炎小鼠体内多种炎症因子表达上调,而过表达IL22可逆转结肠上皮结构损伤、修复肠屏障、减少炎症细胞浸润,从而抑制DSS结肠炎的炎症失衡。由于DSS模型是模拟IBD患者,尤其是UC患者最常用的研究方法之一,而IBD患者体内免疫调节的持续性失衡很可能是长期的肠屏障功能障碍引发的炎症级联反应,二者又互为因果,不断加重病情。因此我们推测IL22起到的屏障维稳作用是治疗IBD的关键一环。
3.3 IL22是重要的肠道屏障保护因子肠道内环境稳态是由肠上皮屏障和黏膜免疫系统等多因素共同维持的,肠道上皮屏障是肠道内环境稳定的基石,它提供了抵御病原体的物理屏障,同时维持了机体免疫应答[21]。上皮屏障功能障碍可引发过度炎症反应,引起促炎细胞因子上调,特别是IL1β、TNFα和IL6水平异常升高,从而加重肠上皮毁损抑制修复[24]。而IL22是公认的肠屏障保护因子,可以通过促进肠道隐窝细胞增殖分化修复黏膜屏障[22],同时促进潘氏细胞分泌抗菌肽和防御素起到化学屏障作用[23]。SERAFINI等[24]发现,通过对小鼠在有限的时间窗内预感染鼠类柠檬酸杆菌,可诱导产生受到良好“训练”的ILC3,这类ILC3可以在再次受到病原菌侵袭时快速增殖并释放大量IL22,从而完成肠道黏膜屏障的修复,同时这种效应可持续4个月以上。与之异曲同工的地方是,我们通过AAV来实现持续性的IL22高表达背景,并展开了对DSS药物作用下肠屏障损伤修复的研究,从而明确IL22对于肠屏障的持续性保护作用,这一结果相较于使用rIL22-Fc一过性过表达IL22而言,具有靶向性、持久性的特点,其治疗模式更符合IBD慢性难治的病理生理特点,在未来可能具有更为广阔的应用前景。然而,本研究仍存在以下不足:首先,以尾静脉注射AAV为治疗策略并未以肠道为靶向组织,多器官感染AAV仍存在潜在风险,在研究方法上可以通过AAV载体上增加肠道特异性启动子或者采用肠系膜下静脉注射的方法靶向肠道达到过表达IL22的目的。其次,既往研究表明IL22可以在通过抑制TGFβ1受体表达及下游Smad2/3通路激活从而对原发性肺纤维化起到治疗作用[25]。另外,本研究主要探究了IL22对急性DSS肠炎的调控作用,而IL22对于慢性DSS诱导结肠炎的保护作用及对慢性纤维化的治疗作用尚有待探索。最后,本研究缺少对于IL22分泌相关免疫细胞的相关研究,未来可通过调控ILC3、Th22等IL22分泌的免疫细胞,精准实现IL22生理局部器官过表达,从而开拓IBD免疫治疗新策略。
综上所述,本研究探索了IL22对于DSS模型下肠道屏障功能修复、炎症稳态调节的重要作用,证实了AAV-IL22这一新型干预策略的高效性,为IBD的治疗提供新的思路。
| [1] |
KAPLAN G G. The global burden of IBD: from 2015 to 2025[J]. Nat Rev Gastroenterol Hepatol, 2015, 12(12): 720-727. DOI:10.1038/nrgastro.2015.150 |
| [2] |
PARIGI T L, D'AMICO F, ABREU M T, et al. Difficult-to-treat inflammatory bowel disease: results from an international consensus meeting[J]. Lancet Gastroenterol Hepatol, 2023, 8(9): 853-859. DOI:10.1016/S2468-1253(23)00154-1 |
| [3] |
PIOVANI D, DANESE S, PEYRIN-BIROULET L, et al. Environmental risk factors for inflammatory bowel diseases: an umbrella review of meta-analyses[J]. Gastroenterology, 2019, 157(3): 647-659. e4. DOI:10.1053/j.gastro.2019.04.016 |
| [4] |
FAYE A S, COLOMBEL J F. Aging and IBD: a new challenge for clinicians and researchers[J]. Inflamm Bowel Dis, 2022, 28(1): 126-132. DOI:10.1093/ibd/izab039 |
| [5] |
ORDÁS I, ECKMANN L, TALAMINI M, et al. Ulcerative colitis[J]. Lancet, 2012, 380(9853): 1606-1619. DOI:10.1016/s0140-6736(12)60150-0 |
| [6] |
KEIR M, YI T S, LU T, et al. The role of IL-22 in intestinal health and disease[J]. J Exp Med, 2020, 217(3): e20192195. DOI:10.1084/jem.20192195 |
| [7] |
SABAT R, OUYANG W, WOLK K. Therapeutic opportunities of the IL-22-IL-22R1 system[J]. Nat Rev Drug Discov, 2014, 13(1): 21-38. DOI:10.1038/nrd4176 |
| [8] |
NAMBU R, WARNER N, MULDER D J, et al. A systematic review of monogenic inflammatory bowel disease[J]. Clin Gastroenterol Hepatol, 2022, 20(4): e653-e663. DOI:10.1016/j.cgh.2021.03.021 |
| [9] |
KIM S, HONG E H, LEE C K, et al. Amelioration of DSS-induced acute colitis in mice by recombinant monomeric human interleukin-22[J]. Immune Netw, 2022, 22(3): e26. DOI:10.4110/in.2022.22.e26 |
| [10] |
HSUEH Y H, CHANG Y N, LOH C E, et al. AAV-IL-22 modifies liver chemokine activity and ameliorates portal inflammation in murine autoimmune cholangitis[J]. J Autoimmun, 2016, 66: 89-97. DOI:10.1016/j.jaut.2015.10.005 |
| [11] |
PUPO A, FERNÁNDEZ A, LOW S H, et al. AAV vectors: the Rubik's cube of human gene therapy[J]. Mol Ther, 2022, 30(12): 3515-3541. DOI:10.1016/j.ymthe.2022.09.015 |
| [12] |
KUZMIN D A, SHUTOVA M V, JOHNSTON N R, et al. The clinical landscape for AAV gene therapies[J]. Nat Rev Drug Discov, 2021, 20(3): 173-174. DOI:10.1038/d41573-021-00017-7 |
| [13] |
BEZZIO C, DELLA CORTE C, VERNERO M, et al. Inflammatory bowel disease and immune-mediated inflammatory diseases: looking at the less frequent associations[J]. Therap Adv Gastroenterol, 2022, 15: 17562848221115312. DOI:10.1177/17562848221115312 |
| [14] |
JIANG P, ZHENG C, XIANG Y, et al. The involvement of TH17 cells in the pathogenesis of IBD[J]. Cytokine Growth Factor Rev, 2023, 69: 28-42. DOI:10.1016/j.cytogfr.2022.07.005 |
| [15] |
PELCZAR P, WITKOWSKI M, PEREZ L G, et al. A pathogenic role for T cell-derived IL-22BP in inflammatory bowel disease[J]. Science, 2016, 354(6310): 358-362. DOI:10.1126/science.aah5903 |
| [16] |
ROTHENBERG M E, WANG Y H, LEKKERKERKER A, et al. Randomized phase Ⅰ healthy volunteer study of UTTR1147A (IL-22Fc): a potential therapy for epithelial injury[J]. Clin Pharmacol Ther, 2019, 105(1): 177-189. DOI:10.1002/cpt.1164 |
| [17] |
LAURENCE A, SHEA J J, WATFORD W T. Interleukin-22: a sheep in wolf's clothing[J]. Nat Med, 2008, 14(3): 247-249. DOI:10.1038/nm0308-247 |
| [18] |
SEIDERER J, BRAND S. IL-22: a two-headed cytokine in IBD?[J]. Inflamm Bowel Dis, 2009, 15(3): 473-474. DOI:10.1002/ibd.20625 |
| [19] |
HEBERT K D, MCLAUGHLIN N, GALEAS-PENA M, et al. Targeting the IL-22/IL-22BP axis enhances tight junctions and reduces inflammation during influenza infection[J]. Mucosal Immunol, 2020, 13(1): 64-74. DOI:10.1038/s41385-019-0206-9 |
| [20] |
ZHAO Y X, LUAN H F, JIANG H, et al. Gegen Qinlian Decoction relieved DSS-induced ulcerative colitis in mice by modulating Th17/Treg cell homeostasis via suppressing IL-6/JAK2/STAT3 signaling[J]. Phytomedicine, 2021, 84: 153519. DOI:10.1016/j.phymed.2021.153519 |
| [21] |
KAYAMA H, OKUMURA R, TAKEDA K. Interaction between the microbiota, epithelia, and immune cells in the intestine[J]. Annu Rev Immunol, 2020, 38: 23-48. DOI:10.1146/annurev-immunol-070119-115104 |
| [22] |
ZWARYCZ B, GRACZ A D, RIVERA K R, et al. IL22 inhibits epithelial stem cell expansion in an ileal organoid model[J]. Cell Mol Gastroenterol Hepatol, 2019, 7(1): 1-17. DOI:10.1016/j.jcmgh.2018.06.008 |
| [23] |
BEVINS C L, SALZMAN N H. Paneth cells, antimicrobial peptides and maintenance of intestinal homeostasis[J]. Nat Rev Microbiol, 2011, 9(5): 356-368. DOI:10.1038/nrmicro2546 |
| [24] |
SERAFINI N, JARADE A, SURACE L, et al. Trained ILC3 responses promote intestinal defense[J]. Science, 2022, 375(6583): 859-863. DOI:10.1126/science.aaz8777 |
| [25] |
GU P Y, WANG D D, ZHANG J, et al. Protective function of interleukin-22 in pulmonary fibrosis[J]. Clin Transl Med, 2021, 11(8): e509. DOI:10.1002/ctm2.509 |




