2. 400038 重庆,陆军军医大学(第三军医大学)药学与检验医学系生药学与中药学教研室
2. Department of Pharmacognosy and Traditional Chinese Pharmacy, Faculty of Pharmacy and Laboratory Medicine, Amy Medical University (Third Military Medical Univerisity), Chongqing, 400038, China
肾移植是终末期肾衰竭患者的最佳治疗选择[1-2]。然而,供体器官短缺仍是全球亟待解决的重大医疗问题[3]。因此在供体器官严重缺乏的背景下,拓展心脏死亡后供体(donation after circulatory death,DCD)的应用能在一定程度上缓解器官移植来源不足的状况,扩大供体池[4]。但是DCD供体因热缺血时间长限制了其临床应用,发生移植物短期和长期功能障碍的风险增加[5]。因此,任何提高DCD供体保存质量的策略均有利于扩大器官移植供体库,同时也将有助于改善移植器官术后功能。右美托咪定(Dexmedetomidine,Dex)是一种高选择性α2肾上腺素能受体激动剂,能通过减少炎症反应,抗氧化应激,激活抗凋亡信号通路减轻缺血再灌注损伤,进而保护细胞,并对神经系统、心、肺、肾、肝、小肠等多种器官具有保护作用[6]。故本研究通过构建大鼠DCD供肾模型,在常用器官保存液(威斯康星大学器官保存液,University of Wisconsin solution,UW液)中添加不同浓度Dex,探索不同浓度Dex对DCD供肾的保护作用及潜在机制。
1 材料与方法 1.1 实验动物6~7周龄健康清洁级雄性SD大鼠40只,体质量180~200 g,购自陆军军医大学实验动物中心。所有动物实验经过大学实验动物福利伦理审查委员会批准,并获得动物伦理证明(AMUWEC20224009),动物实验的操作过程符合动物伦理和动物福利要求。
1.2 药品与试剂Dex购自美国sigma公司;UW液购自美国器官修复医疗科技股份有限公司;肾组织损伤因子1(kidney injury molecule-1,KIM-1)一抗购自武汉博士德生物工程有限公司;丙二醛(MDA)测定试剂盒、总超氧化物歧化酶(T-SOD)测试盒、N-乙酰-β-D-氨基葡萄糖苷酶(N-acetyl-β-D-glucosaminidase,NAG)试剂盒购自南京建成生物工程研究所;注射用苯巴比妥钠购自福建省闽东力捷迅药业有限公司;肝素钠注射液购自常州千红生化制药股份有限公司;Caspase-3一抗和HE染色试剂盒购自武汉赛维尔生物科技有限公司;链霉卵白素-生物素免疫组化检测试剂盒、DAB显色液购自北京中杉金桥生物技术有限公司;总RNA提取试剂盒购自北京天根生化科技有限公司;反转录试剂盒、qPCR试剂盒购自南京诺唯赞(vazyme)生物科技股份有限公司。
1.3 仪器与耗材手术器械购自山东新华手术器械有限公司;灭菌离心管购自浙江硕华生命科学研究股份有限公司;酶标仪购自美国Bio-Rad公司;移液器购自北京大龙兴创实验仪器公司;电动吸引器购自江苏鱼跃医疗设备股份有限公司;正置荧光显微镜购自德国ZEISS公司;PCR仪购自成都百乐科技有限公司;高速冷冻离心机购自Eppendorf中国有限公司。
1.4 方法 1.4.1 实验分组将40只雄性SD大鼠随机分为8组(n=5):对照组(NC组)、模型组(0 nmol/L Dex组)和6个不同浓度Dex组(0.1、1、10、100、1 000、10 000 nmol/L)。NC组大鼠DCD供肾(热缺血30 min) 获取后部分直接4%多聚甲醛固定,一部分-80 ℃保存,不经过冷保存24 h。其余组DCD供肾分别经含相应浓度Dex的UW液冷保存24 h,一部分固定,一部分-80 ℃保存。
1.4.2 大鼠DCD供体肾脏模型构建和静态冷藏大鼠禁食水12 h后腹腔注射1%苯巴比妥钠1 mL,待其麻醉后固定于操作台上。股静脉注射肝素(312.5 U/mL)0.5~0.6 mL行全身肝素化,等待5 min。暴露切开颈动脉(放血法处死大鼠),利用吸引器于此处吸血,死亡时开始记录热缺血时间。开胸开腹暴露腹主动脉、肾脏,剪开右心耳,待热缺血30 min时用24 G留置针经腹主动脉插入肾动脉开始灌注肾脏(肾脏的灌注压力约为40 mmHg,流速为20 mL /min):NC组肾脏灌注5 mL生理盐水;其余组灌注相应器官保存液(0~4 ℃)5 mL。NC组摘取肾脏后剥去包膜,一侧肾脏直接4%多聚甲醛固定,另一侧肾脏置于-80 ℃冰箱保存,未经历冷保存24 h。其他各组灌注保存液后将剥去包膜的肾脏置于含相应浓度Dex的保存液中4 ℃保存24 h。冷藏后的肾脏部分用4%多聚甲醛固定,用于石蜡包埋、HE染色和免疫组化,部分置于-80 ℃冰箱保存,用于SOD、MDA、NAG、q-PCR检测。
1.4.3 肾脏组织病理学观察肾脏经固定后行石蜡包埋切片(4 μm),脱蜡和HE染色,于光镜下观察肾皮质病理学结果。每张切片随机选取10个不重复视野,采用双盲法行组织损伤评分,并计算样本平均值。根据Banff标准[7],对肾皮质损伤进行0~4级评分。根据肾小管损伤的严重程度进行半定量评分[7-8]:无损伤记0分,≤25%为轻度记1分,26%~50%为中度记2分,51%~75%为重度记3分,>75%为极重度记4分。
1.4.4 免疫组化法检测肾组织Caspase-3和KIM-1的表达石蜡切片于60 ℃烘箱烤片2 h,依次经新鲜二甲苯Ⅰ、二甲苯Ⅱ各10 min,无水乙醇Ⅰ、无水乙醇Ⅱ、95%酒精、85%酒精、75%酒精、50%酒精各5 min脱蜡至水,PBS清洗5 min。采用EDTA(pH=8.0)抗原修复液于高压锅内热修复5 min,自然冷却后3%双氧水封闭内源性过氧化氢酶室温30 min,PBS漂洗3次,每次5 min,10%牛血清白蛋白和10%山羊血清封闭内源性抗原,室温60 min。后分别滴加Caspase-3一抗(1 ∶200)、KIM-1一抗(1 ∶200),4 ℃孵育过夜,复温0.5 h,滴加二抗(生物素标记山羊抗兔IgG)室温孵育15 min,滴加辣根酶标记链霉卵白素工作液室温孵育15 min,DAB显色、苏木精复染后依次分化、反蓝、脱水,滴加中性树胶封片。于光镜下观察并采集图片,Image J软件进行灰度计算与半定量分析(AOD=IOD/Area)。
1.4.5 肾脏组织中NAG、T-SOD、MDA测定将肾组织从-80 ℃冰箱中取出,称取20 mg后通过在研钵内加液氮的方法研磨肾组织,再加入0.9% 的生理盐水,制备成浓度约为10%的匀浆液,立即放入高速冷冻离心机离心10 min后取上清液,分别按照试剂盒说明书操作,采用比色法测定NAG活力,羟胺法测定T-SOD活力、TBA法测定MDA含量。
1.4.6 RT-qPCR法测定IL-6 mRNA和TNF-α mRNA扩增水平用总RNA提取试剂盒提取肾组织的RNA,使用超微量分光光度计确认RNA样品的纯度和浓度,重复测量3次取平均值。RNA样品按反转录第一链cDNA合成试剂盒(HiScript®Ⅲ RT SuperMix for qPCR)说明书配制反转录反应体系,离心混匀后进行反转录反应合成cDNA。按照qPCR试剂盒说明书(Taq Pro Universal SYBR qPCR Master Mix)以cDNA为模板配制PCR反应体系,离心混匀,扩增反应条件:95 ℃,3 min;95 ℃,15 s,60 ℃,30 s,40个循环。以采集到的循环阈值(Ct值)作为统计数据,GAPDH为内参基因,使用表达倍数= 2-△△Ct法计算各组目的基因相对表达水平。本研究所使用的引物序列见表 1。
| 引物 | 上游序列 | 下游序列 |
| GAPDH | CTGGAGAAACCTGCCAAGTATG | GGTGGAAGAATGGGAGTTGCT |
| IL-6 | AACAGCCAACGAATCCCAGAC | TTGTTTTTACAGGAGAGGGTAGACA |
| TNF-α | TCAGTTCCATGGCCCAGAC | GTTGTCTTTGAGATCCATGCCATT |
1.5 统计学分析
实验数据以x±s表示。采用Graph Pad Prism 8软件进行统计分析和作图,数据分析采用单因素方差分析(ANOVA)、Turkey多重比较,P < 0.05为差异有统计学意义。
2 结果 2.1 各组肾脏病理形态学变化HE染色显示:NC组结构保存完好,肾小管、肾小球形态与组织结构清晰,核仁清晰,细胞质染色均匀,肾小球壁层(单层扁平细胞)和脏层足细胞完整连续,未见肾小管明显扩张。冷保存24 h后的肾脏部分肾小球壁层和脏层细胞完整性被破坏,肾小管扩张。其他各组肾组织损伤评分较之NC组增加;与0 nmol/L Dex组(肾损伤评分2.14±0.34)比较,100 nmol/L Dex组和1 000 nmol/L Dex组肾组织损伤评分分别降低至(1.33±0.26)和(1.30±0.16),差异有统计学意义(P < 0.05,图 1)。
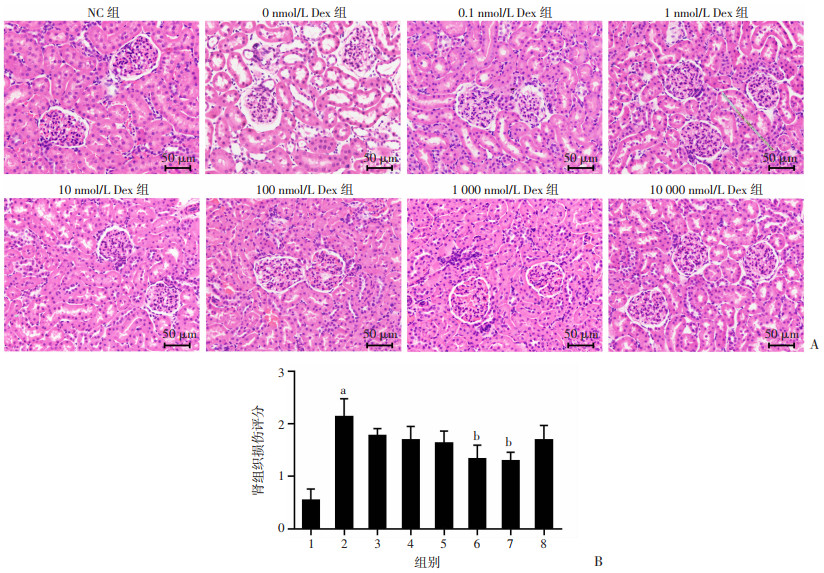
|
|
A:肾脏病理学观察;B:肾组织损伤评分(n=5,x±s) 1: NC组;2:0 nmol/L Dex组;3:0.1 nmol/L Dex组;4:1 nmol/L Dex组;5:10 nmol/L Dex组;6:100 nmol/L Dex组;7:1 000 nmol/L Dex组;8:10 000 nmol/L Dex组;a: P < 0.05, 与NC组比较;b: P < 0.05, 与0 nmol/L Dex组比较 图 1 各组大鼠肾脏病理学观察及损伤评分 |
2.2 各组肾脏组织KIM-1和NAG的表达情况
免疫组化结果显示:KIM-1的表达主要分布于肾小管。与NC组比较,经冷缺血24 h后其余各组肾组织KIM-1的表达量增加。与0 nmol/L Dex组比较,1、10、100和1 000 nmol/L Dex组肾组织KIM-1的表达量显著降低(P < 0.05);与0.1 nmol/L Dex组比较,100、1 000 nmol/L Dex组肾组织KIM-1的表达量降低(P < 0.05),见图 2A、B。经比色法测定NAG活力显示:与NC组比较,0 nmol/L Dex组的NAG活力增加(P < 0.05);与0 nmol/L Dex组比较,100、1 000 nmol/L Dex组NAG活力降低,差异有统计学意义(P < 0.05),见图 2C。
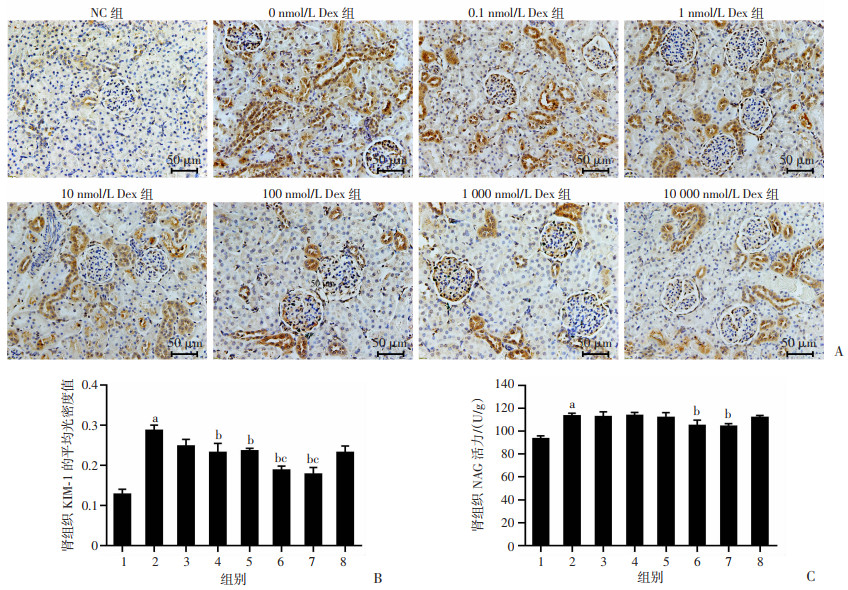
|
|
A:免疫组化检测KIM-1表达;B:KIM-1的平均光密度值;C:NAG活力 1: NC组;2:0 nmol/L Dex组;3:0.1 nmol/L Dex组;4:1 nmol/L Dex组;5:10 nmol/L Dex组;6:100 nmol/L Dex组;7:1 000 nmol/L Dex组;8:10 000 nmol/L Dex组;a: P < 0.05, 与NC组比较;b: P < 0.05, 与0 nmol/L Dex组比较;c: P < 0.05, 与0.1 nmol/L Dex组比较 图 2 各组大鼠肾脏组织KIM-1和NAG表达水平比较(n=4,x±s) |
2.3 免疫组化检测各组肾脏细胞凋亡情况
免疫组化结果显示,Caspase-3的表达分布于肾小球和肾小管。与NC组比较,经冷缺血24 h后其余各组肾组织Caspase-3的表达量均增加。与0 nmol/L Dex组比较,100、1 000 nmol/L Dex组肾组织Caspase-3的表达量显著降低(P < 0.05);与10 nmol/L Dex组比较,1 000 nmol/L Dex组肾组织Caspase-3的表达量降低(P < 0.05),见图 3。
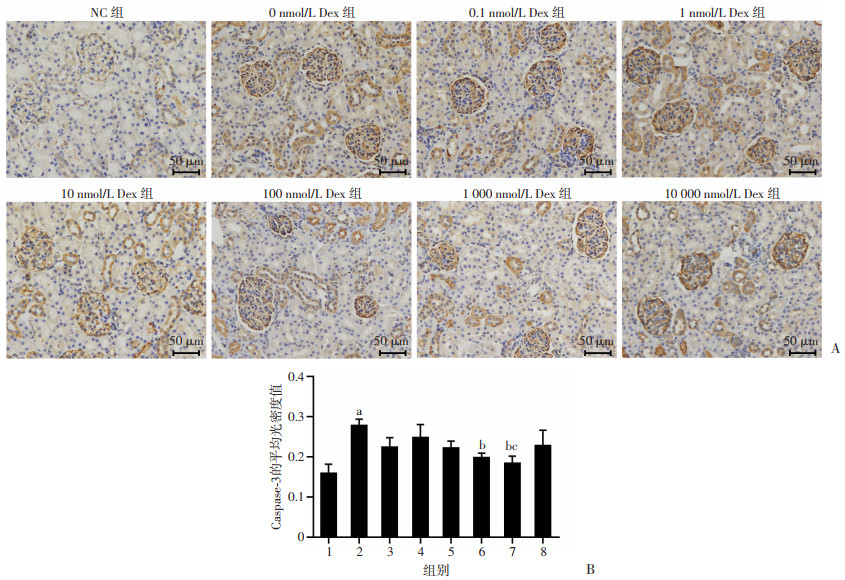
|
|
A:免疫组化检测Caspase-3表达;B:Caspase-3的平均光密度值 1: NC组;2:0 nmol/L Dex组;3:0.1 nmol/L Dex组;4:1 nmol/L Dex组;5:10 nmol/L Dex组;6:100 nmol/L Dex组;7:1 000 nmol/L Dex组;8:10 000 nmol/L Dex组;a: P < 0.05, 与NC组比较;b: P < 0.05, 与0 nmol/L Dex组比较;c: P < 0.05, 与10 nmol/L Dex组比较 图 3 各组大鼠肾脏组织Caspase-3表达水平比较(n=4,x±s) |
2.4 各组肾脏组织总SOD活力和MDA含量的变化
与NC组比较:经冷缺血24 h后其余各组肾组织总SOD活力降低。与0、0.1、10 nmol/L Dex组比较,1 000 nmol/L Dex组肾组织总SOD活力增加,差异有统计学意义(P < 0.05,图 4A)。经冷缺血24 h后其余各组肾组织MDA含量较NC组增加。与0 nmol/L Dex组比较:1、10、100、1 000和10 000 nmol/L Dex组肾组织MDA含量降低,差异有统计学意义(P < 0.05)。与0.1 nmol/L Dex组比较:100、1 000 nmol/L Dex组肾组织MDA含量降低(P < 0.05,图 4B)。
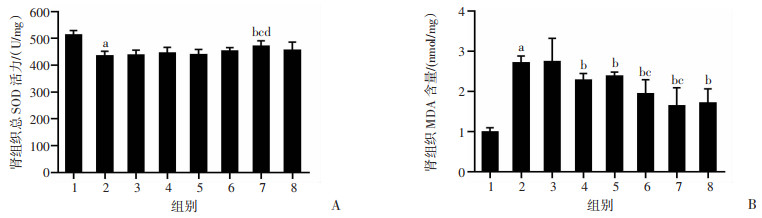
|
|
A:总SOD活力;B:MDA含量 1: NC组;2:0 nmol/L Dex组;3:0.1 nmol/L Dex组;4:1 nmol/L Dex组;5:10 nmol/L Dex组;6:100 nmol/L Dex组;7:1 000 nmol/L Dex组;8:10 000 nmol/L Dex组;a: P < 0.05, 与NC组比较;b: P < 0.05, 与0 nmol/L Dex组比较;c: P < 0.05, 与0.1 nmol/L Dex组比较;d: P < 0.05, 与10 nmol/L Dex组比较 图 4 各组大鼠肾脏组织总SOD和MDA表达水平比较(n=4,x±s) |
2.5 各组肾脏组织IL-6和TNF-α的mRNA的变化
RT-qPCR检测结果提示(图 5):与NC组比较,0 nmol/L Dex组肾组织IL-6的mRNA表达增加(P < 0.05)。与0 nmol/L Dex组比较:0.1、1、10、100和1 000 nmol/L Dex组IL-6的mRNA表达显著降低(P < 0.05),所有不同浓度Dex组TNF-α的mRNA表达显著降低(P < 0.05)。与0.1 nmol/L Dex组比较:10、100和1 000 nmol/L Dex组IL-6和TNF-α的mRNA表达量降低(P < 0.05)。与1 nmol/L Dex组比较:10、100和1 000 nmol/L Dex组TNF-α的mRNA表达降低(P < 0.05)。与10 nmol/L Dex组比较:100、1 000 nmol/L Dex组TNF-α的mRNA表达降低(P < 0.05)。
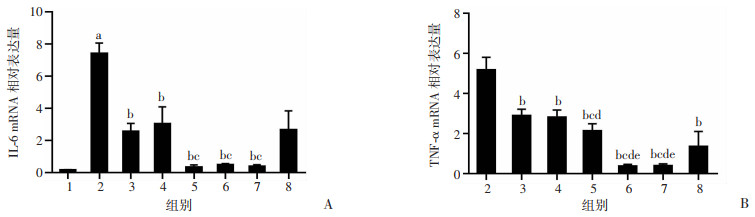
|
|
A:IL-6;B:TNF-α 1: NC组;2:0 nmol/L Dex组;3:0.1 nmol/L Dex组;4:1 nmol/L Dex组;5:10 nmol/L Dex组;6:100 nmol/L Dex组;7:1 000 nmol/L Dex组;8:10 000 nmol/L Dex组;a: P < 0.05, 与NC组比较;b: P < 0.05, 与0 nmol/L Dex组比较;c: P < 0.05, 与0.1 nmol/L Dex组比较;d: P < 0.05, 与1 nmol/L Dex组比较;e: P < 0.05, 与10 nmol/L Dex组比较 图 5 各组大鼠肾脏组织IL-6和TNF-α的mRNA表达水平比较(n=4,x±s) |
3 讨论 3.1 DCD供体应用背景及意义
器官移植被认为是治疗各种器官(如肾、肝、肠、心和肺等)终末期疾病的成功方法[9]。但供体器官严重短缺使器官移植受到很大限制[10]。为缓解供体器官的供需严重不平衡,DCD供体器官的使用正在逐渐增加。然而DCD供体器官热缺血时间较长,发生移植物原发性无功能(primary non-function,PNF)和功能延迟(delayed graft function,DGF)的比例较高[11]。因此,任何提高DCD供体保存质量和利用率的有效策略,是解决供体器官缺乏的重要手段,有利于扩大供体库,改善移植后的移植物功能,从而使更多的终末期器官疾病患者得到器官移植的机会,具有重要的现实意义。DCD多为车祸、创伤等意外因素所致,故器官热缺血时间较长,器官远距离运输及冷藏保存可进一步加重供体器官损伤。根据《中国移植器官保护专家共识(2016版)》[12]:在无血压情况下,热缺血时间>20 min则肾移植效果较差,供肾可接受热缺血时间一般不超过60 min,肾脏冷保存时间不超过24 h。据此,本研究所建立的DCD供肾模型选择热缺血30 min,冷缺血时间24 h。
3.2 研究结果及原因分析本研究通过建立大鼠DCD供肾模型,将肾脏置于含不同浓度Dex的保存液中冷保存24 h,模拟DCD供肾静态冷藏状态。在构建DCD供肾模型中,心脏停搏后相关的缺氧和低血压导致全身血流动力学紊乱和代谢异常,可能导致热缺血期间的细胞损伤。此外,静态冷藏期间细胞代谢减缓但并不停止,腺嘌呤核苷三磷酸(ATP)需求过程仍在继续,静态冷藏可能进一步加重热缺血引起的肾损伤[13]。本研究结果显示,大鼠DCD供肾经热缺血30 min后再静态冷藏24 h,引起了供体肾脏不同程度的结构损伤,包括肾小管扩张,刷状缘脱落或消失,核染色部分消失。Dex干预后可降低肾组织损伤评分,以100、1 000 nmol/L Dex组形态学组织结构保存更佳。
判断肾脏损伤常采用血肌酐、尿素氮、肾小球滤过率、尿常规、渗透压等几项指标,但多数情况下当这些指标增高时,很多肾脏损害已经非常严重或已产生了不可逆的损伤,这些显然不是早期发现肾脏损伤的敏感指标。肾损伤分子1(kidney injury molecule-1,KIM-1) 是一种Ⅰ型跨膜蛋白,具有免疫球蛋白和粘蛋白结构域,在缺血后肾近端小管中表达明显上调[14]。正常情况下,肾脏组织几乎不表达KIM-1蛋白,但是在肾脏损伤后数小时内KIM-1的表达水平即显著升高。在检测到估算肾小球滤过率改变之前,KIM-1已被证明是肾损伤的良好预测指标,KIM-1上调是肾近端肾小管损伤的公认结果[15]。N-乙酰-β-D-氨基葡萄糖苷酶(NAG)是一种细胞内溶酶体糖苷酶,可催化糖脂和糖蛋白中末端葡萄糖残基的水解,组织损伤时NAG的快速升高和稳定性使其成为各种病理状况早期诊断和严重程度评估的敏感临床标志物[16]。KIM-1联合NAG酶检测早期急性肾损伤,具有准确性高、特异性好、假阳性率低等优点,因此本研究选择这两项指标评估肾损伤。本研究发现KIM-1、NAG的检测结果与前述形态学表现一致。
Dex作为α2肾上腺素能受体(α2AR)激动剂,据报道Dex可以通过减少氧化应激、抑制炎症反应[17-19],抗凋亡[18, 20]减轻缺血再灌注损伤,对细胞提供保护作用。缺血再灌注损伤是器官移植过程中不可避免的损伤[21-22]。本课题组前期研究也已证实,Dex可改善肾缺血再灌注损伤[23];Dex可激活PI3K-Akt信号通路抑制肺细胞凋亡,减轻肾缺血再灌注所致急性肺损伤[20];Dex除了直接作用于α2AR外,还通过副交感神经系统激活的抗炎作用,减轻缺血再灌注损伤后的肾损伤,提供肾脏保护效果[24]。据此,本研究在探索Dex对DCD供肾保护作用的机制中选择了细胞凋亡、氧化应激和炎症反应的关键信号分子进行检测验证。
细胞凋亡标志物Caspase-3是一种促凋亡蛋白[25]。超氧化物歧化酶(SOD)和丙二醛(MDA)是评价氧化应激过程中使用最多的两个指标。SOD催化超氧阴离子分解为氧(O2)和过氧化氢(H2O2),是一种生物体内清除超氧阴离子自由基的重要的抗氧化酶,有效地去除活性氧,保护细胞免受氧自由基的损害,维持活性氧的正常代谢[26]。MDA是脂质与氧自由基反应形成的产物之一,其含量代表脂质过氧化的程度。SOD与MDA分别作为评价氧化应激在抗氧化能力和氧化能力方面的重要指标[27]。研究发现Dex通过抑制ROS / JNK途径减少细胞凋亡和抗氧化应激,下调Bax,细胞色素C,Caspase-9和Caspase-3的表达,减少MDA、活性氧(ROS)的产生和提高SOD活力,从而防止大鼠急性应激引起的肾损伤[28]。本研究显示Dex可减轻DCD供肾的细胞凋亡和抗氧化应激,以100 nmol/L Dex和1 000 nmol/L Dex组较为显著。TNF-α、IL-1β和IL-6是最常用的促炎细胞因子[29]。TNF-α和IL-6的释放可进一步加剧促炎反应,加重细胞的损伤。研究发现,Dex预处理可减轻大鼠原位自体肝移植后急性肾损伤,通过抑制TLR4/MyD88/NF-κB通路激活,减少促炎因子TNF-α和IL-1β的释放,降低尿素和SCr水平,有肾脏保护作用[30]。胰肾同时移植患者术中持续输注Dex,Dex通过减少炎症因子TNF-α和IL-6的释放来减轻对术后的心肌损伤[31]。本研究显示Dex可降低促炎因子TNF-α和IL-6的表达,炎症因子随Dex浓度的增加而降低,但在10 000 nmol/L时未见进一步降低。这些结果表明,Dex对DCD供肾发挥器官保护效应的机制涉及抑制细胞凋亡、氧化应激和炎症反应。且Dex对肾脏保护是剂量依赖性的,这与以前的报道一致。
3.3 Dex的作用机制及在肾移植中的临床应用Dex是目前临床应用的一种高选择性α2AR激动剂,激活α2AR是发挥器官保护作用的主要机制。Dex与G蛋白(G蛋白由α、β和γ三个亚基组成)偶联, 通过细胞内不同信号传导机制, 产生不同的效应。激活腺苷酸环化酶的G蛋白被称为Gs,其他抑制剂称为Gi。Dex主要与Gi结合,一方面,通过Gαi蛋白直接抑制AC-cAMP-PKA通路[32]; 另一方面,Gβ、Gγ亚基与Gαi分离激活PI3K/Akt通路,影响MEK/ERK、HGMB1/TLR4/NFκB等一系列下游信号通路[33-34]。但在高浓度的激动剂和高受体表达情况下,Dex可能与Gs偶联,产生相反的生理效应[6]。因此本研究结果显示随着Dex浓度增加呈现出双相效应,太高浓度Dex的保护效果无进一步增加或效果变差。
Dex在临床肾移植应用中,据一项随机临床试验研究,围术期静脉输注Dex 24 h可降低DCD肾移植术后DGF的发生率[35]。在另一项前瞻性、随机、对照、单盲研究中,术中及术后2 h接受Dex输注的肾移植受者术后肌酐水平降低,早期肾功能更好[36]。但也有研究报道,术中输注Dex对选择性活体供肾移植患者的肾功能或DGF没有任何有益影响[37]。
3.4 研究优势及局限性本研究基于DCD供肾模型,通过改变保存液介质的技术扩展DCD供体的应用,扩大供体池。该策略操作简单易实施,易推广应用。但本研究未能验证Dex在体内实验肾移植中的保护作用,有待进一步研究;未深入探索Dex抑制细胞凋亡、炎症反应和氧化应激的具体分子机制。
3.5 研究意义综上所述,Dex可通过抑制细胞凋亡、氧化应激和炎症反应,减少肾组织损伤,实现对DCD供肾的保护作用。在不同浓度的Dex组中,以100 nmol/L Dex组和1 000 nmol/L Dex组展现出对DCD供体肾脏更好的保护效应。这对于拓展DCD供体器官的有效应用,扩大供体库,提高供体器官的保存质量和存活率具有重要的参考意义。
| [1] |
ARZE AIMARETTI L, ARZE S. Preemptive renal transplantation—the best treatment option for terminal chronic renal failure[J]. Transplant Proc, 2016, 48(2): 609-611. |
| [2] |
LU T, YANG B, WANG R, et al. Xenotransplantation: current status in preclinical research[J]. Front Immunol, 2019, 10: 3060. |
| [3] |
OLIVA J. Therapeutic properties of mesenchymal stem cell on organ ischemia-reperfusion injury[J]. Int J Mol Sci, 2019, 20(21): 5511. |
| [4] |
BANKER A, BHATT N, RAO P S, et al. A review of machine perfusion strategies in liver transplantation[J]. J Clin Exp Hepatol, 2023, 13(2): 335-349. |
| [5] |
HOSGOOD S A, HOFF M, NICHOLSON M L. Treatment of transplant kidneys during machine perfusion[J]. Transpl Int, 2021, 34(2): 224-232. |
| [6] |
BAO N R, TANG B. Organ-protective effects and the underlying mechanism of dexmedetomidine[J]. Mediators Inflamm, 2020, 2020: 6136105. |
| [7] |
ROUFOSSE C, SIMMONDS N, CLAHSEN-VAN GRONINGEN M, et al. A 2018 reference guide to the Banff classification of renal allograft pathology[J]. Transplantation, 2018, 102(11): 1795-1814. |
| [8] |
JIA P, TENG J, ZOU J Z, et al. miR-21 contributes to xenon-conferred amelioration of renal ischemia-reperfusion injury in mice[J]. Anesthesiology, 2013, 119(3): 621-630. |
| [9] |
VAN ZANDEN J E, JAGER N M, DAHA M R, et al. Complement therapeutics in the multi-organ donor: do or don't?[J]. Front Immunol, 2019, 10: 329. |
| [10] |
LI X H, WEN L, LIU J, et al. Three-dimensional printing-driving liver therapies[J]. Curr Med Chem, 2021, 28(33): 6931-6953. |
| [11] |
SMITH M, DOMINGUEZ-GIL B, GREER D M, et al. Organ donation after circulatory death: current status and future potential[J]. Intensive Care Med, 2019, 45(3): 310-321. |
| [12] |
中国医师协会器官移植医师分会, 中华医学会外科学分会器官移植学组, 中国肝移植注册中心科学委员会. 中国移植器官保护专家共识(2016版)[J]. 器官移植, 2016, 7(5): 339-350. Organ Transplant Physicians of Chinese Medical Doctor Association, Organ Transplantation Group of Surgical Branch of Chinese Medical Association, Scientific Committee of China Liver Transplantation Registry. Chinese expert consensus on organ protection of transplantation (2016 edition)[J]. Organ Transplant, 2016, 7(5): 339-350. |
| [13] |
SAEB-PARSY K, MARTIN J L, SUMMERS D M, et al. Mitochondria as therapeutic targets in transplantation[J]. Trends Mol Med, 2021, 27(2): 185-198. |
| [14] |
HAN W K, BAILLY V, ABICHANDANI R, et al. Kidney Injury Molecule-1 (KIM-1): a novel biomarker for human renal proximal tubule injury[J]. Kidney Int, 2002, 62(1): 237-244. |
| [15] |
DE SILVA P M C S, MOHAMMED ABDUL K S, EAKANAYAKE E M D V, et al. Urinary biomarkers KIM-1 and NGAL for detection of chronic kidney disease of uncertain etiology (CKDu) among agricultural communities in Sri Lanka[J]. PLoS Negl Trop Dis, 2016, 10(9): e0004979. |
| [16] |
NIRALA N R, ASIKU J, DVIR H, et al. N-acetyl-β-d-glucosaminidase activity assay for monitoring insulin-dependent diabetes using Ag-porous Si SERS platform[J]. Talanta, 2022, 239: 123087. |
| [17] |
WU J, LI S T. Dexmedetomidine may produce extra protective effects on sepsis-induced diaphragm injury[J]. Chin Med J (Engl), 2015, 128(10): 1407-1411. |
| [18] |
SUN M, WANG R, XIA R, et al. Amelioration of myocardial ischemia/reperfusion injury in diabetes: a narrative review of the mechanisms and clinical applications of dexmedetomidine[J]. Front Pharmacol, 2022, 13: 949754. |
| [19] |
TÜFEK A, TOKGÖZ O, ALIOSMANOGLU I, et al. The protective effects of dexmedetomidine on the liver and remote organs against hepatic ischemia reperfusion injury in rats[J]. Int J Surg, 2013, 11(1): 96-100. |
| [20] |
LI J J, CHEN Q, HE X H, et al. Dexmedetomidine attenuates lung apoptosis induced by renal ischemia-reperfusion injury through α-2AR/PI3K/Akt pathway[J]. J Transl Med, 2018, 16(1): 1-11. |
| [21] |
KNIJFF L W D, VAN KOOTEN C, PLOEG R J. The effect of hypothermic machine perfusion to ameliorate ischemia-reperfusion injury in donor organs[J]. Front Immunol, 2022, 13: 848352. |
| [22] |
OCHANDO J, ORDIKHANI F, BOROS P, et al. The innate immune response to allotransplants: mechanisms and therapeutic potentials[J]. Cell Mol Immunol, 2019, 16(4): 350-356. |
| [23] |
GU J T, SUN P, ZHAO H L, et al. Dexmedetomidine provides renoprotection against ischemia-reperfusion injury in mice[J]. Crit Care, 2011, 15(3): R153. |
| [24] |
MA J B, CHEN Q, LI J J, et al. Dexmedetomidine-mediated prevention of renal ischemia-reperfusion injury depends in part on cholinergic anti-inflammatory mechanisms[J]. Anesth Analg, 2020, 130(4): 1054-1062. |
| [25] |
SHEN W C, CHOU Y H, HUANG H P, et al. Induced pluripotent stem cell-derived endothelial progenitor cells attenuate ischemic acute kidney injury and cardiac dysfunction[J]. Stem Cell Res Ther, 2018, 9(1): 1-12. |
| [26] |
GUAN T C, SONG J, WANG Y N, et al. Expression and characterization of recombinant bifunctional enzymes with glutathione peroxidase and superoxide dismutase activities[J]. Free Radic Biol Med, 2017, 110: 188-195. |
| [27] |
赵雪莹, 赵玺宣, 黄振龙, 等. 二至丸活性部位对D-半乳糖衰老模型大鼠SOD、MDA、MAO、LPF及衰老相关蛋白P16、P21影响的研究[J]. 中医药学报, 2023, 51(3): 35-40. ZHAO X Y, ZHAO X X, HUANG Z L, et al. Effect of erzhi pill active parts on SOD, MDA, MAO, LPF and senescence related proteins of P16 and P21 in aging rats induced by D-galactoseon[J]. Acta Chin Med Pharmacol, 2023, 51(3): 35-40. |
| [28] |
CHEN Y P, FENG X J, HU X Y, et al. Dexmedetomidine ameliorates acute stress-induced kidney injury by attenuating oxidative stress and apoptosis through inhibition of the ROS/JNK signaling pathway[J]. Oxidative Med Cell Longev, 2018, 2018: 1-12. |
| [29] |
HENSHAW F R, DEWSBURY L S, LIM C K, et al. The effects of cannabinoids on pro- and anti-inflammatory cytokines: a systematic review of in vivo studies[J]. Cannabis Cannabinoid Res, 2021, 6(3): 177-195. |
| [30] |
YAO H, CHI X J, JIN Y, et al. Dexmedetomidine inhibits TLR4/NF-κB activation and reduces acute kidney injury after orthotopic autologous liver transplantation in rats[J]. Sci Rep, 2015, 5(1): 1-12. |
| [31] |
DONG A L, ZHANG Y J, LU S J, et al. Influence of dexmedetomidine on myocardial injury in patients with simultaneous pancreas-kidney transplantation[J]. Evid Based Complementary Altern Med, 2022, 2022: 1-8. |
| [32] |
GU X Y, LIU B L, ZANG K K, et al. Dexmedetomidine inhibits Tetrodotoxin-resistant Nav1.8 sodium channel activity through Gi/o-dependent pathway in rat dorsal root ganglion neurons[J]. Mol Brain, 2015, 8(1): 15. |
| [33] |
RONG H, ZHAO Z B, FENG J Y, et al. The effects of dexmedetomidine pretreatment on the pro- and anti-inflammation systems after spinal cord injury in rats[J]. Brain Behav Immun, 2017, 64: 195-207. |
| [34] |
DONNAHOO K K, MELDRUM D R, SHENKAR R, et al. Early renal ischemia, with or without reperfusion, activates NFkappaB and increases TNF-alpha bioactivity in the kidney[J]. J Urol, 2000, 163(4): 1328-1332. |
| [35] |
SHAN X S, HU L K, WANG Y Q, et al. Effect of perioperative dexmedetomidine on delayed graft function following a donation-after-cardiac-death kidney transplant[J]. JAMA Netw Open, 2022, 5(6): e2215217. |
| [36] |
WANG Y C, WANG M J, LEE C Y, et al. Effects of perioperative dexmedetomidine infusion on renal function and microcirculation in kidney transplant recipients: a randomised controlled trial[J]. Ann Med, 2022, 54(1): 1233-1243. |
| [37] |
PARK J H, KOO B N, KIM M S, et al. Effects of intraoperative dexmedetomidine infusion on renal function in elective living donor kidney transplantation: a randomized controlled trial[J]. Can J Anesth, 2022, 69(4): 448-459. |




