2. 400042 重庆, 陆军特色医学中心: 野战外科研究部战伤休克与输血研究室, 创伤与化学中毒全国重点实验室
2. State Key Laboratory of Trauma and Chemical Poisoning, Department of War Wound Shock and Transfusion, Institute of Surgery Research, Army Medical Center of PLA, Chongqing, 400042, China
高原地区地域辽阔,约占我国国土面积的1/4,也是我军未来的主要作战区域[1]。近年来,高原旅游业日渐兴旺,随之而来的高原相关疾病发病率逐渐增加,包括急性高山病、高原脑水肿和高原肺水肿等[2-3]。高原肺水肿(high altitude pulmonary edema,HAPE)是一种潜在的致命性疾病,指急进海拔>3 000 m地区的人群所发生的以乏力、呼吸困难、发绀、肺部湿啰音等为主要症状的一种非心源性肺水肿[4]。高原肺水肿的发病率为0.5%~1.0%,死亡率为10%。针对高原肺水肿,目前的治疗主要是通过补充氧气、高压氧舱、由高海拔快速下降或服用地塞米松、硝苯地平、西地那非等药物来缓解症状[5]。而高原环境下发生失血性休克所致肺水肿的发病率和死亡率更高,是平时和战时危及生命的重要问题。然而目前对于高原环境下发生失血性休克肺水肿暂未找到效果更完善的针对性防治措施。
失血性休克是由于血液在短时间内大量丢失所致,大量失血可致组织灌注严重不足,进一步加重缺氧,加重肺血管收缩,恶化肺的生理功能,死亡率极高[6]。目前针对平原失血性休克的治疗主要以液体复苏为主,但在高原环境中,特别是高原环境下发生失血性休克所致肺水肿,液体复苏有加剧肺水肿发生的风险[7]。因此,寻找能够有效保护高原环境下失血性休克患者肺水肿的措施具有极其重要的意义。
右美托咪定(dexmedetomidine,DEX)是临床上常用的镇静、镇痛药物,既往研究表明其对器官功能损伤有保护作用[8],ZHANG等[9]研究发现DEX通过上调沉默信息调节因子1/雷帕霉素靶蛋白(silent information regulator 1/mammalian target of rapamycin,SIRT1/mTOR)轴减少心肌细胞凋亡、氧化应激和炎症反应来减轻心肌缺血/再灌注损伤。HU等[10]报道DEX增加氧-葡萄糖剥夺的星形胶质细胞的活力并抑制其凋亡。在脂多糖诱导的急性肾损伤大鼠模型中,YANG等[11]表明DEX通过减少核苷酸结合域样受体蛋白3(nucleotide-binding domain-like receptor protein 3, NLRP3)炎性体和炎性细胞因子,通过5’-单磷酸腺苷活化蛋白/雷帕霉素靶蛋白(5’-adenosine monophosphate-activated protein kinase/mechanistic target of rapamycin, AMPK/mTOR)途径增强自噬来改善炎症反应。LI等[12]发现DEX通过降低磷酸化细胞外信号调节激酶1/2 (phosphorylation extracellular signal-regulated kinase,p-ERK1/2)蛋白的表达发挥对肺功能的保护作用。然而DEX对高原环境下发生失血性休克所致肺水肿是否具有保护作用尚不清楚。为此,本研究采用低压、低氧舱模拟高原环境,构建高原环境暴露后失血性休克肺水肿模型,观察DEX对高原环境暴露后失血性休克大鼠肺水肿的保护作用,以期为高原环境暴露后失血性休克合并肺水肿寻找新的防治措施。
1 材料与方法 1.1 材料 1.1.1 实验动物SPF级雄性SD大鼠280只,10周龄,体质量180~220 g,由陆军特色医学中心实验动物中心提供[SYXK(军)2017-0058]。饲养于SPF级动物饲养中心,温度维持在(22±2)℃,相对湿度维持在45%~65%,人工光照昼夜12 h循环,大鼠可自由获取食物和水。
1.1.2 实验试剂及耗材戊巴比妥钠购自美国Merck公司;右美托咪定购自中国扬子江药业集团有限公司;油酸购自中国生工生物工程股份有限公司;BCA蛋白浓度测定试剂盒购自美国Merck公司;多聚甲醛购自中国生工生物工程有限公司;PBS缓冲液购自中国博士德生物有限公司;生理盐水、复方氯化钠购自中国四川科伦股份有限公司;动物实验低压氧舱购自中国上海塔望科技有限公司;超低温冰箱购自德国Eppendorf公司;高速台式冷冻离心机购自美国Beckman Coulter公司;超声匀浆机购自德国IKA公司;电热恒温鼓风干燥箱购自中国银河试验仪器有限公司;全自动荧光酶标仪购自美国BioTek公司;倒置显微镜购自德国Leica公司;电子天平购自中国上海跃进医疗器械公司。
1.2 高原环境暴露后失血性休克模型制作将大鼠置于模拟海拔5 000 m低氧分压环境的低压舱内饲养48 h。动物进舱后以匀速减压上升的方式在约10 min达到海拔5 000 m,此时低压缺氧舱内氧含量为20.8%,湿度为58.7%,压力为53.8 kPa,二氧化碳浓度为0.65%,氧分压为11.2 kPa。之后各项指标基本维持在上述参数。室内温度需模拟高原昼夜温度差,并由中央空调统一控制,白天控制在22 ℃左右,夜晚约17 ℃(上下浮动≤2 ℃),期间可自由获取食物和水。出舱后经尾静脉注入油酸(5 μg/100 g)[13]。根据前期预实验,油酸的浓度不会引起明显的肺水肿。油酸诱导0.5 h后,经股动脉缓慢抽血至全身血量的40%~50%,模拟高原环境暴露后失血性休克。
1.3 实验分组及设计将SD大鼠按随机数字抽样法平均分为4组:①高原环境暴露后失血性休克(HS)组,低压舱内48 h后,出舱尾静脉注射生理盐水,1 h后尾静脉注射油酸(5 μL/100 g,1 mg/mL),0.5 h后经股动脉缓慢抽血(40%~50%全身血量),模拟高原肺水肿。②乳酸林格复苏(Lactated Ringer’s solution,LR)组,HS模型0.5 h后,股静脉输注LR(1.5倍失血量,输注速度25 mL/h)。③右美托咪定+ 乳酸林格复苏(DEX+LR)组,出舱后立即经尾静脉注射DEX(0.1 mL/kg,0.1 mg/mL) 预处理1 h,之后处理同乳酸林格复苏组。④高原对照(Sham)组,置于低压舱内48 h,出舱后尾静脉注射生理盐水。具体方案见表 1和图 1。
| 方法分组 | 出舱后即刻尾静脉注射 | 1 h后尾静脉注射油酸 | 0.5 h后构建失血性休克模型 | 0.5 h后LR复苏(1.5倍失血量) |
| Sham组 | 生理盐水(0.1mL/kg) | 否 | 否 | 否 |
| HS组 | 生理盐水(0.1mL/kg) | 是 | 是 | 否 |
| LR组 | 生理盐水(0.1mL/kg) | 是 | 是 | 是 |
| DEX+LR组 | DEX(0.1mL/kg) | 是 | 是 | 是 |
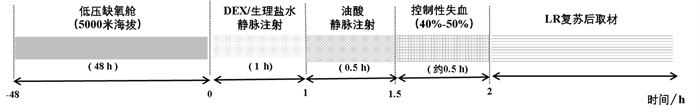
|
| 图 1 时间轴示意图 |
实验分5批进行,第一批(n=8),在治疗完成0.5 h后测定肺功能,后解剖大鼠并放血处死,取大鼠左肺上叶测定肺含水量。第二批(n=8),在治疗完成0.5 h后测定大鼠肺微血管通透性。第三批(n=8),在治疗完成0.5 h后,取大鼠肺泡灌洗液测定蛋白浓度。第四批(n=8),在复苏结束0.5 h后取动脉血做血气分析,取肺组织做病理切片。第五批(n=16)用于观察大鼠存活率和存活时间。
1.4 检测指标及方法 1.4.1 肺含水量(lung water content,LWC)测定取大鼠左肺上叶,在冰的PBS溶液中洗净表面的血迹,滤纸吸干肺叶水分,置于电子天平上称质量3次计算平均值,记为湿质量(g)。锡箔纸完整包裹肺叶并置于6孔板中,50 ℃恒温干燥箱中连续烘烤72 h,待质量恒定后,再次称量3次取平均值,并记为干质量。据公式LWC(%)=(肺湿质量-肺干质量)/肺湿质量×100%计算得出。
1.4.2 肺血管通透性大鼠经股静脉注射浓度为20 mg/mL伊文思蓝(evans blue,EB)60 mg/kg,0.5 h后同时结扎上下腔静脉,剪破腹主动脉并经颈静脉灌注PBS溶液,直至肺组织变白。取右肺上叶,蘸干水分后,加PBS溶液[右肺上叶的质量(g):PBS体积(mL)=0.07]在冰上匀浆,随后将匀浆液离心(加速离心力8 000×g、10 min、4℃)后取上清液继续离心(加速离心力16 000×g、10 min、4 ℃),测定上清液中EB的OD值(波长:620 nm)。另取上清液,使用BCA试剂盒测定蛋白浓度。最终用上清液中EB的OD值/蛋白浓度反映肺血管通透性。
1.4.3 全身体积描记系统测定大鼠肺功能将大鼠置于全身体积描记箱中10 min,让其适应环境,待大鼠平静下来且有效波形能达到90%以上时,连续记录1~2 min,选取6段平稳的波形,对其分析并计算潮气量(tidal volume,VT)、呼吸频率(breath frequency,f)、分钟通气量(minute volume,MV)。
1.4.4 苏木精-伊红(hematoxylin-eosin,HE)染色观察肺组织病理变化每组各取3只大鼠,同时结扎大鼠的上下腔静脉,剪破腹主动脉并经颈静脉缓慢灌注PBS溶液直至肺组织完全变白,更换4%多聚甲醛继续灌注,直至肺组织表面变硬(如鼻尖样触感)。取下完整的肺组织,在冰的PBS溶液中洗净,4%多聚甲醛固定48 h,随后切片(厚度约为1 cm)、脱水、石蜡包埋固定切片,HE染色后在倒置显微镜下观察肺组织形态并拍照。每张切片选取上、中、下、左、右5个具有代表性视野(200×),每个视野随机选取6个轮廓完整的肺泡,使用图像分析软件Image J测量每个肺泡左上、左下、右上、右下肺泡间隔厚度,并求平均值[14]。
1.4.5 大鼠肺泡灌洗液(bronchoalveolar lavage fluid, BALF)蛋白浓度分离大鼠气管,在第三、四气管环间插入灌胃管,深度约为2 cm,缓慢灌注2.5 mL预冷的生理盐水,并反复抽洗3次,收集到的肺泡灌洗液用BCA试剂盒测定蛋白浓度。
1.4.6 血气测定大鼠麻醉固定后进行股动、静脉插管,造模完成后抽取动脉血0.5 mL用血气分析仪测定动脉血气,包括动脉血氧分压(arterial partial pressure of oxygen,PaO2)、动脉血二氧化碳分压(arterial partial pressure of carbon dioxide,PaCO2)、动脉血氧饱和度(arterial oxygen saturation,SaO2)、酸碱度(potential of hydrogen,pH),乳酸(lactic acid,Lac)、标准碳酸氢盐(standard bicarbonate,SBC)、半饱和氧分压(partial pressure of semi saturated oxygen,P50)。
1.4.7 存活率和存活时间复苏结束后,拔出股动、静脉插管并结扎血管,缝合伤口,分别肌肉注射青霉素0.2万单位/kg、链霉素0.2万单位/kg。将大鼠放回鼠笼,连续观察72 h(每小时观察1次),期间可自由获取水和食物,记录大鼠72 h内的存活时间,计算存活率。
1.5 统计学分析采用SPSS 20.0统计软件进行分析。数据以x±s表示。多组比较进行单因素方差分析。检验水准α=0.05。
2 结果 2.1 DEX对高原环境暴露后失血性休克大鼠肺血管通透性的影响高原环境暴露后失血性休克可导致肺水肿增加,表现为肺含水量、肺泡灌洗液蛋白浓度及肺微血管通透性较Sham组,分别增加了2.8%、168.9%和47.3%。LR复苏后,肺水肿进一步加剧,与HS组比较,肺含水量、肺泡灌洗液蛋白浓度及肺微血管通透性分别增加了4.6%、43%和46.3%。DEX预处理可明显改善高原环境暴露后发生失血性休克大鼠的肺水肿,肺含水量、肺泡灌洗液蛋白浓度及肺微血管通透性均显著下降,与LR组比较,分别降低了5.3%、20%、50.9%,差异有统计学意义(P < 0.05,图 2A~C)。
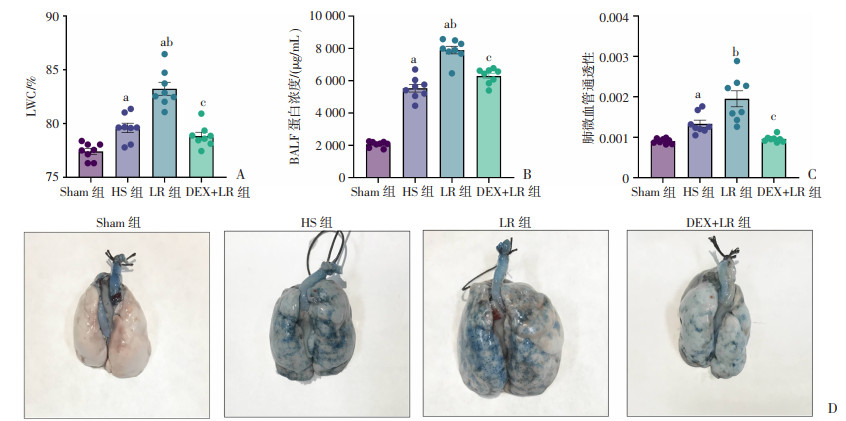
|
|
a:P < 0.05,与Sham组比较;b:P < 0.05,与HS组比较;c:P < 0.05,与LR组比较 A:DEX对高原环境暴露后失血性休克大鼠LWC的影响;B: DEX对高原环境暴露后失血性休克大鼠BLAF蛋白浓度的影响;C: DEX对高原环境暴露后失血性休克大鼠肺微血管通透性的影响;D:伊文思蓝观察各组大鼠肺微血管渗漏情况 图 2 DEX对高原环境暴露后失血性休克大鼠肺血管通透性的影响 |
EB的结果显示,HS组大鼠肺组织表面颜色较Sham组加深,提示有渗漏;LR组肺组织表面颜色最深并且水肿明显,提示渗漏最多;DEX预处理组可显著改善渗漏情况(图 2D)。
2.2 DEX对高原环境暴露后失血性休克大鼠肺功能的影响通过全身体积描记系统测定大鼠的呼吸功能。结果显示,HS组大鼠呼吸频率较Sham组升高18.9%,潮气量、分钟通气量较Sham组分别下降58.3%、49.9%,提示大鼠呈浅快呼吸(图 3);LR复苏后,大鼠呼吸频率及潮气量较HS组升高12.3%、121.2%,提示大鼠呼吸加深加快;DEX+LR组大鼠肺功能整体情况有明显改善,差异有统计学意义(P < 0.05,图 3)。
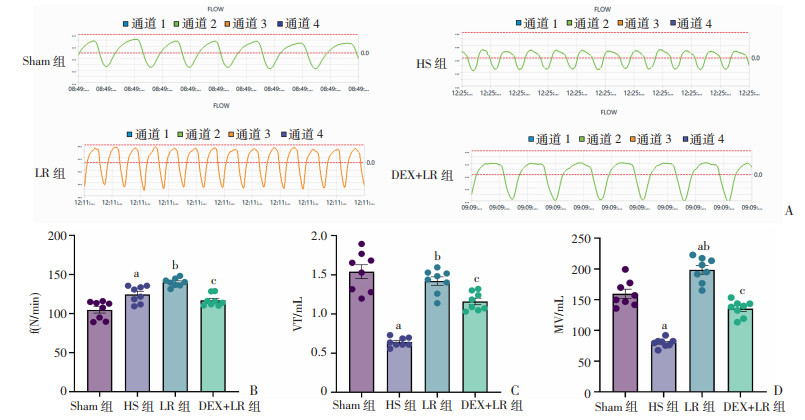
|
|
a:P < 0.05,与Sham组比较;b:P < 0.05,与HS组比较;c:P < 0.05,与LR组比较 A:肺功能的趋势图;B:DEX对肺水肿大鼠呼吸频率的影响;C:DEX对肺水肿大鼠潮气量的影响;D:DEX对肺水肿大鼠分钟通气量的影响 图 3 DEX对高原环境暴露后失血性休克大鼠肺功能的影响 |
2.3 DEX对高原环境暴露后失血性休克大鼠肺组织病理形态的影响
HE染色结果显示,Sham组大鼠肺泡结构完整,大小较均一,肺泡壁厚度尚正常,呈薄壁形态,腔内暂未见液体及细胞渗出。HS组大鼠肺泡结构较完整,大小欠均匀,肺泡壁厚度可见部分增厚,腔内可见少许液体及细胞渗出。LR组大鼠肺泡囊融合,肺泡壁可见不同程度的损伤及断裂,肺泡壁/间隔增厚明显,肺泡腔有少量红细胞、炎性细胞等浸润,大鼠处于间质性肺水肿阶段。在DEX预给药后,大鼠肺组织结构趋于正常,间质仍有轻度增厚,但较LR组及Sham组有明显改善(图 4A)。
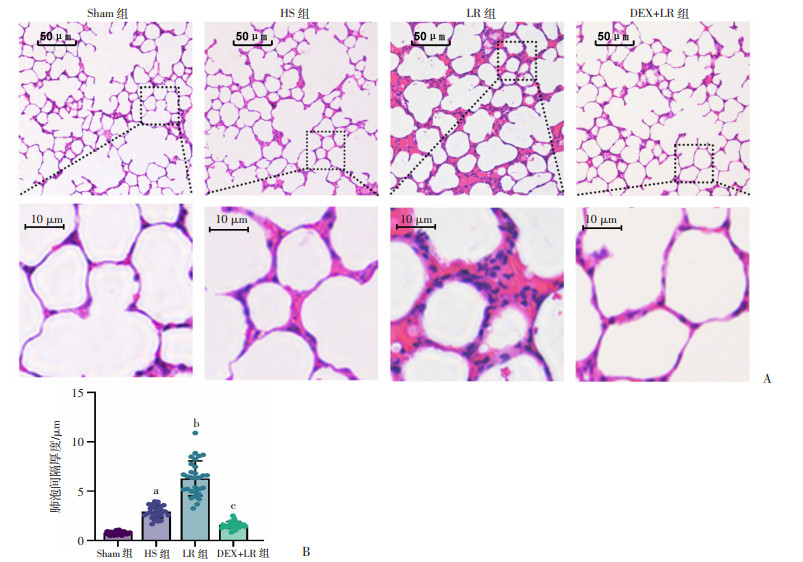
|
| A:肺组织病理形态;B:肺泡间隔厚度a:P < 0.05与Sham组比较;b:P < 0.05,与HS组比较;c:P < 0.05,与LR组比较 图 4 DEX对高原环境暴露后失血性休克大鼠肺组织病理形态的影响 |
Sham组肺泡间隔厚度为(0.77±0.16)μm,HS组肺泡间隔厚度为(2.94±0.61)μm,较Sham组增厚约2.8倍。LR组肺泡间隔厚度为(6.30±1.71)μm,较HS组增厚约1.16倍。DEX+LR组肺泡间隔厚度为(1.57±0.34)μm,较LR组降低约3倍,差异有统计学意义(P < 0.05,图 4B)。
2.4 DEX对高原环境暴露后失血性休克大鼠动脉血气的影响与Sham组比较,HS组大鼠动脉血pH值、PaO2、SaO2、SBC显著降低,PaCO2、Lac、P50显著升高。LR复苏不能改善血气指标,且有进一步加重的趋势。DEX可显著改善血气,包括pH、PaCO2、PO2、SO2、SBC,与LR组比较,分别升高3.1%、59.9%、13.7%、3.6%和36.8%,Lac、P50分别降低53.1%和9.0%,差异有统计学意义(P < 0.05, 表 2)。
| 指标 | Sham组 | HS组 | LR组 | DEX+LR组 |
| pH | 7.40±0.07 | 7.22±0.04a | 7.13±0.06b | 7.35±0.05c |
| PaCO2/mmHg | 34.94±2.65 | 44.55±4.08a | 25.51±1.24b | 36.71±2.77c |
| PaO2/mmHg | 101.90±4.01 | 91.60±3.70a | 90.93±3.71 | 103.36±4.58c |
| SaO2/% | 98.29±0.44 | 94.43±1.35a | 94.69±1.13 | 98.08±0.75c |
| Lac/(mmol/L) | 0.68±0.10 | 8.45±1.03a | 5.03±0.78b | 2.36±0.19c |
| P50/mmHg | 25.81±1.31 | 28.02±1.03a | 30.18±0.88b | 27.46±0.67c |
| SBC/(mmol/L) | 23.20±2.65 | 18.30±0.65a | 11.21±0.70b | 15.30±30.83c |
| a:P < 0.05与Sham组比较;b:P < 0.05,与HS组比较;c:P < 0.05,与LR组比较 | ||||
2.5 DEX对高原环境暴露后失血性休克大鼠存活率和存活时间的影响
HS组大鼠72 h仅存活3只,72 h内存活率为18.8%,72 h内存活时间为(17.4±28.0)h,LR组大鼠72 h存活5只,存活率为31.25%,存活时间(30.9±29.4)h,DEX+LR组72 h存活13只,存活率为81.3%,存活时间为(65.0±15.5)h(图 5)。
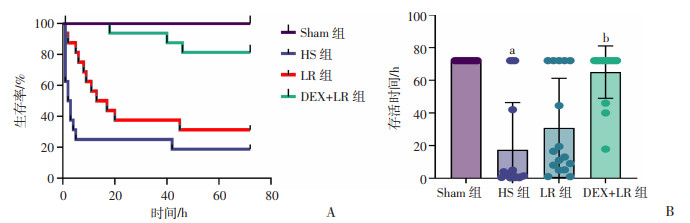
|
| a:P < 0.05,与Sham组比较;b:P < 0.05,与LR组比较 图 5 DEX对高原环境暴露后失血性休克大鼠72 h存活率(A)和存活时间(B)的影响 |
3 讨论
高原环境下发生失血性休克并发症发生率高,病情重、死亡率高,目前针对平原失血性休克提出了液体复苏等策略[15],但针对高原环境下失血性休克采用常规液体复苏不仅不能满足救治需求,反而会加重肺水肿发生。本研究通过复制高原环境暴露后失血性休克模型,发现右美托咪定DEX对高原环境暴露后失血性休克所致的肺损伤具有明显的保护作用。预防性给予DEX后,可明显降低高原环境暴露后失血性休克大鼠肺含水量,改善肺微血管通透性,改善大鼠呼吸功能,减轻肺组织损伤,最终提高高原环境暴露后失血性休克大鼠的存活率和存活时间。
目前治疗失血性休克的首选方案为液体复苏,临床上常用的晶体液为乳酸林格液,它虽然能迅速有效的补充血流量,提高组织灌注量[16],但在高原的极端条件下,机体正经受着缺氧、酸中毒、肺动脉压力升高等多重打击,对输液的耐受力严重下降。有研究报道,缺血再灌注可激发内质网应激,导致组织的损伤和细胞凋亡,从而导致血管通透性增高[17]。在此种背景下,常规的抗休克治疗极易加重水肿,恶化病情。本研究结果显示,高原环境暴露后失血性休克大鼠有轻度肺水肿,呈浅快呼吸,此时大鼠因分钟通气量下降,呈二氧化碳蓄积状态,动脉血气表现为PaCO2显著升高,与文献[18]报道相一致。用常规的乳酸林格液复苏后,肺水肿加剧,肺含水量增多,大鼠呈深大呼吸,分钟通气量升高明显,呈过度通气状态,PaCO2下降显著[18]。因此,失血性休克时大量补充乳酸林格液进行复苏治疗,可能会诱发或加重肺水肿,导致患者的不良预后。
DEX是一种高选择性、强效的α2肾上腺素能受体激动剂,具有镇静、镇痛作用,常用于手术室和重症监护室[19]。既往研究显示,DEX具有抗炎、抗凋亡、抗氧化和上调肺泡上皮钠通道(epithelial Na+ channel,ENaC)表达的作用。ENaC介导的钠离子转运是肺水清除的主要力量,钠离子通过肺泡上皮细胞顶端膜中的ENaC及其他离子通道进入细胞后,通过钠/钾ATP酶(Na/K-ATP酶)转运穿过基底外侧,从而建立跨上皮浓度梯度,驱动肺水的清除,达到减轻肺水肿的效果[20]。此外,有研究显示DEX可通过缺氧诱导因子-1α/血红素加氧酶-1(hypoxia inducible factor-1α/ heme oxygenase-1,HIF-1α/HO-1)信号通路使线粒体的融合/分裂保持动态平衡,从而改善由脂多糖诱导的急性肺损伤。DEX可通过减轻炎症反应、抑制自噬相关蛋白和Toll样受体4-核受体κB(Toll-like receptor 4 and nuclear factor-kappa B, TLR 4-NF-κB)信号通路,对脂多糖诱导的急性肺损伤具有保护作用[21]。基于中毒性休克诱导的肺损伤大鼠模型,LI等[12]发现DEX通过降低磷酸化细胞外信号调节激酶1/2(Phosphorylation extracellular signal-regulated kinase,p-ERK1/2)蛋白的表达抑制自噬和炎症而显著地保护肺损伤。本研究发现,DEX可显著降低高原环境暴露后失血性休克大鼠的肺含水量和肺微血管通透性,改善肺功能,显著减轻肺组织病理损伤,但其具体机制还有待进一步研究。
综上所述,右美托咪定DEX对高原环境暴露后失血性休克大鼠的肺功能有明显的保护作用,早期应用DEX可预防高原环境暴露后失血性休克的早期死亡。
| [1] |
罗勇军, 马四清. 急性高原反应发病的危险因素相关研究进展[J]. 第三军医大学学报, 2019, 41(8): 723-728. LUO Y J, MA S Q. Advances in research of risk factors for acute high-altitude sickness[J]. J Third Mil Med Univ, 2019, 41(8): 723-728. |
| [2] |
LU H, ZHANG H Q, JIANG Y Y. Methazolamide in high-altitude illnesses[J]. Eur J Pharm Sci, 2020, 148: 105326. |
| [3] |
WOODS P, ALCOCK J. High-altitude pulmonary edema[J]. Evol Med Public Health, 2021, 9(1): 118-119. |
| [4] |
EL ALAM S, PENA E, AGUILERA D, et al. Inflammation in pulmonary hypertension and edema induced by hypobaric hypoxia exposure[J]. Int J Mol Sci, 2022, 23(20): 12656. |
| [5] |
LUKS A M, SWENSON E R, BÄRTSCH P. Acute high-altitude sickness[J]. Eur Respir Rev, 2017, 26(143): 160096. |
| [6] |
吴跃, 朱娱, 周远群, 等. 线粒体分裂抑制剂Mdivi-1对高原战创伤休克大鼠的保护作用[J]. 陆军军医大学学报, 2022, 44(20): 2030-2036. WU Y, ZHU Y, ZHOU Y Q, et al. Protective effects of mitochondrial fission inhibitor, Mdivi-1, on traumatic shock rats at high altitude[J]. J Army Med Univ, 2022, 44(20): 2030-2036. |
| [7] |
刘良明. 战创伤休克早期救治研究进展与思考[J]. 陆军军医大学学报, 2022, 44(20): 2025-2029. LIU L M. Advances and thinking for early treatment of war wound and traumatic shock[J]. J Army Med Univ, 2022, 44(20): 2025-2029. |
| [8] |
ZHAO S K, WU W Z, LIN X Z, et al. Protective effects of dexmedetomidine in vital organ injury: crucial roles of autophagy[J]. Cell Mol Biol Lett, 2022, 27(1): 1-19. |
| [9] |
ZHANG X, LI Y X, WANG Y, et al. Dexmedetomidine postconditioning suppresses myocardial ischemia/reperfusion injury by activating the SIRT1/mTOR axis[J]. Biosci Rep, 2020, 40(5): BSR20194030. |
| [10] |
HU Y D, TANG C L, JIANG J Z, et al. Neuroprotective effects of dexmedetomidine preconditioning on oxygen-glucose deprivation-reoxygenation injury in PC12 cells via regulation of Ca2+-STIM1/Orai1 signaling[J]. Curr Med Sci, 2020, 40(4): 699-707. |
| [11] |
YANG T Y, FENG X J, ZHAO Y, et al. Dexmedetomidine enhances autophagy via α2-AR/AMPK/mTOR pathway to inhibit the activation of NLRP3 inflammasome and subsequently alleviates lipopolysaccharide-induced acute kidney injury[J]. Front Pharmacol, 2020, 11: 790. |
| [12] |
LI Z B, LI G C, QIN J. Dexmedetomidine attenuates lung injury in toxic shock rats by inhibiting inflammation and autophagy[J]. Arch Med Res, 2021, 52(3): 277-283. |
| [13] |
BORGES A M, FERRARI R S, DALLA GIACOMASSA ROCHA THOMAZ L, et al. Challenges and perspectives in porcine model of acute lung injury using oleic acid[J]. Pulm Pharmacol Ther, 2019, 59: 101837. |
| [14] |
吴岳, 赵海龙, 吴穹, 等. 急进高原大鼠肺组织结构及形态计量学研究[J]. 青海医学院学报, 2014, 35(2): 95-99. WU Y, ZHAO H L, WU Q, et al. Microscopic observation and morphometric analysis of the lung in rat exposed to high altitude[J]. J Qinghai Med Coll, 2014, 35(2): 95-99. |
| [15] |
何霜霜, 朱娱, 周赫男, 等. 周细胞对失血性休克大鼠血管通透性的保护作用[J]. 第三军医大学学报, 2020, 42(19): 1882-1889. HE S S, ZHU Y, ZHOU H N, et al. Protective effect of pericytes against vascular leakage in rats with hemorrhagic shock[J]. J Third Mil Med Univ, 2020, 42(19): 1882-1889. |
| [16] |
BAKKER J, KATTAN E, ANNANE D, et al. Current practice and evolving concepts in septic shock resuscitation[J]. Intens Care Med, 2022, 48(2): 148-163. |
| [17] |
WANG L, LIU Y, ZHANG X, et al. Endoplasmic reticulum stress and the unfolded protein response in cerebral ischemia/reperfusion injury[J]. Front Cell Neurosci, 2022, 16: 864426. |
| [18] |
武红雨, 闫阳, 冀翔宇, 等. 动脉血-呼气末CO2分压差影响因素分析[J]. 青岛大学医学院学报, 2017, 53(1): 21-24, 27. WU H Y, YAN Y, JI X Y, et al. Multi-factorial analysis of arterial to end-tidal CO2 tension gradient[J]. J Qingdao Univ Med Sci, 2017, 53(1): 21-24, 27. |
| [19] |
SHEHABI Y, SERPA NETO A, BELLOMO R, et al. Dexmedetomidine and propofol sedation in critically ill patients and dose-associated 90-day mortality: a secondary cohort analysis of a randomized controlled trial (SPICE Ⅲ)[J]. Am J Respir Crit Care Med, 2023, 207(7): 876-886. |
| [20] |
TAENAKA H, MATTHAY M A. Mechanisms of impaired alveolar fluid clearance[J]. Anat Rec (Hoboken), 2023, ar25166. |
| [21] |
SHI J, YUT X, SONG K, et al. Dexmedetomidine ameliorates endotoxin-induced acute lung injury in vivo and in vitro by preserving mitochondrial dynamic equilibrium through the HIF-1α/HO-1 signaling pathway[J]. Redox Biol, 2021, 41: 101954. |




