2. 400038 重庆,陆军军医大学(第三军医大学)高原军事医学系:高原生理学与病理学教研室;
3. 400038 重庆,陆军军医大学(第三军医大学)高原军事医学系:极端环境医学教育部重点实验室(培育)
2. Department of High Altitude Physiology and Pathology, Faculty of High Altitude Military Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038, China;
3. Key Laboratory of Extreme Environmental Medicine of Ministry of Education, Faculty of High Altitude Military Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038, China
高原肺水肿(high altitude pulmonary edema,HAPE)是一种起病急、进展快、病死率高的急性重症高原病,发病率为0.5%~2.0%[1],严重威胁初期进入3 000 m以上高原人群的健康和生命安全。HAPE的发生机制复杂,一般认为低氧肺血管收缩,微血管压力升高引起液体外漏是其主要机制[2]。低压低氧是病因这一观点早已被普遍接受,但大量事实表明低压低氧可能不是引起HAPE的唯一因素:①有些人虽然肺动脉压力很高,但并不会出现HAPE;②临床上HAPE患者大多存在寒冷、上呼吸道感染、过度劳累等诱因[3];③单纯低压低氧往往难以复制出稳定的HAPE动物模型[4],通常需要复合低温或运动[5]。近来研究显示,炎症反应可能在HAPE发生中具有重要作用[6],主要证据有:①HAPE患者常伴有发热、外周血白细胞升高等炎症表现;②上呼吸道感染、寒冷、运动等是HAPE发生的重要诱因;③HAPE患者支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)蛋白含量显著增高;④HAPE患者炎症介质和抗炎介质水平均显著升高;⑤激素治疗对HAPE有效。
本研究通过予以低剂量脂多糖(lipopolysaccharide,LPS)诱发大鼠炎症反应,再复合低压低氧,复制出稳定的大鼠HAPE动物模型。通过基因芯片技术分析HAPE大鼠肺组织差异基因表达,并检测炎症介质的表达变化,旨在为深入探讨HAPE发生的分子机制提供新线索。
1 材料与方法 1.1 实验动物及分组健康8周龄雄性SD大鼠,体质量(200±20) g,由陆军特色医学中心实验动物中心提供。将40只大鼠统一从1编至40,采用随机数字表法分为常氧对照(NC)组、LPS组、低压低氧(Hypoxia)组和低压低氧复合低剂量LPS(HL)组,每组10只。LPS组和HL组按照每100 g体质量尾静脉注射0.1 mL浓度为0.05%的LPS溶液,NC组和Hypoxia组给予等量生理盐水。Hypoxia组和HL组置模拟海拔5 000 m(气压约54 kPa)高原低压环境舱内饲养6 h,NC组和LPS组于舱外(重庆,海拔303 m,气压98 kPa)同时饲养[7]。处理期间各组动物均禁食禁水。6 h处理结束后,异氟烷麻醉处死动物,采集肺组织用于组织形态学观察、芯片检测以及mRNA含量测定,采集BALF用于蛋白含量测定。
1.2 主要试剂和仪器LPS购自美国Sigma公司,Bicinchoninic Acid(BCA)法蛋白测定试剂盒、HE染色试剂盒购自上海碧云天生物技术有限公司,DYC低压舱购自贵州风雷航空机械制造公司,酶标仪购自美国Bio-tek仪器有限公司。
1.3 肺组织湿/干质量比(wet/dry mass ratio,WDR)检测摘取大鼠肺脏,取其左肺上叶,迅速用滤纸吸干表面血迹后称取肺组织湿质量。置于60 ℃烤箱内烘烤72 h,称取肺组织干质量。肺湿/干质量比=湿质量/干质量。
1.4 BALF蛋白含量检测用1.5 mL 37 ℃生理盐水灌洗右肺,重复3次。收集灌洗液按1 800×g 4 ℃离心10 min,取上清。采用BCA法进行蛋白定量分析。
1.5 组织形态学观察取左肺下叶肺组织,用4%多聚甲醛溶液进行固定,石蜡包埋切片,HE染色,光镜下观察肺组织形态结构改变。
1.6 肺组织基因表达芯片分析取右肺-80 ℃冻存,由北京博奥晶典生物技术有限公司完成肺组织基因表达芯片检测和分析。具体过程如下:采用随机数字表法,每组选取6个动物标本,提取总RNA并等量混合为1个样本,采用Ambion #1792 cRNA扩增标记试剂盒进行体外扩增和生物素标记,利用Affymetrix公司的Rat Genome 230 2.0 Array,检测大鼠物种的mRNA表达谱。以倍数变化(fold change,FC)≥2.0作为基因表达上调判定标准;以FC≤0.5作为基因表达下调判定标准。采用Metascape在线基因注释和分析系统(http://metascape.org)[8]对差异表达基因进行基因本体论(gene ontology,GO)和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)信号通路聚类分析。
1.7 统计学分析计量资料以x±s表示,采用SPSS 20.0统计软件进行分析,2组间比较采用独立样本t检验,多组间比较采用双因素方差分析,以P<0.05表示差异具有统计学意义。
2 结果 2.1 4组大鼠肺组织病理学改变肺组织HE染色结果显示:NC组大鼠肺组织结构清晰、完整;LPS组和Hypoxia组出现轻度肺组织结构紊乱、肺泡间隔增宽;HL组大鼠肺组织明显表现出间质充血、水肿,肺泡间隔增宽(图 1)。
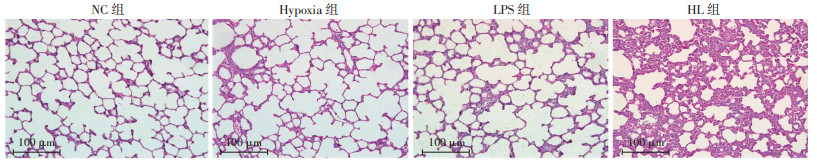
|
| 图 1 HE染色观察4组大鼠肺组织病理学改变 |
2.2 HL组大鼠肺组织WDR与BALF蛋白浓度显著增加
LPS组和Hypoxia组大鼠肺WDR与NC组比较差异无统计学意义(P>0.05);HL组大鼠肺WDR与NC组比较显著升高(P<0.01,图 2A)。LPS组和Hypoxia组大鼠BALF蛋白浓度与NC组比较差异无统计学意义;HL组大鼠BALF蛋白浓度与NC组比较显著升高(P<0.05,图 2B)。
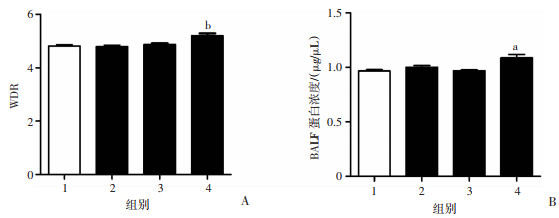
|
|
1:NC组;2:LPS组;3:Hypoxia组;4:HL组;a:P<0.05,b:P<0.01,与NC组比较 A:NC组n=9,LPS组n=7,Hypoxia组n=9,HL组n=8;B:NC组n=7,LPS组n=6,Hypoxia组n=8,HL组n=7 图 2 4组大鼠WDR(A)和BALF蛋白浓度(B)变化(x±s) |
2.3 肺组织基因表达谱变化
将各组表达基因与NC组相比较,结果显示:Hypoxia组有少量基因表达发生改变(79基因上调,59基因下调),LPS组差异基因数(473基因上调,695基因下调)远远高于Hypoxia组,HL组差异基因数(669基因上调,1 253基因下调)较LPS组进一步升高(图 3)。HL组与Hypoxia组有33个基因共同上调、28个基因共同下调,占HL组差异基因的3.174%;HL组与LPS组有409个基因共同上调、632个基因共同下调,占HL组差异基因的54.162%;另外,3组之间有24个基因为共同上调、25个基因共同下调,占HL组差异基因的2.549%。
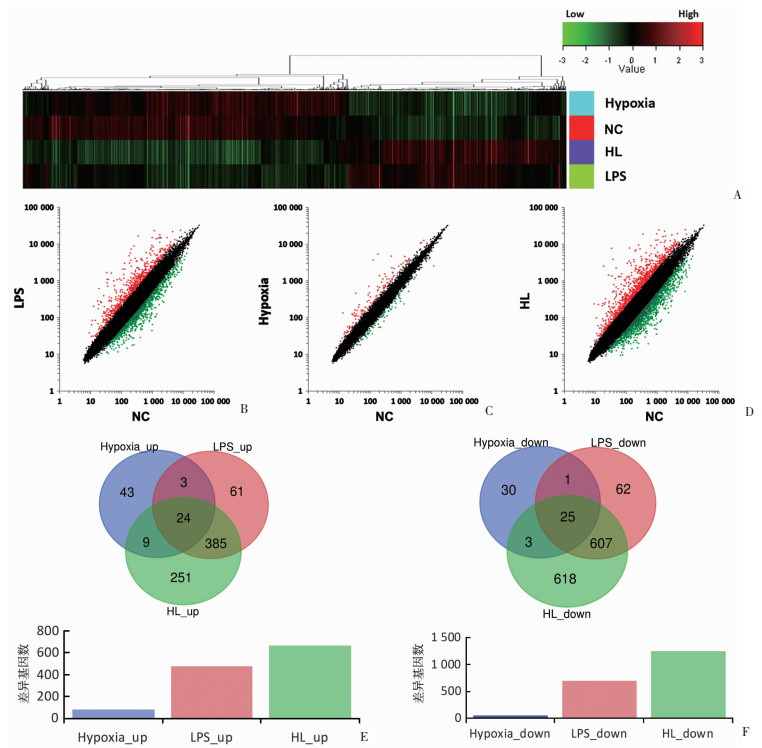
|
| A:基因表达热图;B~D:基因表达散点图 红点:示显著上调基因;绿点:示显著下调基因;黑点:示无差异基因;E、F:差异基因数量韦恩图 图 3 4组大鼠肺组织差异基因表达热图及韦恩图 |
2.4 差异表达基因GO分析
分别对HL、Hypoxia、LPS组差异表达上调和下调的基因进行GO聚类分析,Hypoxia组差异基因数量较少,上调基因GO聚类最显著的是低氧反应、体液免疫反应等。LPS组表达上调基因GO聚类主要为对于细菌(包括LPS)的炎症免疫反应功能,如:细胞因子介导的信号通路、对IL-1的反应等。HL组中上调基因GO聚类仍然以对于细菌(包括LPS)的炎症免疫反应为主,如:细胞因子介导的信号通路、对IL-1的反应等(图 4A)。
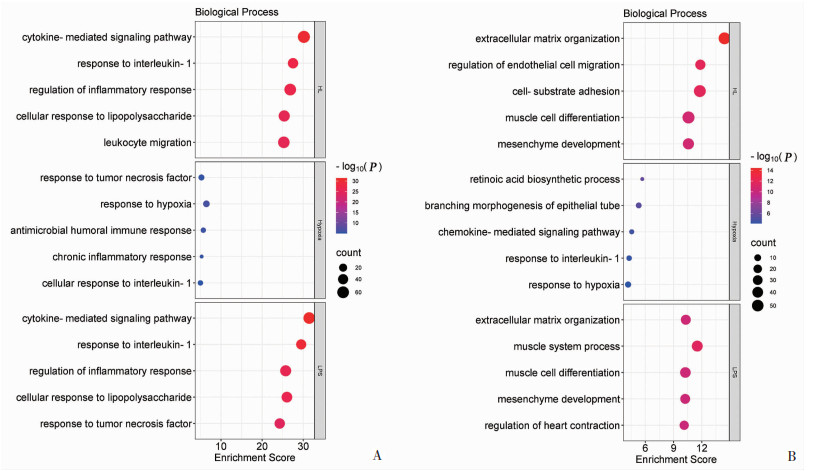
|
| A:Hypoxia、LPS和HL组显著上调基因的生物学过程GO富集条目;B:Hypoxia、LPS和HL组显著下调基因的生物学过程GO富集条目 图 4 Hypoxia、LPS和HL组差异表达基因的生物学过程GO富集分析 |
Hypoxia组表达下调的基因GO聚类主要是一些耗能的生物过程,例如:维甲酸生物合成过程、上皮管分支形态发生过程等。LPS组表达下调的基因GO聚类也主要是一些耗能的生物过程,但与Hypoxia组的分类存在较大差异,主要包括:肌肉系统过程、细胞外基质组织等。HL组表达下调的基因GO聚类与LPS组类似,主要包括:细胞外基质组织、细胞-基质黏附等(图 4B)。
2.5 差异表达基因KEGG信号通路(pathway)聚类分析分别对HL、Hypoxia、LPS组差异表达上调和下调的基因进行KEGG pathway聚类分析。Hypoxia组表达上调基因KEGG pathway主要为PPAR信号通路、IL-17信号通路等。LPS组差异表达上调基因KEGG pathway主要与炎症免疫反应相关,如:细胞因子-细胞因子受体相互作用、TNF信号通路等。HL组差异表达上调基因富集到的KEGG pathway与LPS组有较多重合,但其富集指数和显著性较强(图 5A)。
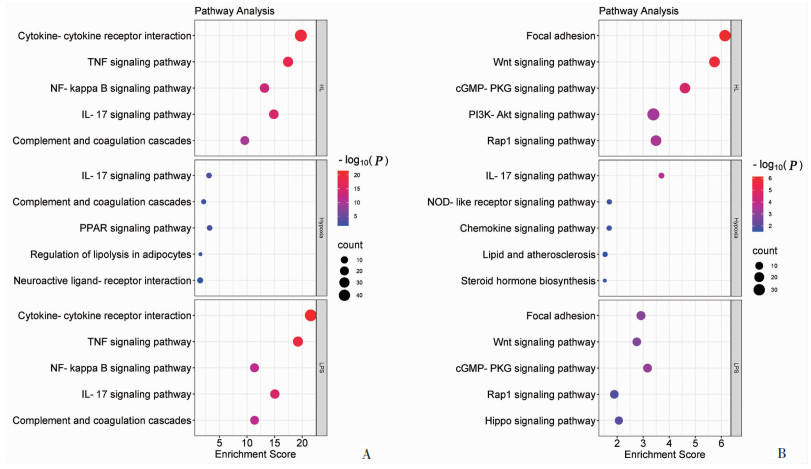
|
| A:Hypoxia、LPS和HL组显著上调基因的富集通路;B:Hypoxia、LPS和HL组显著下调基因的富集通路 图 5 Hypoxia、LPS和HL组差异表达基因的KEGG富集分析 |
Hypoxia组表达下调基因KEGG信号通路主要有:IL-17信号通路、NOD样受体信号通路等。LPS组表达下调基因KEGG信号通路主要有:黏着斑、cGMP-PKG信号通路等。HL组与LPS组相似,主要富集到黏着斑、Wnt信号通路等(图 5B)。
2.6 HL组大鼠特异表达基因GO和KEGG信号通路(pathway)聚类分析本研究进一步对于251个HL组特异性表达上调和618个HL组特异性表达下调基因进行了GO和KEGG pathway聚类分析。特异性上调基因GO功能主要包括:肽基酪氨酸磷酸化、二磷酸核苷代谢过程等。特异性下调基因GO功能主要包括:阿米巴型细胞迁移、泌尿生殖系统发育等(图 6A)。
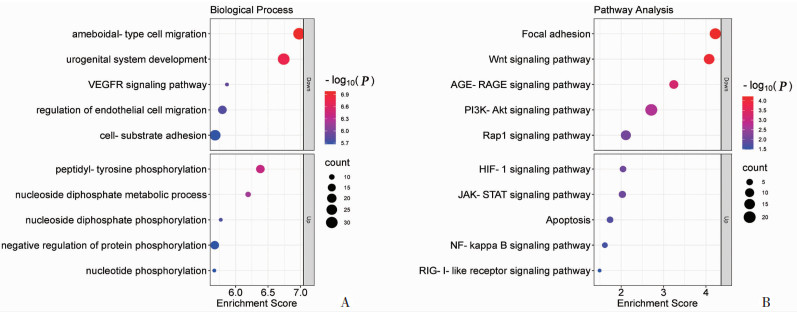
|
| A:HL组特异表达上调和下调基因的生物学过程GO条目;B:HL组特异表达上调和下调基因的富集通路 图 6 HL组特异表达上调和下调基因的GO和KEGG富集分析 |
特异性上调基因KEGG pathway主要包括:HIF-1信号通路、JAK-STAT信号通路等;特异性下调基因KEGG信号通路主要包括:黏着斑、Wnt信号通路等(图 6B)。
2.7 RT-qPCR验证肺组织中炎症介质的表达量提取肺组织mRNA,反转录后采用RT-qPCR检测NF-κB、TNF-α、IL-1β以及IL-6等炎症介质及调控分子的表达变化,结果发现,与NC组相比,LPS处理(LPS组)显著上调转录因子NF-κB的mRNA表达(P<0.05),细胞因子TNF-α、IL-1β和IL-6的mRNA表达也显著上调(P<0.01),单纯低氧处理并未显著上调这些基因的表达,而复合低氧处理(HL组)后,NF-κB、TNF-α、IL-1β和IL-6的mRNA表达上调更为显著(P<0.01,图 7)。
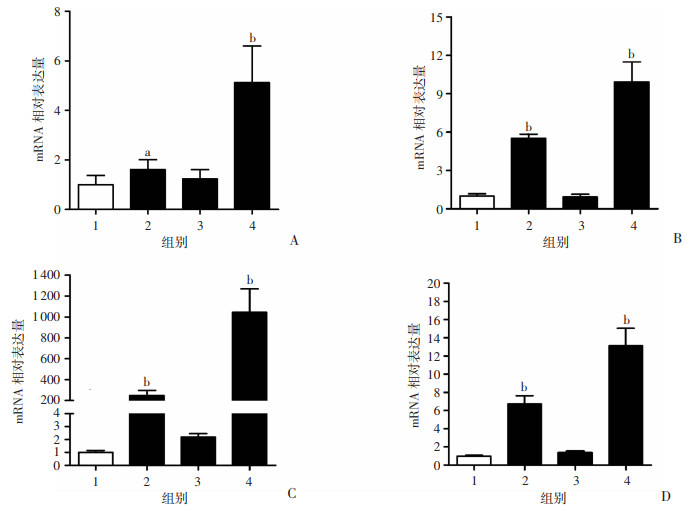
|
|
1:NC组;2:LPS组;3:Hypoxia组;4:HL组;a:P<0.05,b:P<0.01,与NC组比较 A~D:肺组织NF-κB、TNF-α、IL-6、IL-1β基因相对表达量 图 7 4组大鼠肺组织目的基因的相对表达量(n=5,x±s) |
3 讨论 3.1 低氧复合LPS可稳定复制HAPE大鼠模型
HAPE是由平原进入高原地区或在高原地区进入更高海拔地区,因缺氧导致的以肺间质或肺泡水肿为主要特征的一种疾病。如果不及时治疗,可能会发生严重的低氧血症和死亡[9]。临床上可结合症状体征及影像学检查进行诊断。临床症状可见静息时呼吸困难、咳嗽,咳白色、粉红色或血性泡沫状痰。体征可观察到有明显的发绀,血氧饱和度明显降低,且吸氧后发绀和血氧饱和度无显著改善,肺部听诊单侧或双侧可闻及湿性啰音。影像学检查可见肺纹理增粗,磨玻璃样改变,单肺或双肺点片状影等。这些症状体征在动物模型上常不易被观察到或进行有效评估,动物模型上通常采用肺含水量、肺泡毛细血管膜通透性检测,结合肺组织病理学检查进行模型评估。本研究通过低氧复合低剂量LPS,成功复制出大鼠肺水肿模型。HL组的肺组织病理表现符合肺水肿特征,WDR和BALF蛋白含量也显著高于NC组、LPS组及Hypoxia组,表明肺含水量显著增加,肺泡膜通透性显著升高,都提示肺水肿模型复制成功。
3.2 炎症通路在HAPE发生中具有重要作用本研究中肺组织基因表达谱分析发现,低剂量LPS即可诱导大鼠肺组织大量基因表达改变,而单纯低氧诱导大鼠肺组织基因表达改变较少,但低氧复合低剂量LPS(HL组)可诱导更多的基因表达发生显著改变,提示低氧可能增强了低剂量LPS的作用。本研究从基因表达谱的角度,进一步证明单纯低氧往往不足以引起肺组织严重的损伤,也不易复制出稳定的HAPE动物模型。一旦机体内存在一定程度的炎症反应,再复合低氧作用时,其反应可以得到显著增强,从而导致肺组织损伤、水肿,参与HAPE发生。进一步分析发现,HAPE模型(HL组)大鼠差异表达基因的生物学功能涉及了生命活动的多个方面,其中炎症和免疫反应相关的基因占了相当的比例,GO聚类以炎症免疫反应为主,包括细胞因子介导的信号通路、对IL-1的反应、炎症反应调节、细胞对LPS的反应以及白细胞迁移等生物学过程。这些结果提示炎症反应过程在HAPE发生中具有重要作用。
3.3 低氧可增强LPS介导的炎症反应促进HAPE的发生LPS是内毒素的重要群特异性抗原,是革兰氏阴性菌致病的主要结构成分。研究表明,LPS作用于机体,在LPS结合蛋白(LPS-binding protein,LBP)和CD14的帮助下,活化Toll样受体4(Toll like receptor 4,TLR4)及其下游信号通路并介导炎症因子级联释放[10]。本研究采用低剂量LPS诱导炎症反应,相关信号通路,如细胞因子-细胞因子受体相互作用、TNF信号通路、IL-17信号通路、补体和凝血级联反应、NF-κB信号通路等被显著激活,复合低氧后差异表达上调基因也主要富集到这些信号通路,表明这些信号通路被异常活化。LPS处理后下调的基因主要富集到黏着斑、Wnt、cGMP-PKG、Rap1等信号通路,而复合低氧处理后这些信号通路同样被富集,且更为显著。HL组特异性表达基因通路富集分析提示HIF-1、JAK-STAT、细胞凋亡、NF-κB和RIG-I样受体信号通路异常活化,而黏着斑、Wnt、AGE-RAGE、PI3K-Akt以及Rap1信号通路可能受到抑制。表明炎症、免疫反应以及凋亡相关信号通路被异常激活,而与细胞迁移、增殖、分化以及黏附相关信号通路受到抑制。KEGG信号通路聚类分析同样提示炎症免疫反应参与HAPE发生,HIF-1和NF-κB的相互作用可能在其中发挥重要调控作用。HIF-1作为低氧应答反应的关键转录因子,在低氧反应过程中发挥了重要调控作用[11]。HIF-1的表达增强主要是由于低氧使得脯氨酸羟化酶2(Proline hydroxylase 2, PHD2)活性受到抑制,HIF-1的降解减少而稳定表达[12],也有研究发现,IL-1β、TNF-α等炎症介质也可以稳定HIF-1的表达[13],参与低氧反应。NF-κB被认为是炎症反应中调控促炎介质表达的主要转录因子。研究发现,NF-κB在被活化后可以稳定HIF-1,而调节HIF-1蛋白稳定性的PHD2可以HIF-1非依赖性方式激活NF-κB的表达[14]。提示NF-κB和HIF-1之间可相互调控,进而在低氧和炎症反应中发挥调控作用,低氧可增强LPS介导的炎症反应,进而促进HAPE的发生。
3.4 初步验证实验进一步提示炎症反应在HAPE发生中的重要作用炎症介质表达增加在一定程度上反应了肺部的炎症反应状态,研究发现,急性低压缺氧(7 620 m,3 h)可显著上调大鼠肺部促炎细胞因子IL-1β、IL-6和TNF-α的表达[15]。HAPE患者血清中TNF-α和IL-6水平也是升高的[16]。我们在模型大鼠肺组织中进行炎症介质及调控分子的表达检测,也提示低氧复合低剂量LPS处理可显著上调NF-κB、TNF-α、IL-1β和IL-6的mRNA表达。进一步提示炎症反应活化在HAPE发生中具有重要作用。抑制炎症反应可能是防治HAPE重要措施。有研究发现,低氧预处理可减轻大鼠低压低氧(9 142 m,5 h)引起的肺血管渗漏,并减少TNF-α/β、NF-κB、MCP-1和IL-6等炎症介质表达[17]。姜黄素也可抑制NF-κB表达升高,并缓解肺水肿的发生[18]。结合文献报道,进一步提示炎症反应是HAPE发生的重要机制。
综上所述,炎症和低氧暴露的协同作用可能是HAPE发生发展的关键。虽然上呼吸道感染(或低剂量LPS)参与诱导的炎症反应是HAPE发生的重要诱因,但也有相当多的病例是由于寒冷、运动等诱发,尚无研究表明在其发生过程中是否也有LPS的参与。低氧能否增强寒冷、运动等诱发的炎症反应,从而促进或导致HAPE发生,目前还不清楚,有待于进一步研究予以阐明。
| [1] |
HACKETT P H, RENNIE D, LEVINE H D. The incidence, importance, and prophylaxis of acute mountain sickness[J]. Lancet, 1976, 2(7996): 1149-1155. |
| [2] |
石建国, 季华庆, 陈想贵, 等. 高原肺水肿患者血流动力学变化研究[J]. 中国全科医学, 2021, 24(17): 2192-2197. SHI J G, JI H Q, CHEN X G, et al. Hemodynamic changes in patients with high-altitude pulmonary edema[J]. Chin Gen Pract, 2021, 24(17): 2192-2197. |
| [3] |
林法迎, 赵汝频, 杨琼慧. 高原肺水肿256例临床分析[J]. 临床内科杂志, 2006, 23(2): 113-114. LIN F Y, ZHAO R P, YANG Q H. Retrospective clinical analysis on high altitude pulmonary edema[J]. J Clin Intern Med, 2006, 23(2): 113-114. |
| [4] |
BERG J T. Ginkgo biloba extract prevents high altitude pulmonary edema in rats[J]. High Alt Med Biol, 2004, 5(4): 429-434. |
| [5] |
陈有, 高钰琪, 李素芝, 等. 高原肺水肿动物模型的初步研究[J]. 第三军医大学学报, 2006, 28(11): 1176-1177. CHEN Y, GAO Y Q, LI S Z, et al. Primary establishment of HAPE animal model[J]. Acta Acad Med Mil Tertiae., 2006, 28(11): 1176-1177. |
| [6] |
吴刚, 高文祥, 高钰琪. HIF-1: 高原肺水肿防治的新靶点[J]. 中国高原医学与生物学杂志, 2020, 41(1): 8-10, 16. WU G, GAO W X, GAO Y Q. HIF-1: a new target for prevention and treatment of high altitude pulmonary edema[J]. Chin High Alt Med Bio., 2020, 41(1): 8-10, 16. |
| [7] |
WU G, XU G, CHEN D W, et al. Hypoxia exacerbates inflammatory acute lung injury via the Toll-like receptor 4 signaling pathway[J]. Front Immunol, 2018, 9: 1667. |
| [8] |
ZHOU Y Y, ZHOU B, PACHE L, et al. Metascape provides a biologist-oriented resource for the analysis of systems-level datasets[J]. Nat Commun, 2019, 10(1): 1523. |
| [9] |
IMRAY C, BOOTH A, WRIGHT A, et al. Acute altitude illnesses[J]. BMJ, 2011, 343: d4943. |
| [10] |
CIESIELSKA A, MATYJEK M, KWIATKOWSKA K. TLR4 and CD14 trafficking and its influence on LPS-induced pro-inflammatory signaling[J]. Cell Mol Life Sci, 2021, 78(4): 1233-1261. |
| [11] |
PENA E, SIQUES P, BRITO J, et al. Nox2 upregulation and p38α MAPK activation in right ventricular hypertrophy of rats exposed to long-term chronic intermittent hypobaric hypoxia[J]. Int J Mol Sci, 2020, 21(22): 8576. |
| [12] |
SAMANTA D, SEMENZA G L. Maintenance of redox homeostasis by hypoxia-inducible factors[J]. Redox Biol, 2017, 13: 331-335. |
| [13] |
PHAM K, PARIKH K, HEINRICH E C. Hypoxia and inflammation: insights from high-altitude physiology[J]. Front Physiol, 2021, 12: 676782. |
| [14] |
LI J, YUAN W, JIANG S, et al. Prolyl-4-hydroxylase domain protein 2 controls NF-κB/p65 transactivation and enhances the catabolic effects of inflammatory cytokines on cells of the nucleus pulposus[J]. J Biol Chem, 2015, 290(11): 7195-7207. |
| [15] |
ARYA A, SETHY N K, SINGH S K, et al. Cerium oxide nanoparticles protect rodent lungs from hypobaric hypoxia-induced oxidative stress and inflammation[J]. Int J Nanomedicine, 2013, 8: 4507-4520. |
| [16] |
SHARMA M, SINGH S B, SARKAR S. Genome wide expression analysis suggests perturbation of vascular homeostasis during high altitude pulmonary edema[J]. PLoS One, 2014, 9(1): e85902. |
| [17] |
SHUKLA D, SAXENA S, PURUSHOTHAMAN J, et al. Hypoxic preconditioning with cobalt ameliorates hypobaric hypoxia induced pulmonary edema in rat[J]. Eur J Pharmacol, 2011, 656(1/2/3): 101-109. |
| [18] |
NEHRA S, BHARDWAJ V, BANSAL A, et al. Nanocurcumin accords protection against acute hypobaric hypoxia induced lung injury in rats[J]. J Physiol Biochem, 2016, 72(4): 763-779. |




