2. 400014 重庆,重庆市人民医院老年病科
2. Department of Geriatrics, Chongqing General Hospital, Chongqing, 400014, China
系统性硬化症(systemic sclerosis, SSc),又称为硬皮病,是一种免疫介导的结缔组织病,以皮肤和内脏器官纤维化以及血管病变为特征[1]。SSc发病率不高,但其死亡率高于其他风湿性疾病。肺部受累是SSc的早期并发症,也是SSc患者的主要死亡原因[2]。约80%的SSc患者有肺间质异常甚至肺纤维化,最终30%的SSc患者会发展为间质性肺病(interstitial lung disease, ILD)[3]。尼达尼布是唯一被批准用于治疗硬皮病相关性间质性肺病(systemic sclerosis-related interstitial lung disease, SSc-ILD)的药物[4],但效果有限,亟需寻找新的治疗手段。
巴瑞替尼是一种酪氨酸蛋白激酶(Janus kinase, JAK)1/2抑制剂,主要抑制JAK2,用于治疗对肿瘤坏死因子抑制剂治疗无效的成人中重度类风湿关节炎(rheumatoid arthritis, RA)[5]。由于巴瑞替尼在控制炎症方面有显著的作用,该药物成为减轻炎症性疾病中过度免疫反应的候选药物。多个临床试验和病例报告证明巴瑞替尼可以缓解RA、系统性红斑狼疮、银屑病、特应性皮炎、斑秃以及干扰素介导的自身炎性疾病等多种疾病的临床症状[5-7]。尽管巴瑞替尼在多种结缔组织疾病中显示出较好的疗效,但在SSc模型中巴瑞替尼调控巨噬细胞极化的研究还较少。本研究通过建立SSc小鼠模型,探讨巴瑞替尼是否通过抑制JAK2/ STAT3信号通路调控巨噬细胞的极化影响SSc小鼠肺纤维化程度。
1 材料与方法 1.1 实验材料主要实验试剂:博来霉素购自日本化药株式会社公司,巴瑞替尼购自AdooQ BIOSCIENCE公司,白介素(interleukin, IL)-1β、IL-4、IL-6和IL-10酶联免疫吸附法试剂盒购自江莱生物公司,TRIzol试剂和逆转录试剂盒购自TaKaRa公司,PCR Master Mix试剂购自翌圣生物科技公司,RIPA裂解液、BCA蛋白浓度试剂盒、免疫荧光抗原修复液、DAPI和抗荧光淬灭封片液购自碧云天生物技术公司,蛋白酶抑制剂和磷酸酶抑制剂购自TargetMol公司,蛋白质免疫印迹预制胶购自艾思易生物科技公司。蛋白质免疫印迹抗体:β-actin购自杭州华安生物技术公司,胶原蛋白4(collagen 4, Col4)、JAK2、磷酸化JAK2(phospho-JAK2, p-JAK2)、信号传导与转录激活因子3(signal transducer and activator of transcription, STAT3)、磷酸化STAT3(phospho-STAT3, p-STAT3)、CD86和CD163抗体购自Affinity Biosciences公司,辣根过氧化酶标记的二抗购自EarthOx公司。流式抗体:FITC F4/80和PE CD86抗体购自Elabscience公司,APC CD163抗体购自Invitrogengo公司。
1.2 动物模型8周30只SPF级雌性C57BL/6小鼠(体质量18~ 20 g)购于重庆医科大学动物实验中心。所有动物实验经成都达硕实验动物有限公司动物伦理委员会审查批准(Dossy20210119001)。小鼠随机分笼饲养,环境温度22~26 ℃,自由摄食水和饲料。小鼠实验前剃去背部中央区被毛,适应性饲养1周后按随机数字表法分为3组:对照组(Ctl组,n=6)、硬皮病组(SSc组,n=12)和硬皮病+巴瑞替尼组(SSc+Ba组,n=12)。博来霉素使用磷酸缓冲盐溶液配置成3 mg/mL储备液,-20 ℃保存,使用时稀释成1.5 mg/mL。巴瑞替尼使用0.5% CMC-Na配置成5 mg/mL储备液,-20 ℃保存,使用时稀释成1 mg/mL。从第0天开始,Ctl组小鼠于背部皮下注射0.1 mL磷酸缓冲盐溶液,胃内灌注0.1 mL 0.5% CMC-Na;SSc组小鼠于背部皮下注射1.5 mg/mL博来霉素(7.5 mg/kg),胃内灌注0.1 mL 0.5% CMC-Na;SSc+Ba组小鼠于背部皮下注射1.5 mg/mL博来霉素(7.5 mg/kg),胃内灌注1 mg/mL巴瑞替尼(5 mg/kg);每2天干预1次并记录小鼠体质量,共干预4周。于第29天处死小鼠,收集血浆、脾脏、皮肤和肺组织。新鲜肺组织使用磷酸缓冲盐溶液冲洗表面血液,用滤纸吸干后称取其质量。
1.3 病理学检测小鼠左肺和皮肤组织置于4%多聚甲醛固定24 h,常规进行脱水、透明、包埋和切片,分别进行HE和Masson染色。在显微镜下观察组织的病理变化,每张切片随机选取3个视野拍照。肺组织HE染色使用改良Ashcroft评分评估肺纤维化[8]。皮肤HE染色使用明美软件测量真皮层厚度。皮肤和肺组织Masson染色使用Image J软件测量胶原含量。剩余肺和皮肤组织于-80 ℃保存。
1.4 ELISA检测小鼠血浆600×g离心15 min后取上清液进行检测。按照酶联免疫吸附法试剂盒说明书检测血浆中炎症因子(IL-1β、IL-6、IL-4、IL-10)浓度。
1.5 RT-PCR检测取小鼠右肺组织加入1 mL TRIzol后使用研磨仪匀浆,组织匀浆液4 ℃ 12 000×g离心10 min。取上清液,加入0.2 mL氯仿充分混匀,冰上静置5 min,4 ℃ 14 000×g离心20 min。吸取上层无色水相液体400 μL,加入400 μL异丙醇充分混匀,-80 ℃静置30 min,4 ℃ 14 000×g离心20 min。弃去上清液,加入1 mL 75%乙醇洗涤,4 ℃ 14 000×g离心20 min后弃去液体。加入无RNA酶水溶解。使用超微量分光光度计测量RNA浓度。根据逆转录试剂说明书进行逆转录,将RNA逆转录为cDNA。根据PCR Master Mix说明书配置PCR反应液,根据说明书于实时荧光定量PCR仪进行检测。
1.6 Western blot检测取小鼠右肺组织加入RIPA裂解液、蛋白酶抑制剂和磷酸酶抑制剂后,使用研磨仪匀浆,组织裂解液4 ℃ 14 000×g离心10 min,留取上清液。使用BCA蛋白浓度试剂盒检测组织蛋白浓度,加入蛋白上样缓冲液,100 ℃加热10 min,-20 ℃保存。预制胶每孔加入50 μg蛋白样本行SDS-PAGE凝胶电泳,电转模后封闭,一抗(Col4、JAK2、p-JAK2、STAT3、p-STAT3、CD86和CD163)4 ℃孵育过夜,洗膜3次,每次10 min。二抗室温孵育1 h,以β-actin作为内参,使用化学发光成像系统显像,化学分析软件系统分析对比条带强弱程度。
1.7 流式细胞术检测将200目细胞筛用磷酸缓冲盐溶液润湿,剪碎脾脏,用注射器活塞研磨。脾脏单细胞悬液经400目细胞筛过滤后4 ℃ 300×g离心5 min。弃去上清液,加入红细胞裂解液,吹打混匀,4 ℃静置15 min后,4 ℃ 300×g离心5 min,弃上清。无菌磷酸缓冲盐溶液重悬细胞,4 ℃ 300×g离心5 min,离心后弃上清。无菌磷酸缓冲盐溶液重悬细胞,4 ℃保存。50 μL脾脏单细胞悬液加入5 μL FITC F4/80、5 μL PE CD86和0.25 μg APC CD163抗体,4 ℃避光孵育30 min。染色结束后,加入1.5 mL无菌磷酸缓冲盐溶液重悬吹打细胞,离心后弃上清。磷酸缓冲盐溶液重悬细胞后,使用流式细胞仪进行检测。
1.8 免疫荧光检测左肺组织切片常规脱蜡、抗原修复,封闭后一抗(CD86、CD163)4 ℃孵育过夜,洗涤3次,每次10 min。二抗避光室温孵育1 h,洗涤3次,每次10 min。DAPI避光室温孵育5 min,洗涤3次,每次10 min。滴加封片液,盖玻片封片。荧光显微镜下观察CD86和CD163表达并拍照,Image J软件测量荧光强度。
1.9 统计学分析采用GraphPad Prism 8.0.2统计软件分析数据,以x±s表示,多组间采用单因素方差分析,2组间比较采用独立样本t检验,检测水准:α=0.05。
2 结果 2.1 巴瑞替尼减轻博来霉素引起的皮肤和肺组织的纤维化 2.1.1 小鼠一般情况及肺比重在实验2周内,与Ctl组相比,SSc组和SSc+Ba组小鼠逐渐出现饮水、饮食及活动量减少,体质量明显降低(P < 0.05)。在实验3、4周,与SSc组相比,SSc+Ba组小鼠体质量降低情况逐渐缓解。在第4周,SSc+Ba组小鼠体质量明显高于SSc组(P < 0.01,图 1A)。肺比重是评估肺纤维化的重要指标,数值越高,表明肺纤维程度越严重。SSc组小鼠肺比重明显高于Ctl组(P < 0.001),SSc+Ba组肺比重明显低于SSc组(P < 0.05),见图 1B。

|
| a: P < 0.05,b: P < 0.001,与Ctl组比较;c: P < 0.01,d: P < 0.001,e: P < 0.05,与SSc组比较 图 1 各组小鼠体质量(A)与肺比重(B)变化 |
2.1.2 皮肤和肺组织病理
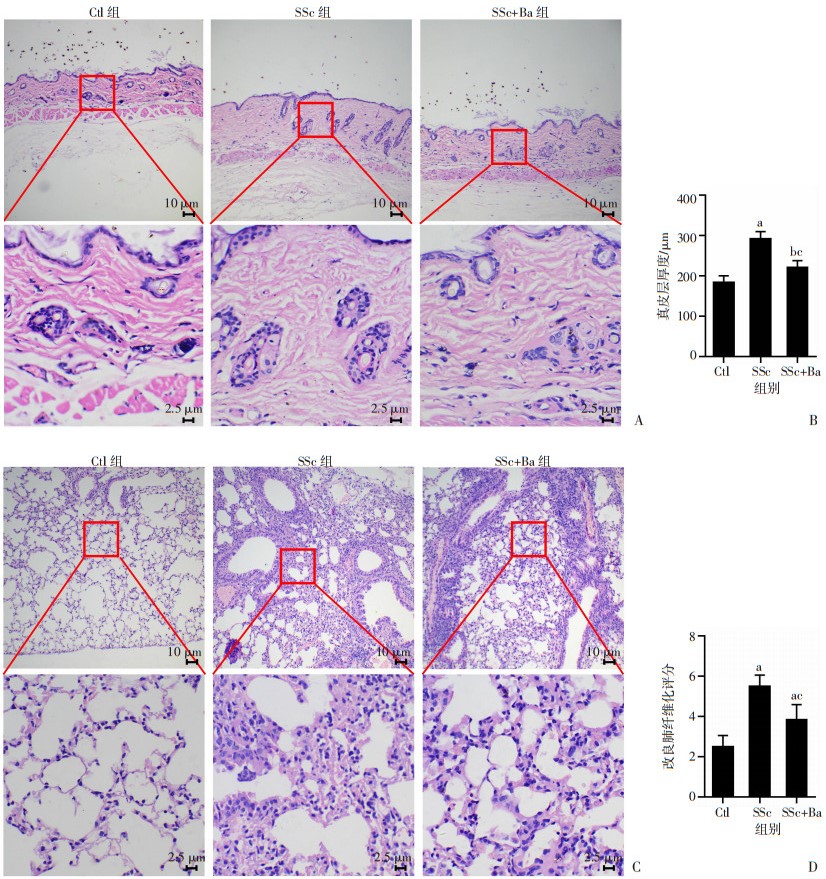
皮肤HE和Masson染色显示,SSc组小鼠真皮层厚度及胶原含量较Ctl组明显增多(P < 0.001),SSc+Ba组与SSc组相比,真皮层厚度及胶原明显减少(P < 0.001;图 2A、B,3A、B)。肺HE和Masson染色显示,SSc组小鼠肺组织结构破坏、炎症细胞浸润较多、肺泡间隔明显增厚、胶原含量较多,巴瑞替尼的干预减轻了上述表现,2组间肺纤维化评分及胶原含量差异均有统计学意义(P < 0.01;图 2C、D,3C、D)。
|
|
a: P < 0.001,b: P < 0.01, 与Ctl组比较; c: P < 0.001,与SSc组比较
A:皮肤HE染色;B:真皮层厚度比较;C:肺组织HE染色;D:改良肺纤维化评分 图 2 各组小鼠皮肤和肺组织HE染色 |

|
|
a: P < 0.001,b: P < 0.01,c: P < 0.05,与Ctl组比较;d: P < 0.001,e: P < 0.01, 与SSc组比较
A:皮肤Masson染色;B:皮肤组织胶原含量比较;C:肺组织Masson染色;D:肺组织胶原含量 图 3 各组小鼠皮肤和肺组织Masson染色 |
2.1.3 肺组织细胞外基质表达
Western blot检测结果发现,与Ctl组相比,SSc组小鼠肺组织中细胞外基质Col4累积明显增多(P < 0.05),SSc+Ba组细胞外基质较SSc组明显减少(P < 0.05, 图 4A、B)。

|
|
a: P < 0.05,b: P < 0.01,c: P < 0.001,与Ctl组比较;d: P < 0.05,与SSc组比较
A:Westen blot检测肺组织蛋白表达1~3:Ctl组;4~6:SSc组;7~9:SSc+Ba组;B:Col4蛋白相对表达量;C: JAK2蛋白相对表达量;D: p-JAK2蛋白相对表达量;E:p-STAT3蛋白相对表达量;F:CD86蛋白相对表达量;G:CD163蛋白相对表达量 图 4 各组小鼠肺组织中细胞外基质Col4、JAK2/STAT3和巨噬细胞标志物表达 |
2.2 巴瑞替尼影响小鼠血浆和肺组织中炎症因子的水平
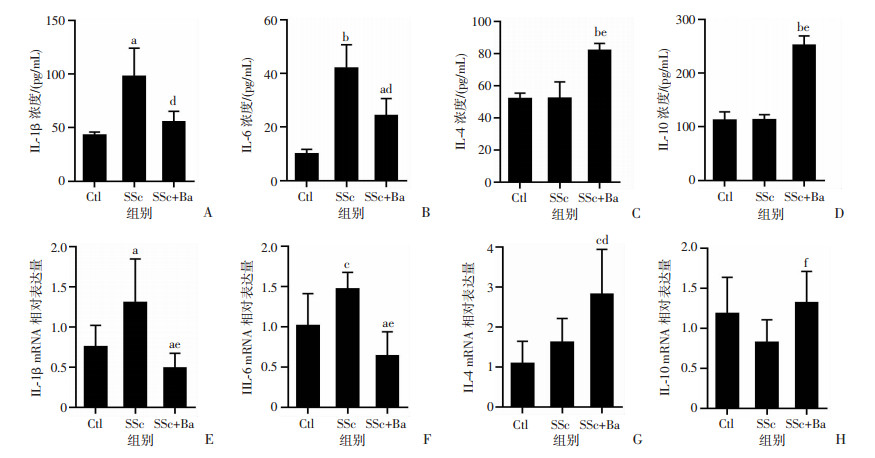
ELISA检测结果显示,与Ctl组相比,SSc组小鼠血浆中促炎因子IL-1β和IL-6浓度明显升高(P < 0.05,P < 0.001),抗炎因子IL-4和IL-10浓度差异无统计学意义。与SSc组相比,SSc+Ba组促炎因子IL-1β和IL-6浓度明显降低、抗炎因子IL-4和IL-10浓度明显升高(P < 0.01,图 5A~D)。肺组织中炎症因子的mRNA水平具有同样的变化趋势(图 5E~H)。
|
|
a: P < 0.05,b: P < 0.001,c: P < 0.01,与Ctl组比较;d: P < 0.01,e: P < 0.001,f: P < 0.05,与SSc组比较
A: 血浆IL-1β浓度;B:血浆IL-6浓度;C:血浆IL-4浓度;D:血浆IL-10浓度;E:肺组织IL-1β mRNA相对表达量;F:肺组织IL-6 mRNA相对表达量;G:肺组织IL-4 mRNA相对表达量;H:肺组织IL-10 mRNA相对表达量 图 5 各组小鼠血浆炎症因子浓度和肺组织炎症因子mRNA水平 |
2.3 巴瑞替尼影响SSc小鼠肺组织中JAK2/STAT3信号通路表达
Western blot检测结果显示,与Ctl组相比,SSc组小鼠肺组织中JAK2和STAT3蛋白激活明显增多,与SSc组相比,SSc+Ba组2种蛋白激活明显减少(P < 0.001,P < 0.05,图 4A、C~E)。
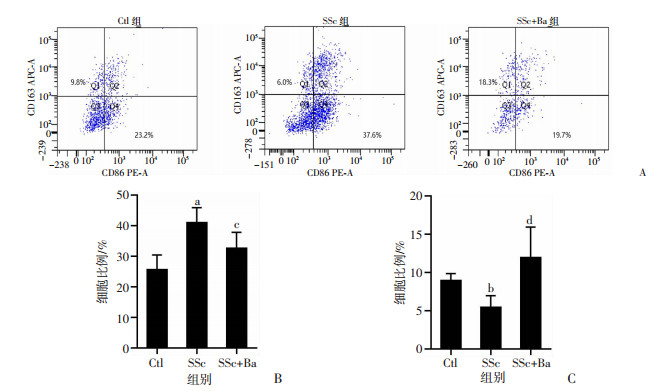
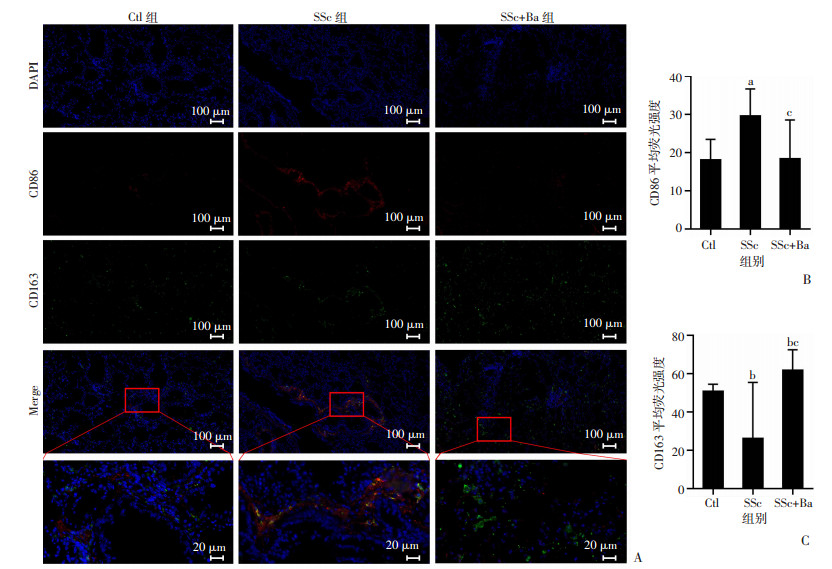
2.4 巴瑞替尼影响SSc小鼠巨噬细胞极化与Ctl组相比,SSc组小鼠脾脏巨噬细胞中F4/80+CD86+CD163-的M1型巨噬细胞比例明显升高(P < 0.001),F4/80+CD86-CD163+的M2型巨噬细胞比例明显降低(P < 0.01)。巴瑞替尼降低了小鼠脾脏中M1细胞比例,升高了M2细胞比例(P < 0.001,图 6)。Westen blot和免疫荧光检测结果显示,与Ctl组相比,SSc组小鼠肺组织中CD86蛋白表达升高,CD163蛋白表达降低,差异具有统计学意义(P < 0.01);SSc+Ba组与SSc组相比,肺组织中CD86表达降低,CD163表达升高,差异具有统计学意义(P < 0.05,图 4A、F、G,图 7)。
|
|
a: P < 0.001,b: P < 0.01,与Ctl组比较;c: P < 0.01,d: P < 0.001,与SSc组比较
A:流式细胞术检测小鼠脾脏巨噬细胞极化;B: 小鼠脾脏F4/80+CD86+CD163-的M1型巨噬细胞比例;C:小鼠脾脏F4/80+CD86-CD163+的M2型巨噬细胞比例 图 6 各组小鼠脾脏巨噬细胞极化情况 |
|
|
a: P < 0.01,b: P < 0.05,与Ctl组比较;c: P < 0.05,d:P < 0. 01,与SSc组比较
A:小鼠肺组织中CD86和CD163免疫荧光表达;B:小鼠肺组织中CD86平均免疫荧光强度;C:小鼠肺组织CD163平均免疫荧光强度 图 7 各组小鼠肺组织CD86和CD163荧光表达 |
3 讨论
JAK是一种受体相关的酪氨酸激酶家族,配体和受体结合后诱导JAK活化。活化的JAK募集并磷酸化STAT蛋白,磷酸化的STAT蛋白形成二聚体进入细胞核调控目的基因转录。JAK2在多种细胞因子信号通路中起重要作用,并参与增殖、分化、凋亡以及免疫调节等多种生物学过程[9]。研究发现JAK2在心脏纤维化[10]、特发性肺纤维化[11-12]和类风湿关节炎伴间质性肺病[11]等炎症和纤维化疾病中高表达,表明JAK2可能在调节组织炎症和纤维化进程中起重要作用。
巨噬细胞是一种固有免疫细胞,在机体的防御、炎症反应、内环境稳定以及抗原呈递等生理过程中发挥重要作用,并具有调控固有免疫和适应性免疫等重要生物学过程的功能[13]。巨噬细胞具有高度可塑性,根据不同刺激物转化为不同表型,包括经典活化巨噬细胞(M1型)和替代活化巨噬细胞(M2型)。脂多糖单独或联合干扰素-γ可诱导巨噬细胞极化为M1型,释放如IL-1β、IL-6、IL-12、IL-23、肿瘤坏死因子-α和环氧合酶2等因子促进炎症反应[14]。IL-4、IL-10、IL-13、糖皮质激素和免疫复合物等可诱导巨噬细胞极化为M2型,M2型巨噬细胞又分为4个亚型,包括M2a、b、c和d,其中M2a主要由IL-4和IL-13诱导,表达Ⅰ型精氨酸酶编码基因、甘露糖受体和CD163等,促进组织的损伤修复[15]。
肺组织纤维化分为早期炎症阶段和中晚期纤维化阶段[16]。在肺纤维化的早期,肺组织中巨噬细胞极化为M1型,诱导持续的炎症反应和组织损伤。在肺纤维化的中晚期,肺组织中巨噬细胞极化为M2型,促进损伤修复和重塑[16]。WANG等[17]在急性肺损伤动物模型中发现M1型巨噬细胞显著增加,分泌大量炎症因子和趋化因子,加剧肺泡上皮细胞和血管内皮细胞损伤。另一项研究表明在急性肺损伤早期,肺组织中存在大量M1型巨噬细胞浸润,而在急性肺损伤晚期,肺组织中聚集大量M2型巨噬细胞[18]。DONG等[19]在碳纳米管诱导的小鼠肺纤维化模型中发现M1型巨噬细胞在模型诱导的第1天明显上升,第3天达到峰值。以上研究表明,在肺组织纤维化的早期阶段,巨噬细胞极化为M1表型,诱导持续的炎症反应和组织损伤。
巨噬细胞极化机制目前尚不明确,但有研究表明JAK/STAT信号通路与巨噬细胞极化有关[20-21]。一项关于炎症性肠病的研究发现托法替尼通过靶向抑制JAK3和JAK2进而抑制炎症因子IL-6和IL-22分泌,同时抑制STAT3信号过度表达来改善肠道屏障功能受损和降低疾病易感性[22]。在另一项研究中,RUNTSCH等[23]发现衣康酸及其衍生物在巨噬细胞中通过修饰JAK1的残基减少巨噬细胞极化为M2表型,其机制是靶向JAK1/STAT6信号通路。激活JAK/STAT1通路可促进干扰素-γ诱导M1极化,而抑制JAK/STAT6通路可抑制IL-4诱导M2极化[24]。此外,在缺血性脑损伤和心肌再灌注损伤的研究中发现鲁索利替尼和黄芩苷通过抑制JAK2/STAT3磷酸化调控巨噬细胞极化来减轻炎症反应和组织损伤[25-26]。
本研究发现JAK2/STAT3在SSc小鼠肺组织中激活,证明JAK2/STAT3信号通路很可能促进SSc肺纤维化的发生和发展。在干预4周SSc小鼠肺纤维化模型中,SSc组小鼠肺组织巨噬细胞主要极化为M1型,分泌更多促炎因子(IL-1β和IL-6)。巴瑞替尼通过减少促炎因子分泌和抑制M1极化发挥抗炎和减轻组织炎症损伤的作用,其机制与靶向抑制JAK2/STAT3信号通路有关。
本研究在构建SSc-ILD模型的同时予以巴瑞替尼干预,因此巴瑞替尼减轻SSc肺纤维化的作用是预防性的,而非治疗性。但由于发现巴瑞替尼具有缓解皮肤增厚和改善组织炎症损伤的作用,因此巴瑞替尼可能对SSc患者的病情有一定的改善作用。成纤维细胞在纤维化疾病的发病机制中具有重要作用,在纤维化过程中,成纤维细胞和巨噬细胞存在相互作用[27]。本研究仅探讨了巨噬细胞在SSc小鼠模型中的极化情况,而成纤维细胞和巨噬细胞的相互作用及其机制尚不明确,仍需更深入的研究。
| [1] |
DENTON C P, KHANNA D. Systemic sclerosis[J]. Lancet, 2017, 390(10103): 1685-1699. |
| [2] |
PERELAS A, SILVER R M, ARROSSI A V, et al. Systemic sclerosis-associated interstitial lung disease[J]. Lancet Respir Med, 2020, 8(3): 304-320. |
| [3] |
KHANNA D, NAGARAJA V, TSENG C H, et al. Predictors of lung function decline in scleroderma-related interstitial lung disease based on high-resolution computed tomography: implications for cohort enrichment in systemic sclerosis-associated interstitial lung disease trials[J]. Arthritis Res Ther, 2015, 17: 372. |
| [4] |
DISTLER O, HIGHLAND K B, GAHLEMANN M, et al. Nintedanib for systemic sclerosis-associated interstitial lung disease[J]. N Engl J Med, 2019, 380(26): 2518-2528. |
| [5] |
JORGENSEN S C J, TSE C L Y, BURRY L, et al. Baricitinib: a review of pharmacology, safety, and emerging clinical experience in COVID-19[J]. Pharmacotherapy, 2020, 40(8): 843-856. |
| [6] |
ASSADIASL S, FATAHI Y, MOSHARMOVAHED B, et al. Baricitinib: from rheumatoid arthritis to COVID-19[J]. J Clin Pharmacol, 2021, 61(10): 1274-1285. |
| [7] |
KALIL A C, PATTERSON T F, MEHTA A K, et al. Baricitinib plus remdesivir for hospitalized adults with covid-19[J]. N Engl J Med, 2021, 384(9): 795-807. |
| [8] |
HVBNER R H, GITTER W, EL MOKHTARI N E, et al. Standardized quantification of pulmonary fibrosis in histological samples[J]. Biotechniques, 2008, 44(4): 507-511, 514-517. |
| [9] |
RUAN H, LUAN J Y, GAO S Y, et al. Fedratinib attenuates bleomycin-induced pulmonary fibrosis via the JAK2/STAT3 and TGF-β1 signaling pathway[J]. Molecules, 2021, 26(15): 4491. |
| [10] |
EID R A, ALKHATEEB M A, EL-KOTT A F, et al. A high-fat diet rich in corn oil induces cardiac fibrosis in rats by activating JAK2/STAT3 and subsequent activation of ANG Ⅱ/TGF-1β/Smad3 pathway: the role of ROS and IL-6 trans-signaling[J]. J Food Biochem, 2019, 43(8): e12952. |
| [11] |
WANG S H, LIU M F, LI X J, et al. Canonical and noncanonical regulatory roles for JAK2 in the pathogenesis of rheumatoid arthritis-associated interstitial lung disease and idiopathic pulmonary fibrosis[J]. FASEB J, 2022, 36(6): e22336. |
| [12] |
MILARA J, HERNANDEZ G, BALLESTER B, et al. The JAK2 pathway is activated in idiopathic pulmonary fibrosis[J]. Respir Res, 2018, 19(1): 24. |
| [13] |
周宪宾. 巨噬细胞M1/M2极化分型的研究进展[J]. 中国免疫学杂志, 2012, 28(10): 957-960. ZHOU X B. Research progress on M1/M2 polarization typing of macrophages[J]. Chin J Immunol, 2012, 28(10): 957-960. |
| [14] |
RUSSELL D G, HUANG L, VANDERVEN B C. Immunometabolism at the interface between macrophages and pathogens[J]. Nat Rev Immunol, 2019, 19(5): 291-304. |
| [15] |
WANG L X, ZHANG S X, WU H J, et al. M2b macrophage polarization and its roles in diseases[J]. J Leukoc Biol, 2019, 106(2): 345-358. |
| [16] |
蔡泽慧, 赵鹏, 张蓝熙, 等. 巨噬细胞活化参与肺纤维化机制研究进展[J]. 中国老年学杂志, 2022, 42(15): 3853-3857. CAI Z H, ZHAO P, ZHANG L X, et al. Research progress on the mechanism of macrophage activation participating in pulmonary fibrosis[J]. Chin J Gerontol, 2022, 42(15): 3853-3857. |
| [17] |
WANG L, ZHANG H S, SUN L Y, et al. Manipulation of macrophage polarization by peptide-coated gold nanoparticles and its protective effects on acute lung injury[J]. J Nanobiotechnology, 2020, 18(1): 38. |
| [18] |
石小云. M2巨噬细胞在脂多糖诱导肺纤维化中的作用及机制[D]. 南昌: 南昌大学, 2021. SHI X Y. Effects and mechanism of M2 macrophages on pulmonary fibrosis induced by lipopolysaccharide[D]. Nanchang: Nanchang University, 2021. |
| [19] |
DONG J, MA Q. Macrophage polarization and activation at the interface of multi-walled carbon nanotube-induced pulmonary inflammation and fibrosis[J]. Nanotoxicology, 2018, 12(2): 153-168. |
| [20] |
LIANG Y B, TANG H, CHEN Z B, et al. Downregulated SOCS1 expression activates the JAK1/STAT1 pathway and promotes polarization of macrophages into M1 type[J]. Mol Med Rep, 2017, 16(5): 6405-6411. |
| [21] |
周琦, 孙慧娟, 于栋华, 等. 巨噬细胞M1/M2型极化在不同疾病中的作用机制[J]. 中国药理学通报, 2020, 36(11): 1502-1506. ZHOU Q, SUN H J, YU D H, et al. Mechanisms of M1/M2 macrophage polarization in different diseases[J]. Chin Pharmacol Bull, 2020, 36(11): 1502-1506. |
| [22] |
SPALINGER M R, SAYOC-BECERRA A, ORDOOKHANIAN C, et al. The JAK inhibitor tofacitinib rescues intestinal barrier defects caused by disrupted epithelial-macrophage interactions[J]. J Crohns Colitis, 2021, 15(3): 471-484. |
| [23] |
RUNTSCH M C, ANGIARI S, HOOFTMAN A, et al. Itaconate and itaconate derivatives target JAK1 to suppress alternative activation of macrophages[J]. Cell Metab, 2022, 34(3): 487-501.e8. |
| [24] |
SHAN X, HU P, NI L, et al. Serine metabolism orchestrates macrophage polarization by regulating the IGF1-p38 axis[J]. Cell Mol Immunol, 2022, 19(11): 1263-1278. |
| [25] |
ZHU H, JIAN Z H, ZHONG Y, et al. Janus kinase inhibition ameliorates ischemic stroke injury and neuroinflammation through reducing NLRP3 inflammasome activation via JAK2/STAT3 pathway inhibition[J]. Front Immunol, 2021, 12: 714943. |
| [26] |
XU M, LI X Y, SONG L C. Baicalin regulates macrophages polarization and alleviates myocardial ischaemia/reperfusion injury via inhibiting JAK/STAT pathway[J]. Pharm Biol, 2020, 58(1): 655-663. |
| [27] |
BUECHLER M B, FU W X, TURLEY S J. Fibroblast-macrophage reciprocal interactions in health, fibrosis, and cancer[J]. Immunity, 2021, 54(5): 903-915. |




