2. 400042 重庆,陆军特色医学中心野战外科研究部战伤感染与特需药品研究室;
3. 400042 重庆,陆军特色医学中心放射科;
4. 400042 重庆,陆军特色医学中心野战外科研究部军事交通伤防治研究室
2. Department of Wound Infection and Drug, Army Medical Center of PLA, Chongqing, 400042, China;
3. Department of Radiology, Army Medical Center of PLA, Chongqing, 400042, China;
4. Department of Military Traffic Injury Prevention and Treatment, Army Medical Center of PLA, Chongqing, 400042, China
肝脏作为抵御血源、肠源病原体的重要防线[1-2],含有丰富的巨噬细胞、自然杀伤细胞,以及体内最大的内皮细胞网络,其免疫监测对宿主的免疫和生存至关重要[3]。Kupffer(枯否)细胞是肝内常驻的巨噬细胞,占体内总组织巨噬细胞的80%~90%,是宿主防御细菌感染早期阶段的关键组成部分[4]。脓毒症发生后,巨噬细胞功能下降,主要表现为吞噬能力下降、炎症因子减少及细胞凋亡增多等,严重威胁脓毒症患者的生存及预后[5-6]。因此,当发生免疫抑制后,研究肝脏中最大的细胞群体肝实质细胞在感染中的作用具有重要的生物学意义。研究表明,细菌感染的单核细胞、巨噬细胞等分泌细胞因子(如IL-6、IL-1、TNF-α等)刺激肝细胞产生相关蛋白或介质,促进杀菌作用,主要机制有:①分泌调理素介导杀菌,如C-反应蛋白(C-reactive protein,CRP)和血清淀粉样蛋白P成分(serum amyloid P,SAP)与细菌结合,激活补体系统在细菌或感染的宿主细胞膜上形成攻膜复合物裂解靶细胞;此外血清淀粉样蛋白A(serum amyloid A,SAA)与细菌外膜蛋白A家族成员结合以激活吞噬细胞的吞噬作用;②产生LPS(脂多糖)配体或受体活化机体固有免疫,如LBP(LPS结合蛋白)、CD14、MD-2蛋白,LPS与其结合后,活化TLR4-MD2下游通路;③分泌铁代谢相关蛋白限制细菌生长:如转铁蛋白与游离铁结合,限制细菌对铁的利用;脂运载蛋白-2通过与铁载体结合降低细菌对铁的吸收;铁调素通过调节血铁浓度,抑制宿主体内病原菌生长;④产生凝血因子纤维蛋白原激活补体或募集中性粒细胞产生其胞外诱捕网(neutrophil extracellular traps,NETs)清除病原菌[7-8]。除分泌介导抗菌的相关蛋白外,肝脏上皮细胞作为非专职吞噬细胞还可通过内吞作用吞噬凋亡和坏死细胞,发生细胞套亡,维持稳态,但肝细胞在病原体攻击时是否发挥直接作用并不明确[9]。本研究以FL83B肝细胞建立细菌感染模型为切入点,探讨肝细胞在感染中的作用,为研究免疫细胞失调后传统非免疫细胞的先天免疫能力提供新思路。
1 材料与方法 1.1 材料 1.1.1 实验细胞小鼠肝Kupffer细胞(GPC0448)购自中国典型培养物保藏中心细胞库,FL83B肝细胞(CRL-2390)购自ATCC,大肠杆菌购自北纳生物。
1.1.2 主要试剂RPMI1640培养基、Ham’s F-12K培养基、胎牛血清、PBS缓冲液、胰蛋白酶购自Gibco公司;无酚红Ham’s F-12K培养基购自武汉普诺赛生命科技有限公司;胰蛋白胨、酵母提取物等购自英国Oxiod公司;台盼蓝、青霉素链霉素溶液、蛋白裂解液、BCA蛋白浓度测定试剂盒购自碧云天生物技术有限公司;碘化丙啶溶液(PI;00-6990-50)、吞噬作用检测试剂盒(V6694)购自ThermoFisher Scientific公司;RNAiso Plus(9109), 定量PCR专用反转录试剂PrimeScriptTM(RR047A),快速qPCR试剂TB Green®(RR820A)购自TaKaRa公司;p-NF-κB p65(3033)、NF-κB p65(8242)、p-STAT3(9134)、STAT3(4904)、p-p38 MAPK(4511)、p38 MAPK(9212)、iNOS(13120)、β-Tublin(2128)抗体购自Cell Signaling Technology公司;RhoB(sc-8048)、NOX2(sc-130543)购自Santa Cruz Biotechnology公司。
1.2 方法 1.2.1 细胞培养Kupffer和FL83B细胞采用常规传代培养,分别用RPMI1640培养基、Ham’s F-12K培养基(含体积分数为10%的胎牛血清、1%青霉素-链霉素溶液)于37 ℃、5%CO2培养箱中进行培养。
1.2.2 大肠杆菌的制备将-80 ℃保存的大肠杆菌用三线法接种于固体LB平板上,37 ℃过夜,复苏菌株。次日挑选单个菌落,接种于液体LB培养基中,于37 ℃,速度200 r/min摇动过夜。LB液体培养基:酵母提取物5.0 g、蛋白胨10.0 g、氯化钠10.0 g加水1 L后高压灭菌备用;固体培养基则是在1 L LB培养基中加入琼脂粉15.0 g,高压灭菌后分装至6 cm的培养皿中备用。
1.2.3 大肠杆菌生长曲线的绘制将含有5×105CFU的大肠杆菌接种到分别含LB培养基、无酚红细胞培养基、Kupffer细胞(5×106个)和无酚红细胞培养基、FL83B肝细胞(5×106个)和无酚红细胞培养基的培养瓶中,置于37 ℃、5%CO2培养箱中进行培养,并于指定时间点测定每组培养基中大肠杆菌的菌落形成单位(colony forming units, CFU),以大肠杆菌相对数量为纵坐标,培养时间为横坐标,绘制大肠杆菌的生长曲线。
1.2.4 死菌的测定为了评估共培养后细胞及上清对细菌的影响,用碘化丙啶(PI)对细菌进行染色,因为PI无法进入质膜完整的细胞,膜受损的细胞被认为已经死亡或垂死,会染上红色。将细菌与PI共孵育90 min,通过分光光度计分别在535 nm和617nm的激发和发射波长下测定相对荧光强度。
1.2.5 吞噬能力的检测采用吞噬测定试剂盒检测FL83B肝细胞的吞噬能力,该试剂盒含有荧光素标记的大肠杆菌颗粒,吞入细胞的大肠杆菌可被分光光度计或者荧光显微镜检测到,细胞外的荧光可被试剂盒中的台盼蓝淬灭。将荧光素标记的大肠杆菌与细胞共培养2 h(在无细胞孔中加入等量荧光菌作为阴性对照),用分光光度计分别在480 nm和520 nm的激发和发射波长下测定荧光强度;用Olympus荧光显微镜观察细胞吞噬情况并拍照。
1.2.6 qRT-PCR实验每组FL83B肝细胞约2.5×106个,将1.5×106CFU的大肠杆菌加入各组感染6、12、24 h,收集细胞团块,使用RNAiso Plus试剂提取细胞总RNA。按照定量PCR反转录试剂盒反转录成cDNA。按照快速qPCR试剂盒说明书配制反应溶液,采用CFX-96 real-time PCR system(Bio-Rad公司)完成反应。引物由擎科生物设计合成,Fcgr1上游:5′-FAGGTTCCTCAATGCCAAGTGA-3′,下游:5′-GCGACCTCCGAATCTGAAGA-3′;Marco上游:5′-ACAGAGCCGATTTTGACCAAG-3′,下游:5′-CAGCAGTGCAGTACCTGCC-3′;Cdc42上游:5′-TGGGTGCCTGAGATAACTCACC-3′,下游:5′-GCACTCCACATACTTGACAGCC-3′;RhoB上游: 5′-CAACTGCTGCAAGGTGCTATG-3′,下游: 5′-CCAGCAGATGTCAGGCAGTC-3′;H2-K1上游:5′-GGGAGCCCCGGTACATGGAA-3′,下游: 5′-GGTGACTTTATCTTCAGGTCTGCT-3′;β2M上游: 5′-ATGGCTCGCTCGGTGACCCTG-3′,下游: 5′-ATTGCTCAGCTATCTAGGATA-3′; GAPDH上游: 5′-CAGTGGCAAAGTGGAGATTGTTG-3′,下游: 5′-TCGCTCCTGGAAGATGGTGAT-3′。
1.2.7 Western blot实验每组FL83B肝细胞约5×106个,将3×106CFU的大肠杆菌加入各组感染6、12、24 h,收集细胞团块,加入适量含蛋白酶/磷酸酶抑制剂的RIPA裂解液,冰上裂解细胞,12 000×g离心10 min后取上清进行BCA蛋白定量,加入5×loading buffer制成蛋白样本,用于常规Western blot检测。抗体p-NF-κB p65、NF-κB p65、p-STAT3、STAT3、p-p38 MAPK、p38 MAPK、iNOS、β-tublin稀释比例均为1 ∶1 000,RhoB、NOX2稀释比例均为1 ∶500。
1.3 统计学分析每个实验均独立重复3次,采用GraphPad Prism 7.0软件进行数据分析。采用Student’s t检验或重复测量设计。P<0.05表示差异有统计学意义。
2 结果 2.1 FL83B肝细胞可抑制大肠杆菌的增殖为探究肝细胞是否发挥直接抑菌作用,前期通过预实验测定了细菌感染细胞系模型的最佳细菌/细胞比例,如果细菌细胞比例过大,细胞(包括免疫细胞)会迅速死亡,无法较好观察到抑菌现象;而比例过小,细菌增殖缓慢,无法成功构建细菌感染细胞系模型。最终确定了5×105CFU(细菌)/5×106(细胞)的最佳比率进行本研究。在Kupffer细胞和FL83B肝细胞正常生长的培养瓶中分别接种等量的大肠杆菌,于不同时间点测定大肠杆菌的CFU,评估其增殖情况,同步设置LB培养基、无酚红细胞培养基组为对照。接种大肠杆菌后,置于37 ℃、5%CO2培养箱中进行培养,并于0、1、2、4、6、8、10、12、14、16、18、20、22、24、26 h测定每组培养基中大肠杆菌的CFU,以大肠杆菌数量为纵坐标,培养时间为横坐标,绘制大肠杆菌的生长曲线。如图 1A、B所示,从4 h开始,相较于LB培养基组和细胞培养基组,与Kupffer细胞和FL83B肝细胞共培养的大肠杆菌增殖量显著减少(P<0.05),说明与细胞共培养的大肠杆菌生长受到抑制;而细胞培养基与LB培养基两组的大肠杆菌生长差异无统计学意义,即所用的无酚红细胞培养基不影响细菌的生长。为直观显示大肠杆菌数量差异,取细胞培养基组、细胞共培养组24 h培养基稀释后涂于LB固体培养基上,结果显示与Kupffer细胞和FL83B肝细胞共培养的大肠杆菌数量明显少于细胞培养基组(图 1C)。为检测细胞存活率,将与细菌共培养24 h的两种细胞进行台盼蓝染色,两组均只有少量细胞死亡(图 1D)。以上结果说明肝细胞可抑制大肠杆菌的增殖,且自身细胞活性不受影响。

|
| A、B: 分别为Kupffer细胞、FL83B肝细胞生长体系中大肠杆菌的生长曲线 a: P<0.05;C:Kupffer细胞、FL83B肝细胞生长体系中大肠杆菌在LB平板上生长菌落;D: Kupffer细胞、FL83B肝细胞台盼蓝染色 图 1 不同条件下大肠杆菌的生长情况和细胞完整性 |
2.2 FL83B肝细胞对大肠杆菌增殖发挥直接抑制作用
为明确FL83B肝细胞对细菌的抑制是直接作用还是通过分泌细胞因子等间接作用,在6、12、24 h收集正常培养的Kupffer和FL83B的细胞培养基,离心取上清,将6、12、24 h上清分别加入含细胞或空白培养孔中,并加入等量大肠杆菌共培养,检测大肠杆菌的增殖情况。将共培养的各组上清分别涂于LB平板上,发现上清联合细胞组的大肠杆菌菌落数低于单独上清组(图 2A、B),测量各组上清中大肠杆菌CFU也获得一致结果(图 2C、D),差异有统计学意义(P<0.05)。为进一步研究对细菌的杀伤作用,对大肠杆菌进行PI染色,发现上清联合细胞组的相对死菌数量明显大于单独上清组(P<0.05,图 2E、F),说明上清联合细胞组对细菌的杀伤作用大于单独上清组。即肝细胞可通过细胞接触直接抑制大肠杆菌增殖。

|
|
1:细胞联合6 h细胞培养上清组; 2:细胞联合12 h细胞培养上清组; 3:细胞联合24 h细胞培养上清组; 4:6 h细胞培养上清组; 5:12 h细胞培养上清组; 6:24 h细胞培养上清组; a: P<0.05,分别与相应单独上清组比较 A、B: Kupffer细胞、FL83B肝细胞生长体系中大肠杆菌在LB平板上生长菌落;C、D:Kupffer细胞、FL83B肝细胞生长体系中大肠杆菌计数;E、F: Kupffer细胞、FL83B肝细胞生长体系中大肠杆菌总数中的相对死菌量 图 2 不同培养条件下大肠杆菌生长情况 |
2.3 FL83B肝细胞可直接吞噬大肠杆菌
FL83B肝细胞胞内荧光强度显著高于阴性对照(无细胞孔)(P<0.05,图 3A)。用Olympus荧光显微镜观察各组荧光,结果显示,FL83B细胞类似于Kupffer细胞,可在胞内观察到荧光颗粒(图 3B)。qRT-PCR对吞噬和抗原递呈相关分子进行检测(图 3C),结果显示与未处理肝细胞相比,大肠杆菌感染6 h后,与吞噬相关受体Fcgr1、Marco、Cdc42和RhoB mRNA水平显著增加(P<0.05);与MHCI抗原递呈相关分子检测发现,H2-K1 mRNA在6 h出现升高趋势,但差异无统计学意义;β2M mRNA在6 h后逐渐升高(P<0.05),并于12 h到达峰值后迅速降低。以上结果显示,肝细胞在应对细菌感染时,具备细菌吞噬能力和抗原递呈能力。

|
|
a: P<0.05,与对照组比较 A:肝细胞吞噬细菌后荧光强度的表达;B:肝细胞吞噬细菌后细胞内荧光颗粒的检测;C:qRT-PCR检测大肠杆菌感染后FL83B细胞中相关分子的mRNA表达 图 3 FL83B的吞噬功能及相关分子mRNA表达水平 |
2.4 大肠杆菌激活FL83B细胞的NF-κB、MAPK、STAT3信号通路
为探究细菌感染时肝细胞活化的信号通路,通过检测大肠杆菌感染FL83B肝细胞6、12、24 h的蛋白,发现NF-κB信号通路中p-p65的表达显著增加(P<0.05),表明NF-κB信号通路被激活;p-STAT3随大肠杆菌感染呈时间依赖性增加(P<0.05);大肠杆菌感染12、24 h后,p-p38 MAPK显著增加(P<0.05),见图 4,表明MAPK通路活化。提示细菌感染可直接激活肝细胞内NF-κB、MAPK、STAT3信号通路。

|
|
a: P<0.05,与对照组比较 A:Western blot检测大肠杆菌感染6、12、24 h后FL83B细胞中蛋白表达;B:蛋白半定量分析 图 4 大肠杆菌感染FL83B细胞后通路蛋白表达 |
2.5 大肠杆菌感染FL83B细胞中抗菌相关蛋白的表达
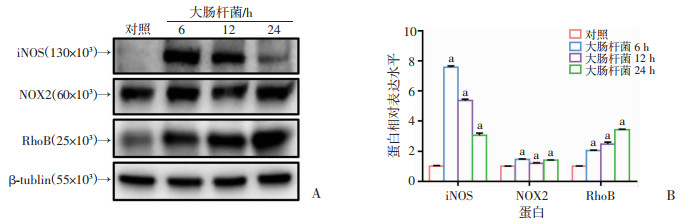
上述活化的通路已报道可上调巨噬细胞表达iNOS(诱导NO生成)、NOX2(诱导ROS生成)、RhoB(促进病原菌吞噬),为进一步明确FL83B细胞中是否也产生介导抗菌作用的相关蛋白,本研究对感染大肠杆菌6、12、24 h后的FL83B肝细胞进行检测,发现大肠杆菌感染后,FL83B细胞中iNOS蛋白急剧增加,于6 h到达峰值,在12、24 h依次下降;NOX2蛋白也呈现不同程度的增加;RhoB蛋白呈时间依赖性增加(P<0.05,图 5)。表明FL83B细胞在细菌感染时杀菌介质生成增强,促进吞噬的蛋白表达上调。
|
|
a: P<0.05,与对照组比较 A:Western blot检测大肠杆菌感染6、12、24 h后FL83B细胞中介导抗菌作用的相关蛋白表达;B:蛋白半定量分析 图 5 大肠杆菌感染FL83B细胞后抗菌相关蛋白的表达 |
3 讨论
不同于专职吞噬细胞(如单核细胞、巨噬细胞等),非专职吞噬细胞(如上皮细胞、成纤维细胞等)吞噬颗粒能力有限[10-11]。肝脏上皮细胞是非专职吞噬细胞,可吞噬凋亡和坏死细胞形成细胞叠套结构,在炎症和癌症中意义重大[9, 11-12]。目前报道的肝细胞内吞作用有胞葬、细胞侵入性死亡、伸入运动、胞壳溶解[9]。本研究发现肝细胞可直接吞噬细菌颗粒来发挥抑菌作用,丰富了对肝细胞作为非专职吞噬细胞的认识。且肝细胞在抗菌过程中也保持高存活率,说明细胞还存在除焦亡、自噬、胀亡、坏死性细胞死亡和细胞套亡方式之外的目前未知的抗菌方式,这也是本课题组后续关注的重点。
Fcgr1属于FcγR家族,是细胞表面吞噬作用受体,Fcgr1的mRNA水平与吞噬能力正相关[13-14]。Marco敲低会导致巨噬细胞吞噬伪足的数量显著减少,并抑制细胞的吞噬作用;Marco过表达促进巨噬细胞的吞噬作用,在宿主防御中起着关键作用[15-16]。有研究发现吞噬作用主要依赖于Cdc42和RhoB的激活[17-18]。本研究发现感染上调了FL83B细胞的Fcgr1、Marco、Cdc42和RhoB mRNA水平,即提示在细菌感染后FL83B细胞吞噬细菌颗粒的能力提高。组织相容性复合体MHC是免疫系统中最主要的抗原呈递分子,本研究检测了经典的MHCI亚型H2-K1,发现感染后虽然只有略微上调,但其在肝细胞中基础表达量较高,总体都维持高水平表达;MHCI的辅因子β2M mRNA在6 h逐渐升高,并于12 h达到峰值,以上结果提示在FL83B肝细胞吞噬细菌颗粒后可进行抗原递呈[19]。
肝细胞是肝脏中数量最多的细胞,也是执行代谢、解毒、蛋白质合成等肝功能最主要的细胞。此前研究显示,肝细胞在免疫细胞的协同作用下参与了抗菌过程[7],细菌感染后,免疫细胞分泌如IL-6、IL-1、TNF-α(肿瘤坏死因子)等细胞因子,激活STAT3和NF-κB来调节肝细胞产生介导抗菌作用的相关蛋白[8, 20-21]。Kupffer细胞是先天免疫的重要组成部分,支持肝脏在系统防御和区域防御中发挥着核心作用[22]。本研究以Kupffer细胞为对照,探究FL83B肝细胞在细菌攻击时的应答能力。与Kupffer细胞类似,FL83B肝细胞也可抑制大肠杆菌的增殖,且细菌攻击可直接促进FL83B肝细胞中STAT3和NF-κB活化,即肝细胞可单独发挥抑菌作用,表明其直接参与免疫反应。
既往研究表明肝细胞分泌的介导抗菌作用的相关蛋白可在细菌表面形成孔洞状“膜攻击复合物”,使细菌内容物外漏破裂而亡[7]。在此基础上我们研究了FL83B肝细胞的抑菌途径,发现上清联合细胞组对大肠杆菌的生长抑制作用显著强于单独上清组,且PI染色显示上清联合细胞组对细菌的杀伤作用大于单独上清组,提示在此抑菌效应中有除分泌蛋白以外的细胞因素。为了阐明该现象,本研究进行吞噬检测,发现FL83B肝细胞可吞噬大肠杆菌。吞噬作用是有效清除病原体的早期和基本步骤,吞噬和杀死病原体的能力被认为是巨噬细胞的主要效应功能,是先天免疫防御第一道防线的重要组成部分[23]。这些结果提示肝细胞可通过吞噬作用和分泌介导抗菌作用的相关蛋白共同发挥直接免疫防御。
RhoB是小Rho-GTPases家族的一员,细胞暴露于LPS或炎性细胞因子后可能以NF-κB依赖性途径快速上调[24],RhoB可通过诱导LC3脂质化和自噬体形成来促进细胞内细菌清除[25]。在本研究中,我们发现在大肠杆菌攻击后,肝细胞中的RhoB蛋白水平显著增加,即肝细胞吞噬细菌后,可能通过RhoB促进胞内细菌清除。iNOS(一氧化氮合酶亚型)的激活比组成型表达的内皮NOS和神经元NOS能引发更多的NO生成,NO可直接介导细菌的清除[26-27]。既往报道NF-κB和p38活化可诱导iNOS的表达[26-28], 与本研究结果一致,即p38-MAPK、NF-κB、iNOS途径也可能是肝细胞发挥抑菌作用的机制。NADPH氧化酶是一种与吞噬细胞相关的氧化剂生成系统,NADPH氧化酶NOX2将电子从细胞质NADPH穿梭到吞噬体或细胞外空间中的分子氧,以产生氧化剂,支持吞噬细胞的抗菌活性[29]。本研究显示,肝细胞在细菌攻击后NOX2的表达量也进一步增加,提示肝细胞抑菌的可能机制。更深入的分子机制仍需要进一步探索,这将是我们后续关注的重点。
综上所述,本研究发现肝细胞可直接吞噬细菌并上调介导抗菌功能的相关蛋白来发挥直接抑菌作用。由此可见,肝细胞可与驻守肝脏的传统免疫细胞一样直接参与免疫防御,颇似“平时为民,战时为兵”的细胞民兵。作为组成肝脏的主要细胞,肝细胞的直接抗菌功能不容忽视。考虑到脓毒症时免疫细胞难以纠正的功能失衡,寻找调控肝细胞直接免疫功能的关键靶点是值得进一步探索的方向。本研究为肝细胞免疫防御提供新理论、新思路,对研究非专职吞噬细胞的生理活动及宿主先天免疫功能具有重要的科学意义。
作者贡献声明 马娓和舒俊傑负责方法设计、实验试剂材料准备、实验操作、数据整理及分析、实验结果可视化、初稿撰写等;陈地友、王丽负责实验操作、数据整理、实验结果可视化等;高强国、杨霞负责实验构思与设计、结果的审核、实验监督管理、稿件审阅和修改等
| [1] |
SON G, KREMER M, HINES I N. Contribution of gut bacteria to liver pathobiology[J]. Gastroenterol Res Pract, 2010, 2010: 453563. |
| [2] |
BERG R D. Bacterial translocation from the gastrointestinal tract[J]. Trends Microbiol, 1995, 3(4): 149-154. |
| [3] |
VAN DER HEIDE D, WEISKIRCHEN R, BANSAL R. Therapeutic targeting of hepatic macrophages for the treatment of liver diseases[J]. Front Immunol, 2019, 10: 2852. |
| [4] |
BILZER M, ROGGEL F, GERBES A L. Role of Kupffer cells in host defense and liver disease[J]. Liver Int, 2006, 26(10): 1175-1186. |
| [5] |
QIU P, LIU Y, ZHANG J. Review: the role and mechanisms of macrophage autophagy in sepsis[J]. Inflammation, 2019, 42(1): 6-19. |
| [6] |
XIE J F, WANG H L, KANG Y, et al. The epidemiology of sepsis in Chinese ICUs: a national cross-sectional survey[J]. Crit Care Med, 2020, 48(3): e209-e218. |
| [7] |
ZHOU Z, XU M J, GAO B. Hepatocytes: a key cell type for innate immunity[J]. Cell Mol Immunol, 2016, 13(3): 301-315. |
| [8] |
NORRIS C A, HE M, KANG L I, et al. Synthesis of IL-6 by hepatocytes is a normal response to common hepatic stimuli[J]. PLoS One, 2014, 9(4): e96053. |
| [9] |
DAVIES S P, TERRY L V, WILKINSON A L, et al. Cell-in-cell structures in the liver: a tale of four E's[J]. Front Immunol, 2020, 11: 650. |
| [10] |
SEEBERG J C, LOIBL M, MOSER F, et al. Non-professional phagocytosis: a general feature of normal tissue cells[J]. Sci Rep, 2019, 9(1): 11875. |
| [11] |
SCHWEGLER M, WIRSING A M, DOLLINGER A J, et al. Clearance of primary necrotic cells by non-professional phagocytes[J]. Biol Cell, 2015, 107(10): 372-387. |
| [12] |
DAVIES S P, REYNOLDS G M, STAMATAKI Z. Clearance of apoptotic cells by tissue epithelia: a putative role for hepatocytes in liver efferocytosis[J]. Front Immunol, 2018, 9: 44. |
| [13] |
NIÑO D F, CAUVI D M, DE MAIO A. Itraconazole, a commonly used antifungal, inhibits Fcγ receptor-mediated phagocytosis: alteration of Fcγ receptor glycosylation and gene expression[J]. Shock, 2014, 42(1): 52-59. |
| [14] |
MATUSZEWSKA M, CIESLIK M, WILKANIEC A, et al. The role of bromodomain and extraterminal (BET) proteins in controlling the phagocytic activity of microglia in vitro: relevance to alzheimer's disease[J]. Int J Mol Sci, 2022, 24(1): 13. |
| [15] |
CARPENTIER K S, DAVENPORT B J, HAIST K C, et al. Discrete viral E2 lysine residues and scavenger receptor MARCO are required for clearance of circulating alpha viruses[J]. eLife, 2019, 8: 49163. |
| [16] |
XING Q Q, FENG Y X, SUN H M, et al. Scavenger receptor MARCO contributes to macrophage phagocytosis and clearance of tumor cells[J]. Exp Cell Res, 2021, 408(2): 112862. |
| [17] |
ZHANG J M, ZHU J P, BU X, et al. Cdc42 and RhoB activation are required for mannose receptor-mediated phagocytosis by human alveolar macrophages[J]. Mol Biol Cell, 2005, 16(2): 824-834. |
| [18] |
O'CALLAGHAN A A, DEMPSEY E, IYER N, et al. Intestinal metabolites influence macrophage phagocytosis and clearance of bacterial infection[J]. Front Cell Infect Microbiol, 2021, 11: 622491. |
| [19] |
MANGOLD C A, MASSER D R, STANFORD D R, et al. CNS-wide sexually dimorphic induction of the major histocompatibility complex 1 pathway with aging[J]. J Gerontol A Biol Sci Med Sci, 2017, 72(1): 16-29. |
| [20] |
EDER C. Mechanisms of interleukin-1beta release[J]. Immunobiology, 2009, 214(7): 543-553. |
| [21] |
BODE J G, ALBRECHT U, HÄUSSINGER D, et al. Hepatic acute phase proteins—Regulation by IL-6- and IL-1-type cytokines involving STAT3 and its crosstalk with NF-κB-dependent signaling[J]. Eur J Cell Biol, 2012, 91(6/7): 496-505. |
| [22] |
LI P Z, HE K, LI J Z, et al. The role of Kupffer cells in hepatic diseases[J]. Mol Immunol, 2017, 85: 222-229. |
| [23] |
SCHUMANN J. It is all about fluidity: fatty acids and macrophage phagocytosis[J]. Eur J Pharmacol, 2016, 785: 18-23. |
| [24] |
VEGA F M, RIDLEY A J. The RhoB small GTPase in physiology and disease[J]. Small Gtpases, 2018, 9(5): 384-393. |
| [25] |
MIAO C H, YU M Y, PEI G, et al. An infection-induced RhoB-Beclin 1-Hsp90 complex enhances clearance of uropathogenic Escherichia coli[J]. Nat Commun, 2021, 12(1): 2587. |
| [26] |
YOSHIDA T, DAS N A, CARPENTER A J, et al. Minocycline reverses IL-17A/TRAF3IP2-mediated p38 MAPK/NF-κB/iNOS/NO-dependent cardiomyocyte contractile depression and death[J]. Cell Signal, 2020, 73: 109690. |
| [27] |
CAPUTA G, MATSUSHITA M, SANIN D E, et al. Intracellular infection and immune system cues rewire adipocytes to acquire immune function[J]. Cell Metab, 2022, 34(5): 747-760.e6. |
| [28] |
CHEN H I, HU W S, HUNG M Y, et al. Protective effects of luteolin against oxidative stress and mitochondrial dysfunction in endothelial cells[J]. Nutr Metab Cardiovasc Dis, 2020, 30(6): 1032-1043. |
| [29] |
NAUSEEF W M. The phagocyte NOX2 NADPH oxidase in microbial killing and cell signaling[J]. Curr Opin Immunol, 2019, 60: 130-140. |




