2. 637000 四川 南充,川北医学院附属医院儿科/新生儿科;
3. 637000 四川 南充,川北医学院附属医院手术中心
2. Department of Pediatrics/Neonatology, Affiliated Hospital of North Sichuan Medical College, Nanchong, Sichuan Province, 637000, China;
3. Surgery Center, Affiliated Hospital of North Sichuan Medical College, Nanchong, Sichuan Province, 637000, China
主动脉夹层是心血管外科最常见的急症,发病急、病死率高,若不及时干预,48 h内的每小时病死率增加1%~2%,1周内病死率高达90%[1-2]。目前尚无有效的药物治疗方法,手术治疗是挽救患者生命唯一的方法[3-4]。目前关于主动脉夹层的机制研究较多,但具体机制仍不清楚[5]。近年研究发现,炎症在主动脉疾病的发生中起着重要作用[6]。NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)是众多炎症小体中最重要的一种,它可以通过激活Caspase-1裂解IL-1β调控炎症,在许多疾病的发生中起着重要作用[7]。NLRP3/Caspase-1/IL-1β炎症小体信号通路已在免疫性疾病、心肌病、动脉硬化等疾病中被证实[8-10],但关于NLRP3/Caspase-1/IL-1β炎症小体信号通路与主动脉夹层的关系报道较少。MCC950是一种新型的、高选择性的NLRP3炎症小分子抑制剂,能够抑制NLRP3活化,减轻炎症、抑制动脉硬化[11];但MCC950能否通过抑制NLRP3炎性通路的活化减少主动脉夹层形成,目前尚不清楚。本研究旨在通过构建小鼠主动脉夹层模型并用MCC950进行干预,探讨NLRP3/Caspase-1/IL-1β炎症小体通路在主动脉夹层中的作用及MCC950对主动脉夹层的影响,为主动脉夹层的机制研究提供理论依据。
1 材料与方法 1.1 主要仪器和试剂本研究主要采用的仪器和试剂有:小动物手术器械(上海医疗器械公司),无创尾袖BP-2000系统(美国Visitech system公司),石蜡切片机(德国Leica公司),生物组织包埋机(德国Leica公司),恒温水浴锅(日本Sanyo公司),电泳槽、蛋白转膜槽(美国Bio-Rad公司),倒置荧光显微镜(德国Carl Zeiss公司),化学发光仪(湖南湘仪实验室仪器开发有限公司),β-氨基丙腈(上海麦克林生化科技有限公司),MCC950(美国MCE公司),凋亡试剂盒(北京索莱宝科技有限公司),HE染色试剂盒、EVG弹力纤维试剂盒、DAPI(上海碧云天生物技术有限公司),NLRP3抗体、Caspase-1抗体、ASC抗体、IL-1β抗体、α-SMA抗体、OPN抗体、β-tubulin内参(美国Proteintech公司),Cy3标记红色驴抗山羊IgG、488标记绿色驴抗山羊IgG(武汉艾美捷科技有限公司)。
1.2 实验动物50只3周龄雄性C57BL/6小鼠,体质量10~13 g[动物许可证号:SCXK(川)2021-30,四川达硕生物科技有限公司]。饲养在定湿、定温的动物房内,温度20~25 ℃,相对湿度20%~25 %,昼夜节律12 h/12 h。小鼠的饲养和处置过程均符合《中国实验动物管理要求》。
1.3 实验分组及干预采用随机抽样法将小鼠分为3组:①对照组(n=10),无干预;② BAPN组(n=20),饮水中加入1 g/(kg·d) β-氨基丙腈(β-aminopropionitrile,BAPN);③BAPN+MCC950组(n=20),饮水中加入1 g/(kg·d) BAPN、腹腔注射MCC950 20 mg/(kg·d)[11]。3组小鼠自由饮食、饮水,连续观察28 d。每3天记录体质量、饮水量,每周使用无创尾袖BP-2000系统测量小鼠血压、心率。喂养过程中若出现死亡,立即解剖,观察夹层发生情况。未死亡小鼠于给药28 d后,颈椎脱臼法处死,取下主动脉,游标卡尺测量主动脉最大直径,将主动脉分为2份,1份放于4 %多聚甲醛中用于染色,1份放于-80°冰箱中用于Western blot实验。
1.4 HE染色主动脉标本经4%多聚甲醛固定过夜,脱水,石蜡包埋,切成5 μm切片。切片经过脱蜡,水化后,加入HE染色液染色,酒精脱水,二甲苯清洗,封片,显微镜下观察,并采集图像。
1.5 弹力纤维(elastic van gieson,EVG)染色将主动脉组织切成5 μm厚切片,脱蜡、水化,EVG染色50 min,背景分化,复染VG,蒸馏水冲洗后封皮,显微镜下观察,图像采集分析。
1.6 免疫荧光染色石蜡切片经脱水、分化后,用柠檬酸抗原提取缓冲液中进行抗原修复,0.1% Triton X-100破膜5 min,10%驴血清室温封闭1 h,分别用一抗NLRP3(1 ∶200)、IL-1β(1 ∶200)、a-SMA(1 ∶200)、OPN(1 ∶200) 孵育过夜;洗片,加入荧光二抗避光孵育1 h;DAPI复染细胞核10 min。抗荧光淬灭剂封片后,在荧光显微镜下观察并采集图像,使用Image J软件进行阳性面积分析。
1.7 Western blot使用蛋白酶抑制剂和RIPA裂解缓冲液从小鼠胸主动脉中提取蛋白质。使用BCA蛋白检测试剂盒检测蛋白浓度。用10% 聚丙烯酰胺凝胶电泳分离等蛋白,然后将蛋白转移到聚偏二氟乙烯膜上。用5%牛血清蛋白封闭2 h后,用一抗NLRP3 (1 ∶1 000)、Caspase-1(1 ∶1 000)、ASC(1 ∶1 000)、IL-1β抗体(1 ∶1 000)、α-SMA抗体(1 ∶1 000)、OPN抗体(1 ∶1 000)、β-tubulin内参(1 ∶2 000)孵育过夜,PBS/T洗膜,然后用相应的来源的二抗(1 ∶5 000)孵育2 h,洗膜。使用化学发光成像系统曝光,并使用Image J软件进行半定量分析。
1.8 统计学分析所有数据采用GraphPad Prism 7.0和SPSS 19.0软件进行分析。正态分布的计量资料以x±s表示,2组间比较采用独立样本t检验。计数资料以频数(%)表示,2组比较采用χ2检验。Kaplan-Meier曲线用于评估生存期,Log-rank检验用于确定差异。P < 0.05为差异有统计学意义。
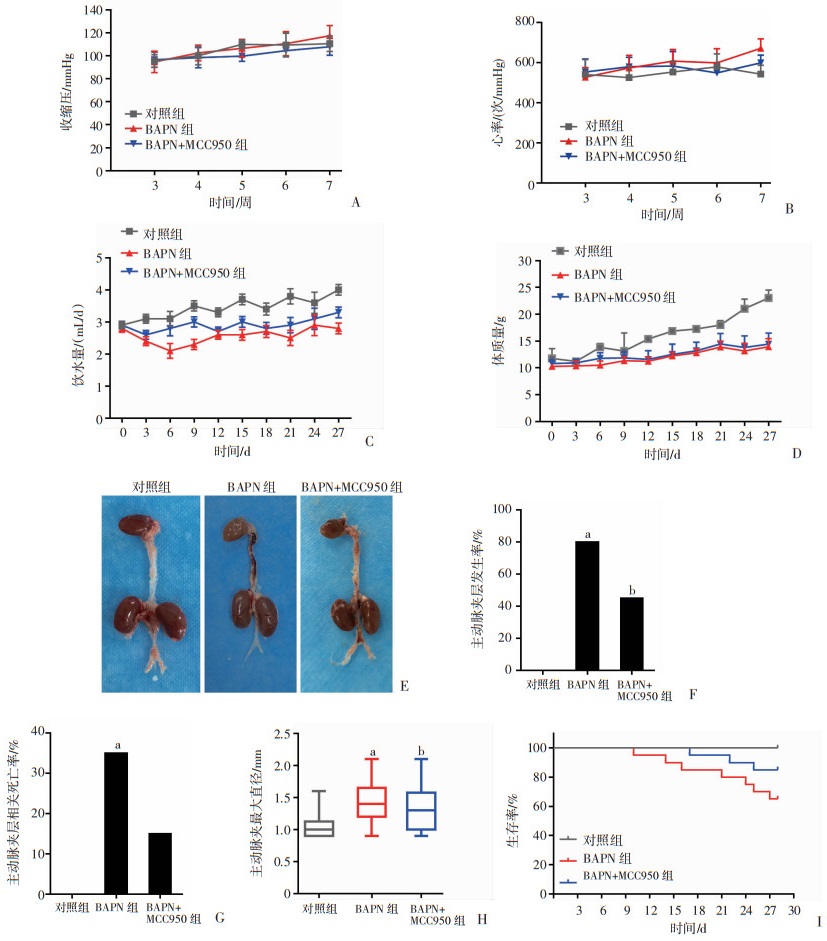
2 结果 2.1 NLRP3抑制剂MCC950减少了主动脉夹层的发生采用NLRP3抑制剂MCC950抑制NLRP3活化来进一步检测主动脉夹层发生是否有NLRP3炎症小体参与,结果显示:各组小鼠血压、心率差异无统计学意义(图 1A、B)。给予BAPN后,小鼠饮水量下降,体质量增加缓慢(P < 0.05,图 1C、D);与对照组比较,BAPN组小鼠主动脉增粗,假腔血栓形成(图 1E),主动脉夹层发生率(P < 0.001,图 1F)和夹层相关病死率(P=0.018,图 1G)明显增加;给予MCC950后,与BAPN组比较,BAPN+MCC950组小鼠主动脉壁损伤减轻(图 1E),主动脉夹层的发生率(P=0.004,图 1F)和夹层相关病死率(P=0.144,图 1G)下降,主动脉直径减小,生存率明显提高(P < 0.05,图H、I)。
|
|
a:P < 0.05,与对照组比较;b:P < 0.05,与BAPN组比较;对照组:n=10,BAPN组:n=20,BAPN+MCC950组:n=20 A:收缩压;B:心率;C:饮水量; D:体质量;E:主动脉解剖大体观察;F:主动脉夹层发生率;G:主动脉夹层相关死亡率;H:主动脉最大直径;I:生存曲线 图 1 各组实验小鼠主动脉夹层形成及生存情况(x±s) |
2.2 NLRP3/Caspase-1/IL-1β在主动脉夹层中表达增加
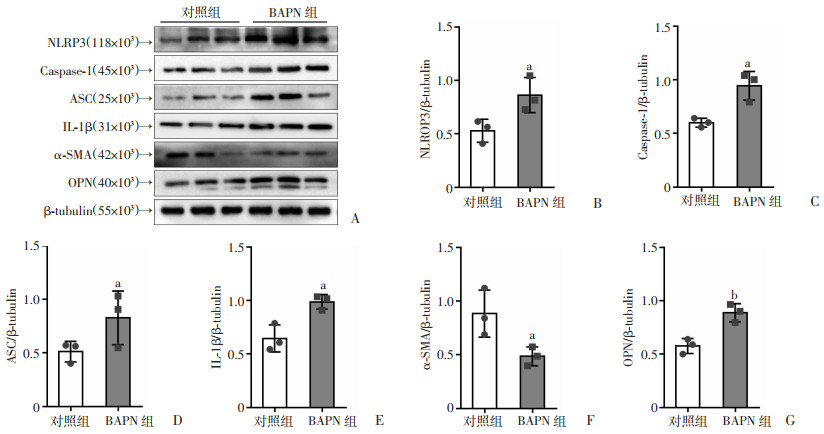
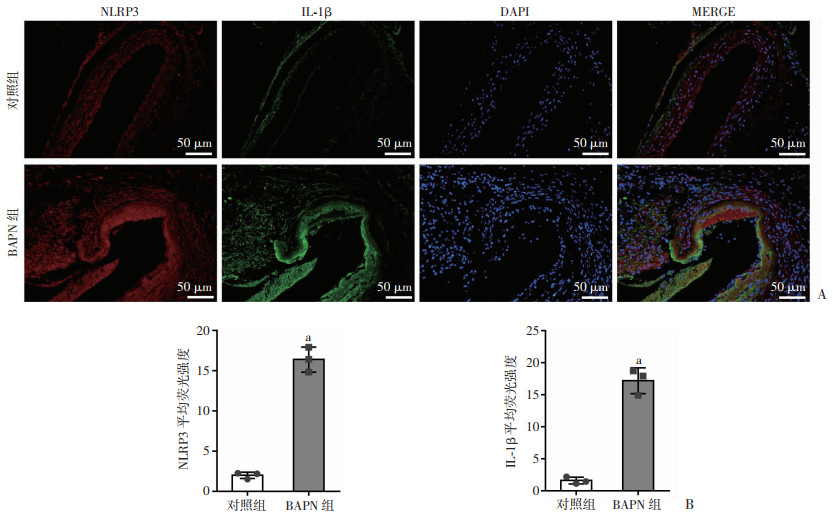
对各组小鼠主动脉中NLRP3/Caspase-1/IL-1β通路相关因子进行Western blot和免疫荧光检测,结果显示:与对照组比较,BAPN组中NLRP3、Caspase-1、ASC、IL-1β蛋白表达显著增加,收缩型蛋白α-SMA减少,而合成型蛋白OPN增加(P < 0.05,图 2)。免疫荧光结果亦显示:BAPN组中NLRP3、IL-1β表达显著增加(P < 0.05,图 3),证明主动脉夹层发生过程中,NLRP3/Caspase-1/IL-1β炎性信号通路被激活,而且主动脉平滑肌细胞由收缩型向合成型发生表型转换。
|
|
a:P < 0.05,b:P < 0.01,与对照组比较 A:Western blot检测NLRP3、Caspase-1、ASC、IL-1β、α-SMA、OPN蛋白的表达;B~G:NLRP3、Caspase-1、ASC、IL-1β、α-SMA、OPN蛋白的半定量分析 图 2 对照组及BAPN组小鼠主动脉中NLRP3/Caspase-1/IL-1β炎性信号通路相关蛋白表达(n=3, x±s) |
|
| a:P < 0.01, 与对照组比较;对照组:n=10,BAPN组:n=20 图 3 免疫荧光观察对照组及BAPN组小鼠主动脉中NLRP3、IL-1β表达(A)及平均荧光强度分析(B) (x±s) |
2.3 NLRP3抑制剂MCC950减轻了主动脉夹层炎性和弹力纤维断裂
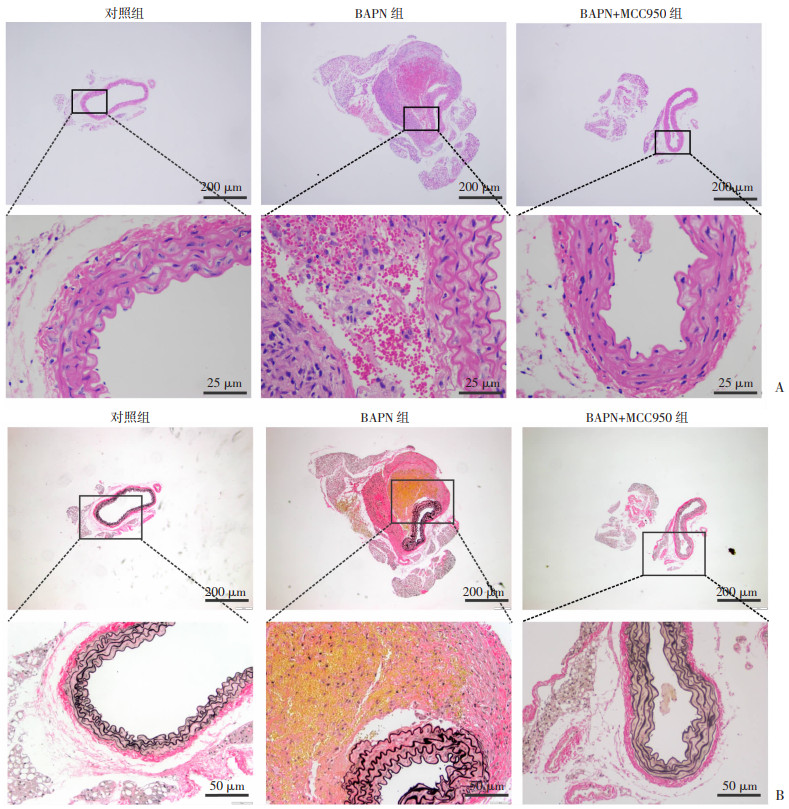
对各组小鼠主动脉进行HE和EVG染色,以观察主动脉弹力纤维断裂情况,由此判断主动脉夹层形成。结果显示:与对照组比较,BAPN组主动脉壁炎症明显增加,弹力纤维明显断裂;给予MCC950后,与BAPN组比较,BAPN+MCC950组主动脉壁炎症细胞浸润减少,弹力纤维断裂减少(图 4)。
|
| A:各组小鼠主动脉HE染色结果 蓝色:细胞核、细胞质内的核酸;红色:细胞质、细胞外基质;B:各组小鼠主动脉EVG染色结果 红色:细胞间的胶原纤维;黑色:弹力纤维 图 4 各组小鼠主动脉HE及EVG染色观察 |
2.4 NLRP3抑制剂MCC950抑制了NLRP3/Caspase-1/IL-1β通路活化
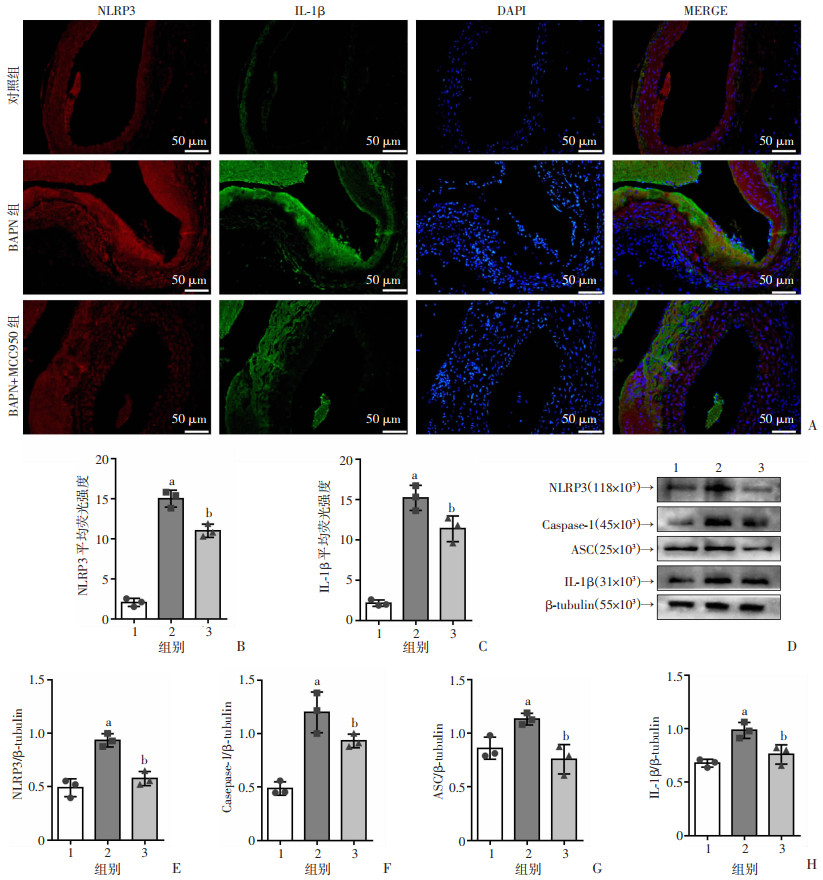
前述研究已通过动物模型及病理染色观察到NLRP3抑制剂MCC950可以减少主动脉夹层的发生和夹层相关死亡,并且可以减轻主动脉夹层血管壁的炎症。为进一步明确机制,本研究对其通路相关蛋白进行免疫荧光染色和Westen blot检测。免疫荧光结果显示:与BAPN组比较,BAPN+MCC950组血管壁中NLRP3、IL-1β表达下降(P < 0.05,图 5A~C)。Western blot结果显示:与BAPN组比较,BAPN+MCC950组的NLRP3、Caspase-1、ASC、IL-1β蛋白表达降低(P < 0.05,图 5D~H),表明MCC950成功抑制了主动脉夹层血管壁中NLRP3的表达,同时还降低了主动脉夹层所致的Caspase-1、ASC、IL-1β蛋白的升高。
|
|
1: 对照组;2:BAPN组;3:BAPN+ MCC950组;a:P < 0.05,与对照组比较,b:P < 0.05,与BAPN组比较 A:免疫荧光观察NLRP3、IL-1β表达;B、C:NLRP3、IL-1β荧光强度分析;D:Western blot检测NLRP3/Caspase-1/IL-1β炎性信号通路相关蛋白的表达;E~H:NLRP3、Caspase-1、ASC、IL-1β蛋白的半定量分析 图 5 NLRP3抑制剂MCC950对各组小鼠主动脉NLRP3/Caspase-1/IL-1β炎症信号通路的影响(n=3, x±s) |
2.5 NLRP3抑制剂MCC950减轻了平滑肌细胞收缩蛋白降解
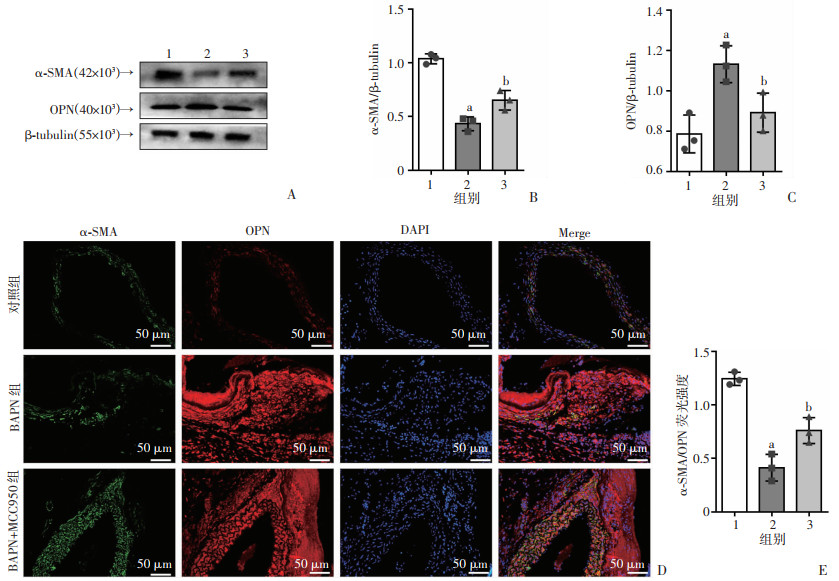
前述研究证实了主动脉夹层发生时平滑肌细胞由收缩型向合成型发生转换。Western blot及免疫荧光结果均显示:与BAPN组比较,BAPN+ MCC950组收缩型蛋白α-SMA含量增加,而合成型蛋白OPN含量下降(P < 0.05,图 6),表明MCC950抑制了主动脉夹层血管平滑肌表型转换。
|
|
1: 对照组;2:BAPN组;3:BAPN+ MCC950组;a:P < 0.05,与对照组比较,b:P < 0.05,与BAPN组比较 A:Western blot检测表型转换相关蛋白α-SMA、OPN的表达;B、C:α-SMA、OPN蛋白的半定量分析;D:α-SMA、OPN免疫荧光观察;E:α-SMA/OPN荧光强度比值 图 6 NLRP3抑制剂MCC950对各组小鼠主动脉平滑肌细胞表型转换的影响(n=3,x±s) |
3 讨论 3.1 NLRP3/Caspase-1/IL-1β炎症信号通路参与主动脉夹层的发生
主动脉夹层发病机制复杂,可能与主动脉壁血管平滑肌细胞表型转化、凋亡异常、细胞外基质异常降解、内皮功能障碍和免疫细胞浸润有关[12-13]。近年研究发现,炎症直接参与了主动脉夹层的发生。本课题组前期研究也发现,炎症与主动脉夹层的预后直接相关[14]。但炎症是主动脉夹层的始动因素还是主动脉夹层发生后的结局,目前尚无统一意见。目前对其他疾病的研究发现,炎症小体激活可能导致疾病发病增加,同时疾病发生后又增加了机体的炎症,二者互为因果存在[15]。而NLRP3作为先天免疫反应的关键调节因子,参与了许多疾病的发生[10, 16]。本研究发现,在小鼠主动脉夹层模型中,NLRP3/Caspase-1/IL-1β炎症信号通路被激活,给予NLRP3特异性抑制剂MCC950后,夹层的发生率和病死率明显减少,主动脉直径降低,NLRP3/Caspase-1/IL-1β炎症信号通路活化抑制,从而对血管起到保护作用。因此,炎症可能是主动脉夹层的重要启动因素。
3.2 抑制NLRP3可以通过抑制NLRP3/Caspase-1/IL-1β通路活化减少主动脉夹层的发生NLRP3/Caspase-1/IL-1β炎症信号通路参与疾病进展主要与IL-1β对炎症的调控有关[17-18]。NLRP3活化后,可以通过ASC接头募集Caspase-1,作用于IL-1β前体,使之活化为成熟的IL-1β发挥作用[15]。而在主动脉夹层发生过程中,中层的血管平滑肌细胞明显降解、弹力纤维断裂,炎症水平增加,而敲除IL-1β和使用IL-1β抑制剂后,能明显降低小鼠主动脉夹层的发生,降低主动脉壁弹性纤维断裂、减少平滑肌细胞降解、减轻主动脉炎症[19]。本研究亦显示:在小鼠主动脉夹层模型中,NLRP3、ASC、Caspase-1、IL-1β蛋白水平增加。为研究NLRP3参与主动脉夹层的可能机制,本研究通过腹腔注射NLRP3特异性抑制剂MCC950来降低小鼠体内NLRP3,以观察下调NLRP3后,对小鼠主动脉夹层的形成影响和对NLRP3炎症小体下游通路的影响,结果显示:MCC950能显著减少NLRP3、ASC、Caspase-1、IL-1β的释放,降低小鼠主动脉的夹层发生率和病死率,从而减轻血管炎症。说明NLRP3炎症小体参与主动脉夹层的发生亦通过IL-1β调控炎症相关。
3.3 抑制NLRP3可以减轻平滑肌细胞表型转换既往研究已经证实主动脉发生时,血管平滑肌收缩型蛋白α-SMA表达降低,而合成型蛋白OPN增加,说明平滑肌细胞收缩功能障碍和表型转换在主动脉夹层中起着重要作用[20-22]。本研究结果与报道一致,同时,使用NLRP3抑制剂MCC950后,主动脉壁中收缩型蛋白α-SMA的降解减少,收缩型蛋白向合成型蛋白转换减少,这可能是MCC950引起主动脉夹层小鼠血管壁炎症减轻,平滑肌细胞降解减少,导致夹层病变更轻的结果。
综上所述,主动脉夹层发生与NLRP3/Caspase-1/IL-1β炎性信号通路活化有相关,而NLRP3抑制剂MCC950能够抑制NLRP3的活化能减轻主动脉壁的炎症、血管平滑肌表型转换,从而起到减少主动脉夹层发生的作用,对血管起保护作用。
| [1] |
CARREL T, SUNDT T M, VON KODOLITSCH Y, et al. Acute aortic dissection[J]. Lancet, 2023, 401(10378): 773-788. |
| [2] |
向军, 李东林, 何玲, 等. 缺血修饰白蛋白对急性主动脉夹层患者院内死亡的预测价值[J]. 中华医学杂志, 2022, 102(101): 162-166. XIANG J, LI D L, HE L, et al. The value of ischemia modified albumin level for predicting in-hospital mortality in patients with acute aortic dissection[J]. Natl Med J China, 2022, 102(101): 162-166. |
| [3] |
HAMEED I, CIFU A S, VALLABHAJOSYULA P. Management of thoracic aortic dissection[J]. JAMA, 2023, 329(9): 756. |
| [4] |
ISSELBACHER E M, PREVENTZA O, HAMILTON BLACK J, et al. 2022 ACC/AHA guideline for the diagnosis and management of aortic disease: a report of the American Heart Association/American College of Cardiology Joint Committee on clinical practice guidelines[J]. Circulation, 2022, 146(24): e334-e482. |
| [5] |
RYLSKI B, SCHILLING O, CZERNY M. Acute aortic dissection: evidence, uncertainties, and future therapies[J]. Eur Heart J, 2023, 44(10): 813-821. |
| [6] |
SKOTSIMARA G, ANTONOPOULOS A, OIKONOMOU E, et al. Aortic wall inflammation in the pathogenesis, diagnosis and treatment of aortic aneurysms[J]. Inflammation, 2022, 45(3): 965-976. |
| [7] |
HUANG Y, XU W, ZHOU R B. NLRP3 inflammasome activation and cell death[J]. Cell Mol Immunol, 2021, 18(9): 2114-2127. |
| [8] |
WANG L, HAUENSTEIN A V. The NLRP3 inflammasome: mechanism of action, role in disease and therapies[J]. Mol Aspects Med, 2020, 76: 100889. |
| [9] |
HOSEINI Z, SEPAHVAND F, RASHIDI B, et al. NLRP3 inflammasome: its regulation and involvement in atherosclerosis[J]. J Cell Physiol, 2018, 233(3): 2116-2132. |
| [10] |
TAKAHASHI M. NLRP3 inflammasome as a common denominator of atherosclerosis and abdominal aortic aneurysm[J]. Circ J, 2021, 85(12): 2129-2136. |
| [11] |
GRANT A J, YANG N J, MOORE M J, et al. Selective NLRP3 inflammasome inhibitor MCC950 suppresses inflammation and facilitates healing in vascular materials[J]. Adv Sci, 2023, 10(20): e2300521. |
| [12] |
WORTMANN M, PETERS A S, ERHART P, et al. Inflammasomes in the pathophysiology of aortic disease[J]. Cells, 2021, 10(9): 2433. |
| [13] |
JI N, QI Z W, WANG Y Y, et al. Pyroptosis: a new regulating mechanism in cardiovascular disease[J]. J Inflamm Res, 2021, 14: 2647-2666. |
| [14] |
向军, 何玲, 李东林, 等. 胸主动脉腔内修复术后全身炎症反应综合征的危险因素分析[J]. 临床心血管病杂志, 2021, 37(5): 468-472. XIANG J, HE L, LI D L, et al. Analysis of risk factors for systemic inflammatory response syndrome after thoracic endovascular aortic repair[J]. J Clin Cardiol, 2021, 37(5): 468-472. |
| [15] |
MEYERS A K, ZHU X W. The NLRP3 inflammasome: metabolic regulation and contribution to inflammaging[J]. Cells, 2020, 9(8): 1808. |
| [16] |
TAKAHASHI M. NLRP3 inflammasome as a key driver of vascular disease[J]. Cardiovasc Res, 2022, 118(2): 372-385. |
| [17] |
SWANSON K V, DENG M, TING J P Y. The NLRP3 inflammasome: molecular activation and regulation to therapeutics[J]. Nat Rev Immunol, 2019, 19(8): 477-489. |
| [18] |
XU J, NÚÑEZ G. The NLRP3 inflammasome: activation and regulation[J]. Trends Biochem Sci, 2023, 48(4): 331-344. |
| [19] |
JOHNSTON W F, SALMON M, POPE N H, et al. Inhibition of interleukin-1β decreases aneurysm formation and progression in a novel model of thoracic aortic aneurysms[J]. Circulation, 2014, 130(11_suppl_1): S51-S59. |
| [20] |
ROMBOUTS K B, VAN MERRIENBOER T A R, KET J C F, et al. The role of vascular smooth muscle cells in the development of aortic aneurysms and dissections[J]. Eur J Clin Investig, 2022, 52(4): e13697. |
| [21] |
LU H, DU W, REN L, et al. Vascular smooth muscle cells in aortic aneurysm: from genetics to mechanisms[J]. J Am Heart Assoc, 2021, 10(24): e023601. |
| [22] |
GAO W B, YU H C, ZHANG Y J, et al. Latest findings on the pathogenic mechanisms of thoracic aortic dissection[J]. J Sichuan Univ Med Sci, 2023, 54(3): 699-704. |




