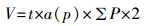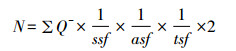认知功能障碍常见于多种神经精神疾病,包括卒中、阿尔茨海默病、帕金森病、创伤性脑损伤和精神分裂症等[1]。随着我国人口迅速老龄化,认知障碍相关疾病患者数量持续增加,极大加重了个人、家庭、社会的经济负担[2]。但是目前可用于治疗认知功能障碍的药物相对匮乏[1],因此, 对认知功能障碍具体机制以及治疗策略的研究迫在眉睫。
海马在记忆、导航和认知方面发挥着关键作用,对其研究的历史由来已久[3]。研究发现,海马体积减小与认知表现变化之间存在很强的相关性[4]。出现明显认知功能障碍的患者及模型小鼠均伴随海马体积的显著降低[5-6]。而作为神经信号传输的关键节点,突触丢失也与认知功能障碍密切相关[7-8]。研究者发现,在空间学习和记忆能力损伤的小鼠海马中存在大量树突棘和突触的功能障碍、数量减少[9-10]。慢性应激后伴随认知功能障碍的大鼠也被发现海马树突棘数量及分支显著减少[11]。以上研究表明,海马体积减小和树突棘突触的丢失可能是记忆和认知功能障碍的重要结构基础。
LINGO-1是一种富含亮氨酸的特异性跨膜蛋白,在大脑中广泛表达,特别是在大脑皮层和边缘系统中高表达[12],其基因编码于染色体15q24-26位点,而该位点涉及许多神经系统疾病[13]。VANGUILDER等[14]发现空间学习记忆能力受损的老年大鼠海马内LINGO-1的表达水平显著性升高,且与记忆损伤成正比。在多种认知障碍性疾病模型如多发性硬化症(multiple sclerosis, MS)、实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis, EAE)及阿尔茨海默病(Alzheimer’s disease, AD)中发现拮抗LINGO-1能够改善其认知功能障碍[15-17]。我们前期研究也发现,在认知改变初期,转基因AD小鼠海马内LINGO-1高表达,而腹腔注射LINGO-1拮抗剂能够改善其空间学习记忆能力[18-19]。由此推测,LINGO-1可能是导致认知功能障碍的一个重要的致病因子和治疗靶点。但目前的研究主要集中在拮抗LINGO-1对多种认知障碍性疾病模型的治疗作用上,而正常动物LINGO-1异常过表达能否导致认知功能障碍?如果能够,导致认知功能障碍的结构基础又是什么?目前尚不清楚。因此本研究在正常小鼠中运用脑立体定位注射腺相关病毒特异性过表达海马LINGO-1,探讨其对小鼠空间学习和记忆能力以及海马各亚区体积、树突棘突触的作用,以探究LINGO-1对空间学习与记忆能力及其依赖的海马结构的影响,以期在认知功能障碍性疾病的治疗中制定更加有针对性的治疗策略。
1 材料与方法 1.1 实验动物与分组C57小鼠由重庆医科大学实验动物中心提供,按照美国国家卫生研究院实验动物护理和使用指南(NIH出版物No.85-23)在重庆医科大学IVC级实验动物房进行标准喂养。选取20只7月龄雄性小鼠,采用简单随机法分为对照组(n=10)和LINGO-1过表达组(n=10),对照组小鼠海马立体定位注射携带绿色荧光的空载腺相关病毒(adeno-associated virus,AAV),LINGO-1过表达组小鼠海马立体定位注射同时携带绿色荧光和LINGO-1过表达载体的AAV。LINGO-1过表达载体病毒滴度为1.6×1012 VG/mL,空载病毒滴度为1.5×1012 VG/mL。
1.2 腺相关病毒脑立体定位注射将小鼠固定于脑立体定位注射仪上,通过呼吸面罩持续给予4% 异氟烷麻醉,随后将小鼠头顶皮肤消毒后剪开,使用棉签蘸取少量双氧水拭去脑膜,暴露囟门三角,并将囟门三角中点作为坐标原点,根据海马方位坐标(bregma M: -2.3 mm, L: -1.8 mm, V: -2.0 mm) 对双侧海马进行钻孔。采用自动注射泵以0.4 μL/min的速度向双侧海马各注射2 μL病毒,随后对小鼠头皮进行缝合并涂抹红霉素软膏消毒。将完成病毒注射的小鼠于正常环境下常规单笼饲养,并密切观察小鼠的状态和体质量。
1.3 Morris水迷宫实验病毒注射4周后,对2组小鼠进行Morris水迷宫实验,测试其海马依赖的空间学习和记忆能力[19]。水迷宫由1个内径120 cm的圆形水池、1个直径10 cm的平台及行为学分析系统Smart V3.0组成。实验开始前使用钛白粉将水染成白色,控制水温在25 ℃左右,将水池均分为4个象限并放置标记物,固定平台位置。实验第1天为可视平台定位航行训练,将平台调至高于水面1.5 cm,测试距离平台最远的两个象限,记录小鼠游泳轨迹及找到平台所需时间;第2~6天为隐藏平台定位航行训练,将平台调至低于水面1.5 cm,分别测试4个象限,记录小鼠游泳轨迹及找到平台所需时间;第7天为空间探索实验,取出平台,测试距离平台最远的2个象限,分别记录小鼠游泳速度、游泳轨迹、目标象限游泳时间、目标象限游泳路程百分比以及穿台次数等参数。
1.4 RNA提取和荧光定量PCR检测每组采用简单随机抽样法选取3只小鼠,腹腔注射1%戊巴比妥钠麻醉后,断颈处死,迅速开颅取出大脑,使用预冷的无酶器械于冰上快速分离出整个海马组织,在组织中加入RNA裂解液,并于冰上进行组织裂解。然后加入RNA稀释液混匀,14 000 r/min高速离心5 min,取其上清以2 ∶1加入无水乙醇充分混匀后进行RNA纯化。最后分别采用PrimeScriptTM RT reagent Kit with gDNA Eraser试剂盒和SYBR Green qPCR Master Mix试剂盒对获得的纯化RNA进行反转录和对目的基因进行荧光定量PCR。LINGO-1的正向引物序列为5′-TCCTGGGCGTTGTCCTATTCTG-3′,反向引物序列为5′-CGATGTTGTGCTTTGTGTTGCC-3′;β-actin的正向引物序列为5′-ACTCTTCCAGCCTTC-CTTC-3′,反向引物序列为5′-ATCTCCTTCTGCATCCT-GTC-3′。
1.5 连续等距离冰冻切片制备每组采用简单随机抽样法选取4只小鼠,腹腔注射1%戊巴比妥钠麻醉后,从剑突处剪开胸腔,暴露心脏,于心尖处将灌注针插入左心室,用止血钳固定,剪开右心耳后打开灌注泵,以8 mL/min的流速灌注生理盐水至肝脏变白后,用4%的多聚甲醛继续灌注至小鼠僵直。灌注后迅速取脑,将大脑置入4% 的多聚甲醛中继续固定1周以上。随机选取一侧大脑半球依次置10%、20%、30%蔗糖溶液中梯度脱水24 h,使用OCT包埋,速冻10 min后以50 μm的厚度进行连续切片,以1/5的抽样分数进行连续等距离抽样。将另一侧大脑半球以同样的处理进行脱水后,以30 μm的厚度进行连续切片,以1/20的抽样分数进行连续等距离抽样。通过体视学抽样,每只小鼠可获得5组50 μm和20组30 μm厚海马连续等距离切片。将抽样获得的这些切片先后置于0.01 mol/L的磷酸盐缓冲液(phosphate buffer saline,PBS)和75% 的乙醇中各浸洗3次×5 min,-20 ℃冰箱保存备用。
1.6 免疫荧光染色每组每只小鼠采用简单随机抽样法选取1组30 μm海马冰冻切片,用0.01 mol/L PBS室温漂洗10 min× 3次,用含0.3% triton+0.1% tween的PBS漂洗10 min× 6次,然后将切片放入枸橼酸盐缓冲液中,于99 ℃沸水浴修复30 min。待自然冷却至室温后,用含0.3% triton+0.1% tween的PBS漂洗10 min×3次。将切片置于封闭液(0.3% triton+0.1% tween+1%胎牛血清+10%山羊血清)中37 ℃孵育2 h。封闭后,用封闭液配制一抗anti-LINGO-1(abcam, 兔来源,1 ∶300),将切片置入一抗中,4 ℃冰箱孵育72 h。常温下切片复温1 h,用含0.3% triton+0.1% tween的PBS漂洗10 min×6次。然后将切片放入荧光二抗(DyLight 649,1 ∶200)中,37 ℃水浴锅中避光孵育2 h。切片取出后,用含0.3% triton+0.1% tween的PBS漂洗10 min×3次。DAPI复染5 min, 含0.3% triton+0.1% tween的PBS漂洗10 min×3次。将切片平整贴于防脱载玻片上,抗荧光淬灭剂封片,4 ℃避光保存。使用激光共聚焦显微镜(日本尼康)在100倍镜下刺激相应波长后观察并拍摄整个海马图像。
1.7 免疫组织化学染色每组每只小鼠采用简单随机抽样法选取1组50 μm海马冰冻切片,用0.01 mol/L PBS室温漂洗5 min× 3次,用含0.3% triton+0.1% tween的PBS漂洗10 min× 3次,然后将切片置于封闭液(0.3% triton+0.1% tween+1% 胎牛血清+10%山羊血清)中37 ℃孵育2 h。封闭后,将切片置入一抗anti-Spinophilin(14136S,兔来源,单克隆抗体,1 ∶1 000)中,4 ℃冰箱中孵育72 h。常温下切片复温1 h,用含0.3% tween的PBS漂洗10 min×6次,随后将切片置入金标二抗(AURION Ultra-Small Gold Reagents,1 ∶200)中37 ℃避光孵育3 h。此后,用含0.3% tween的PBS漂洗10 min×3次,用0.01 mol/L PBS漂洗10 min×3次,用2%的戊二醛室温避光固定10 min。随后分别用0.01 mol/L PBS、一级水、含0.3% triton+0.1% tween的PBS分别各漂洗10 min×3次。将切片置于银增强试剂(AURION R-Gent Silver Enhancement Kit,1 ∶1)中室温25 ℃避光显色30 min,显色后用一级水漂洗5 min×6次,0.01 mol/L PBS漂洗10 min×3次。最后,将切片平整贴于防脱载玻片上,风干后置于0.01 mol/L PBS中20 min。苏木精复染2 min,一级水冲洗3次,饱和NaHPO4溶液返蓝30 s,一级水冲洗3次。经梯度酒精脱水,置入二甲苯中透明10 min×3次,中性树脂封片,通风处晾干。
1.8 体视学计数海马各亚区体积和树突棘(spinophilin+着色点)嗜棘蛋白(spinophilin)是树突棘中存在的肌动蛋白和蛋白质磷酸酶-1结合蛋白,研究发现spinophilin可以标记恒河猴海马中93%的树突棘,成为定量评估树突棘数量的绝佳标记[20-21]。因此采用spinophilin作为树突棘突触标记物,运用无偏体视学方法计数小鼠海马各亚区体积及spinophilin+ (Sp+)树突棘突触总数。
在光学显微镜2.5倍镜下扫描出载玻片上完整的海马组织切片,参照小鼠脑图谱画出海马各亚区的轮廓,并在海马各亚区轮廓上叠加等距离测试点(图 1),计数落在海马各亚区轮廓内的点数,然后根据卡瓦列里原理,按照以下公式计算海马各亚区的体积V[18]。
|
| 计算落在海马各亚区内测试点的个数 图 1 小鼠海马各亚区体积计算示意图 |
其中t表示相邻两张切片之间的距离,即0.25 mm;a(p) 表示叠加测试点的面积;ΣP表示落在海马各亚区内测试点的个数总和。
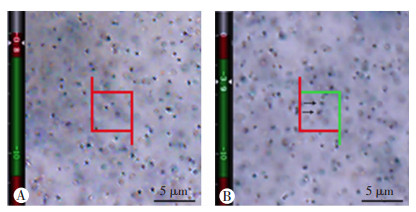
在光学显微镜4倍镜下,参照小鼠脑图谱画出海马各亚区的轮廓。随后在100倍油镜下,测量切片厚度,进行体视学面积抽样和计数高度抽样。根据无偏体视框计数原则,对在保护高度内没有清晰聚焦而在测试高度内清晰聚焦的Sp+着色点进行计数[22](图 2),最后根据光学分合法公式计算海马各亚区内树突棘突触的总数量N。
|
| A: 体视框保护高度为2 μm,处于保护高度内的Sp+树突棘不被计数;B: 对处于计数高度且不与体视框红色排除线相交的Sp+树突棘进行计数 黑色箭头示被计数的Sp+树突棘 图 2 小鼠海马各亚区Sp+树突棘计数示意图 |
其中N为小鼠海马各亚区内树突棘Sp+着色点的总数;ΣQ-为计数的Sp+着色点的数量;切片抽样分数ssf为1/5;面积抽样分数asf为0.2%;高度抽样分数tsf为计数框高度10 μm与每组切片平均厚度的比值。
1.9 统计学分析数据采用x±s表示,使用SPSS 26.0进行统计分析。采用重复测量方差分析(ANOVA)分析Morris水迷宫隐藏平台定位航行数据。对其余数据进行正态性检验,如果符合正态分布则用t检验,如果不符合正态分布则用非参数检验。以P < 0.05为差异有统计学意义。所有体视学定量数据的观察变异系数(OCV)和观察误差系数(OCE)的计算方法与团队前期研究方法一致[23]。
2 结果 2.1 对照组和LINGO-1过表达组小鼠病毒注射前后体质量差异无统计学意义海马定位注射AAV前,对照组小鼠体质量为(23.95± 2.87) g, LINGO-1过表达组小鼠体质量为(24.89±2.86) g。AAV注射4周后,对照组小鼠体质量为(25.57±3.35) g, LINGO-1过表达组小鼠体质量为(26.29±3.69) g。AAV注射前后,2组小鼠体质量变化差异无统计学意义。
2.2 海马定位注射过表达LINGO-1腺相关病毒能够有效上调小鼠海马LINGO-1基因表达水平和蛋白水平LINGO-1过表达组小鼠海马内LINGO-1的mRNA表达水平显著高于对照组小鼠[(67.77±14.62) vs (3.59±0.82),t=7.59,P < 0.01],同时,LINGO-1过表达组小鼠海马各亚区内LINGO-1蛋白的荧光强度显著性高于对照组小鼠(t=35.94,P < 0.01;t=32.61,P < 0.01;t=8.37,P < 0.01,图 3)。
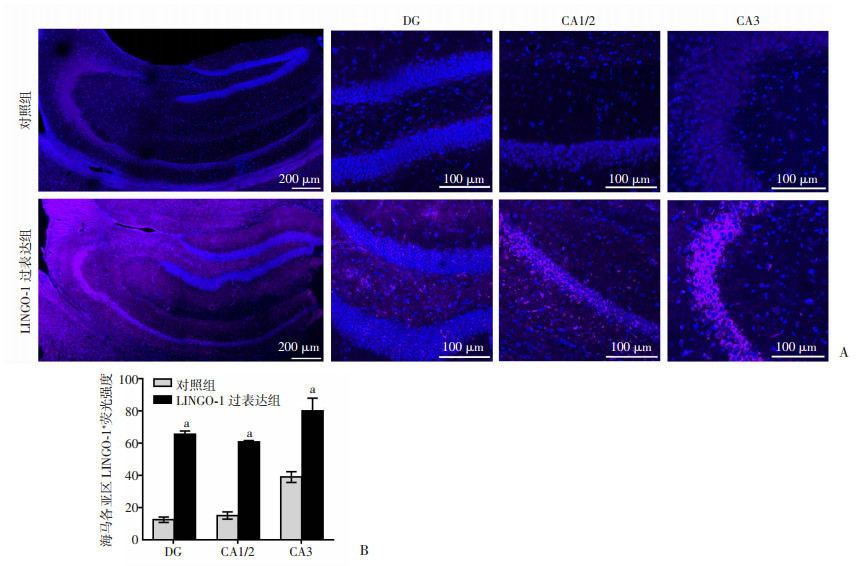
|
|
A:免疫荧光染色观察蓝色荧光为DAPI;紫色荧光为LINGO-1;B:2组小鼠海马各亚区LINGO-1+荧光强度(n=4)
a: P < 0.01, 与对照组比较 图 3 2组小鼠海马各亚区DAPI/LINGO-1+细胞免疫荧光染色观察 |
2.3 海马定位注射过表达LINGO-1的腺相关病毒可损伤小鼠的空间学习和记忆能力
从游泳轨迹看,LINGO-1过表达组小鼠在Morris水迷宫实验中表现明显差于对照组小鼠(图 4A)。可见平台实验中,2组小鼠逃避潜伏期差异无统计学意义;定位航行实验中,与对照组小鼠相比,LINGO-1过表达组小鼠的逃避潜伏期显著延长, 其中第5~6天2组小鼠出现显著差异(t=2.50,P < 0.05,图 4B)。空间探索实验中,2组小鼠游泳速度无明显差异(图 4C),尽管对照组和LINGO-1过表达组小鼠的穿台次数与目标象限游泳时间差异无统计学意义(图 4D、E),但LINGO-1过表达组小鼠的目标象限游泳路程百分比显著低于对照组小鼠(t=2.75,P < 0.05,图 4F)。
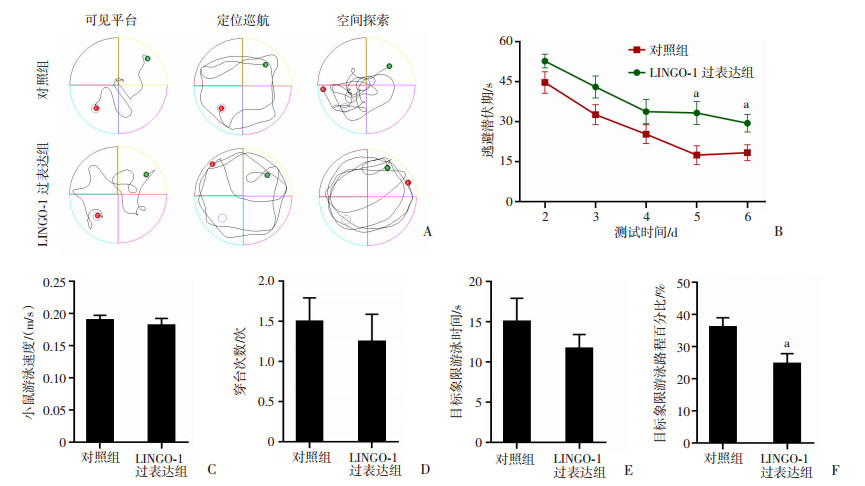
|
| A: 2组小鼠在可见平台、定位巡航和空间探索实验中的轨迹;B: 2组小鼠在定位航行实验中的逃避潜伏期;C: 2组小鼠在空间探索实验中的游泳速度;D: 2组小鼠的穿台次数;E: 2组小鼠在空间探索实验中的目标象限游泳时间;F: 2组小鼠在空间探索实验中的目标象限游泳路程百分比 a: P < 0.05,与对照组比较。 图 4 2组小鼠在Morris水迷宫中的表现 (n=10) |
2.4 海马定位注射过表达LINGO-1的腺相关病毒显著减少小鼠海马各亚区体积
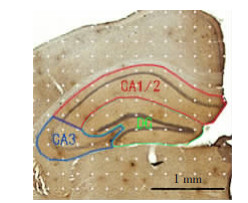
海马定位注射过表达LINGO-1的腺相关病毒后,对照组与LINGO-1过表达组小鼠海马各亚区分区见示意图(图 5A)。结果显示:与对照组小鼠相比,LINGO-1过表达组小鼠海马总体积、DG、CA1/2及CA3区体积均显著减少(t=7.36,P < 0.05;t=2.76,P < 0.05;t=3.43,P < 0.05;t=4.46,P < 0.01。图 5B),其中OCE值均小于0.15,OCV2/OCV2均小于0.5,提示体视学抽样符合抽样标准。结果表明海马注射过表达LINGO-1病毒能够显著减少小鼠海马各亚区体积。
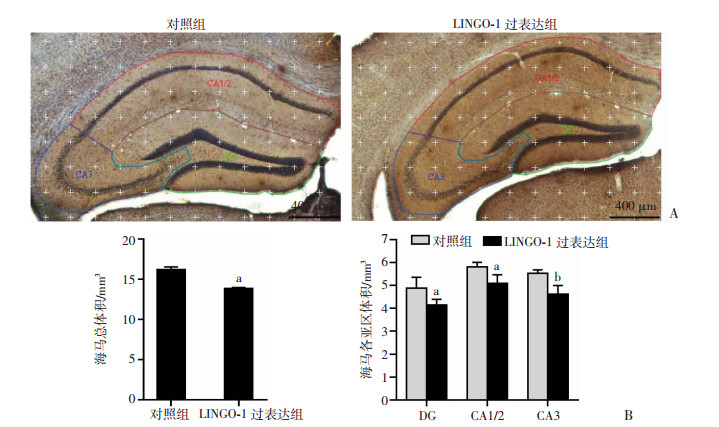
|
| A: 病毒注射后,2组小鼠海马各亚区分区示意图绿色区域内为海马DG区;红色区域内为海马CA1/2区;蓝色区域内为海马CA3区;B: 2组小鼠海马总体积及各亚区体积(n=4) a: P < 0.05,b: P < 0.01, 与对照组比较 图 5 2组小鼠海马各亚区体积及体视学定量分析 |
2.5 海马定位注射过表达LINGO-1的腺相关病毒显著减少小鼠海马各亚区Sp+树突棘总数及密度
通过免疫组织化学染色对小鼠海马Sp+树突棘进行标记(图 6A),并运用体视学方法对小鼠海马各亚区Sp+树突棘进行计数。结果显示:LINGO-1过表达组小鼠海马各亚区内Sp+树突棘数量显著低于对照组小鼠(t=2.50,P < 0.05;t=3.18,P < 0.05;t=2.84,P < 0.05。图 6B);同时与对照组相比,LINGO-1过表达组小鼠海马各亚区内Sp+树突棘密度也显著降低(t=5.14,P < 0.01;t=2.89,P < 0.05;t=3.28,P < 0.05。图 6B)。结果提示过表达小鼠海马LINGO-1会导致小鼠海马各亚区树突棘丢失。
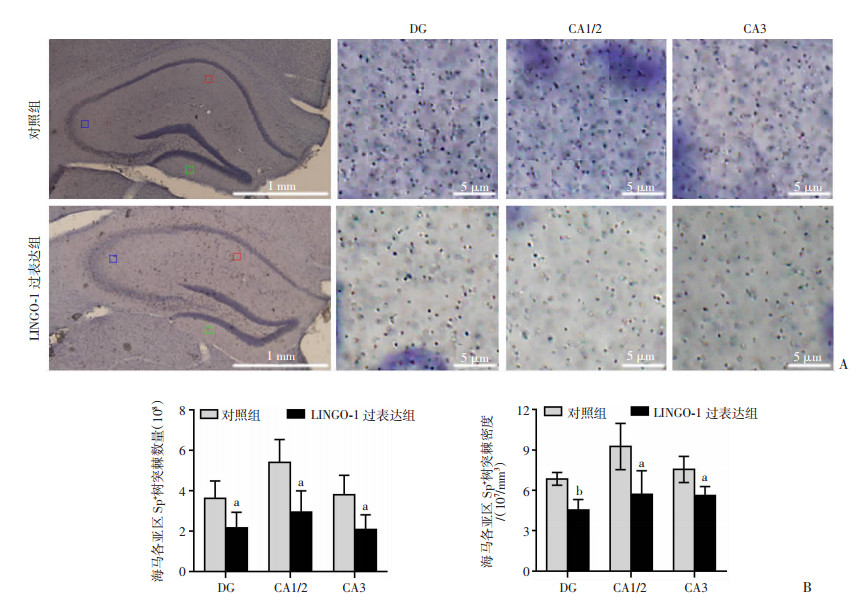
|
| A: 免疫组化观察2组小鼠海马各亚区Sp+树突棘;B: 2组小鼠海马各亚区Sp+树突棘数量及密度(n=4) a: P < 0.05, b: P < 0.01,与对照组比较 图 6 2组小鼠海马各亚区Sp+树突棘免疫组化染色及体视学定量分析 |
2.6 小鼠海马各亚区Sp+树突棘体视学定量与小鼠海马各亚区体积的相关性分析
对小鼠海马各亚区Sp+树突棘体视学定量与小鼠海马各亚区体积结果进行相关性分析。结果显示,小鼠海马各亚区Sp+树突棘数量与海马各亚区体积相关(表 1)。
| 海马各亚区Sp+树突棘数目 | 海马各亚区体积 | ||
| DG | CA1/2 | CA3 | |
| DG | r=0.807a;P=0.015 | ||
| CA1/2 | r=0.855b;P=0.007 | ||
| CA3 | r=0.900b;P=0.002 | ||
| a: P < 0.05, b: P < 0.01 | |||
3 讨论
认知功能下降是多种神经精神疾病出现显著功能障碍的前兆,早期对认知功能下降进行干预,甚至能够延缓或阻止疾病的进展[24]。因此,对认知功能障碍的结构基础及发病机制的研究极为重要。
近年来大量证据表明,LINGO-1可能作为认知功能障碍相关疾病的有效防治靶点。VANGUILDER等[14]发现空间学习记忆能力受损的老年大鼠海马内LINGO-1的表达水平显著性升高,且与记忆损伤成正比。WU等[17]发现5×FAD小鼠海马各亚区内LINGO-1存在异常高表达,而抑制其表达可以改善小鼠的空间记忆缺陷。对慢性应激后产生认知功能障碍的大鼠使用抗LINGO-1抗体治疗后其空间记忆损伤明显改善[25]。在多发性硬化症、实验性自身免疫性脑脊髓炎等疾病模型中也发现拮抗LINGO-1能够改善认知障碍[15-16]。本课题组前期研究也发现,APP/PS1小鼠在认知改变初期海马内LINGO-1高表达,且与记忆损伤呈正相关[19]。单细胞RNA测序发现,LINGO-1在AD患者神经元和胶质细胞中均出现明显的上调[26],并且死后AD患者大脑中也检测到LINGO-1表达水平的增高[27]。以上研究表明,出现认知功能障碍的模型或患者大脑海马中均出现了LINGO-1的显著高表达。由此我们推测,海马内异常高表达LINGO-1可能参与了海马依赖的空间学习与认知功能的损伤。为了验证这一推测,本研究对7月龄的正常小鼠海马立体定位注射过表达LINGO-1的腺相关病毒以特异性过表达其海马区的LINGO-1,随后对其进行LINGO-1表达量的检测及Morris水迷宫测试。对海马LINGO-1基因表达水平及荧光强度定量分析结果显示,小鼠海马LINGO-1的基因和蛋白水平均明显上调。以上结果表明,海马定位注射过表达LINGO-1的腺相关病毒成功特异性地上调了小鼠海马内LINGO-1的表达水平。在Morris水迷宫实验中,海马过表达LINGO-1组小鼠表现明显差于对照组小鼠。在定位航行实验中,过表达LINGO-1小鼠的逃避潜伏期显著长于对照组小鼠;在空间探索实验中,过表达LINGO-1小鼠的目标象限游泳路程百分比显著低于对照组小鼠且两组小鼠游泳速度无显著性差异。上述结果提示,特异性过表达海马LINGO-1可能在一定程度上损伤小鼠的空间学习与记忆能力。
海马在空间学习和记忆中具有重要作用[3],空间记忆的形成强烈依赖于海马的完整性,但海马非常容易受到内部和外部变化的影响[28]。CHEN等[29]研究表明与健康对照组相比,认知障碍患者的左海马体积、右海马体积和总海马体积均降低。还有研究发现海马体积的变化与整体认知、情景记忆功能之间存在很强的关联[30]。研究者通过简易精神状态检查测量发现,海马体积与认知能力之间存在正相关关系[31-32]。本研究通过Morris水迷宫测试和体视学方法分析海马体积后也发现,海马定位注射过表达LINGO-1的腺相关病毒能够显著减少小鼠海马各亚区体积并且损伤其空间学习与记忆能力。突触作为神经元间信息传递的关键部位,维持突触结构和功能的完整性对认知功能尤为重要。大量研究表明突触丢失与认知功能障碍之间存在密切关系,认知功能降低时存在树突复杂性降低、树突棘突触密度降低等改变[33]。在慢性噪声应激后模型动物出现认知功能减退,同时伴随着动物海马CA1和CA3区神经元树突棘数量减少[11]。AD模型小鼠出现认知功能降低时即出现了突触丢失[7],甚至早于淀粉样斑块沉积或Tau蛋白病理学[34]。研究发现LINGO-1可以调节啮齿动物疾病模型中突触蛋白的表达[35-36]。脑缺血后抑制LINGO-1的表达被发现能够增加突触的数量[35]。研究表明,LINGO-1可以激活细胞内信号级联,限制兴奋性突触的数量[37]。由此推测,LINGO-1可能通过作用于海马突触进而导致认知功能障碍。在以往的研究中,人们多采用半定量的方法对海马整体的树突棘突触进行研究,但海马各亚区功能不同,在不同疾病情况下的损伤程度也不同,需要对其分别进行研究。因此,本研究使用突触后膜蛋白Spinophilin对海马立体定位注射腺相关病毒的小鼠海马突触进行免疫组织化学染色标记,并采用无偏体视学方法对海马各亚区树突棘进行精确计数。结果表明,LINGO-1过表达组小鼠海马各亚区内Sp+树突棘数量及密度均显著低于对照组小鼠,对小鼠海马各亚区体积与树突棘数量进行相关性分析结果显示二者存在明显相关性。本研究结果提示,小鼠海马LINGO-1过表达可能是导致海马各亚区体积减小及突触丢失的原因之一。
综上所述,特异性过表达海马LINGO-1可使小鼠海马各亚区体积减小、Sp+树突棘突触数量及密度减少,并在一定程度上损伤小鼠空间学习与记忆能力。这些结果提示LINGO-1异常高表达可能是海马体积萎缩和树突棘突触丢失的关键,LINGO-1可能是认知功能障碍性疾病致病因子和治疗的一个重要靶点。
| [1] |
DECKER M. Cognition models and drug discovery[M]//Animal models of cognitive impairment. CRC Press, 2006: 343-353. DOI: 10.1201/9781420004335.ch16.
|
| [2] |
REN R J, QI J L, LIN S H, et al. The China Alzheimer report 2022[J]. Gen Psych, 2022, 35(1): e100751. |
| [3] |
LISMAN J, BUZSÁKI G, EICHENBAUM H, et al. Viewpoints: how the hippocampus contributes to memory, navigation and cognition[J]. Nat Neurosci, 2017, 20(11): 1434-1447. |
| [4] |
PENG G P, FENG Z, HE F P, et al. Correlation of hippocampal volume and cognitive performances in patients with either mild cognitive impairment or Alzheimer's disease[J]. CNS Neurosci Ther, 2015, 21(1): 15-22. |
| [5] |
FJELL A M, MCEVOY L, HOLLAND D, et al. What is normal in normal aging? Effects of aging, amyloid and Alzheimer's disease on the cerebral cortex and the hippocampus[J]. Prog Neurobiol, 2014, 117: 20-40. |
| [6] |
REDWINE J M, KOSOFSKY B, JACOBS R E, et al. Dentate gyrus volume is reduced before onset of plaque formation in PDAPP mice: a magnetic resonance microscopy and stereologic analysis[J]. Proc Natl Acad Sci USA, 2003, 100(3): 1381-1386. |
| [7] |
JOHN A, REDDY P H. Synaptic basis of Alzheimer's disease: focus on synaptic amyloid beta, P-tau and mitochondria[J]. Ageing Res Rev, 2021, 65: 101208. |
| [8] |
SELKOE D J. Alzheimer's disease is a synaptic failure[J]. Science, 2002, 298(5594): 789-791. |
| [9] |
ZHANG P S, KISHIMOTO Y, GRAMMATIKAKIS I, et al. Senolytic therapy alleviates Aβ-associated oligodendrocyte progenitor cell senescence and cognitive deficits in an Alzheimer's disease model[J]. Nat Neurosci, 2019, 22(5): 719-728. |
| [10] |
ZHANG Y, CHAO F L, ZHOU C N, et al. Atrophy of lacunosum moleculare layer is important for learning and memory in APP/PS1 transgenic mice[J]. Neuroreport, 2021, 32(7): 596-602. |
| [11] |
MANIKANDAN S, PADMA M K, SRIKUMAR R, et al. Effects of chronic noise stress on spatial memory of rats in relation to neuronal dendritic alteration and free radical-imbalance in hippocampus and medial prefrontal cortex[J]. Neurosci Lett, 2006, 399(1/2): 17-22. |
| [12] |
ANDREWS J L, FERNANDEZ-ENRIGHT F. A decade from discovery to therapy: lingo-1, the dark horse in neurological and psychiatric disorders[J]. Neurosci Biobehav Rev, 2015, 56: 97-114. |
| [13] |
MCINNES L A, NAKAMINE A, PILORGE M, et al. A large-scale survey of the novel 15q24 microdeletion syndrome in autism spectrum disorders identifies an atypical deletion that narrows the critical region[J]. Mol Autism, 2010, 1(1): 5. |
| [14] |
VANGUILDER H D, BIXLER G V, SONNTAG W E, et al. Hippocampal expression of myelin-associated inhibitors is induced with age-related cognitive decline and correlates with deficits of spatial learning and memory[J]. J Neurochem, 2012, 121(1): 77-98. |
| [15] |
SUN J J, ZHOU H, BAI F, et al. Myelin injury induces axonal transport impairment but not AD-like pathology in the hippocampus of cuprizone-fed mice[J]. Oncotarget, 2016, 7(21): 30003-30017. |
| [16] |
SUN J J, REN Q G, XU L, et al. LINGO-1 antibody ameliorates myelin impairment and spatial memory deficits in experimental autoimmune encephalomyelitis mice[J]. Sci Rep, 2015, 5: 14235. |
| [17] |
WU D, TANG X, GU L H, et al. LINGO-1 antibody ameliorates myelin impairment and spatial memory deficits in the early stage of 5 XFAD mice[J]. CNS Neurosci Ther, 2018, 24(5): 381-393. |
| [18] |
HE Q, JIANG L, ZHANG Y, et al. Anti-LINGO-1 antibody ameliorates cognitive impairment, promotes adult hippocampal neurogenesis, and increases the abundance of CB1R-rich CCK-GABAergic interneurons in AD mice[J]. Neurobiol Dis, 2021, 156: 105406. |
| [19] |
YANG H, JIANG L, ZHANG Y, et al. Anti-LINGO-1 antibody treatment alleviates cognitive deficits and promotes maturation of oligodendrocytes in the hippocampus of APP/PS1 mice[J]. J Comp Neurol, 2022, 530(10): 1606-1621. |
| [20] |
HAO J D, RAPP P R, LEFFLER A E, et al. Estrogen alters spine number and morphology in prefrontal cortex of aged female rhesus monkeys[J]. J Neurosci, 2006, 26(9): 2571-2578. |
| [21] |
TANG Y, JANSSEN W G, HAO J D, et al. Estrogen replacement increases spinophilin-immunoreactive spine number in the prefrontal cortex of female rhesus monkeys[J]. Cereb Cortex, 2004, 14(2): 215-223. |
| [22] |
ZHANG L, TANG W, CHAO F L, et al. Four-month treadmill exercise prevents the decline in spatial learning and memory abilities and the loss of spinophilin-immunoreactive puncta in the hippocampus of APP/PS1 transgenic mice[J]. Neurobiol Dis, 2020, 136: 104723. |
| [23] |
ZHU L, FAN J H, CHAO F L, et al. Running exercise protects spinophilin-immunoreactive puncta and neurons in the medial prefrontal cortex of APP/PS1 transgenic mice[J]. J Comp Neurol, 2022, 530(6): 858-870. |
| [24] |
MOROZOVA A, ZORKINA Y, ABRAMOVA O, et al. Neurobiological highlights of cognitive impairment in psychiatric disorders[J]. Int J Mol Sci, 2022, 23(3): 1217. |
| [25] |
XIE Y H, ZHOU C N, LIANG X, et al. Anti-Lingo-1 antibody ameliorates spatial memory and synapse loss induced by chronic stress[J]. J Comp Neurol, 2021, 529(7): 1571-1583. |
| [26] |
GRUBMAN A, CHEW G, OUYANG J F, et al. A single-cell atlas of entorhinal cortex from individuals with Alzheimer's disease reveals cell-type-specific gene expression regulation[J]. Nat Neurosci, 2019, 22(12): 2087-2097. |
| [27] |
LAAT R D, MEABON J S, WILEY J C, et al. LINGO-1 promotes lysosomal degradation of amyloid-β protein precursor[J]. Pathobiol Aging Age Relat Dis, 2015, 5: 25796. |
| [28] |
LEE C H, YOO K Y, CHOI J H, et al. Neuronal damage is much delayed and microgliosis is more severe in the aged hippocampus induced by transient cerebral ischemia compared to the adult hippocampus[J]. J Neurol Sci, 2010, 294(1/2): 1-6. |
| [29] |
CHEN X P, REN G Q, LI Y, et al. Level of LncRNA GAS5 and hippocampal volume are associated with the progression of Alzheimer's disease[J]. Clin Interv Aging, 2022, 17: 745-753. |
| [30] |
DAWE R J, BENNETT D A, SCHNEIDER J A, et al. Neuropathologic correlates of hippocampal atrophy in the elderly: a clinical, pathologic, postmortem MRI study[J]. PLoS One, 2011, 6(10): e26286. |
| [31] |
YANG C L, REN J C, LI W, et al. Individual-level morphological hippocampal networks in patients with Alzheimer's disease[J]. Brain Cogn, 2021, 151: 105748. |
| [32] |
YAMASHITA K, KUWASHIRO T, ISHIKAWA K, et al. Right entorhinal cortical thickness is associated with Mini-Mental State Examination scores from multi-country datasets using MRI[J]. Neuroradiology, 2022, 64(2): 279-288. |
| [33] |
CONRAD C D, ORTIZ J B, JUDD J M. Chronic stress and hippocampal dendritic complexity: methodological and functional considerations[J]. Physiol Behav, 2017, 178: 66-81. |
| [34] |
ROY D S, ARONS A, MITCHELL T I, et al. Memory retrieval by activating engram cells in mouse models of early Alzheimer's disease[J]. Nature, 2016, 531(7595): 508-512. |
| [35] |
XING H Y, MENG E Y, XIA Y P, et al. Effect of retinoic acid on expression of LINGO-1 and neural regeneration after cerebral ischemia[J]. J Huazhong Univ Sci Technol[Med Sci ], 2015, 35(1): 54-57. |
| [36] |
WU H F, CEN J S, ZHONG Q, et al. The promotion of functional recovery and nerve regeneration after spinal cord injury by lentiviral vectors encoding Lingo-1 shRNA delivered by Pluronic F-127[J]. Biomaterials, 2013, 34(6): 1686-1700. |
| [37] |
WILLS Z, MANDEL-BREHM C, MARDINLY A, et al. The nogo receptor family restricts synapse number in the developing hippocampus[J]. Neuron, 2012, 73(3): 466-481. |