2. 110001 沈阳,中国医科大学组织学与胚胎学教研室;
3. 121001 辽宁 锦州,锦州医科大学医疗学院形态学教研室
2. Department of Histology and Embryology, China Medical University, Shenyang, Liaoning Province, 110001;
3. Department of Morphology, Medical College of Jinzhou Medical University, Jinzhou, Liaoning Province, 121001, China
肾脏组织构建精细,配合以多种细胞膜转运蛋白质在肾小管各段上皮的分布以实现其重要的生理功能:重吸收肾小球滤过的血浆成分、尿液稀释与浓缩、维持体内水及酸碱离子平衡等。近年来,一些重要的小管上皮膜转运蛋白的发现推动了肾脏学研究的深入,其中,最引人注目的是大分子糖蛋白受体Megalin和Cubilin。Megalin和Cubilin是在肾近端小管主要负责重吸收蛋白和多肽的受体,因其转运作用又称膜转运体[1]。虽然在肾单位各个小管节段分布的研究时有报道,但是,上述膜转运体在肾发生发育中时空表达规律却少有报道。
Megalin和Cubilin共表达在肾脏近端小管的上皮细胞中,分子量分别为600和450 KDa[1]。迄今为止,二者是协助重吸收肾小球滤过的大部分蛋白质及多肽的主要受体。Megalin通过其自身分子的跨膜部分介导与其结合的配体的细胞内吞,从而实现其重吸收[2]。而Cubilin是一个膜周蛋白质,分子中缺乏跨膜区域和细胞内信号转导的序列。在重吸收与其结合的配体时,Cubilin先结合到Megalin上,再通过Megalin介导将Cubilin及其配体通过细胞内吞吸收[3]。Megalin和Cubilin表达缺陷的小鼠或狗以及Cubilin基因突变的患者均出现蛋白尿[4]。目前,两种膜受体常被作为肾近端小管的标志物。对发生发育中两种受体表达的研究有助于理解肾小管节段化及功能成熟的时空性。本实验采用改良的组织块染技术,通过免疫组化和免疫荧光技术观察发生发育小鼠肾脏中Megalin和Cubilin的表达情况,进行准确定位,探索其分布规律和特点。为在小鼠肾脏发生发育中二者的时空表达顺序建立一个较完整的数据,为以后的功能研究提供依据。
1 材料与方法 1.1 材料 1.1.1 实验动物C57BL/6健康小鼠120只,2月龄,雌雄各半,购自中国医科大学实验动物中心,使用许可:SYXK(辽)2008-0005;生产许可:SCXK(辽)2008-0005。雌、雄(1∶1)同窝饲养,每日3次观察受孕情况,以观察到阴道栓脱落的最早时间计为胚龄0 d(E0 d)。孕鼠分笼饲养2周后,每日2次观察生产情况,以观察到仔鼠出生的最早时间计为生后0 d(P0 d)。选取E10、12、14、16、18 d的胎鼠和P1、3、7、14、28、42 d的仔鼠,每个时间点各取3只。
1.1.2 主要仪器与试剂绵羊抗Megalin抗体、兔抗Cubilin抗体为丹麦奥尔胡斯大学肾脏学研究室ERIK教授馈赠,兔抗羊IgG、驴抗鼠IgG、驴抗兔IgG、驴抗羊IgG购自英国Abcam公司,羊抗兔IgG、兔抗绵羊IgG购自丹麦DAKO公司,DAB试剂盒购自中国武汉博士德生物技术有限公司,计算机图像采集系统(Olympus AX70显微镜和Olympus DP50相机)购自日本Olympus公司,倒置荧光显微镜90i、正置显微镜80iBF-F-P购自日本尼康公司,LKB-V超薄切片机购自德国徕卡公司,共聚焦激光扫描显微镜购自日本Olympus公司。
1.2 方法 1.2.1 不同发育阶段小鼠肾脏标本的制备分别取孕E10、12、14、16、18 d小鼠,戊巴比妥钠腹腔注射麻醉。取出胚胎,眼科镊将羊膜挑破,然后从胎鼠背部挑开皮肤,分离双侧肾脏,立即投入4%多聚甲醛溶液中固定。将生后P1、3、7、14、28、42 d(成熟)小鼠,麻醉后从腹部开口取双侧肾脏,去掉多余的结缔组织,然后投入到上述配制好的固定染色液中。根据肾脏标本大小固定染色12~24 h,然后清水冲洗后入30%、50%、70%、80%、90%、95%、100%梯度酒精中脱水,每一梯度中5~10 min(根据组织块大小决定时间长短)。然后分别入二甲苯Ⅰ和二甲苯Ⅱ溶液中透明,以肉眼观察到组织刚透明终止。入60 ℃液体石蜡中浸蜡30 min至1 h,具体可根据组织大小调整浸蜡时间。浸蜡结束后,将肾脏组织于包埋盒内进行包埋。上切片机做连续切片(4~5 μm)、经展片后贴于粘附有“明矾-硌明胶”涂层的载玻片上,烤片后,入二甲苯脱蜡,封片即成。以此同时,按许平庆[5]的块染组织方法进行树脂包埋。
1.2.2 块染组织连续切片的显微图像获取与配准应用“计算机-显微镜-数码相机”图像采集系统(Olympus AX70显微镜;Olympus DP50相机,日本),对块染包埋的肾脏进行连续切片,然后显微镜下拍照。图像大小为2 596×1 889像素,每个像素相当于1.83 μm×1.83 μm。图像配准过程在Windows平台上操作。其原理是:通过比较相邻两幅图像内生理对应点的像素灰度值的相似性来确定每个图像平移及旋转,使其达到生理空间的一致。首先得出相邻两幅图的相对变换值(平移距离和旋转角度),再通过求相对变换值的相加函数得出系列图像中的每幅图的绝对变换值,从而实现图像配准。
1.2.3 免疫组织化学染色从三维肾脏发育数据库中选择不同发育阶段的肾脏标本切片,65 ℃恒温箱内烤片至少2 h。切片冷却后入二甲苯Ⅰ和二甲苯Ⅱ溶液中脱蜡,15 min/次。然后,依次入100%、95%、90%、80%、70%、50%梯度酒精中。0.3% H2O2阻断内源性过氧化物酶10 min;经pH=9.0的TEG(Tris 1.21 g、EGTA 0.190 g和双蒸水1 000 mL)缓冲液高温高压修复,室温冷去;组化笔圈画组织,5%BSA封闭室温孵育10 min;甩掉封闭血清,直接加一抗:绵羊抗Megalin、兔抗Cubilin多克隆抗体(1∶500)于湿盒内4 ℃孵育过夜,次日PBS冲洗;分别用二抗兔抗绵羊和山羊抗兔IgG与一抗结合,室温孵育1 h;PBS冲洗;DAB显色;苏木精复染、脱水、透明、封片。以PBS代替一抗作阴性对照,光镜下观察。
1.2.4 免疫荧光化学染色取全胚切片中包含中肾及后肾的石蜡切片和全肾切片中包含有皮质和髓质的切片,脱蜡至水,3% 过氧化氢30 min消除内源性过氧化物酶活性。pH=9.0的(Tris 1.21 g、EGTA 0.190 g和双蒸水1 000 mL)缓冲液中行微波炉抗原热修复30 min自然凉至室温。入50 mmol/L NH4Cl 30 min,滴加5%正常牛清封闭15 min。加入多克隆羊抗鼠Megalin(1∶500)、兔抗Cubilin(1∶500)抗体4 ℃过夜。次日分别滴加FITC标记驴抗绵羊和TR标记驴抗兔血清(1∶500)、于暗室内室温孵育1 h。冲洗后甘油封片,荧光显微镜观察。以上各步骤均用1%牛血清、0.2%明胶、0.05%皂角苷与PBS混合缓冲液冲洗,同时另用PBS代替一抗作为阴性对照。抗体稀释均用0.1%牛血清、0.3%Triton X-100与pH=7.4 PBS的缓冲液。
1.2.5 灰度值测定Megalin和Cubiln表达的总蛋白含量图像用CIAS-1000型细胞图像分析系统处理。每个动物的肾脏随机取6张切片,每张切片随机取5个阳性表达区。在560~660 nm范围内测灰度值,以切片背景色作为参照,灰度值越高,表明该物质含量高,灰度值愈低,则表明该物质含量越低。
1.3 统计学分析实验计量数据以x±s表示。各组间比较采用单因素方差分析,SPSS 17.0统计分析软件用于数据处理,且P<0.05被认为差异具有统计学意义。
2 结果 2.1 Megalin在发生发育肾脏中的表达E10 d为小鼠中肾发育阶段,后肾还未形成,可见生肾索横切面的中肾管和“S”型的中肾小管,Megalin表达于中肾管及中肾小管上皮细胞游离面(图 1A、B)。E12 d, 小鼠可见生后肾组织出现,生肾区横切面可见少数输尿管芽,有的有分支,细胞成方形或矮柱状,紧密排列。输尿管芽周围出现细胞密集聚集区域,称之为帽状结构;Megalin开始表达在输尿管芽的上皮细胞。“逗号”小体或“S”型小体的细胞游离面仅有微弱表达(图 1C、D)。E14 d,肾脏已经形成完整的被膜,输尿管芽管腔有增大,在输尿管芽周围出现肾囊泡,“逗号”小体、“S”型小体期开始有明显的表达。也可见Ⅲ期肾小体,在Ⅲ期肾小体周围可见一些未成熟肾小管开始明显表达Megalin(图 1E、F)。E16 d,肾脏光镜下可见皮、髓质,髓放线,第一代成熟髓旁肾单位出现(图 1G、H)。至E18 d,肾脏皮质增厚明显,成熟肾单位逐渐增多,髓放线结构清楚,Megalin表达逐渐增强,主要表达在从皮质到髓质区域不同发育时期的肾近端小管上皮细胞游离面上。此外也有部分表达于输尿管芽上皮细胞游离面,还表达在皮质浅层未成熟肾小管的上皮游离缘和近腔面,及近髓肾单位成熟近端小管的刷状缘,S小体期肾单位呈弱阳性表达(图 1I、J)。P1~3 d,肾脏皮质明显增厚。随着大量成熟肾单位的出现,Megalin主要集中在近端小管的刷状缘,且表达量逐渐增强,在髓放线和皮髓交界区域表达也丰富(图 1K、L)。P7 d,被膜下的皮质生肾区消失,内髓出现(图 1M)。P14 d,髓质已明显区分为髓质外带、内带(图 1N)。P28 d,结构与成熟肾脏相近,其表达模式已经接近成熟小鼠肾脏水平,大量表达于皮质近端小管和皮髓交界区(图 1O、P)。
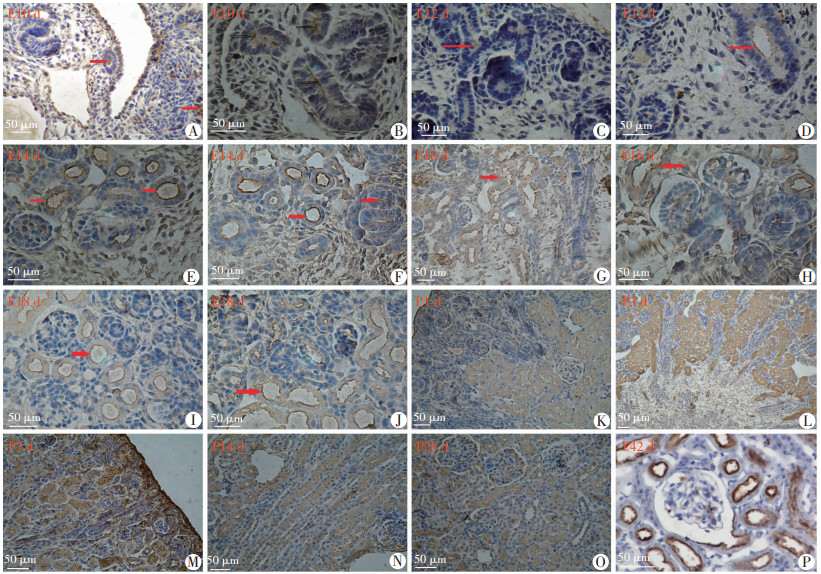
|
|
箭头示Megalin表达 A、B:E10 d时,可见中肾小管管腔内细胞游离面有Megalin表达;C、D:E12 d时,可见输尿管芽上皮细胞顶端有Megalin表达;E、F:E14 d时,Megalin表达于分化接近成熟或已经成熟的肾近端小管以及未“逗号”小体处;G、H:E16 d时,Megalin在成熟的肾近端小管大量表达;I、J:E18 d时,Megalin在近端小管刷状缘大量表达;K、L:分别为P1、3 d时,Megalin在髓放线和皮髓交界处大量表达;M、N:分别为P7、14 d时Megalin表达情况,此时被膜下的生肾区消失,内髓出现;O、P分别为P28、42 d时,肾脏发育成熟,Megalin广泛表达于近端小管游离缘 图 1 免疫组化观察Megalin在小鼠发生发育肾脏中的表达(S-P) |
2.2 Cubilin在发生发育肾脏中的表达
Cubilin表达模式和Megalin模式基本一致。E10 d时开始在中肾管以及中肾小管上皮细胞腔面出现表达(图 2A、B)。E12 d时开始出现在输尿管芽的上皮细胞游离面(图 2C、D)。E14 d,随着肾发育进展,后肾生肾区“逗号”小体、“S”型小体上皮细胞游离面开始有微弱的表达(图 2E、F)。E16 d,由于已经诱导出较成熟的肾单位,Cubilin开始大量表达于接近成熟的肾近端小管以及成熟的肾近端小管(图 2G、H)。E18 d,Cubilin在皮质和皮髓交界处表达丰富(图 2I、J)。P1~3 d,小鼠肾脏皮质和髓质进一步增厚,Cubilin大量表达于近端小管上皮细胞游离缘(图 2K、L)。P7~14 d,生肾区不再有新的肾单位出现,Cubilin稳定的表达在近端小管区域(图 2M、N)。P28 d,Cubilin表达已经接近成熟小鼠水平(图 2O、P)。

|
|
箭头示Cubilin表达 A、B:E10 d时,Cubilin表达于中肾管上皮细胞的腔面;C、D:E12 d时,Cubilin表达于输尿管芽细胞游离面;E、F:E14 d时,可见Cubilin在发生发育肾脏的“逗号”或“S”型小体细胞游离面开始有弱表达;G、H:E16 d时,可见皮髓分界,Cubilin开始表达于接近成熟的肾近端小管;I、J:E18 d时,可见Cubilin开始在皮髓交界处表达丰富;K、L分别为P1、3 d时,可见Cubilin大量表达于近端小管上皮细胞游离缘;M、N:P7、14 d,可见Cubilin开始稳定且大量的表达在近端小管区域;O、P:分别为P28、42 d时,可见Cubilin表达已经达到成熟小鼠水平 图 2 免疫组化观察Cubilin在发生发育肾脏中的表达(S-P) |
2.3 Megalin和Cubilin的免疫荧光表达情况
Megalin免疫荧光染色(FITC标记,绿色)和Cubilin免疫荧光染色(TR标记,红色),其阳性反应物结果与免疫组织化学染色的结果一致。E10 d,Megalin(绿色荧光表达区)和Cubilin(红色荧光表达区)表达于中肾管及中肾小管上皮细胞游离面。E12、14、16、18 d主要表达于未成熟肾小管的上皮游离缘和成熟的近端小管刷状缘,在“逗号”小体、“S”型小体上有弱表达。生后P1、3、7、42 d主要表达于成熟近端小管刷状缘内,其表达模式和免疫组化染色一致(图 3)。
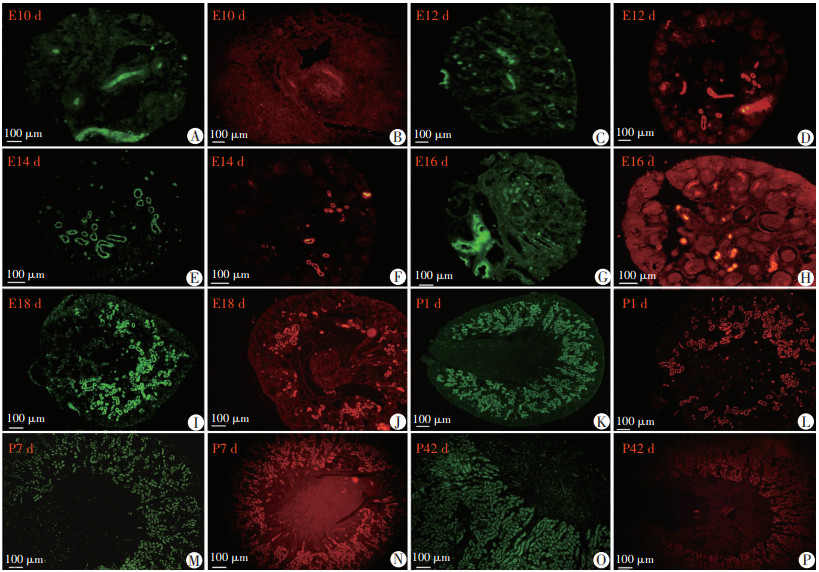
|
|
绿色荧光示FITC标记的Megalin表达情况;红色荧光示TR标记的Cubilin表达情况 A、B:分别为E10 d时Megalin和Cubilin表达情况;C、D:分别为E12 d时Megalin和Cubilin表达情况;E、F:分别为E14 d时Megalin和Cubilin表达情况;G、H:分别为E16 d时Megalin和Cubilin表达情况;I、J:分别为E18 d时Megalin和Cubilin表达情况;K、L:分别为P1 d时Megalin和Cubilin表达情况;M、N:分别为P7 d时Megalin和Cubilin表达情况;O、P:分别为P42 d时Megalin和Cubilin表达情况 图 3 免疫荧光观察小鼠肾脏不同发育时期Megalin和Cubilin的表达情况 |
2.4 细胞图像分析系统测量Megalin和Cubilin的灰度值
将背景染色调节到211.567±10.212,小鼠肾脏不同发育时期Megalin和Cubilin总体表达的灰度值见表 1。灰度值评分最高(染色最浅)的是E10 Megalin和Cubilin, 与背景色相比,差异具有统计学意义(P<0.01),表明此期Megalin和Cubilin已有一定的表达。从E12~P7 d,Megalin和Cubilin的表达有显著变化,P14~P28 d, Megalin和Cubilin表达没有显著变化(表 1)。
| 时间/d | Megalin | Cubilin |
| E10 | 197.667±5.807 | 199.230±4.365 |
| E12 | 209.626±5.941 | 212.088±5.554 |
| E14 | 264.435±6.264a | 266.523±6.251a |
| E16 | 346.456±8.806a | 349.794±8.291a |
| E18 | 422.798±10.481a | 429.412±10.527a |
| P1 | 510.593±12.375a | 509.513±12.211a |
| P3 | 594.089±15.154a | 596.513±16.251a |
| P7 | 686.513±16.581a | 684.251±17.611a |
| P14 | 696.794±16.229 | 701.603±17.211 |
| P28 | 707.214±17.049 | 706.343±17.223 |
| P42 | 702.342±17.849 | 699.211±17.523 |
| a: P<0.01, 与前一发育时间点比较 | ||
3 讨论
本研究应用免疫组织化学及免疫荧光技术,对膜蛋白转运体在肾脏发育中的分布进行了研究。结果显示,在肾脏的发育过程中,Megalin和Cubilin在E10 d开始出现,主要表达于中肾管上皮细胞的近腔面。E12 d, 随着输尿管芽形成二者出现在输尿管芽上皮细胞以及“逗号”小体和“S”型小体细胞近管腔面。以后随着肾单位的形成,两种膜蛋白受体开始在某些未发育成熟的肾小管和发育成熟的肾近端小管上大量表达。E16~18 d,随着肾小管发育的逐渐完善和成熟,二者表达逐渐增加。P1 d, 皮质与髓质分化较好,可见二者大量表达在皮质部分。P7 d,被膜下皮质生肾区消失,内髓出现,此时不再有新的肾单位出现,肾脏进入生长和成熟时期。P7 d以后,Megalin和Cubilin表达的量和模式基本未见明显变化。P14 d,髓质已明显区分出髓质外带、内带。P21、42 d,与成鼠形态结构相同,基本接近成熟。因此,二者随着肾发育的成熟,其在肾小管上的表达基本稳定。Megalin和Cubilin的表达模式说明,在结构分化成熟以前已经有膜蛋白转运体的存在,即细胞已具备转运蛋白或多肽的功能,只是此时功能还不是很成熟。
免疫组织化学和免疫荧光实验结果显示,Megalin和Cubilin在肾脏胚胎发育和生后成熟过程中的表达存在着时空顺序。E10 d为小鼠中肾发育阶段,免疫组织化学染色和免疫荧光染色均显示其表达于中肾管和中肾小管的上皮细胞游离面。后肾发育早期,Megalin和Cubilin主要表达于输尿管芽上皮细胞游离面,“S”型小体期呈弱阳性表达,随着肾小体的发育成熟,Megalin和Cubilin表达于未成熟近端小管的近腔面和成熟近端小管的刷状缘[6]。出生后,Megalin和Cubilin主要表达于近端小管的刷状缘[7]。关于胚胎期肾小体形成过程中Megalin和Cubilin的表达,ZOU等[8]发现其最早出现于小鼠Ⅲ期肾小体的有被小凹膜、致密小管和胞吞小泡,在Ⅳ期肾小体主要表达于近端小管微绒毛的有被小凹。ZHAI等[9]研究结果证实,Megalin和Cubilin在小鼠Ⅱ期肾小体就能检测到,分布于所有将形成肾小体、近端小管和远端小管的细胞,在这些细胞中,Megalin和Cubilin存在于细胞表面、细胞基侧膜、粗面内质网池和核周区。而DRAKE等[10]实验发现Megalin和Cubilin在小鼠Ⅲ期肾小体表达于未成熟近端小管的近腔面胞质,Ⅳ期肾小体Megalin和Cubilin只表达于近端小管部分微绒毛的有被小凹。显然,本实验结果支持DRAKE实验结果。Megalin和Cubilin在生后肾组织的表达,免疫组织化学染色和免疫荧光染色结果均显示其主要位于近端小管的刷状缘,在肾小球内也有散在表达。CHRISTENSEN等[11]报道在成年大鼠Megalin和Cubilin节段性地表达于近端小管的微绒毛,近端小管节段2上的微绒毛上表达强烈,非常有限地分布在近端小管的节段3上。而在细胞顶部富含致密小管和细胞小泡的近端小管节段1微绒毛上却没有表达,肾小球足细胞有表达。而本实验结果显示近端小管刷状缘的表达没有明显的节段性,近端小管起始段有表达。这与小鼠与大鼠的近端小管不同的形态结构有关。此依据来自于小鼠近端小管的三维重建,发现其与大鼠近端小管相比形态结构上没有明显分段[12]。
有研究报道Megalin和Cubilin广泛分布于体内多种极化上皮细胞内(如小肠上皮细胞的纹状缘),而且是以共表达的方式存在[13],二者通过协同作用方式以通过胞吞作用介导腔内一些配体的吸收从而完成对蛋白及某些脂类物质的转运。尤其在哺乳动物的成年肾脏Megalin和Cubilin主要分布于近端小管的刷状缘。介导体内蛋白质、微量元素及一些营养物质的重吸收以及保持机体内环境的稳定发挥重要生理功能[14]。实验结果显示Megalin和Cubilin在小鼠肾发生发育过程中出现于中肾,而中肾具有一过性尿的滤过功能,因此我们认为Megalin和Cubilin在中肾发育阶段已经发挥其胞吞功能,与滤过中肾管营养物质的重吸收有关。后肾的形成基础是输管芽和生后肾相互诱导,并受多种因子、分子和细胞外基质的调控[15]。同时本实验发现Megalin和Cubilin在输尿管芽的上皮细胞游离面也有表达。Megalin和Cubilin在输尿管芽上皮细胞游离面的表达是否也存在胞吞或其他功能尚有待于进一步研究[16]。E16~18 d,随着成熟髓旁肾单位出现,皮、髓分界清楚,相应地从皮质到髓质出现不同发育时期的肾小管。免疫组织化学染色显示Megalin和Cubilin表达于这些小管游离面。发育期的近端小管细胞膜游离面出现微绒毛,游离面胞质部分出现了少量与细胞内吞相关的结构,免疫组织化学染色显示其表达于发育期近端小管游离面和近腔面的胞质。成熟期的近端小管微绒毛发达,微绒毛基部出现丰富的内吞小凹和致密小管,Megalin和Cubilin表达于成熟期近端小管的刷状缘。提示分化早期和未成熟期肾小管处于受体蛋白的形成阶段。近端小管成熟之后,Megalin和Cubilin可能发挥其胞吞功能,重吸收管内营养物质。提示Megalin和Cubilin的表达与肾小管的发育成熟是同步,与肾小管的重吸收功能相辅相成的,即Megalin和Cubilin是肾小管的重吸收功能的必需装置。
综上所述,Megalin和Cubilin在肾发生发育成熟过程中的表达具有时空性,其表达与肾小管重吸收相关的细胞内吞体及微绒毛发育成熟相一致。基因敲除Megalin和Cubilin的小鼠出现脑发育不全、呼吸功能失调、维生素D缺乏相关的骨畸形、肾近端小管上皮细胞小、内吞小泡等胞吞结构缺乏等畸形[17]。Megalin和Cubilin表达和功能异常出现蛋白尿和高血压等症状[17]。Megalin和Cubilin在胚胎期神经系统和肾脏发育成熟起着重要的作用。然而其作用机制还有待于进一步探讨,希望能在分子生物学水平或干细胞移植上得到突破。因此,进一步研究肾发生发育过程Megalin和Cubilin表达的作用机制,将更有利于阐明其在机体的潜在功能,为临床肾病的研究提供理论依据。
| [1] |
AGRE P. Molecular physiology of water transport: aquaporin nomenclature workshop. Mammalian aquaporins[J]. Biol Cell, 1997, 89(5/6): 255-257. |
| [2] |
SHIPMAN K E, LONG K R, COWAN I A, et al. An adaptable physiological model of endocytic megalin trafficking in opossum kidney cells and mouse kidney proximal tubule[J]. Function (Oxf), 2022, 3(6): zqac046. |
| [3] |
DE S, KUWAHARA S, SAITO A. The endocytic receptor megalin and its associated proteins in proximal tubule epithelial cells[J]. Membranes (Basel), 2014, 4(3): 333-355. |
| [4] |
SUN Y, LU X F, DANSER A. Megalin: a novel determinant of renin-angiotensin system activity in the kidney?[J]. Curr Hypertens Rep, 2020, 22(4): 30. |
| [5] |
许平庆. 916塑料包埋剂在病理技术中应用的体会[J]. 第三军医大学学报, 1993, 15(5): 452. XU P Q. 916 experience with the use of plastic embedding agents in pathologic techniques[J]. Acta Acad Med Mil Tertiae, 1993, 15(5): 452. |
| [6] |
CHRISTENSEN E I, BIRN H. Megalin and cubilin: synergistic endocytic receptors in renal proximal tubule[J]. Am J Physiol Ren Physiol, 2001, 280(4): F562-F573. |
| [7] |
MIAO X M, ZHAI X Y, GUO M, et al. Expression of endocytic receptor megalin/cubilin in embryonic mouse kidneys[J]. Acta Anatomica Sinica, 2009, 40(4): 671-674. |
| [8] |
ZOU Z Y, CHUNG B, NGUYEN T, et al. Linking receptor-mediated endocytosis and cell signaling[J]. J Biol Chem, 2004, 279(33): 34302-34310. |
| [9] |
ZHAI X Y, NIELSEN R, BIRN H, et al. Cubilin- and megalin-mediated uptake of albumin in cultured proximal tubule cells of opossum kidney[J]. Kidney Int, 2000, 58(4): 1523-1533. |
| [10] |
DRAKE C J, FLEMING P A, LARUE A C, et al. Differential distribution of cubilin and megalin expression in the mouse embryo[J]. Anat Rec, 2004, 277A(1): 163-170. |
| [11] |
CHRISTENSEN E I, KRISTOFFERSEN I B, GRANN B, et al. A well-developed endolysosomal system reflects protein reabsorption in segment 1 and 2 of rat proximal tubules[J]. Kidney Int, 2021, 99(4): 841-853. |
| [12] |
SUN Y, MARTINI A G, JANSSEN M J, et al. Megalin: A novel endocytic receptor for prorenin and renin[J]. Hypertension, 2020, 75(5). |
| [13] |
YAMMANI R R, SEETHARAM S, SEETHARAM B. Cubilin and megalin expression and their interaction in the rat intestine: effect of thyroidectomy[J]. Am J Physiol Endocrinol Metab, 2001, 281(5): E900-E907. |
| [14] |
SMITH C P, LEE W K, HALEY M, et al. Proximal tubule transferrin uptake is modulated by cellular iron and mediated by apical membrane megalin-cubilin complex and transferrin receptor 1[J]. J Biol Chem, 2019, 294(17): 7025-7036. |
| [15] |
CARRARO-LACROIX L R, MALNIC G. Acid-base transport by the renal distal nephron[J]. J Nephrol, 2010, 23(Suppl 16): S19-S27. |
| [16] |
MOESTRUP S K, VERROUST P J. Megalin- and cubilin-mediated endocytosis of protein-bound vitamins, lipids, and hormones in polarized epithelia[J]. Annu Rev Nutr, 2001, 21(1): 407-428. |
| [17] |
NIELSEN R, CHRISTENSEN E I, BIRN H. Megalin and cubilin in proximal tubule protein reabsorption: from experimental models to humandisease[J]. Kidney Int, 2016, 89(1): 58-67. |




