2. 401220 重庆,重庆市长寿区人民医院神经外科;
3. 408499 重庆,重庆市南川区人民医院神经外科;
4. 400014 重庆,重庆市急救中心神经外科
2. Department of Neurosurgery, Changshou People's Hospital, Chongqing, 401220, China;
3. Department of Neurosurgery, Nanchuan People's Hospital, Chongqing, 408499, China;
4. Department of Neurosurgery, Chongqing Emergency Medical Center, Chongqing, 400014, China
蛛网膜下腔出血(subarachnoid hemorrhage,SAH)约占脑卒中的5%,85%的病因仍然是颅内动脉瘤破裂所致[1-2]。脑积水是SAH常见的并发症之一,一旦发生脑积水将延长患者住院时间以及重症监护天数,同时增加脑脊液分流依赖风险[3]。此外,即使动脉瘤性蛛网膜下腔出血(aneurysmal subarachnoid hemorrhage,aSAH)已经通过外科干预被完全治愈,脑积水导致认知能力下降和神经功能恶化,依然是aSAH患者再入院接受治疗的最常见的原因[4-5]。SAH中的脑积水可分为急性、亚急性和慢性。aSAH后急性脑积水(acute hydrocephalus,AHC) 在SAH出血后3 d内发生,亚急性发生在出血后4~13 d,慢性则在出血后≥14 d发生[6]。AHC往往病情严重且进展迅速,部分需要临时的引流,腰池脑脊液引流可持续地清除蛛网膜下腔内的血液及其分解物,改善脑组织微环境。该方法不通过脑室穿刺,避免了医源性的脑组织损伤,是常见的非梗阻性AHC的引流方法[7]。但目前腰池引流量对于患者预后情况的影响尚未得到很好研究,尤其是远期效果尚需更多临床研究证实[8]。笔者在临床工作中发现增加腰池引流量能改善aSAH后AHC患者的预后,本研究试图明确aSAH后AHC预后不良的预测因素,同时评估腰池引流量对aSAH后AHC患者预后的影响,以指导临床通过对腰池引流量的主动调整来改善预后。
1 资料与方法 1.1 一般资料纳入2017年1月至2022年1月就诊于重庆医科大学附属第一医院神经外科因动脉瘤性蛛网膜下腔出血发生AHC的患者进行回顾性分析。本研究通过重庆医科大学附属第一医院伦理委员会的审查[2022年科研伦理(2022-K514)]。
1.2 纳入、排除标准纳入标准:①计算机断层扫描(CT)或腰椎穿刺证实蛛网膜下腔出血;计算机断层扫描血管造影(computed tomography artery,CTA)或数字减影血管造影(digital subtraction angiography,DSA)证实颅内动脉瘤,且颅内动脉瘤行介入或夹闭手术;②术前或术后CT或磁共振成像(MRI)证实AHC存在;③患者住院期间未死亡,且出院后随访时间超过半年。
排除标准:①合并颅内肿瘤等病变及其他重要器官严重病变者;②梗阻性脑积水需行脑室外引流;③缺少腰池引流量数据;④患者或家属放弃手术处理颅内动脉瘤;⑤aSAH后AHC保守治疗未行腰池引流者。
1.3 治疗及随访患者入院时进入神经重症监护病房(neurological intensive care unit,NICU)进行密切监测生命体征和神经症状,卧床休息保持呼吸通畅,对于烦躁患者可给予地西泮。使用拉贝洛尔、尼卡地平等短效降压药控制血压在140/90 mmHg以内,所有患者使用尼莫地平抗血管痉挛,动脉瘤手术治疗方案根据患者动脉瘤形态特征及部位情况而定,主要包括血管内介入微创动脉栓塞术和动脉瘤夹闭术。患者在术前于气管插管全身麻醉后取侧卧位,头靠胸部,双下肢屈曲,消毒,取L3-4或L4-5椎间隙为穿刺点,穿刺针进入蛛网膜下腔后有CSF流出后,向头侧置入腰大池引流管8~15 cm,外接引流袋,固定。夹闭引流管,若术中因脑肿胀暴露困难者可缓慢释放脑脊液,不超过100 mL。术后调节引流袋高度及夹闭来控制每日腰池引流量,保持腰池引流总量在0~200 mL/d。通过门诊及电话对出院6个月的患者进行随访并进行mRS评分。
1.4 数据收集收集患者的人口学特征(年龄、BMI、性别、高血压和糖尿病病史、吸烟)、蛛网膜下腔出血特征(入院时Hunt-Hess分级、改良Fisher分级、WFNS分级、动脉瘤位置)、手术方式、感染、脑血管痉挛、腰池引流时间、引流量、高度、是否引流依赖、抗纤溶治疗。临床随访时的功能结果用mRS评分进行评估,分为预后好(mRS 0~2)和预后差(mRS 3~6)。对出现意识障碍、步态不稳、颅内高压、尿失禁等症状;发病后3个月内经头颅CT检查提示脑室系统进行性扩大,且侧脑室前角间最大径和同一层面的颅腔最大径之比>0.3;需开展永久分流术干预;中脑导水管无严重狭窄的患者定义为分流依赖[9]。mRS评分由2名神经外科医师评估商量一致后进行打分,并且高年资医师监督指导。腰池引流的数据,包括腰池引流时间、腰池引流量、腰池引流压力,从患者护理记录单中提取。血管痉挛的放射学表现主要采用CTA评估。与入院时的CTA相比,评估的血管包括双侧大脑前动脉、大脑中动脉、前交通动脉、后交通动脉和基底动脉。根据血管内径减少的程度分为轻度(< 30%)、中度(30%~60%)或重度(>60%)。
1.5 统计学分析采用SAS 9.4和R 4.2.2进行数据处理。计数资料以构成比(%)或率(%)表示,采用χ2检验或者Fisher精确检验。对于满足正态性检验的计量资料以x±s描述,采用独立t检验;否则以中位数M(P25,P75)描述,采用非参数Wilcoxon检验。aSAH术后发生AHC后短期临床预后不良相关影响因素的筛查采用单因素和多因素Logistic逐步回归分析(α入=0.05,α出=0.10);筛选出的危险因素引入R软件,构建结局预测模型并做出Nomogram图;十折交叉验证计算准确度、灵敏度、特异度、阳性预测值、阴性预测值、ROC曲线下面积(AUC)来评估模型稳定性和预测效能。采用Bootstrap内部验证法(自主重复抽样1 000次)计算平均一致性指数(C指数),评价模型的区分度(1为完全一致、>0.90为区分度较高、0.71~0.90为区分度中等、0.50~0.70为区分度较低、< 0.50为完全随机);绘制校准曲线,评价模型的校准度(模型预测概率与实际概率之间具有良好的一致性提示校准度良好)。以P < 0.05为差异具有统计学意义。
2 结果本研究期间,共有1 108例患者进行了手术治疗,其中有136例患者发生AHC,按照纳入排除标准,排除行脑室外引流患者32例、放弃治疗患者8例、合并其他重要器官严重病变6例、失访患者11例,最终纳入82例患者进行后续研究。根据mRS评分,预后好的有46例(56.1%),预后差的有36例(43.9%),两组人口学特征以及腰池引流指标比较见表 1。预后好组患者年龄(55.43±8.50)岁,预后差组年龄(58.69±9.87)岁,差异无统计学意义。预后好组男性有15例,女性31例,而预后差组患者男女均有18例,差异无统计学意义。此外,BMI、腰池引流压力、既往是否合并高血压与糖尿病病史、是否吸烟饮酒、动脉瘤位置、手术方式、是否发生颅内感染在两组间差异均无统计学意义。而预后好组WFNS分级低、Hunt-Hess分级和mFisher分级也低、腰池引流时间少、引流量大、不存在引流依赖、脑血管痉挛和脑梗死发生的病例数少,两组间差异具有统计学意义(P < 0.05)。
| 变量 | 预后好(mRS 0~2) | 预后差(mRS 3~6) | P |
| 年龄/岁 | 55.43±8.50 | 58.69±9.87 | 0.113a |
| 性别 | |||
| 男 | 15(32.61) | 18(50.00) | 0.111c |
| 女 | 31(67.39) | 18(50.00) | |
| BMI/(kg/m2) | 24.82±3.34 | 25.67±3.24 | 0.250a |
| WFNS分级 | 2(2, 3) | 3(2.5, 4) | < 0.001b |
| Hunt-Hess分级 | 2(2, 2) | 3(2, 3) | < 0.001b |
| mFisher分级 | 3(1, 3) | 3(2, 4) | 0.007b |
| 腰池引流时间/d | 8(6, 11) | 11.5(8, 17.5) | 0.009b |
| 腰池引流压力/cmHg | 15(10, 15) | 15(10, 15) | 0.808b |
| 腰池引流量/10 mL | 9.9(6.7, 13.9) | 6.8(5.3, 9.2) | 0.013b |
| 抗纤溶时间/d | 5(3, 8) | 5.5(3, 12) | 0.528b |
| 分流依赖 | 12(26.09) | 19(52.78) | 0.013c |
| 高血压 | 24(52.17) | 21(58.33) | 0.578c |
| 吸烟 | 12(26.09) | 15(41.67) | 0.136c |
| 饮酒 | 10(21.74) | 12(33.33) | 0.239c |
| 糖尿病 | 5(10.87) | 4(11.11) | 1.000d |
| 动脉瘤位置 | 0.494d | ||
| 后循环 | 4(8.70) | 5(13.89) | |
| 前循环 | 42(91.30) | 31(86.11) | |
| 手术方式 | 0.632c | ||
| 介入 | 19(41.30) | 13(36.11) | |
| 开颅 | 27(58.70) | 23(63.89) | |
| 合并颅内感染 | 17(36.96) | 11(30.56) | 0.544c |
| 脑血管痉挛 | 4(8.70) | 20(55.56) | < 0.001c |
| a:t检验;b:非参数Wilcoxon检验;c:Pearson卡方检验;d:Fisher精确检验 | |||
将单因素分析中P < 0.10的变量,包括WFNS、Hunt-Hess、mFisher、腰池引流时间、分流依赖、脑血管痉挛、腰池引流量7个变量纳入多因素分析,采用Logistic逐步回归筛选出影响mRS的变量,得到5个因素可独立影响患者预后(P < 0.05),根据OR值发现WFNS高分级(OR:3.25,95%CI:1.11~9.48,P= 0.031)、mFisher高分级(OR:3.66,95%CI:1.08~12.35,P=0.037)、发生分流依赖(OR:15.56,95% CI:1.22~198.57,P=0.030)与脑血管痉挛(OR:22.24,95%CI:3.08~160.68,P=0.002)是影响mRS的独立危险因素, 只有腰池引流量(OR: 0.57, 95%CI: 0.40~ 0.82, P=0.002)是影响mRS的保护性因素(表 2)。
| 变量 | 估计 | 标准差 | χ2 | P | OR | 95%CI |
| WFNS | 1.18 | 0.55 | 4.63 | 0.031 | 3.25 | 1.11~9.48 |
| mFisher | 1.30 | 0.62 | 4.36 | 0.037 | 3.66 | 1.08~12.35 |
| 分流依赖 | 2.74 | 1.30 | 4.46 | 0.030 | 15.56 | 1.22~198.57 |
| 脑血管痉挛 | 3.10 | 1.01 | 9.45 | 0.002 | 22.24 | 3.08~160.68 |
| 腰池引流量 | -0.56 | 0.18 | 9.50 | 0.002 | 0.57 | 0.40~0.82 |
根据Logistic回归分析结果,以WFNS、mFisher、分流依赖、脑血管痉挛、腰池引流量作为预测因素,以术后6个月mRS评分作为临床结局,构建Nomogram模型(图 1)。举例:女性患者,65岁,临床诊断为颅内动脉瘤破裂蛛网膜下腔出血,入院时WFNS评分3分,mFisher评分2分,急诊入院行动脉瘤夹闭术。术后发生AHC,发生脑血管痉挛,未并发分流依赖性脑积水,腰池引流量47 mL。根据Nomogram模型,5项预测因素对应的总分值为23+13+0+31+89=156分,预测其术后临床预后不良的概率为90%。
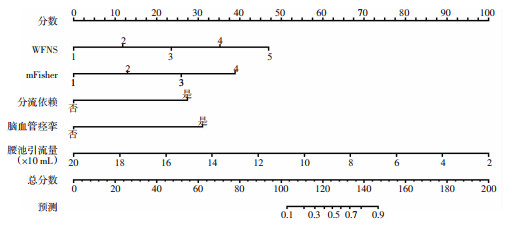
|
| 图 1 mRS预测Nomogram模型 |
通过十折交叉验证得到训练集和测试集的准确度、灵敏度、特异度、阳性预测值和阴性预测值,AUC曲线下面积均大于0.80,提示模型具有较好的预测能力和稳定性(表 3);通过Bootstrap方法验证,显示该列线图模型具有良好的判别能力[C-index: 0.950,95%CI:0.904~0.996),校正后的C-index为0.934];校准曲线显示,以纳入预测模型的WFNS、mFisher、分流依赖、脑血管痉挛、腰池引流量为预测因素,对aSAH术后发生AHC临床预后不良的预测概率与实际概率之间具有良好的一致性(图 2),表明模型校准度良好。
| 数据集 | ACC/% | SEN/% | SPE/% | PPV/% | NPV/% | AUC |
| 全集 | 90.2 | 86.1 | 93.5 | 91.2 | 89.6 | 0.90 |
| 训练集 | 90.5 | 86.4 | 92.9 | 90.6 | 89.7 | 0.90 |
| 测试集 | 87.5 | 87.5 | 100.0 | 100.0 | 91.7 | 0.85 |
| ACC:预测准确率;SEN:灵敏度;SPE:特异度;PPV:阳性预测值;NPV:阴性预测值;AUC:ROC曲线下面积 | ||||||
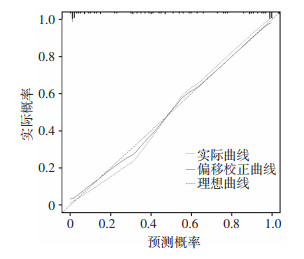
|
| 图 2 校准曲线 |
为进一步评估腰池引流量作为单一因素对患者预后的影响:使用WFNS、Hunt-Hess、mFisher进行校正后,预后危险度降为原来的0.743倍(OR:0.743,95%CI:0.625~0.883,P=0.001);使用分流依赖进行校正后,预后危险度降为原来的0.721倍(OR:0.721,95%CI:0.599~0.867,P=0.001);使用血管痉挛校正后,预后危险度降为原来的0.862倍(OR:0.862,95%CI:0.754~0.985,P=0.029);使用WFNS、Hunt-Hess、mFisher、分流依赖、脑血管痉挛进行校正后,预后危险度降为原来的0.586倍(OR:0.586,95%CI:0.409~0.842,P=0.004),单独考虑腰池引流对预后影响,评估腰池引流量每增加10 mL,mRS预后危险度能降为原来的0.869倍(OR:0.869,95%CI:0.776~0.973,P=0.015),见表 4。
| 变量 | 估计 | 标准差 | χ2 | P | OR | 95%CI |
| Model 1 | -0.140 | 0.057 8 | 5.887 | 0.015 | 0.869 | 0.776~0.973 |
| Model 2 | -0.297 | 0.088 1 | 11.357 | 0.001 | 0.743 | 0.625~0.883 |
| Model 3 | -0.328 | 0.094 4 | 12.046 | 0.001 | 0.721 | 0.599~0.867 |
| Model 4 | -0.149 | 0.068 3 | 4.755 | 0.029 | 0.862 | 0.754~0.985 |
| Model 5 | -0.534 | 0.184 4 | 8.380 | 0.004 | 0.586 | 0.409~0.842 |
Model 1:单独考虑引流量预测因素的情况;Model 2:校正WFNS、Hunt-Hess、mFisher;Model 3:校正分流依赖;Model 4:校正脑血管痉挛;Model 5:校正WFNS、Hunt-Hess、mFisher、分流依赖、脑血管痉挛联合WFNS、mFisher、分流依赖、脑血管痉挛、腰池引流量预测mRS效果佳,ROC曲线下面积可达0.898(灵敏度0.861,特异度:0.935, 图 3A),具有良好临床预测效果;为了更直观地从预测的角度分析腰池引流量对患者预后重要性,仅单独使用腰池引流量对mRS进行预测时,其ROC曲线下面积就可达到0.632(灵敏度0.611,特异度:0.652,图 3B)。
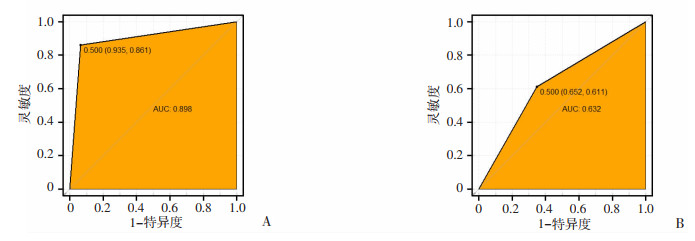
|
| A:WFNS、mFisher、分流依赖、脑血管痉挛、腰池引流量联合预测动脉瘤性蛛网膜下腔出血后AHC患者预后的ROC曲线;B:腰池引流量预测动脉瘤性蛛网膜下腔出血后AHC患者预后的ROC曲线 图 3 aSAH后AHC患者预后的ROC曲线 |
3 讨论
动脉瘤性蛛网膜下腔出血(aSAH)是自发性蛛网膜下腔出血的常见类型,具有发病率高、病死率高的特点[9-10]。当动脉瘤发生破裂后,血液进入蛛网膜下腔,严重者形成团块效应,阻碍了脑脊液的正常流动,引发脑积水[10-11]。此外,颅内蛛网膜下腔中血块的分解产物会触发炎性级联,导致蛛网膜颗粒粘连,进一步加重脑积水[12]。有7%~37%的aSAH患者术后出现AHC,需要接受脑脊液引流手术[13]。当前脑室外引流(external ventricular drainage,EVD)和腰池引流(lumbar cistern drainage,LD)是临床工作中脑脊液持续引流最常用的手段[14]。
LD与EVD都具有可控性,实现脑脊液的长期持续引流,有效控制颅内高压,有效减少血液积聚,降低脑积水风险[15]。前者创伤较小,且避免患者重复腰椎穿刺术,在患者中接受度更高[16]。有研究发现脑脊液引流量会改变颅内蛛网膜下腔积血的量,进而影响患者症状与预后,在早期尽可能清除基底池的血性脑脊液可以明显减少分流依赖的发生率[17]。与EVD相比,LD清除基底池内的血液速度更快,分流依赖性的发生率较低[18]。脑脊液比血液更轻,从脑室引流容易重力因素影响,导致血液停留在基底池难以清除。aSAH后同时接受EVD和LD治疗的患者中,LD的脑脊液明显比EVD的脑脊液更红或黄,血红蛋白含量更高[7]。与EVD相比,LD发生颅内感染的风险更低;同时LD的脑出血发生率更低[14]。LD安全问题也不容忽视,可以通过调节引流管高度、引流速度、引流量来避免过度引流导致的大脑中心疝等严重并发症[19]。
我们前期基于患者人口学特征以及SAH相关临床指标进行单因素Logistic分析发现WFNS、Hunt-Hess、mFisher、腰池引流时间、分流依赖、脑血管痉挛、腰池引流量可影响患者预后。进一步Logistic逐步回归表明WFNS、mFisher、发生分流依赖、脑血管痉挛是影响患者预后的独立危险因素,而只有腰池引流量是独立保护因素。mFisher等级越高,发生脑血管痉挛和迟发性神经功能缺损的风险越高,是预后不良的独立危险因素[20]。较高的WFNS分级是一项独立危险因素,反映出蛛网膜下腔出血后对脑组织的损伤程度较重,出现较差的意识水平,预后较差[21]。分流依赖性脑积水为动脉瘤性蛛网膜下腔出血后常见且严重的并发症,脑积水会导致颅内压升高,脑灌注压降低,导致脑缺血,影响患者预后[22]。据报道,20%~30%的aSAH患者存在脑血管痉挛,导致脑缺血,影响脑组织血供,出现神经功能缺损,是aSAH术后不良预后的预测因素之一[23]。基于上述5项危险因素构建预测aSAH患者术后短期临床预后的Nomogram模型,并绘制ROC曲线,Nomogram模型的曲线下面积为0.898(95%CI:0.935~0.861),通过十折交叉验证得到训练集和测试集的准确度、灵敏度、特异度、阳性预测值和阴性预测值,该模型区分度较高、稳定性良好、校准度良好。表明腰池引流量联合WFNS、mFisher高分级、发生分流依赖与脑血管痉挛危险因素构建的Nomogram模型在预测预后方面具有临床应用价值。
关于LD引流相关数据对于患者预后的研究报道非常少,有研究报道增加LD引流量可以更有效清除积血,减少脑积水发生率,改善并发症[24]。本研究也发现预后好组的平均引流量为99.5 mL, 明显高于预后差组患者的平均引流量68 mL。引流量超过196.33 mL时,腰池引流相关并发症会明显增加[25],本研究日引流量在200 mL内,以10 mL为单位进行引流量增加调整能明显改善预后评分,我们认为在一定的范围内适当增加引流量能降低分流依赖性脑积水的发生,改善预后。为了进一步验证引流量对预后的影响,通过统计学方法调整多因素分析中对预后的影响因素,在5种矫正模型中分析发现腰池引流量作为判断患者预后的因素是可靠的。此外,通过模型分析发现LD的引流量AUC为0.632。说明单独调整引流量可以作为改善预后的一项措施。本研究为单中心回顾性研究,存在一定的局限性。首先,数据提取过程中可能发生了信息偏倚。每例患者的脑脊液高度和腰池引流时间的变化可能是这一偏倚的潜在来源。其次,基于CT血管造影诊断血管痉挛,目前的研究表明,CT血管造影在发现轻中度痉挛方面的准确性较低。最后,本研究使用的样本量小,无法检测组间差异。
由于本研究存在样本量偏小的问题,故在未来的研究中我们将进一步扩大aSAH术后有留置LD的病例资料收集,以降低小样本带来的选择性偏倚;同时延长随访时间,用多方式随访减少失访率,补充长期预后数据,进一步验证Nomogram的预测效能。因此,本研究结论的临床实用价值仍有待前瞻性临床试验的进一步验证。
综上所述,WFNS、mFisher、发生分流依赖、脑血管痉挛是影响aSAH后AHC患者预后不良的独立危险因素,腰池引流量是独立保护因素。基于这5项因素构建的列线图预测模型,对临床结局有良好的预测能力;通过研究腰池引流量作为单一因素对预后的影响能力,本研究发现,适当增加但控制每日引流总量小于200 mL的LD持续引流可以更有效清除蛛网膜下腔积血,在一定程度上避免分流依赖的发生,减轻患者神经功能障碍,从而改善预后。
| [1] |
STEINER T, JUVELA S, UNTERBERG A, et al. European Stroke Organization guidelines for the management of intracranial aneurysms and subarachnoid haemorrhage[J]. Cerebrovasc Dis, 2013, 35(2): 93-112. |
| [2] |
ASPIDE R, PEGOLI M, FUSTINI M F, et al. Correlation between hypo-pituitarism and poor cognitive function using neuropsychological tests after aneurysmal subarachnoid haemorrhage: a pilot study[J]. Clin Neurol Neurosurg, 2022, 214: 107167. |
| [3] |
GERAGHTY J R, LARA-ANGULO M N, SPEGAR M, et al. Severe cognitive impairment in aneurysmal subarachnoid hemorrhage: Predictors and relationship to functional outcome[J]. J Stroke Cerebrovasc Dis, 2020, 29(9): 105027. |
| [4] |
LUCKE-WOLD B, DODD W, MOTWANI K, et al. Investigation and modulation of interleukin-6 following subarachnoid hemorrhage: targeting inflammatory activation for cerebral vasospasm[J]. J Neuroinflamm, 2022, 19(1): 228. |
| [5] |
ERIKSEN N, ROSTRUP E, FABRICIUS M, et al. Early focal brain injury after subarachnoid hemorrhage correlates with spreading depolarizations[J]. Neurology, 2019, 92(4): e326-e341. |
| [6] |
GARCÍA-ARMENGOL R, PUYALTO P, MISIS M, et al. Cerebrospinal fluid output as a risk factor of chronic hydrocephalus after aneurysmal subarachnoid hemorrhage[J]. World Neurosurg, 2021, 154: e572-e579. |
| [7] |
HOEKEMA D, SCHMIDT R H, ROSS I. Lumbar drainage for subarachnoid hemorrhage: technical considerations and safety analysis[J]. Neurocrit Care, 2007, 7(1): 3-9. |
| [8] |
LEE C Y, JANG K M, WUI S H, et al. The benefits and feasibility of external lumbar cerebrospinal fluid drainage for cerebral vasospasm in patients with aneurysmal subarachnoid hemorrhage: meta-analysis and trial sequential analysis[J]. World Neurosurg, 2022, 167: e549-e560. |
| [9] |
SORRENTINO Z A, LAURENT D, HERNANDEZ J, et al. Headache persisting after aneurysmal subarachnoid hemorrhage: a narrative review of pathophysiology and therapeutic strategies[J]. Headache, 2022, 62(9): 1120-1132. |
| [10] |
KAWAKITA F, KANAMARU H, ASADA R, et al. Roles of glutamate in brain injuries after subarachnoid hemorrhage[J]. Histol Histopathol, 2022, 37(11): 1041-1051. |
| [11] |
KANAT A, TURKMENOGLU O, AYDIN M D, et al. Toward changing of the pathophysiologic basis of acute hydrocephalus after subarachnoid hemorrhage: a preliminary experimental study[J]. World Neurosurg, 2013, 80(3/4): 390-395. |
| [12] |
YANG C, LI Y H. Review of the prevention and treatment of hydrocephalus after aneurysmal subarachnoid hemorrhage[J]. World Neurosurg, 2022, 168: 134-138. |
| [13] |
YOKOYA S, HINO A, GOTO Y, et al. Pros and cons of tentative clipping in intracranial aneurysm surgery: review of 867 direct clippings in single institution[J]. World Neurosurg, 2018, 118: e185-e187. |
| [14] |
SUN C, DU H, YIN L. Choice for the removal of bloody cerebrospinal fluid in postcoiling aneurismal subarachnoid hemorrhage: external ventricular drainage or lumbar drainage?[J]. Turk Neurosurg, 2014, 24(5): 737-744. |
| [15] |
HUSSEIN M, ABDELLATIF M. Continuous lumbar drainage for the prevention and management of perioperative cerebrospinal fluid leakage[J]. Asian J Neurosurg, 2019, 14(2): 473-478. |
| [16] |
DUAN F, WANG G F, MA X H, et al. A controlled study of continuous lumbar drainage of fluid and lumbar puncture drainage for aneurysmal SAH after intracranial aneurysm clipping[J]. J Healthc Eng, 2021, 2021: 1-8. |
| [17] |
LU X C, JI C Y, WU J, et al. Intrathecal fibrinolysis for aneurysmal subarachnoid hemorrhage: evidence from randomized controlled trials and cohort studies[J]. Front Neurol, 2019, 10: 885. |
| [18] |
DEMIRGIL B T, TUGCU B, POSTALCI L, et al. Factors leading to hydrocephalus after aneurysmal subarachnoid hemorrhage[J]. Minim Invas Neurosurg, 2003, 46(6): 344-348. |
| [19] |
LIANG H S, ZHANG L Y, GAO A L, et al. Risk factors for infections related to lumbar drainage in spontaneous subarachnoid hemorrhage[J]. Neurocrit Care, 2016, 25(2): 243-249. |
| [20] |
WU X Y, JI D F, WANG Z F, et al. Elevated serum NOX2 levels contribute to delayed cerebral ischemia and a poor prognosis after aneurysmal subarachnoid hemorrhage: a prospective cohort study[J]. Neuropsychiatr Dis Treat, 2023, 19: 1027-1042. |
| [21] |
ZHAO B, YANG H, ZHENG K, et al. Preoperative and postoperative predictors of long-term outcome after endovascular treatment of poor-grade aneurysmal subarachnoid hemorrhage[J]. J Neurosurg, 2017, 126(6): 1764-1771. |
| [22] |
ASADA R, NAKATSUKA Y, KANAMARU H, et al. Higher plasma osteopontin concentrations associated with subsequent development of chronic shunt-dependent hydrocephalus after aneurysmal subarachnoid hemorrhage[J]. Transl Stroke Res, 2021, 12(5): 808-816. |
| [23] |
EAGLES M E, JAJA B N R, MACDONALD R L. Incorporating a modified Graeb score to the modified fisher scale for improved risk prediction of delayed cerebral ischemia following aneurysmal subarachnoid hemorrhage[J]. Neurosurgery, 2017, 82(3): 299-305. |
| [24] |
FANG Y J, SHAO Y J, LU J N, et al. The effectiveness of lumbar cerebrospinal fluid drainage in aneurysmal subarachnoid hemorrhage with different bleeding amounts[J]. Neurosurg Rev, 2020, 43(2): 739-747. |
| [25] |
吴恒浩, 张万宏, 郑光明. 自发性颅内出血患者开颅术后腰大池置管引流过度的临床研究[J]. 国际神经病学神经外科学杂志, 2015, 42(6): 519-522. WU H H, ZHANG W H, ZHENG G M. Clinical study of excessive lumbar drainage after craniotomy in patients with spontaneous intracranial hemorrhage[J]. J Int Neurol Neurosurg, 2015, 42(6): 519-522. |




