2型糖尿病(diabetes mellitus type 2,T2DM)是一种慢性代谢紊乱性疾病,具有各种并发症,构成巨大的全球医疗保健负担。目前全球约有4.35亿人患有糖尿病(diabetes mellitus,DM),其中有19%~34%的患者可能会形成足部溃疡伤口[1]。糖尿病足(diabetic foot ulcer,DFU)是导致非创伤性肢体截肢的主要原因。由于高血糖、慢性炎症、氧化应激、反复微生物感染、血管损伤(外周动脉疾病)和DM周围神经病变等一系列内在和外在的因素常使得DFU难以愈合[2]。目前临床对DFU患者的处理措施主要包括宣传教育、预防、清洗创面和早期诊断,仍缺乏有效地促进伤口创面愈合的干预措施。
鱼油富含ω-3多不饱和脂肪酸(Omega-3 polyunsaturated fatty acids,ω-3PUFAs),ω-3PUFAs是人体参与细胞内代谢调节和细胞信号传导的必需营养素之一,其中二十碳五烯酸(EPA)、二十二碳六烯酸(DHA)是ω-3PUFAs的主要活性成分。研究表明,ω-3PUFAs具有改善机体营养状况、调节免疫功能、炎症反应和氧化应激等诸多健康效应[3]。在临床实践中,大多数DFU患者存在缺血性神经病变,其中近50%~75%的病例中可检测到外周动脉疾病。由于伤口创面的血运不良,以及在消化、吸收和代谢过程的损失,DHA、EPA及其功能性代谢物在伤口部位以口服递送的形式积累受到限制;ω-3PUFAs具有亲脂性和较高的上皮渗透能力,与口服相比,ω-3PUFAs局部给药可将活性物质直接作用到皮肤病灶中,同时生物利用度更高,对伤口愈合更有效[4]。基于鱼源性ω-3PUFA的抗炎活性,有研究者提出使用富含长链ω-3PUFA的完整鱼皮移植物应用于DM患者的伤口以促进其愈合[5-6]。ω-3PUFAs(包括DHA和EPA)在正常鼠及糖尿病鼠伤口模型中也显现出其对伤口的愈合潜力[7-11]。本课题组前期动物预实验结果也显示:鱼油可以有效促进T2DM大鼠的伤口愈合。目前国内外关于外用ω-3PUFA对高血糖状态下伤口创面愈合的效果的详细时间依赖性研究甚少。本研究通过建立T2DM大鼠伤口创面模拟DFU病变,观察局部外用鱼油的作用效果并探讨其可能作用机制。特定的鱼油类型以及鱼油中的多不饱和脂肪酸百分比是对皮肤有益的重要因素[12],鉴于一般的鱼油成分复杂,难以进行质量控制,因此本项研究采用了经化学合成,纯度较高的试剂型鱼油。
1 材料与方法 1.1 试剂和材料鱼油(罗恩试剂:18%EPA 20%Ω3),玉米油(阿拉丁),链脲佐菌素(streptozotocin,STZ)(美国Sigma公司),丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase, CAT)测定试剂盒由南京建成生物工程研究所提供,肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)、白介素-1β(interleukin-1β,IL-1β)、白介素-6(interleukin-6,IL-6)、白介素-10(Interleukin-10,IL-10)ELISA试剂盒厂家为厦门慧嘉生物技术有限公司,Masson染色试剂盒(北京索莱宝),核因子E2相关因子2(nuclear factor erythroid2-related factor 2,Nrf2)(上海AbMART), 沉默信息调节因子1(silent Information Regulator 1,SIRT1)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3 -phosphate dehydrogenase,GAPDH)(上海碧云天生物技术公司),醌氧化还原酶1(NADH quinone oxidoreductase 1,NQO1)(上海生工生物工程有限公司)。血糖仪及血糖试纸(瑞士罗氏公司),高脂高糖饲料:35%脂肪比糖尿病大小鼠定制饲料(北京博爱港生物技术有限公司),普通饲料(陆军军医大学实验动物中心)。
1.2 T2DM大鼠模型建立实验按照陆军军医大学实验动物福利伦理审查委员会批准的程序进行。62只健康雄性SD大鼠购于陆军军医大学动物实验中心,实验动物许可证号:SYXK(渝)2022-0018。大鼠饲养于温度19~23 ℃、湿度40%~60%、12 h光暗周期循环的环境中,自由饮水和进食。其中5只正常饲料喂养,另57只采用8周高脂高糖饲料喂养联合小剂量STZ(25 mg/kg)腹腔注射进行建模,初次注射3 d后测量空腹血糖(fasting plasma glucose,FPG),隔日复测,若FPG值均≥16.7 mmol/L,则认为T2DM大鼠模型制备成功;对FPG < 16.7 mmol/L的大鼠再次腹腔注射STZ(25 mg/kg),共建模成功49只。
1.3 分组及干预T2DM大鼠模型建立1周后,在7%水合氯醛(0.3 ml/ 100 g)腹腔注射麻醉下,于背部造2 cm×2 cm矩形创口,伤口均深至筋膜层。模型参考中华人民共和国医药行业标准:诱导糖尿病大鼠皮肤缺损模型(YY/T1754.2-2020)。采用随机数字表法将大鼠分为鱼油组(n=17)、玉米油组(n=16)、模型对照组(n=16)。建模成功后第2天开始上药,将创面周围用生理盐水清洁后,擦干上药。鱼油组、玉米油组分别局部外用鱼油、玉米油,模型对照组仅用生理盐水清洁,干预中使用注射器每次吸取0.5 mL注入同一规格的医用毛刷后统一于创面均匀涂抹2遍。前3 d均使用无菌敷料进行包扎,每日上药1次,直至创口愈合。每组中选取5只大鼠用于观察创面愈合情况,其余分别于7 d(n=5)、14 d(n=4)随机处死取样(干预期间大鼠死亡7只,鱼油组3只,玉米油组及模型对照组各2只,最终剩42只)。
1.4 观察创面愈合情况使用数码相机采集并记录各组大鼠(n=5)术后1、3、7、14、21 d创面愈合图像,创面的完全上皮化作为创面愈合依据。使用Image J软件测定创面愈合率。计算公式:创面愈合率(%)=(第1天创面面积-特定日期测量面积)/第1天创面面积×100%。
1.5 创面组织病理学观察取第7、14天经4%多聚甲醛溶液固定的皮肤创面组织,经脱水、石蜡包埋、切片(经创面组织中间切开,垂直于创缘)、脱蜡等处理,进行苏木精-伊红(HE)染色、马松染色(Masson)染色,正置荧光显微镜下观察皮肤创面组织显微结构并拍照记录,Masson染色中使用Image J软件颜色反卷积算法计算各组胶原容积分数,每组标本选择16个随机场(20×,比例尺50 μm)。HE染色参考SALRIAN等[13]的研究方法进行半定量分析,由两名接受病理培训的研究人员独立盲法评估组织病理切片。半定量评估量表见表 1。
| 评分 | 再上皮化 | 多形核白细胞 | 成纤维细胞 | 血管生成 |
| 0 | 切割缘厚度 | 无 | 无 | 无 |
| 1 | 细胞迁移(<50%) | 轻度-ST | 轻度-ST | 轻度-ST |
| 2 | 细胞迁移(≥50%) | 轻度-DL/GT | 轻度-GT | 轻度-GT |
| 3 | 桥接切割缘 | 中度-DL/GT | 中度-GT | 中度-GT |
| 4 | 角质化 | 显著-DL/GT | 显著-GT | 显著-GT |
| ST: 周围组织,即GT以外的组织; DL: 分界线; SCT: 皮下组织; GT: 肉芽组织 | ||||
1.6 创面组织氧化应激及炎症因子水平检测
取第7、14天皮肤创面组织于预冷生理盐水中进行匀浆,按照试剂盒说明书检测匀浆中氧化应激指标MDA、SOD、CAT水平;取皮肤创面组织于预冷PBS(pH=7.4)中制备匀浆,按照ELISA试剂盒说明书检测匀浆中炎症因子TNF-α、IL-1β、IL-6、IL-10水平。
1.7 Western blot检测取第7、14天冻存大鼠皮肤创面组织提取总蛋白,BCA法测定各组上清蛋白浓度后采用Western blot检测创面组织中SIRT1、Nrf2、NQO1蛋白表达情况,以GAPDH为内参,采用ImageJ软件计算各组蛋白相对表达量。
1.8 统计学分析采用SPSS 26.0统计软件进行分析。计量资料以x±s表示, 多组间比较采用单因素方差分析,两两比较采用LSD检验。使用非参数Kruskal-Wallis检验比较半定量评价的数据。检验标准均为α=0.05。
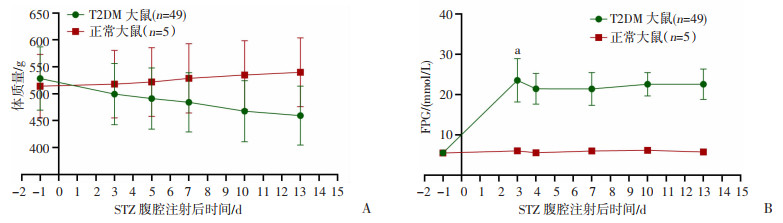
2 结果 2.1 T2DM大鼠建模情况建模前大鼠体型肥硕,食欲精神良好,毛色顺泽,建模大鼠与正常饲料大鼠FPG无显著差异。注射STZ后,建模大鼠出现多饮、多尿症状,食欲精神差,反应迟钝,背毛污秽枯黄,垫料潮湿,FPG升高(P < 0.05)并持续高于16.7 mmol/L,体质量减轻(P < 0.05),符合T2DM特征。见图 1。干预期间三组T2DM大鼠呈现持续高血糖,组间无显著差异,见表 2。
|
| a: P < 0.05, 与建模前1 d相比 图 1 T2DM大鼠建模前后体质量(A)和血糖(B)变化情况 |
| 组别 | 1 d | 3 d | 6 d | 9 d | 13 d | 19 d |
| 鱼油组 | 21.85±3.03 | 24.34±4.62 | 23.12±4.07 | 23.50±3.05 | 22.30±2.34 | 22.26±2.12 |
| 玉米油组 | 22.71±4.60 | 26.03±4.98 | 23.99±3.90 | 22.93±3.94 | 22.17±2.47 | 22.22±3.34 |
| 模型对照组 | 23.43±4.31 | 25.67±5.10 | 23.64±3.47 | 22.26±2.03 | 22.53±2.30 | 22.38±2.68 |
| F | 0.63 | 0.55 | 0.20 | 0.37 | 0.06 | 0.05 |
| P | 0.54 | 0.58 | 0.82 | 0.69 | 0.95 | 0.10 |
2.2 各组大鼠皮肤创面愈合率比较
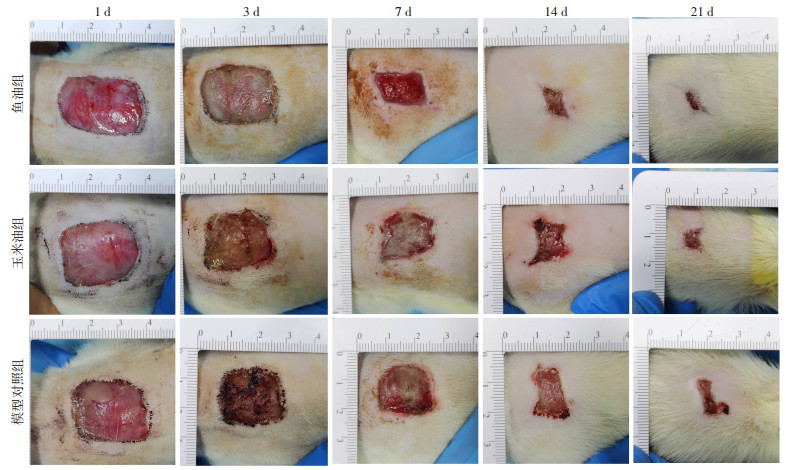
随着时间进展,三组大鼠创口面积均逐渐缩小,伤口创面愈合率呈上升趋势。第3天时,三组大鼠创口处的渗出液均较第1天减少,玉米油组和模型对照组可见少许脓性分泌物,创面开始结痂,各组间愈合率未见明显差异(P>0.05);第7天时,玉米油组和模型对照组创口硬痂下积脓,硬痂脱落后创面呈淡红色,可见少许渗血,其中鱼油组创面面积收缩程度最高;在第14、21天时,各组大鼠创口均趋向愈合。在第7、14、21天时鱼油组伤口创面愈合率较玉米油组和模型对照组显著升高(P < 0.05),而玉米油组与模型对照组组间伤口创面愈合率均无显著差异,见图 2、表 3、图 3。
|
| 图 2 三组大鼠创面愈合情况比较 |
| 组别 | 例数(只) | 3 d | 7 d | 14 d | 21 d |
| 鱼油组 | 5 | 25.94±6.93 | 59.51±13.42ab | 84.69±3.65ab | 96.53±1.57ab |
| 玉米油组 | 5 | 27.19±3.11 | 42.73±9.86 | 73.60±5.80 | 91.73±2.83 |
| 模型对照组 | 5 | 21.67±8.26 | 38.06±10.38 | 74.17±7.05 | 91.30±4.01 |
| F | 1.00 | 4.96 | 6.05 | 4.75 | |
| P | 0.40 | 0.03 | 0.02 | 0.03 | |
| 注:F时间效应=306.95,P时间效应 < 0.01;F分组效应=7.90,P分组效应=0.01;F交互效应=2.41,P交互效应=0.047;a: P < 0.05, 与玉米油组比较;b: P < 0.05, 与模型对照组比较 | |||||

|
| 图 3 三组大鼠创面愈合率交互效应轮廓图 |
2.3 各组大鼠皮肤创面HE染色结果
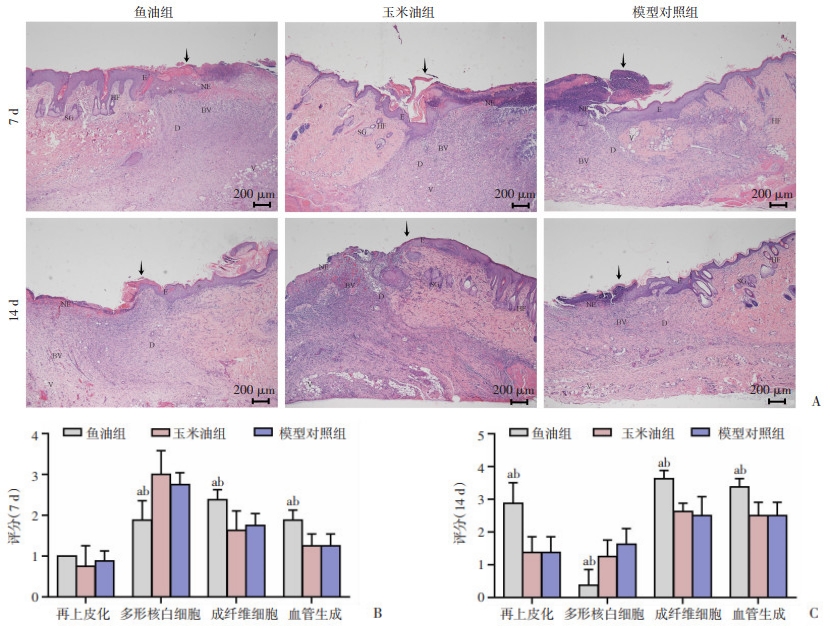
第7天时,玉米油组和模型对照组创面组织中可观察到大量炎症细胞浸润、大面积表皮层与真皮层坏死溶解和少量坏死细胞碎片,而胶原纤维沉积、肉芽组织和新生毛细血管较少;鱼油组创面组织炎症细胞浸润相对较少,而肉芽组织、新生血管生长相对明显。第14天时,各组创面组织炎症细胞浸润程度减轻,真皮层出现增生的结缔组织,胶原纤维沉积及新生毛细血管数量增多,可见大量成纤维细胞与纤维细胞;其中鱼油组成纤维细胞和毛细血管数量及形态优于其他两组,伤口可见新生表皮层覆盖。通过半定量分析术后7 d与14 d组织病理学评分(再上皮化、多形核白细胞、成纤维细胞、血管生成),鱼油组的半定量评分较玉米油组及模型对照组有统计学意义(P < 0.05),见图 4。
|
|
A:(伤口边缘:黑色箭头,E:表皮,D:真皮,S:结痂, V:液泡,BV:血管,SG:皮脂腺,HF:毛囊) B:术后7 d;C:术后14 d;a: P < 0.05, 与玉米油组比较;b: P < 0.05, 与模型对照组比较 图 4 HE染色观察各组大鼠皮肤创面组织病理学变化及半定量分析(4×) |
2.4 各组大鼠皮肤创面Masson染色结果
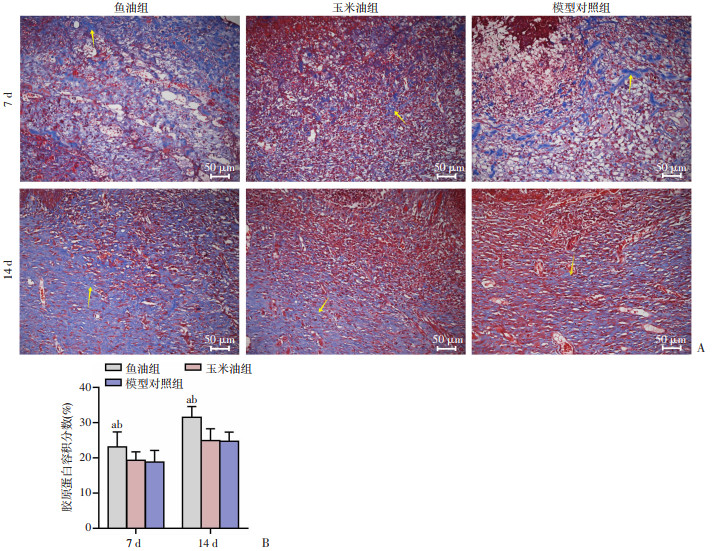
第7、14天时,三组创面Masson染色均可见轻微不规则的胶原纤维,其中鱼油组胶原纤维相对较致密规则,通过半定量分析发现鱼油组胶原蛋白容积分数较玉米油组及模型对照组显著上升(P < 0.05),见图 5。
|
| A:Masson染色病理学比较黄色箭头:胶原纤维;B:胶原蛋白容积分数比较;a: P < 0.05, 与玉米油组比较;b: P < 0.05, 与模型对照组比较 图 5 Masson染色观察各组大鼠创面组织病理学变化及半定量分析(20×) |
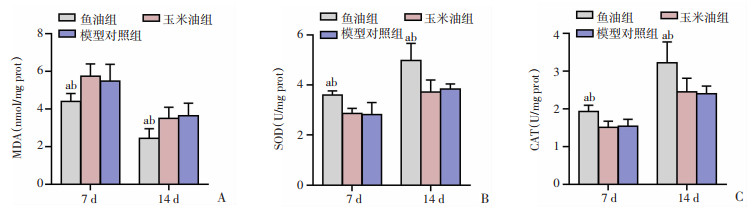
2.5 各组大鼠皮肤创面组织氧化应激指标比较
第7、14天时,与玉米油组及模型对照组相比,鱼油组大鼠创面组织MDA值明显降低(P < 0.05),SOD、CAT值明显升高(P < 0.05),玉米油组与模型对照组组间相比差异无统计学意义,见图 6。
|
| A:MDA;B:SOD;C:CAT;a: P < 0.05, 与玉米油组比较;b: P < 0.05, 与模型对照组比较 图 6 各组大鼠7、14 d创面组织氧化应激水平比较 |
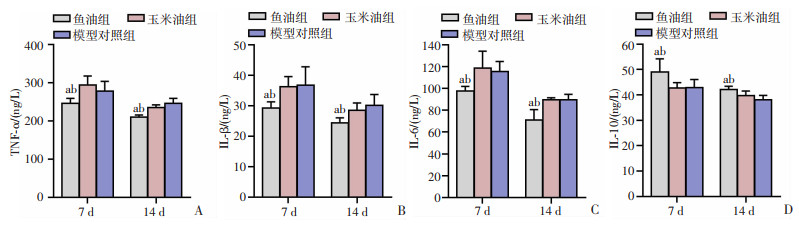
2.6 各组大鼠皮肤创面组织炎症因子比较
在用药第7天和第14天,与玉米油组及模型对照组相比,鱼油组大鼠创面组织TNF-α、IL-1β、IL-6水平显著降低(P < 0.05),IL-10水平显著升高(P < 0.05),而玉米油组与模型对照组组间相比差异无统计学意义;且14 d时大鼠创面组织炎症因子水平均较第7天时呈下降趋势,见图 7。
|
| A:TNF-α;B:IL-1β;C:IL-6;D:IL-10;a: P < 0.05, 与玉米油组比较;b: P < 0.05, 与模型对照组比较 图 7 各组大鼠7、14 d创面组织炎症因子水平比较 |
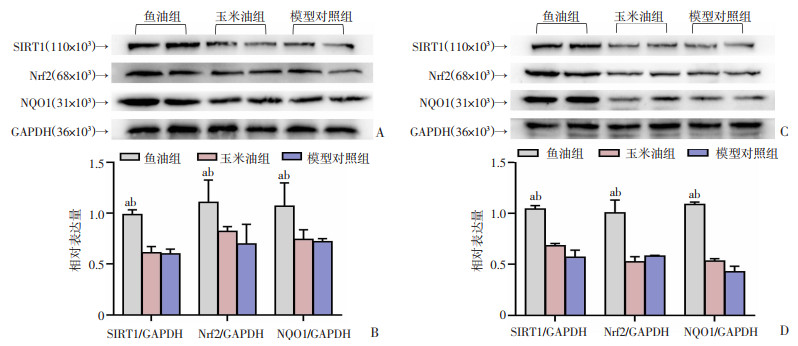
2.7 各组大鼠创面组织SIRT1、Nrf2、NQO1蛋白表达水平
Western blot结果显示,与玉米油组及模型对照组相比,鱼油组创面组织SIRT1、Nrf2、NQO1蛋白表达量在第7、14天均显著增加(P < 0.05),玉米油组与模型对照组间无统计学差异,见图 8。
|
| A、C:Western blot检测蛋白表达;B、D: 蛋白相对表达量比较:a: P < 0.05, 与玉米油组比较;b: P < 0.05, 与模型对照组比较 图 8 各组大鼠7、14 d创面组织SIRT1、Nrf2、NQO1蛋白表达比较 |
3 讨论
本研究探讨了在T2DM背景下局部给予鱼油对大鼠皮肤创面的影响及作用机制,实验使用了目前应用最广泛的伤口创面造模方法:皮肤全层切除模型,该模型操作简单、成模率高,便于疗效分析。上药方式为每日医用毛刷局部涂抹,模拟DM患者能接受的治疗方式。在面积测量设计上,本研究直接采用相机摄像再经软件分析,通过软件分析来使误差最小化。
ω-3PUFAs对正常生长发育至关重要,同时还参与冠状动脉疾病、高血压、糖尿病、关节炎、自身免疫性疾病和癌症等疾病的预防[14]。ω-3PUFAs具有抗炎、抗氧化、抗菌和神经保护等多种生物活性,其对机体抗炎作用的经典机制已得到研究[15-17],同时其抗氧化应激能力也在众多的研究中得到证实[18-20]。基于膳食ω-3PUFAs及其代谢衍生物的公认抗炎、抗氧化应激效应,近年来,外源性补充ω-3PUFAs已成为炎症相关伤口愈合的关注热点。DFU的发展是由高血糖,炎症和氧化应激的复杂相互作用驱动的,其发展与氧化应激和炎症过程增强有关[21]。DFU难治愈的主要原因在于其不遵循正常有序的愈合过程,目前的药物治疗均无法达到理想效果,解决伤口病理氧化应激问题及精确调节炎症的开始和结束是促进DFU恢复的关键。本研究中,与玉米油组和模型对照组相比,鱼油干预组促炎症因子(TNF-α、IL-1β、IL-6)和氧化应激因子(MDA)的水平降低,而抗炎因子(IL-10)和抗氧化酶(SOD、CAT)的水平升高,抗炎抗氧化能力增强。
在伤口面积测量中,鱼油组伤口较玉米油组及模型对照组在第7、14天愈合更快,而在第3天时并无明显差异,这主要是由于伤口一般在2~3 d后由肌成纤维细胞增生牵拉伤口边缘开始收缩。有研究表明[11]在所有全层伤口中(尤其是在切除术中),收缩在伤后5-15日达到高峰。炎症因子IL-1β、IL-6和TNF-α都抑制伤口收缩,阻碍伤口愈合,本次研究中鱼油的抗炎作用也通过促进伤口收缩得以体现。通过组织学观察发现,鱼油治疗后伤口肉芽组织形成更好,成纤维细胞明显增殖,血管形成增加,胶原纤维沉积。
SIRT1作为Sirtuin家族蛋白中研究最为深入的蛋白之一,被证明不仅可以作为组蛋白脱乙酰酶,还可以作为许多转录调节因子和蛋白质的脱乙酰酶起作用。研究表明,SIRT1在调节葡萄糖/脂质代谢、胰岛素抵抗、炎症、氧化应激和线粒体功能方面具有关键作用[22]。Nrf2是调节细胞内众多抗氧化物表达的关键性因子,其作为SIRT1的下游调控分子,在外部氧化应激刺激时转移至细胞核内启动保护性分子的产生。有研究发现SIRT1活化通过促进血管生成来加速DM小鼠的伤口愈合,SIRT1活化可能通过AKT途径介导的Nrf2和NQO1表达增加来保护内皮细胞免受高血糖诱导的氧化应激[23]。SIRT1可以使Nrf2脱乙酰,并通过产生抗氧化剂酶来促进其减少活性氧(Reactive oxygen species,ROS)的作用,靶向激活SIRT1可能是通过减少ROS,从而减轻DM周围神经病变中的氧化应激[24]。在DM中,氧化应激和炎症反应可以下调SIRT1活性,因此通过激活SIRT1有可能作为治疗DFU潜在重要且有效的治疗靶点。研究表明[25-27],使用ω-3 PUFAs通过激活SIRT1可抑制小鼠小胶质细胞炎症,缓解肝脂肪变性引起的炎症,减轻肠缺血灌注引起的肺损伤和其他基于炎症的疾病。本研究中鱼油组伤口创面组织中SIRT1、Nrf2、NQO1蛋白水平均高于玉米油组和模型对照组,提示鱼油可能通过激活SIRT1介导Nrf2和NQO1表达增加,防御ROS引起的氧化损伤从而在DFU伤口创面愈合起促进作用。
综上所述,T2DM大鼠伤口局部外用鱼油可降低其创面组织中TNF-α、IL-1β、IL-6等促炎因子,同时增加抗炎因子(IL-10)和抗氧化酶(SOD、CAT)的水平,因而促进创面愈合。其部分分子机制可能与鱼油激活SIRT1信号通路有关。
| [1] |
REARDON R, SIMRING D, KIM B, et al. The diabetic foot ulcer[J]. Aust J Gen Pract, 2020, 49(5): 250-255. |
| [2] |
DAVIS F M, KIMBALL A, BONIAKOWSKI A, et al. Dysfunctional wound healing in diabetic foot ulcers: new crossroads[J]. Curr Diab Rep, 2018, 18(1): 2. |
| [3] |
SHAHIDI F, AMBIGAIPALAN P. Omega-3 polyunsaturated fatty acids and their health benefits[J]. Annu Rev Food Sci Technol, 2018, 9: 345-381. |
| [4] |
KAROUD W, GHLISSI Z, KRICHEN F, et al. Oil from Hake (Merluccius merluccius): characterization, antioxidant activity, wound healing and anti-inflammatory effects[J]. J Tissue Viability, 2020, 29(2): 138-147. |
| [5] |
LULLOVE E J, LIDEN B, WINTERS C, et al. A multicenter, blinded, randomized controlled clinical trial evaluating the effect of omega-3-rich fish skin in the treatment of chronic, nonresponsive diabetic foot ulcers[J]. Wounds, 2021, 33(7): 169-177. |
| [6] |
WOODROW T, CHANT T, CHANT H. Treatment of diabetic foot wounds with acellular fish skin graft rich in omega-3: a prospective evaluation[J]. J Wound Care, 2019, 28(2): 76-80. |
| [7] |
ONTORIA-OVIEDO I, AMARO-PRELLEZO E, CASTELLANO D, et al. Topical administration of a marine oil rich in pro-resolving lipid mediators accelerates wound healing in diabetic db/db mice through angiogenesis and macrophage polarization[J]. Int J Mol Sci, 2022, 23(17): 9918. |
| [8] |
ARANTES E L, DRAGANO N, RAMALHO A, et al. Topical docosahexaenoic acid (DHA) accelerates skin wound healing in rats and activates GPR120[J]. Biol Res Nurs, 2016, 18(4): 411-419. |
| [9] |
JIA Y C, QIU S, XU J, et al. Docosahexaenoic acid improves diabetic wound healing in a rat model by restoring impaired plasticity of macrophage progenitor cells[J]. Plast Reconstr Surg, 2020, 145(5): 942e-950e. |
| [10] |
PENG Y C, YANG F L, SUBEQ Y M, et al. Lipid emulsion enriched in omega-3 PUFA accelerates wound healing: a placebo-controlled animal study[J]. World J Surg, 2018, 42(6): 1714-1720. |
| [11] |
BABAEI S, ANSARIHADIPOUR H, NAKHAEI M, et al. Effect of Omegaven on mast cell concentration in diabetic wound healing[J]. J Tissue Viability, 2017, 26(2): 125-130. |
| [12] |
HUANG T H, WANG P W, YANG S C, et al. Cosmetic and therapeutic applications of fish oil's fatty acids on the skin[J]. Mar Drugs, 2018, 16(8): 256. |
| [13] |
SALRIAN A A, BEHZADI A, OLOUMI M M, et al. Amplification of wound healing by Propolis and honey ointment in healthy and diabetic rat models; histopathological and morphometric findings[J]. Arch Razi Inst, 2022, 77(5): 1673-1681. |
| [14] |
DJURICIC I, CALDER P C. Beneficial outcomes of omega-6 and omega-3 polyunsaturated fatty acids on human health: an update for 2021[J]. Nutrients, 2021, 13(7): 2421. |
| [15] |
OH D Y, TALUKDAR S, BAE E J, et al. GPR120 is an omega-3 fatty acid receptor mediating potent anti-inflammatory and insulin-sensitizing effects[J]. Cell, 2010, 142(5): 687-698. |
| [16] |
CHITRANJALI T, ANOOP CHANDRAN P, MURALEEDHARA KURUP G. Omega-3 fatty acid concentrate from Dunaliella salina possesses anti-inflammatory properties including blockade of NF-κB nuclear translocation[J]. Immunopharmacol Immunotoxicol, 2015, 37(1): 81-89. |
| [17] |
SERHAN C N, NAN C A, VAN DYKE T E. Resolving inflammation: dual anti-inflammatory and pro-resolution lipid mediators[J]. Nat Rev Immunol, 2008, 8(5): 349-361. |
| [18] |
ANDERSON E J, THAYNE K A, HARRIS M, et al. Do fish oil omega-3 fatty acids enhance antioxidant capacity and mitochondrial fatty acid oxidation in human atrial myocardium via PPARγ activation?[J]. Antioxid Redox Signal, 2014, 21(8): 1156-1163. |
| [19] |
VELASQUE M J S G, BRANCHINI G, CATARINA A V, et al. Fish oil -omega-3 exerts protective effect in oxidative stress and liver dysfunctions resulting from experimental sepsis[J]. J Clin Exp Hepatol, 2023, 13(1): 64-74. |
| [20] |
GOLPOUR P, NOURBAKHSH M, MAZAHERIOUN M, et al. Improvement of NRF2 gene expression and antioxidant status in patients with type 2 diabetes mellitus after supplementation with omega-3 polyunsaturated fatty acids: a double-blind randomised placebo-controlled clinical trial[J]. Diabetes Res Clin Pract, 2020, 162: 108120. |
| [21] |
VUJČIĆ S, KOTUR-STEVULJEVIĆ J, VEKIĆ J, et al. Oxidative stress and inflammatory biomarkers in patients with diabetic foot[J]. Medicina, 2022, 58(12): 1866. |
| [22] |
MIHANFAR A, AKBARZADEH M, GHAZIZADEH DARBAND S, et al. SIRT1: a promising therapeutic target in type 2 diabetes mellitus[J]. Arch Physiol Biochem, 2021, 1-16. |
| [23] |
LI X Q, WU G F, HAN F, et al. SIRT1 activation promotes angiogenesis in diabetic wounds by protecting endothelial cells against oxidative stress[J]. Arch Biochem Biophys, 2019, 661: 117-124. |
| [24] |
HASHEMI M, ZANDIEH M A, ZIAOLHAGH S, et al. Nrf2 signaling in diabetic nephropathy, cardiomyopathy and neuropathy: therapeutic targeting, challenges and future prospective[J]. Biochim Biophys Acta Mol Basis Dis, 2023, 1869(5): 166714. |
| [25] |
INOUE T, TANAKA M, MASUDA S, et al. Omega-3 polyunsaturated fatty acids suppress the inflammatory responses of lipopolysaccharide-stimulated mouse microglia by activating SIRT1 pathways[J]. Biochim Biophys Acta Mol Cell Biol Lipids, 2017, 1862(5): 552-560. |
| [26] |
WANG T J, YANG B, JI R L, et al. Omega-3 polyunsaturated fatty acids alleviate hepatic steatosis-induced inflammation through Sirt1-mediated nuclear translocation of NF-κB p65 subunit in hepatocytes of large yellow croaker (Larmichthys crocea)[J]. Fish Shellfish Immunol, 2017, 71: 76-82. |
| [27] |
JING H R, YAO J H, LIU X M, et al. Fish-oil emulsion (omega-3 polyunsaturated fatty acids) attenuates acute lung injury induced by intestinal ischemia-reperfusion through Adenosine 5'-monophosphate-activated protein kinase-sirtuin1 pathway[J]. J Surg Res, 2014, 187(1): 252-261. |




