慢性非特异性下腰痛(chronic nonspecific low back pain,CNLBP)是指持续12周以上而无明确病因,发生在第12肋至臀褶的肌肉骨骼源性疼痛,有时疼痛可延伸到大腿(膝盖以上)[1-2]。腰痛将导致患者生活质量下降,同时增加社会经济负担[3]。对此临床多采取对症治疗,其中运动疗法可通过增加腰椎旁肌的协调性和稳定性显著改善腰痛症状和功能障碍[4]。
慢性下腰痛患者往往因腰痛所致的保护性体位或肌肉的废用性、炎症介质的增多引起腰椎旁肌肉结构的退变,宏观上主要表现为肌肉萎缩及脂肪浸润,微观上表现为肌纤维类型及结构的变化[5]。磁共振成像技术不仅能反映肌肉宏观结构的退变,其中扩散张量成像技术(diffusion tensor imaging,DTI)通过无创量化水分子的扩散及其方向各向异性,能够对生物组织的微观结构改变进行评估[6]。近年,在下肢骨骼肌方面的研究已经证明DTI具有在微观结构水平上进行探测的能力,而该项技术在探究腰椎旁肌的结构变化方面的应用较少[7-9]。因此,本研究拟通过多模态MRI成像来定量评估CNLBP患者腰椎旁肌结构变化,从而为CNLBP患者临床诊疗提供参考依据。
1 资料与方法 1.1 研究对象收集2022年5月至2023年3月因腰痛就诊于本院并行腰椎MRI检查的门诊患者作为CNLBP组。根据2020年北美脊柱协会(the North American Spine Society, NASS)针对非特异性下腰痛患者诊断循证医学指南[1],制定纳入标准:①年龄≥18岁;②局限于躯体牵涉痛/局限于膝盖以上的非根性疼痛;③疼痛时间持续12周以上。排除标准:①特异性下腰痛(由肿瘤、感染、骨折、代谢性疾病等引起);②脊椎畸形(脊椎滑脱、侧弯等);③脊椎外疾病(即内脏、血管、生殖器、泌尿系);④既往接受过腰椎手术的患者;⑤存在神经系统缺陷;⑥腰痛伴2个及以上其他部位疼痛;⑦妊娠。同期招募自愿参与本研究的健康志愿者作为对照组,排除标准同CNLBP组。本研究经本院伦理委员会批准[2022年科伦审(研)100号]。
1.2 仪器与方法所有腰椎扫描在Siemens Verio 3.0T磁共振上完成,使用全脊柱相控阵线圈,受试者取仰卧位,分别行T2WI矢状位(TR 3 000 ms,TE 114 ms,FOV 280 mm×280 mm,层厚4 mm),T2WI轴位(TR 3 500 ms,TE 93 ms,FOV 180 mm×180 mm,层厚4 mm),T1-mprage(TR 1 970 ms,TE 2.26 ms,FOV 350 mm×350 mm,层厚1 mm), DTI扫描(TR 6 300 ms,TE 83 ms,FOV 460 mm×460 mm,层厚5 mm,b=500 s/mm2,3个方向),扫描范围从腰1(L1)椎体上缘至骶1(S1)椎体下缘。
1.3 图像处理由于双侧腰大肌受腹部呼吸伪影干扰显示欠佳,L1/2、L2/3椎间盘中心层面的多裂肌面积较小,测值易有误差,且下节段腰椎旁肌更多参与维持椎体稳定性,故本研究测值主要针对L3/4、L4/5、L5/S1椎间盘中心层面双侧多裂肌、竖脊肌。
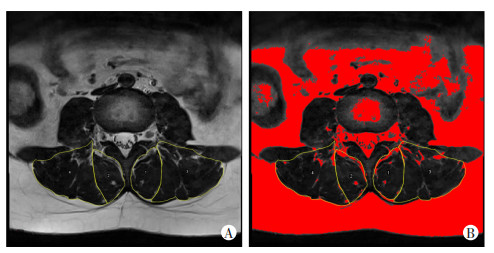
1.3.1 双侧多裂肌、竖脊肌横截面积及脂肪浸润程度的测量将腰椎轴位T2WI图像导入Image J软件(版本1.8.0),在L3/4、L4/5、L5/S1椎间盘中心层面分别沿双侧多裂肌及竖脊肌轮廓勾画不规则曲线,包括肌肉及肌间脂肪,测量得到总横截面积(total cross-sectional area,TCSA);利用Image J软件阈值技术[10]测得多裂肌及竖脊肌的脂肪浸润面积(fatty infiltration cross sectional area,FICSA),见图 1。双侧多裂肌及竖脊肌功能横截面积(functional cross sectional area,FCSA)=TCSA-FICSA;为减小个体体型、习惯性对结果的影响,将相对功能横截面积(relative functional cross sectional area,RFCSA)[RFCSA=FCSA/体质指数(body mass index,BMI)][11]作为最终结果;双侧多裂肌及竖脊肌脂肪浸润率(fatty infiltration rate,FIR)=FICSA/TCSA。
|
| A:沿肌肉轮廓勾画测量总横截面积;B:利用Image J软件自动阈值技术测量脂肪浸润面积 黑色:肌肉;红色:脂肪 图 1 基于腰椎轴位T2WI序列测量双侧多裂肌、竖脊肌横截面积及脂肪浸润面积ROI勾画示意图 |
以上数据由2名放射科医师独立测量,并通过组内相关系数(intraclass correlation efficient,ICC)评估结果一致性。ICC>0.75一致性较高。通过分析,双侧多裂肌、竖脊肌CSA、FIR值的ICC均>0.8(表 1),提示测量结果可靠,最终结果取两者测量值平均值。
| 指标 | 肌肉 | 脊柱部位 | ICC | 95%CI |
| RFCSA | 多裂肌 | L3/4 | 0.986 | 0.977~0.991 |
| L4/5 | 0.988 | 0.981~0.992 | ||
| L5/S1 | 0.982 | 0.972~0.989 | ||
| 竖脊肌 | L3/4 | 0.995 | 0.991~0.997 | |
| L4/5 | 0.992 | 0.987~0.995 | ||
| L5/S1 | 0.991 | 0.986~0.994 | ||
| FIR | 多裂肌 | L3/4 | 0.918 | 0.870~0.949 |
| L4/5 | 0.856 | 0.770~0.909 | ||
| L5/S1 | 0.828 | 0.725~0.892 | ||
| 竖脊肌 | L3/4 | 0.868 | 0.790~0.917 | |
| L4/5 | 0.821 | 0.715~0.888 | ||
| L5/S1 | 0.899 | 0.838~0.936 |
1.3.2 DTI相关参数测量
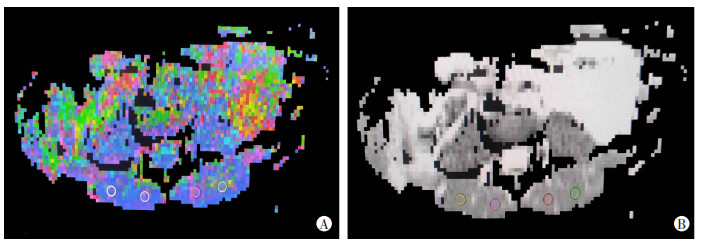
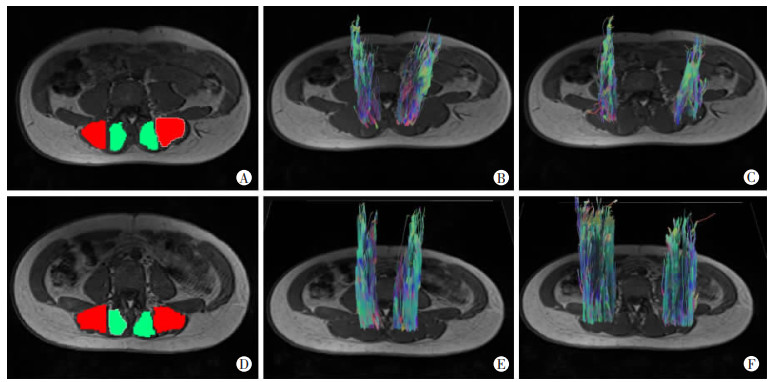
将扫描所得的DTI原始图像导入Siemens Verio 3.0工作站后处理工作站,经图像融合生成各向异性分数(fractional anisotropy,FA)及表观弥散系数(apparent diffusion coefficient,ADC)图,在FA图、ADC图勾画感兴趣区(region of interest,ROI),尽可能选择肌肉中心区,测量3次取平均值,得到双侧多裂肌、竖脊肌的FA值和ADC值,ROI面积为(65±5)mm2(图 2)。以上测量由2名放射科医师共同完成,有分歧时,与1名放射科副主任医师协商,达成一致后记录最终结果。将DTI图像导入第三方软件DSI Studio,通过涂抹种子区,最终生成并获取双侧腰椎旁肌纤维束(图 3)。
|
| A:FA图;B:ADC图 紫、红圈:多裂肌ROI;黄、绿圈:竖脊肌ROI 图 2 26岁女性腰痛患者双侧腰椎旁肌FA、ADC图及ROI勾画示意图 |
|
| A~C:CNLBP组(26岁女性腰痛患者);D~F:对照组(24岁女性健康志愿者);A、D:参考T1-mprage在腰椎旁勾画双侧多裂肌(绿色)、竖脊肌(红色)ROI以生成纤维束;B、E:双侧多裂肌纤维束;C、F:双侧竖脊肌纤维束 图 3 CNLBP患者及健康者双侧腰椎旁肌纤维束示意图 |
1.4 慢性非特异性下腰痛患者疼痛程度及功能障碍评分
使用视觉模拟评分(visual analogue scale,VAS)评估患者疼痛程度,将1段长10 cm线段平分为10等分,代表分值0~10分,分值越高,疼痛程度越高。Oswestry功能障碍指数(Oswestry disability index,ODI)量表评估患者功能障碍程度,量表包括10个问题,每题6个选项,最低得分0分,最高得分5分,10个问题均回答,记分方法:实际得分/50(最高可能得分)×100%;有1个问题未回答,记分方法:实际得分/45(最高可能得分)×100%。得分越高,功能障碍越严重。
1.5 统计学分析采用SPSS 23.0软件包进行统计学分析。计量资料用x±s表示,经Shapiro-Wilk检验验证是否符合正态分布。一般资料(年龄、身高、体质量、BMI)及双侧多裂肌、竖脊肌RFCSA、FIR、FA、ADC值中符合正态分布者使用两独立样本t检验,不符合正态分布者使用Mann-Whitney U检验。性别差异采用χ2检验。使用多元线性回归分析年龄、性别、BMI及下腰痛症状与双侧多裂肌、竖脊肌FIR的相关性。采用Spearman检验VAS、ODI评分与双侧多裂肌、竖脊肌RFCSA、FIR、FA、ADC值的相关性。以P < 0.05为差异有统计学意义。
2 结果 2.1 CNLBP组与对照组一般资料比较CNLBP组共纳入45例CNLBP患者,其中男性12例,女性33例,年龄(29.82±8.18)岁,VAS评分为(4.11±1.84)分,ODI为(19.79±13.38)%。对照组纳入28例健康志愿者,其中男性11例,女性17例,年龄(27.00±6.76)岁。2组年龄、性别、身高、体质量、BMI差异均无统计学意义(表 2)。
| 组别 | n | 性别(男/女) | 年龄/岁 | 身高/cm | 体质量/kg | BMI/(kg/m2) |
| CNLBP组 | 45 | 12/33 | 29.82±8.18 | 162.96±7.74 | 60.53±10.51 | 22.69±2.83 |
| 对照组 | 28 | 11/17 | 27.00±6.76 | 165.46±7.67 | 60.71±9.94 | 22.10±2.61 |
2.2 CNLBP组与健康对照组双侧多裂肌、竖脊肌RFCSA、FIR差异分析
CNLBP组与对照组双侧多裂肌、竖脊肌RFCSA差异均无统计学意义。CNLBP组L3/4、L4/5、L5/S1节段双侧多裂肌脂肪浸润率分别约(13.71±5.56)%、(13.73±4.79)%、(15.38±4.21)%,CLBP组L3/4、L4/5、L5/S1节段双侧竖脊肌脂肪浸润率分别约(8.91±4.94)%、(12.20±4.50)%、(22.95±8.70)%,均高于对照组,差异具有统计学意义(P < 0.05),见表 3。
| 肌肉 | 脊柱部位 | CNLBP组 | 对照组 | |||
| RFCSA/[mm2/(kg·m-2)] | FIR/% | RFCSA/[mm2/(kg·m-2)] | FIR/% | |||
| 多裂肌 | L3/4 | 43.86±10.32 | 13.71±5.56a | 47.84±10.14 | 10.41±3.45 | |
| L4/5 | 61.82±13.04 | 13.73±4.79a | 64.99±11.85 | 11.36±3.83 | ||
| L5/S1 | 71.17±14.19 | 15.38±4.21a | 72.87±11.96 | 13.03±4.70 | ||
| 竖脊肌 | L3/4 | 128.80±32.51 | 8.91±4.94a | 134.51±32.24 | 6.78±2.23 | |
| L4/5 | 110.63±31.61 | 12.20±4.50a | 109.44±24.15 | 9.80±3.15 | ||
| L5/S1 | 76.02±27.69 | 22.95±8.70a | 79.46±24.74 | 18.00±4.78 | ||
| RFCSA:相对功能横截面积;FIR:脂肪浸润率;a:P < 0.05,与对照组比较 | ||||||
2.3 CNLBP组与对照组双侧多裂肌、竖脊肌ADC、FA值差异分析
CNLBP组L3/4、L4/5、L5/S1节段双侧多裂肌、竖脊肌FA值均低于对照组,L3/4节段右侧多裂肌及L4/5、L5/S1节段双侧多裂肌、竖脊肌FA值差异有统计学意义(P < 0.05)。CNLBP组L3/4、L4/5、L5/S1节段双侧多裂肌、竖脊肌ADC值均高于对照组,L4/5、L5/S1节段双侧多裂肌及L5/S1节段双侧竖脊肌ADC值差异具有统计学意义(P < 0.05),见表 4。
| 肌肉 | 脊柱部位 | CNLBP组 | 对照组 | |||
| FA值 | ADC值 | FA值 | ADC值 | |||
| 多裂肌 | L3/4左侧 | 0.256±0.025 | 1.787±0.080 | 0.265±0.027 | 1.757±0.087 | |
| L3/4右侧 | 0.265±0.030a | 1.779±0.086 | 0.283±0.030 | 1.745±0.075 | ||
| L4/5左侧 | 0.293±0.020a | 1.799±0.086a | 0.304±0.028 | 1.736±0.081 | ||
| L4/5右侧 | 0.293±0.024a | 1.772±0.080a | 0.305±0.026 | 1.732±0.084 | ||
| L5/S1左侧 | 0.289±0.020a | 1.774±0.076a | 0.302±0.028 | 1.728±0.097 | ||
| L5/S1右侧 | 0.247±0.046a | 1.727±0.072a | 0.267±0.030 | 1.688±0.079 | ||
| 竖脊肌 | L3/4左侧 | 0.281±0.041 | 1.705±0.082 | 0.286±0.038 | 1.675±0.114 | |
| L3/4右侧 | 0.284±0.026 | 1.670±0.071 | 0.293±0.034 | 1.642±0.134 | ||
| L4/5左侧 | 0.300±0.027a | 1.789±0.080 | 0.315±0.024 | 1.771±0.060 | ||
| L4/5右侧 | 0.296±0.024a | 1.778±0.077 | 0.309±0.028 | 1.751±0.079 | ||
| L5/S1左侧 | 0.284±0.028a | 1.783±0.087a | 0.301±0.032 | 1.720±0.144 | ||
| L5/S1右侧 | 0.272±0.043a | 1.757±0.099a | 0.293±0.032 | 1.709±0.077 | ||
| a:P < 0.05,与对照组比较 | ||||||
2.4 年龄、性别、BMI、下腰痛与双侧多裂肌、竖脊肌FIR的相关性
多元线性回归分析结果显示,年龄与L3/4、L4/5、L5/S1节段双侧多裂肌、竖脊肌的FIR呈正相关(P < 0.05);下腰痛患者相较于健康者双侧多裂肌、竖脊肌的脂肪浸润率更高(P < 0.05),女性相较于男性在双侧多裂肌、竖脊肌的脂肪浸润率更高(P < 0.05);BMI仅与L5/S1双侧竖脊肌的FIR呈正相关(P < 0.05),见表 5、6。
| 脊柱部位 | 参数 | 多裂肌FIR | ||||
| B | SE | β | t | P | ||
| L3/4节段 | 常量 | 0.013 | 5.019 | - | 0.003 | 0.998 |
| 年龄 | 0.149 | 0.073 | 0.226 | 2.051 | 0.044 | |
| BMI | 0.192 | 0.209 | 0.103 | 0.917 | 0.363 | |
| 性别(女) | 3.526 | 1.215 | 0.324 | 2.903 | 0.005 | |
| CNLBP(+) | 2.315 | 1.140 | 0.222 | 2.030 | 0.046 | |
| L4/5节段 | 常量 | 0.399 | 4.312 | - | 0.093 | 0.927 |
| 年龄 | 0.166 | 0.062 | 0.282 | 2.667 | 0.010 | |
| BMI | 0.176 | 0.180 | 0.106 | 0.978 | 0.331 | |
| 性别(女) | 4.262 | 1.044 | 0.437 | 4.083 | <0.001 | |
| CNLBP(+) | 2.365 | 1.070 | 0.254 | 2.211 | 0.030 | |
| L5/S1节段 | 常量 | 11.718 | 4.635 | - | 2.528 | 0.014 |
| 年龄 | 0.146 | 0.069 | 0.251 | 2.119 | 0.038 | |
| BMI | -0.247 | 0.195 | -0.150 | -1.270 | 0.208 | |
| 性别(女) | 2.351 | 1.122 | 0.243 | 2.096 | 0.040 | |
| CNLBP(+) | 2.344 | 1.060 | 0.254 | 2.211 | 0.030 | |
| CNLBP:慢性非特异性下腰痛;BMI:体质量指数;FIR:脂肪浸润率 | ||||||
| 脊柱部位 | 参数 | 竖脊肌FIR | ||||
| B | SE | β | t | P | ||
| L3/4节段 | 常量 | 3.253 | 2.058 | - | 1.581 | 0.118 |
| 年龄 | 0.132 | 0.063 | 0.243 | 2.108 | 0.039 | |
| BMI | 0.245 | 0.180 | 0.159 | 1.361 | 0.178 | |
| 性别(女) | 1.309 | 1.060 | 0.145 | 1.234 | 0.221 | |
| CNLBP(+) | 2.131 | 0.992 | 0.247 | 2.148 | 0.035 | |
| L4/5节段 | 常量 | 5.309 | 1.907 | - | 2.783 | 0.007 |
| 年龄 | 0.123 | 0.058 | 0.228 | 2.115 | 0.038 | |
| BMI | 0.255 | 0.178 | 0.168 | 1.434 | 0.156 | |
| 性别(女) | 3.549 | 0.964 | 0.397 | 3.683 | < 0.001 | |
| CNLBP(+) | 2.396 | 0.973 | 0.281 | 2.463 | 0.016 | |
| L5/S1节段 | 常量 | 10.299 | 3.633 | - | 2.835 | 0.006 |
| 年龄 | 0.239 | 0.111 | 0.237 | 2.152 | 0.035 | |
| BMI | 0.762 | 0.312 | 0.268 | 2.437 | 0.017 | |
| 性别(女) | 5.681 | 1.836 | 0.341 | 3.095 | 0.003 | |
| CNLBP(+) | 4.949 | 1.795 | 0.311 | 2.756 | 0.007 | |
| CNLBP:慢性非特异性下腰痛;BMI:体质量指数;FIR:脂肪浸润率 | ||||||
2.5 VAS、ODI评分与双侧多裂肌、竖脊肌RFCSA、FIR、FA、ADC值的相关性
ODI评分与双侧多裂肌及竖脊肌RFCSA有显著负相关性(P<0.05;P < 0.01),VAS、ODI评分与双侧多裂肌及竖脊肌FIR均有显著正相关性(P<0.05;P < 0.01),VAS评分与双侧多裂肌及竖脊肌RFCSA、VAS、ODI评分与双侧多裂肌及竖脊肌FA、ADC值均无明显相关性(P>0.05),见表 7~9。
| 指标 | 脊柱部位 | VAS | ODI |
| 多裂肌RFCSA | L3/4节段 | -0.095 | -0.405b |
| L4/5节段 | -0.101 | -0.372a | |
| L5/S1节段 | -0.101 | -0.396b | |
| 多裂肌FIR | L3/4节段 | 0.243 | 0.335a |
| L4/5节段 | 0.266 | 0.402b | |
| L5/S1节段 | 0.457b | 0.451b | |
| 竖脊肌RFCSA | L3/4节段 | -0.361a | -0.450b |
| L4/5节段 | -0.283 | -0.402b | |
| L5/S1节段 | -0.259 | -0.197a | |
| 竖脊肌FIR | L3/4节段 | 0.410b | 0.529b |
| L4/5节段 | 0.464b | 0.571b | |
| L5/S1节段 | 0.240a | 0.328a | |
| RFCSA:相对功能横截面积;FIR:脂肪浸润率;a:P < 0.05;b:P < 0.01 | |||
| 指标 | 脊柱部位 | VAS | ODI |
| 多裂肌FA值 | L3/4左侧 | -0.048 | -0.223 |
| L3/4右侧 | -0.024 | -0.002 | |
| L4/5左侧 | -0.084 | -0.256 | |
| L4/5右侧 | -0.125 | -0.139 | |
| L5/S1左侧 | -0.065 | -0.103 | |
| L5/S1右侧 | -0.087 | -0.160 | |
| 竖脊肌FA值 | L3/4左侧 | -0.079 | -0.057 |
| L3/4右侧 | -0.234 | -0.195 | |
| L4/5左侧 | -0.090 | -0.029 | |
| L4/5右侧 | -0.304a | -0.122 | |
| L5/S1左侧 | -0.102 | -0.004 | |
| L5/S1右侧 | -0.215 | -0.167 | |
| a:P < 0.05 | |||
| 指标 | 脊柱部位 | VAS | ODI |
| 多裂肌ADC值 | L3/4左侧 | 0.204 | 0.033 |
| L3/4右侧 | 0.148 | 0.043 | |
| L4/5左侧 | 0.473b | 0.330a | |
| L4/5右侧 | 0.255 | 0.221 | |
| L5/S1左侧 | 0.165 | 0.105 | |
| L5/S1右侧 | 0.171 | 0.075 | |
| 竖脊肌ADC值 | L3/4左侧 | 0.004 | 0.160 |
| L3/4右侧 | 0.072 | 0.042 | |
| L4/5左侧 | 0.119 | 0.126 | |
| L4/5右侧 | 0.119 | 0.020 | |
| L5/S1左侧 | 0.148 | 0.093 | |
| L5/S1右侧 | 0.118 | 0.049 | |
| a:P < 0.05;b:P < 0.01 | |||
3 讨论
非特异性下腰痛的病因及发病机制尚不明确,肌肉因素、椎间盘退变因素、椎小关节退变因素、生物力学异常因素、心理因素等都可能导致下腰痛的发生。其中腰椎旁肌的退变和肌纤维结构的变化与下腰痛的发生与复发密切相关[12-13]。
下腰痛患者往往会伴随着腰椎旁肌萎缩及脂肪浸润的增加,且主要集中在多裂肌及竖脊肌[14]。本研究考虑到个体体型、习惯性对腰椎旁肌肉结构的影响,引入RFCSA(即FCSA/BMI)减少上述差异对测量结果的干扰。结果显示,与对照组比较,CNLBP组L3/4、L4/5、L5/S1节段双侧多裂肌及L3/4、L5/S1节段双侧竖脊肌的RFCSA均有所减小,L4/5节段双侧竖脊肌RFCSA稍高于对照组,但差异无统计学意义。分析该结果,可能与受试者处于中青年,对下腰痛耐受力较高有关;其次,BALASCH-BERNAT等[15]研究发现,在运动过程中,慢性下腰痛患者双侧多裂肌及竖脊肌较健康者具有更高的肌肉活性,多裂肌与竖脊肌在维持腰椎节段稳定与脊柱矢状面平衡中起着重要作用[16],CNLBP患者在进行活动或功能锻炼时,腰椎旁肌为维持腰椎节段及脊柱稳定性,其活动会代偿性增加,进而导致肌肉代偿性肥大。本研究结果也显示,CNLBP组L3/4、L4/5、L5/S1节段双侧多裂肌、双侧竖脊肌的FIR均高于对照组,且从L3/4至L5/S1节段呈现递增趋势,差异具有统计学意义,与HUANG等[17]研究结果一致。本研究采用Spearman检验显示腰痛患者VAS、ODI评分均与双侧腰椎旁肌的FIR呈显著正相关,研究表明肌肉脂肪浸润的增加与炎症因子的表达失调有关,高脂肪浸润者肌肉中肿瘤坏死因子、瘦素等炎症因子表达上调,其可促进脂肪细胞的生成与肥大[18]。CNLBP患者由于腰椎旁肌受到长时间压力负荷导致肌肉疲劳、肌内压力升高而产生缺血性疼痛,椎间盘退变释放炎症介质,加剧脂肪变性,脂肪浸润、肌肉萎缩进一步降低腰椎旁肌肉的体积及功能,并可能加剧椎间盘退变,如此循环,可能会导致更多脂肪变性[19-21]。
本研究采用多元线性回归分析显示,年龄、性别与腰椎旁肌的脂肪浸润率有关,随着年龄的增大,脂肪浸润程度也随之增加,女性相较于男性更易发生腰椎旁肌脂肪浸润,与既往研究[17, 22]结果一致。这可能与生长激素、性激素水平下降以及男性进行功能锻炼更多有关。本研究CNLBP组与对照组年龄、性别差异皆无统计学意义,同时考虑了BMI因素,从而减小其对结果的干扰。
DTI技术既往主要用于测量脑白质纤维结构改变,通过测量DTI图像中FA值和ADC值可以无创量化组织中水分子的扩散及方向各向异性。FA值反映水分子扩散方向各向异性,纤维束的方向性越一致,越具有较高的FA值,当纤维束被破坏时,这种各向异性特征就被打乱,FA值降低。ADC值可反映水分子扩散是否受限,ADC值越高,代表组织间隙越大,水分子扩散越不受限。近年DTI技术逐渐用于反映四肢骨骼肌纤维结构的改变,由于腹部呼吸干扰及患者配合度欠佳,其在腰椎旁肌方面的研究较少。椎旁肌类型包括Ⅰ型、Ⅱa型及Ⅱx型,非特异性下腰痛患者多会伴随椎旁肌Ⅰ型慢肌纤维向Ⅱx型快肌纤维转变,导致肌肉耐力下降,对疲劳的抵抗力下降[5],更易产生疼痛。本研究Spearman检验显示,腰痛患者VAS、ODI评分与双侧腰椎旁肌的FA值呈负相关性、与ADC值呈正相关性,但相关性不具有统计学意义,出现该结果可能与样本量小有关。同时,我们推测,由于肌纤维类型构成比例的失调,肌束体积改变,CNLBP患者腰椎旁肌纤维可能伴随着不同程度的损伤,进而导致肌间隙变化,椎旁肌水分子的扩散和各向异性也会发生一定的改变。本研究结果显示,与对照组比较,CNLBP组双侧多裂肌及竖脊肌FA值降低、ADC值增高,L3/4节段右侧多裂肌及L4/5、L5/S1节段双侧多裂肌、竖脊肌FA值差异有统计学意义,且在L4/5、L5/S1节段双侧多裂肌、竖脊肌FA值呈现递减趋势,L4/5、L5/S1节段双侧多裂肌及L5/S1节段双侧竖脊肌ADC值差异具有统计学意义。表明下腰椎节段椎旁肌更多地参与脊柱的稳定性维持及脊柱运动,且越靠下节段的椎旁肌越容易发生肌肉退变。
本研究存在一些局限性,首先,本研究仅从影像学方面评估腰椎旁肌结构的改变,缺乏病理结果的支持;其次,本研究样本量较小,未对腰痛患者进行更加详细分组研究,不同发病情况人群腰椎旁肌结构改变可能不同,后续可进一步扩大样本量,研究不同发病情况腰痛人群腰椎旁肌结构的改变。
总之,本研究通过多模态MRI成像定量分析发现,慢性非特异性下腰痛患者的双侧多裂肌及竖脊肌脂肪浸润程度高于健康人群,且随脊柱节段的下降逐渐增加,其中年龄、性别、下腰痛症状及程度与腰椎旁肌脂肪浸润具有相关性,ODI、VAS评分越高,腰椎旁肌相对功能横截面积越小,脂肪浸润程度越高;相对功能横截面积两者差异无统计学意义。DTI技术可以量化慢性非特异性下腰痛患者腰椎旁肌纤维结构改变,为临床诊疗非特异性下腰痛患者、制定功能锻炼计划提供参考依据。
| [1] |
KREINER D S, MATZ P, BONO C M, et al. Guideline summary review: an evidence-based clinical guideline for the diagnosis and treatment of low back pain[J]. Spine J, 2020, 20(7): 998-1024. |
| [2] |
URITS I, BURSHTEIN A, SHARMA M, et al. Low back pain, a comprehensive review: pathophysiology, diagnosis, and treatment[J]. Curr Pain Headache Rep, 2019, 23(3): 23. |
| [3] |
KNEZEVIC N N, CANDIDO K D, VLAEYEN J W S, et al. Low back pain[J]. Lancet, 2021, 398(10294): 78-92. |
| [4] |
GORJI S M, MOHAMMADI NIA SAMAKOSH H, WATT P, et al. Pain neuroscience education and motor control exercises versus core stability exercises on pain, disability, and balance in women with chronic low back pain[J]. Int J Environ Res Public Health, 2022, 19(5): 2694. |
| [5] |
NOONAN A M, BROWN S H M. Paraspinal muscle pathophysiology associated with low back pain and spine degenerative disorders[J]. JOR Spine, 2021, 4(3): e1171. |
| [6] |
KLUPP E, CERVANTES B, SCHLAEGER S, et al. paraspinal muscle DTI metrics predict muscle strength[J]. J Magn Reson Imaging, 2019, 50(3): 816-823. |
| [7] |
MALIS V, SINHA U, CSAPO R, et al. Diffusion tensor imaging and diffusion modeling: application to monitoring changes in the medial gastrocnemius in disuse atrophy induced by unilateral limb suspension[J]. J Magn Reson Imaging, 2019, 49(6): 1655-1664. |
| [8] |
OH J, JUNG J Y, KO Y J. Can diffusion tensor imaging and tractography represent cross-sectional area of lumbar multifidus in patients with LUMBAR spine disease?[J]. Muscle Nerve, 2018, 57(2): 200-205. |
| [9] |
DI PIETRO G, SCIMECA M, IUNDUSI R, et al. Differences between muscle from osteoporotic and osteoarthritic subjects: in vitro study by diffusion-tensor MRI and histological findings[J]. Aging Clin Exp Res, 2020, 32(12): 2489-2499. |
| [10] |
ZHU D C, LIN J H, XU J J, et al. An assessment of morphological and pathological changes in paravertebral muscle degeneration using imaging and histological analysis: a cross-sectional study[J]. BMC Musculoskelet Disord, 2021, 22(1): 854. |
| [11] |
VIRK S, SANDHU M, WRIGHT-CHISEM J, et al. The association between spondylolisthesis and decreased muscle health throughout the lumbar spine for patients with operative lumbar spinal stenosis[J]. Eur Spine J, 2021, 30(9): 2605-2612. |
| [12] |
GOUBERT D, DE PAUW R, MEEUS M, et al. Lumbar muscle structure and function in chronic versus recurrent low back pain: a cross-sectional study[J]. Spine J, 2017, 17(9): 1285-1296. |
| [13] |
沈峥嵘, 王勇, 吴哲. 非特异性下腰痛评估量表、发病机制及诊疗的研究进展[J]. 中国临床医生杂志, 2017, 45(8): 16-19. SHEN Z R, WANG Y, WU Z. Research progress of nonspecific low back pain assessment scale, pathogenesis, diagnosis and treatment[J]. Chin J Clin, 2017, 45(8): 16-19. |
| [14] |
SIONS J M, ELLIOTT J M, POHLIG R T, et al. Trunk muscle characteristics of the multifidi, erector spinae, psoas, and quadratus lumborum in older adults with and without chronic low back pain[J]. J Orthop Sports Phys Ther, 2017, 47(3): 173-179. |
| [15] |
BALASCH-BERNAT M, WILLEMS T, DANNEELS L, et al. Differences in myoelectric activity of the lumbar muscles between recurrent and chronic low back pain: a cross-sectional study[J]. BMC Musculoskelet Disord, 2021, 22(1): 756. |
| [16] |
DING J Z, KONG C, LI X Y, et al. Different degeneration patterns of paraspinal muscles in degenerative lumbar diseases: a MRI analysis of 154 patients[J]. Eur Spine J, 2022, 31(3): 764-773. |
| [17] |
HUANG Y L, WANG L, ZENG X L, et al. Association of paraspinal muscle CSA and PDFF measurements with lumbar intervertebral disk degeneration in patients with chronic low back pain[J]. Front Endocrinol (Lausanne), 2022, 13: 792819. |
| [18] |
JAMES G, CHEN X L, DIWAN A, et al. Fat infiltration in the multifidus muscle is related to inflammatory cytokine expression in the muscle and epidural adipose tissue in individuals undergoing surgery for intervertebral disc herniation[J]. Eur Spine J, 2021, 30(4): 837-845. |
| [19] |
SUDHIR G, JAYABALAN V, SELLAYEE S, et al. Is there an interdependence between paraspinal muscle mass and lumbar disc degeneration? A MRI based study at 2520 levels in 504 patients[J]. J Clin Orthop Trauma, 2021, 22: 101576. |
| [20] |
NAKAMURA M, OTANI K, KANEKO Y, et al. The relationship between exercise-induced low back pain, the fat infiltration rate of paraspinal muscles, and lumbar sagittal balance[J]. Spine Surg Relat Res, 2022, 6(3): 261-270. |
| [21] |
FUJⅡ K, YAMAZAKI M, KANG J D, et al. Discogenic back pain: literature review of definition, diagnosis, and treatment[J]. JBMR Plus, 2019, 3(5): e10180. |
| [22] |
DALLAWAY A, HATTERSLEY J, DIOKNO M, et al. Age-related degeneration of lumbar muscle morphology in healthy younger versus older men[J]. Aging Male, 2020, 23(5): 1583-1597. |




