2. 710021 西安,西安市肿瘤早诊创新转化重点实验室;
3. 710021 西安,陕西省呼吸病预防与诊治工程研究中心;
4. 710077 西安,西安医学院第一附属医院神经内科
2. Xi'an Key Laboratory of Innovative and Translational Cancer Early Diagnosis, Xi'an, Shaanxi Province, 710021;
3. Research Center for Prevention and Treatment of Respiratory Disease, School of Clinical Medicine, Xi'an Medical University, Xi'an, Shaanxi Province, 710021;
4. Department of Neurology, First Affiliated Hospital of Xi'an Medical University, Xi'an, Shaanxi Province, 710077, China
胶质瘤是最常见的原发性神经系统肿瘤,占所有原发性神经系统肿瘤的40%以上[1]。高级别胶质母细胞瘤(glioblastoma,GBM)因生长迅速、侵袭性强,患者5年生存率低于10%,严重危害人类健康。目前GBM治疗的策略主要是在手术切除后联合放化疗干扰肿瘤细胞DNA复制,以抑制肿瘤细胞的恶性增殖,但治疗效果不理想。90%以上的患者在指南推荐的标准治疗后数月出现复发[2-3],目前对胶质瘤发病机制研究仍不清楚。最近两项独立研究发现,苍术酮和梣酮通过调控SIRT3-SOD2-ROS信号通路抑制胶质瘤发展[4-5],越来越多的证据表明自噬-溶酶体途径参与胶质瘤发生[6]。在真核细胞中,沉默调节蛋白3(sirtuin 3,Sirt3)对溶酶体降解的正调控作用促进三阴性乳腺癌的进展[7],但Sirt3通过调控溶酶体在胶质瘤发生发展中的作用尚不清楚。
Sirt3是哺乳动物sirtuin家族成员之一,主要位于线粒体中,依赖烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide, NAD)发挥去乙酰化酶作用[8]。其在体内有44、28 kD 2种形式,主要靠短同源异构体发挥生物学功能[9]。Sirt3参与生物体内诸多代谢过程,如能量代谢[10]、氧化应激[11]、酮体代谢[12]、线粒体稳态[13]、脂肪酸代谢[14]和尿素循环[15]。
溶酶体是负责细胞内消化的细胞器,含多种酸性水解酶[16]。溶酶体相关膜蛋白(lysosome-associated membrane protein,LAMP)是溶酶体膜蛋白的主要成分,对维持其功能至关重要[17]。研究表明,溶酶体数量的增加会导致细胞生长失控[18]。因此,调节溶酶体蛋白是肿瘤靶向治疗的有效方法。转录因子EB(transcription factor EB,TFEB)是溶酶体生物合成的主要调控因子[19]。调控TFEB蛋白磷酸化的激酶主要有mTOR、ERK、GSK3和AKT,其能影响TFEB蛋白的核质转位进而抑制LAMP的转录、表达[20]。但Sirt3在调节溶酶体中的作用尚不清楚,本研究利用CRISPR/Cas9和shRNA系统干预胶质瘤细胞U87中Sirt3的表达,观察其对细胞凋亡,LAMP1、LAMP2、LAMP2A的蛋白水平及mTOR信号通路的影响。探讨Sirt3在胶质瘤发生发展中的作用及可能的分子机制,以期为胶质瘤治疗提供新的靶点。
1 材料与方法 1.1 细胞、试剂人源胶质瘤细胞系(U87、LN-229、U251、SH-SY5Y、A172)、人胚肾细胞(HEK293T)购自美国ATCC细胞库;胎牛血清、DMEM细胞培养基、胰蛋白酶(货号:SV30208.02、SH30022.01、SH30042.01) 购自Hyclone公司;LipofectamineTM2000(货号:11668-027)购自Invitrogen公司;总蛋白提取试剂盒(货号:0006-100)购自碧云天公司;Sirt3(货号:A5781)购自爱博泰克生物科技有限公司;GAPDH(货号:KC-5G4)购自康成生物工程有限公司;LAMP1、LAMP2、LAMP2A、Acetylation及Cleaved-caspase3(货号:ab24170、ab199946、ab125068、ab115124、E83-77)购自Abcam公司;p-TFEB(货号:ABE1971)购自Merck Millipore公司;mTOR、p-mTOR、Bax(货号:2983、5536、41162)购自CST公司;TFEB(货号:13372-1-AP)购自Proteintech公司;Rapamycin(货号:AY-22989)购自Selleck公司;辣根过氧化物酶标记的小鼠二抗(货号:A4416)和辣根过氧化物酶标记的兔二抗(货号:A0545)购自Sigma公司;TUNEL、PI-Annexin-V试剂盒(货号:C1086、C1062M)和溶酶体红色荧光标记探针、细胞核染料Hoechst 33342(货号:C1046、C1028)购自碧云天公司。
1.2 实验方法 1.2.1 细胞培养及组织样品胶质瘤细胞系U87、LN-229、U251、SH-SY5Y、A172和人胚肾细胞HEK293T在37 ℃、5% CO2饱和湿度的恒温培养箱中培养,培养基为含10%胎牛血清(FBS),1%双抗(链霉素、青霉素)的DMEM高糖完全培养基,待细胞融合率达到80%左右进行传代。10 μmol/L mTOR抑制剂Rapamycin处理细胞24 h后,收集样品进行相关蛋白检测。6例胶质瘤及相邻癌旁组织于术后立即置于液氮中快速冷冻,患者平均年龄45岁,其中男性2例(星形细胞瘤),女性4例(多形性胶质母细胞瘤)。所有患者样本来自西安医学院第一附属医院(2016年1月至2021年12月)。研究中所使用样本均获得捐赠者的知情同意书,并得到医院伦理委员会的批准(XYLS2023092)。
1.2.2 生物信息学分析利用中国胶质瘤数据库CGGA(http://www.cgga.org.cn/)、GEPIA2数据库(http://gepia.cancer-pku.cn/)分析Sirt3在人源胶质瘤组织中的表达情况。CGGA数据库中获得325例胶质瘤样本(WHO Ⅱ、Ⅲ、Ⅳ),分析在胶质瘤不同级别、分类中Sirt3的表达及其与存活的相关性。同时还利用GEPIA2数据库分析Sirt3在正常组织(n=207)及癌症组织(n=163)中的表达。
1.2.3 质粒载体构建将公司合成的shRNA及gRNA正义链、反义链加蒸馏水溶解,先加热至煮沸然后自然冷却至室温进行退火,退火产物与酶切后的载体pLKO.1(EcoRⅠ、AgeⅠ)、PX459(BbsI)混匀后在DNA连接酶的作用下(16 ℃)反应16 h后进行转化,挑取单克隆菌落进行培养、提取质粒,通过测序验证。分别用限制性内切酶EcoRⅠ、BamHⅠ切割pLVX-IRES-Zs及目的基因片段,经连接、转化、质粒提取后通过测序比对验证。对照组(shScramble)、Sirt3敲减序列(shSirt3、Sirt3-gRNA)及过表达基因扩增引物由擎科生物公司合成,见表 1。
| 名称 | 序列(5′→3′) |
| shScramble | 正义链:CCGGGAACTCGAGTTCACATGGTTCCTCGAGGAACCATGTGAACTCGAGTTCTTTTTG |
| 反义链:AATTCAAAAAGAACTCGAGTTCACATGGTTCCTCGAGGAACCATGTGAACTCGAGTTC | |
| shSirt3-1 | 正义链:CCGGGCGGCTCTACACGCAGAACATCTCGAGATGTTCTGCGTGTAGAGCCGCTTTTTG |
| 反义链:AATTCAAAAAGCGGCTCTACACGCAGAACATCTCGAGATGTTCTGCGTGTAGAGCCGC | |
| shSirt3-2 | 正义链:CCGGGTGGGTGCTTCAAGTGTTGTTCTCGAGAACAACACTTGAAGCACCCACTTTTTG |
| 反义链:AATTCAAAAAGTGGGTGCTTCAAGTGTTGTTCTCGAGAACAACACTTGAAGCACCCAC | |
| gRNA-1 | 正义链:CACCGCTACACGCAGAACATCGAT |
| 反义链:AAACATCGATGTTCTGCGTGTAGC | |
| gRNA-2 | 正义链:CACCGTACGATCTCCCGTACCCCG |
| 反义链:AAACCGGGGTACGGGAGATCGTAC | |
| pLVX-Sirt3 | 正义链:GAATTCCACC ATGGCGTTCTGGGGTTGG |
| 反义链:GGATCCTTACTTGTCGTCATCGTCTTTGTAGTCTTTGTCTGGTCCATCAAGC | |
| pLVX-TFEB | 正义链:GAATTCCACCATGACAGCAAGCTCAG |
| 反义链:GGATCCTTACTTGTCGTCATCGTCTTTGTAGTCTCACAGCACATCGCCCT |
1.2.4 病毒包装和细胞感染
HEK293T细胞融合度达到70%时,用分别将8 μg骨架质粒psPAX2、pMD2.G和Scr、shSirt3、过表达质粒及30 μL转染试剂PEI加入1 500 μL DMEM培养基(不含血清、双抗)混匀,室温放置20 min后,加入HEK293T细胞转染4~6 h换成新鲜完全培养基,继续培养48 h后收集培养基,1 500×g离心10 min取上清,再用0.45 μm滤膜过滤,所得液体即为包装后病毒。用上述包装好的病毒感染U87细胞48 h后,用含2.5 μg/mL嘌呤霉素的培养基筛选48 h,收集样本用Western blot检测Sirt3、LAMP1、LAMP2、LAMP2A、mTOR、p-mTOR、TFEB、p-TFEB等蛋白的表达水平。
1.2.5 细胞裂解与核质分离在收集好的细胞样品中加入含有蛋白酶抑制剂的预冷提取缓冲液置于冰上,每隔5 min剧烈涡旋1次,共裂解20 min,12 500×g、4 ℃离心5 min,取上清进行BCA蛋白定量,再加入对应体积的蛋白上样缓冲液(5× Loading buffer)95 ℃加热5 min后进行SDS-PAGE电泳。细胞蛋白质核、质分离实验参照WANG等[21]的方法进行,将细胞重悬于CSK缓冲液,置于冰上孵育15 min后,5 000 r/min、4 ℃离心5 min,细胞核组分用CSK溶液重悬并用超声破碎仪处理。
1.2.6 Western blot检测U87细胞中的蛋白表达将制备好的蛋白样品经过10% SDS-PAGE电泳分离,在低温下转移至PVDF膜(使用前用甲醇浸泡激活30 s),用含5%脱脂奶粉的PBST封闭液摇床室温孵育1 h,加入Sirt3、Acetylation、Bax、Cleaved-Caspase3、LAMP1、LAMP2、LAMP2A、m-TOR、p-mTOR、TFEB、p-TFEB、GAPDH等抗体4 ℃孵育过夜,用PBST洗膜4次,每次5 min,室温孵育二抗1 h(1 ∶20 000),再用PBST洗膜4次,每次5 min,最后用ECL法发光后胶片曝光。
1.2.7 TUNEL染色将Scr、shSirt3稳转细胞系接种于含有盖玻片的6孔板中培养24 h,4%多聚甲醛(PFA)固定10 min后,用1×PBS缓慢冲洗1次,0.3% TritonX-100室温孵育2 min后,加入适当体积的TUNEL染色试剂避光条件下染色1 h,再用1×PBS缓慢冲洗,最后用10 μg/mL的DAPI复染2 min后在荧光显微镜下进行观察统计。
1.2.8 PI-Annexin V染色筛选稳定的Scr、shSirt3胶质瘤细胞系用1×PBS洗涤2次,加入不含EDTA的胰酶消化后,1 000×g离心5 min,弃上清后用1×PBS重悬计数,再1 000×g离心5 min,加入195 μL Annexin V-FITC结合液和5 μL Annexin V-FITC轻轻重悬细胞,最后加入10 μL碘化丙啶染色液(PI)室温避光孵育15 min,采用流式细胞仪检测分析。
1.2.9 Lyso-Tracker Red染色将一定数量的细胞接种在24孔板中培养过夜,去除细胞培养液并加入配好的Lyso-Tracker Red荧光探针工作液(1 ∶20 000),与细胞在37 ℃共孵育30 min后,去除Lyso-Tracker染液,加入新鲜细胞培养液,随后在荧光显微镜下拍照并进行统计分析。
1.3 统计学分析使用Image J软件对通过Western blot测定的蛋白质表达进行定量分析,数据以x±s表示,实验至少进行3次。使用Microsoft Excel 2003(Microsoft Corp)与GraphPad Prism 5.0(GraphPad Software Inc.)软件进行数据采集、记录、运算与分析。两组间比较采用两独立样本t检验,多组间差异分析采用方差分析(Tukey’s多重比较)。P < 0.05表示差异具有统计学意义。
2 结果 2.1 Sirt3表达与人胶质瘤临床分级显著相关基于CGGA数据库中胶质瘤患者数据,通过分析发现在不同临床分级胶质瘤患者中Sirt3 mRNA水平显著性增加(P=0.018,图 1A),同时根据中枢神经系统肿瘤最新的分类标准进行分析,显示Sirt3在胶质母细胞瘤中的表达最高(P=0.013,图 1B)。利用GEPIA2数据库分析正常组织与胶质瘤组织中Sirt3的表达,发现Sirt3在胶质瘤组织中高表达(P < 0.05,图 1C)。进一步将患者分为Sirt3高表达组和Sirt3低表达组,发现Sirt3高表达与胶质瘤患者的低生存率密切相关(P < 0.01,图 1D)。Western blot检测6名胶质瘤患者的临床肿瘤样本和配对的相邻癌旁组织中的Sirt3表达,结果显示Sirt3在胶质瘤组织中高表达(P < 0.01,图 1E)。以上结果提示Sirt3可能在胶质瘤发生发展过程中发挥重要的生物学作用。基于数据库分析和实验结果,提示Sirt3在胶质瘤中异常高表达,可能是胶质瘤发展的促进因素。
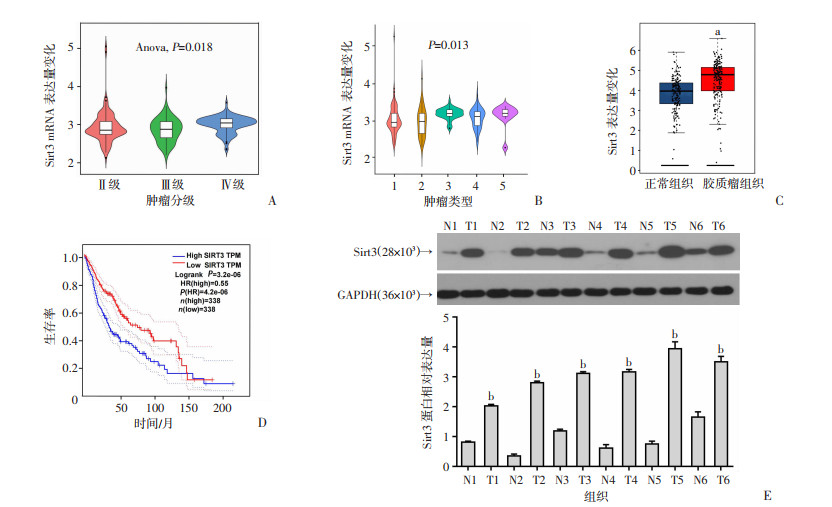
|
| A:Sirt3在CGGA数据库不同临床分级胶质瘤中的表达差异;B:Sirt3在不同类型胶质瘤中的表达差异 1:星形胶质细胞瘤;2:少突胶质细胞瘤;3:间变性少突胶质细胞瘤;4:间变性星形细胞瘤;5:胶质母细胞瘤;C:利用GEPIA2数据库分析胶质瘤组织与正常组织中Sirt3的表达 a:P < 0.05,与正常组织比较;D:Sirt3表达对胶质瘤患者生存率的影响;E:Western blot检测Sirt3在胶质瘤患者癌旁及肿瘤组织中的表达及半定量分析 N:癌旁组织;T:肿瘤组织;b:P < 0.01,与癌旁组织比较 图 1 Sirt3在不同临床分级、不同类型胶质瘤中的表达及对胶质瘤患者生存的影响 |
2.2 胶质瘤细胞系中Sirt3的表达
利用Western blot检测胶质瘤细胞系LN-229、U251、U87、SH-SY5Y、A172中Sirt3的表达情况,结果显示Sirt3在U87中的表达明显高于其他细胞系(P < 0.05,图 2)。因此,选择U87细胞用于后续实验。
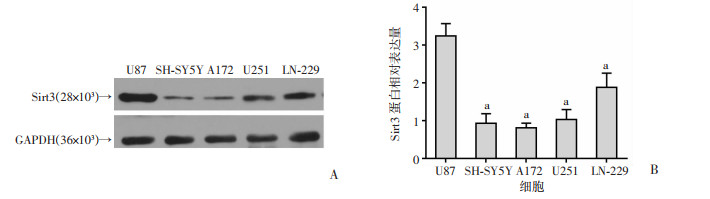
|
| A:Western blot检测结果;B:Sirt3的相对表达量分析 a:P < 0.05,与U87比较 图 2 Western blot检测Sirt3在不同胶质瘤细胞中的表达 |
2.3 胶质瘤细胞U87中敲减Sirt3
为进一步明确Sirt3在胶质瘤进展中的生物学功能,构建2个靶向Sirt3不同位点的shRNA载体用来敲减Sirt3的蛋白水平,通过Western blot检测Sirt3、Acetylation确定2个shRNA的敲减效率。与Scr组相比,shSirt3组Sirt3蛋白水平显著降低,Acetylation明显上调(P < 0.01,图 3),表明shSirt3质粒敲减效率较高,可以用于后续实验。
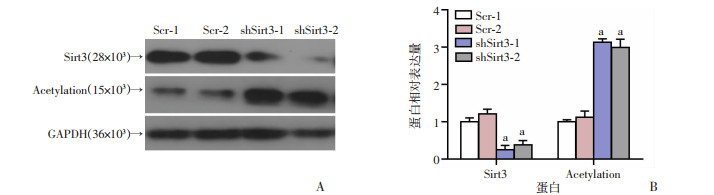
|
|
Scr-1、Scr-2:对照组;shSirt3-1、shSirt3-2:Sirt3敲减组;a:P < 0.01,与对照组比较 A:Western blot检测结果;B:蛋白相对表达量分析 图 3 Western blot检测Sirt3的敲减效果 |
2.4 胶质瘤细胞U87中敲减Sirt3诱导细胞凋亡
U87细胞中敲减Sirt3后,TUNEL染色结果显示,与对照组(Scr)相比,敲减Sirt3后细胞凋亡显著增加(P < 0.01,图 4A)。用PI-Annexin V染料标记后流式细胞术分析显示,Sirt3敲减后阳性细胞百分比显著增加(P < 0.01,图 4B)。Western blot检测结果显示,Sirt3敲减后凋亡蛋白Bax、Cleaved-caspase3显著增加(P < 0.01,图 4C)。提示敲减Sirt3会增加U87细胞凋亡。
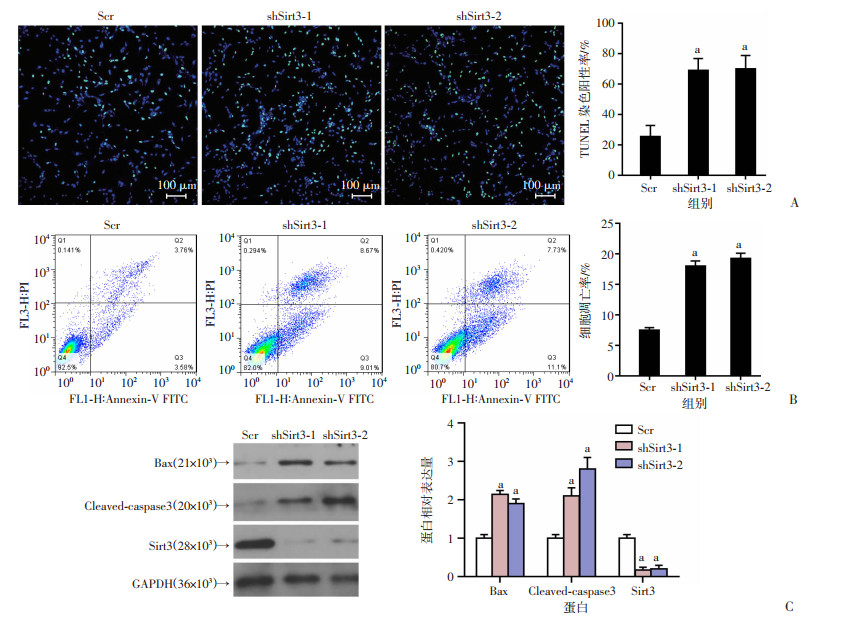
|
|
Scr:对照组;shSirt3-1、shSirt3-2:Sirt3敲减组;a:P < 0.01,与对照组比较 A:TUNEL染色观测敲减Sirt3前后U87细胞凋亡情况及比例变化;B:流式细胞术分析敲减Sirt3后U87细胞凋亡情况及比例变化;C:Western blot检测Sirt3敲减后U87细胞凋亡蛋白的表达及半定量分析 图 4 胶质瘤细胞U87中敲减Sirt3诱导细胞凋亡 |
2.5 胶质瘤细胞U87中敲减(除)Sirt3导致溶酶体功能异常
溶酶体具有重要的生物学功能,不仅在延长细胞寿命中有作用,还参与调控细胞凋亡过程。因此,进一步探究Sirt3在调控胶质瘤细胞溶酶体中的作用。结果显示,敲减Sirt3后溶酶体膜蛋白LAMP1和LAMP2A显著降低(P < 0.01,图 5A)。利用Sirt3敲除细胞系进行Western blot验证,结果显示敲除Sirt3也会导致LAMP1、LAMP2、LAMP2A蛋白水平显著下调(P < 0.01,图 5B)。进一步利用Lysotracker染色体系分析溶酶体的数量变化,与Scr组相比,Sirt3敲除组荧光强度明显降低(P < 0.01,图 5C)。最后在Sirt3敲除组中转入Sirt3外源过表达质粒(pLVX-Sirt3),利用Western blot和Lysotracker染色分别检测溶酶体膜蛋白LAMPs和数目的变化,发现LAMP1、LAMP2的蛋白质水平能够恢复(P < 0.01,图 5D),同时溶酶体的数量也显著增加(P < 0.01,图 5E)。证明Sirt3可能在调控胶质瘤溶酶体数量中发挥重要作用。

|
|
Scr:对照组;shSirt3-1、shSirt3-2:Sirt3敲减组;WT:空白对照组;Sirt3 KO:Sirt3敲除组;a:P < 0.01, 与对照组比较;b:P < 0.01, 与Sirt3敲除组比较 A:Western blot检测Sirt3敲减后U87细胞溶酶体膜蛋白LAMP1、LAMP2A的表达;B:Western blot检测Sirt3敲除后U87细胞溶酶体膜蛋白LAMP1、LAMP2、LAMP2A的表达;C:Lysotracker探针染色分析U87细胞溶酶体数量变化;D:Western blot检测在敲除Sirt3的U87细胞中过表达Sirt3后LAMP1、LAMP2蛋白表达Scr:对照组;shSirt3-1、shSirt3-2:Sirt3敲减组;WT:空白对照组;Sirt3 KO:Sirt3敲除组;a:P < 0.01, 与对照组比较;b:P < 0.01, 与Sirt3敲除组比较 E:Lysotracker染色分析外源过表达Sirt3后细胞溶酶体的数量变化1: WT; 2: Sirt3 KO; 3: WT+pLVX-Sirt3 图 5 胶质瘤细胞U87中敲减(除)Sirt3导致溶酶体功能异常 |
2.6 胶质瘤细胞U87中敲减Sirt3通过mTOR通路诱导细胞凋亡
mTOR信号通路是调控细胞凋亡、自噬的重要通路,在细胞代谢中发挥重要的作用。通过Western blot检测发现,与对照组相比,敲减Sirt3后p-mTOR、p-TFEB蛋白显著上调(P < 0.01,图 6A)。为探究Sirt3敲减所导致的细胞凋亡增加是否依赖于mTOR通路,将mTOR通路抑制剂雷帕霉素(Rapamycin)加入Sirt3敲减的U87细胞中,通过流式细胞术分析发现细胞凋亡比例明显减少(P < 0.01,图 6B)。进一步说明敲减Sirt3后U87细胞凋亡增加是由mTOR激活导致。
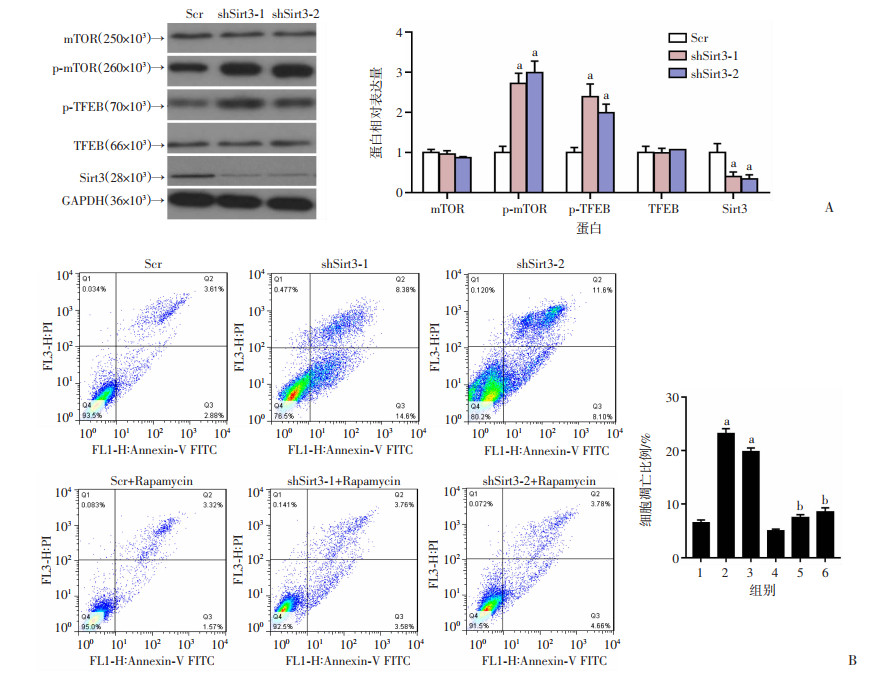
|
|
Scr:对照组;shSirt3-1、shSirt3-2:Sirt3敲减组;a:P < 0.01,与对照组比较;b:P < 0.01,与Sirt3敲减组比较 A:Western blot检测敲减Sirt3后U87细胞Sirt3、mTOR、p-mTOR、TFEB及p-TFEB蛋白表达的变化;B:流式细胞术分析敲减Sirt3的U87细胞经Rapamycin处理后细胞凋亡比例的变化1:Scr;2:shSirt3-1;3:shSirt3-2;4:Scr+Rapamycin; 5: shSirt3-1+Rapamycin; 6: shSirt3-2+Rapamycin 图 6 胶质瘤细胞U87中敲减Sirt3通过mTOR通路诱导细胞凋亡 |
2.7 胶质瘤细胞U87中干预Sirt3表达通过mTOR通路影响LAMPs
TFEB是溶酶体蛋白LAMPs的主要调控因子,可被mTOR激酶磷酸化。因此,进一步探究Sirt3在调节细胞凋亡和LAMPs蛋白水平的潜在机制。利用敲除Sirt3的U87细胞进行核质分离实验,通过Western blot检测发现,与对照组相比,敲除Sirt3会导致溶酶体膜蛋白LAMP2A表达显著减少,但细胞质中p-TFEB表达显著增加(P < 0.01,图 7A)。此外,利用Rapamycin处理Sirt3敲减的U87细胞,Western blot检测发现,LAMPs蛋白水平显著升高(P < 0.01,图 7B)。与对照组相比,在敲减Sirt3的U87细胞中外源过表达TFEB后LAMPs蛋白明显上调(P < 0.01,图 7C)。以上结果均证明Sirt3可能通过调节mTOR通路,影响TFEB的磷酸化状态及核质分布,进而下调LAMPs蛋白表达。
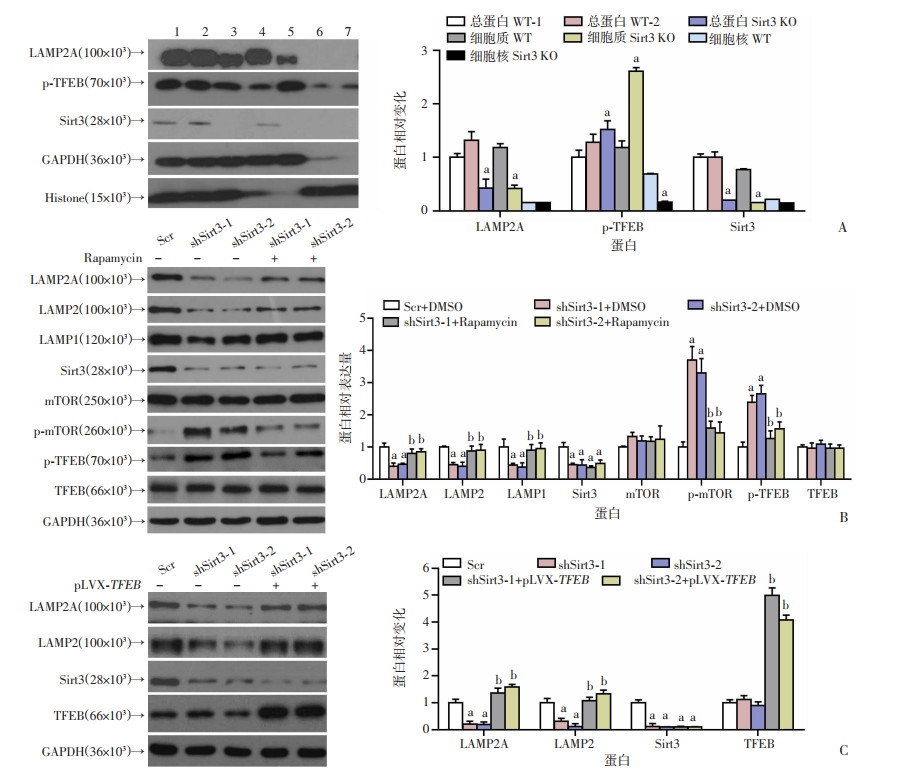
|
|
Scr:对照组;shSirt3-1、shSirt3-2:Sirt3敲减组;WT:空白对照组;Sirt3 KO:Sirt3敲除组;a:P < 0.01, 与对应对照组比较;b:P < 0.01, 与Sirt3敲减组比较 A:Western blot检测Sirt3敲除前后核质分离的U87细胞LAMP2A、Sirt3、p-TFEB蛋白表达1: 总蛋白WT-1; 2: 总蛋白WT-2; 3:总蛋白Sirt3 KO; 4: 细胞质WT; 5:细胞质Sirt3 KO; 6:细胞核WT; 7:细胞核Sirt3 KO; GAPDH代表胞浆蛋白组分;Histone代表胞核蛋白组分;B:Western blot检测Rapamycin处理敲减Sirt3的U87细胞LAMP1、LAMP2、LAMP2A、Sirt3、mTOR、p-mTOR、TFEB、p-TFEB蛋白表达;C:Western blot检测过表达TFEB敲减Sirt3的U87细胞LAMP2A、LAMP2、TFEB蛋白表达 图 7 胶质瘤细胞U87中敲除(减)Sirt3下调LAMPs依赖mTOR途径 |
3 讨论
经标准化的替莫唑胺化疗结合放射治疗后,胶质瘤患者的预后仍较差,且容易复发,5年生存率极低[22]。因此,筛选和探究新的干预靶点对制定新的治疗策略和改善患者预后具有重要意义。Sirt3是线粒体中重要的去乙酰化酶,在肿瘤发生发展中具有双重调节作用[23]。最近的一项研究表明,Sirt3通过阻断上皮-间质转化过程抑制胆囊癌的发展[24]。本研究结果显示,Sirt3在胶质瘤组织中异常高表达,且与患者生存率呈负相关,提示Sirt3在胶质瘤进程中发挥促进作用,是胶质瘤发生的驱动因素。因此,本研究聚焦探讨Sirt3在胶质瘤发生发展中的作用机制,旨在为胶质瘤的临床诊治提供理论和实验依据。
mTOR信号通路在哺乳动物生命活动中有重要的作用,细胞内外多种信号通路上的生长因子、激素、应激和能量转化代谢等因素通过激活mTOR,调控细胞生长、增殖、凋亡等生理过程[25]。其活性一旦异常就会导致细胞代谢和增殖状态高度活跃,从而导致肿瘤的发生[26]。溶酶体是细胞中调控分解代谢的重要细胞器,参与体内大分子、细胞器循环利用及细胞凋亡等关键生物学过程[27-28]。正常情况下,细胞内的溶酶体数目是恒定的,一旦出现异常可能会导致细胞清除能力障碍,诱发细胞凋亡甚至死亡[29]。LAMP1、LAMP2和LAMP2A是溶酶体上重要的膜蛋白,高度糖基化修饰能增加其稳定性[30]。TFEB是溶酶体生物发生的主要调节因子[31],与溶酶体膜上的生长调节蛋白mTOR复合物1(mTORC1)共定位,且mTORC1能使TFEB发生磷酸化,进而抑制TFEB核转位过程[32]。
Sirt3主要位于线粒体,可对靶蛋白进行去乙酰化并增强其活性,进而调控多种生物学过程。乙酰化修饰是一种主要发生在蛋白质赖氨酸残基上的可逆性化学修饰。发生在线粒体上会导致线粒体上多个代谢酶活性降低,严重影响线粒体功能的维持。Sirt3是调控线粒体蛋白翻译后修饰的重要调节因子,能有效调控超氧化物歧化酶2(superoxide dismutase 2, SOD2)、乙酰辅酶A合成酶等线粒体蛋白乙酰化修饰,从而降低细胞内能量代谢水平及活性氧(ROS)水平。ROS作为第二信使分子,可以参与mTOR等的信号级联反应,进而调控细胞增殖、凋亡等重要生物学过程。近期研究表明芳樟醇通过调控Sirt3的表达调节SOD2的活性,进而诱导ROS促胶质瘤细胞凋亡[33]。本研究显示,敲减Sirt3导致细胞凋亡增加,溶酶体膜蛋白LAMP明显降低,p-mTOR、胞质中p-TFEB蛋白表达上调,且外源过表达TFEB能使LAMPs蛋白水平恢复,表明敲减Sirt3后mTOR信号通路激活,从而影响TFEB的核质易位,导致LAMPs的表达下调,进而诱发细胞凋亡。因此,Sirt3可能通过调控mTOR信号通路,增强LAMPs蛋白表达,促进胶质瘤的发生发展。
总之,本研究探讨Sirt3表达水平与胶质瘤发生发展及患者生存的关系,结果表明Sirt3高表达与胶质瘤患者临床分级正相关,与患者生存负相关。敲减Sirt3会影响mTOR信号通路及p-TFEB细胞定位,最终导致胶质瘤细胞中LAMP的表达急剧减少且细胞凋亡明显增加。这些发现表明Sirt3可能是胶质瘤诊治中一个新的生物标志物,靶向Sirt3也是一种很有前景的胶质瘤治疗策略。
| [1] |
PETKOVIC M, YALÇIN M, HEESE O, et al. Differential expression of the circadian clock network correlates with tumour progression in gliomas[J]. BMC Med Genomics, 2023, 16(1): 154. DOI:10.1186/s12920-023-01585-w |
| [2] |
VERGARA Z, GOMEZ M S, DESVOYES B, et al. Distinct roles of Arabidopsis ORC1 proteins in DNA replication and heterochromatic H3K27me1 deposition[J]. Nat Commun, 2023, 14(1): 1-13. DOI:10.1038/s41467-023-37024-8 |
| [3] |
XU S C, TANG L, LI X Z, et al. Immunotherapy for glioma: current management and future application[J]. Cancer Lett, 2020, 476: 1-12. DOI:10.1016/j.canlet.2020.02.002 |
| [4] |
SHI J L, SUN S S, XING S Q, et al. Fraxinellone inhibits progression of glioblastoma via regulating the SIRT3 signaling pathway[J]. Biomedecine Pharmacother, 2022, 153(1): 113416. DOI:10.1016/j.biopha.2022.113416 |
| [5] |
XU Q C, LIU X Y, MOHSENI G, et al. Mechanism research and treatment progress of NAD pathway related molecules in tumor immune microenvironment[J]. Cancer Cell Int, 2022, 22(1): 1-21. DOI:10.1186/s12935-022-02664-1 |
| [6] |
VISINTIN R, RAY S K. Intersections of ubiquitin-proteosome system and autophagy in promoting growth of glioblastoma multiforme: challenges and opportunities[J]. Cells, 2022, 11(24): 4063. DOI:10.3390/cells11244063 |
| [7] |
ZHANG J, ZOU L, SHI D F, et al. Structure-guided design of a small-molecule activator of sirtuin-3 that modulates autophagy in triple negative breast cancer[J]. J Med Chem, 2021, 64(19): 14192-14216. DOI:10.1021/acs.jmedchem.0c02268 |
| [8] |
WANG T S, CAO Y, ZHENG Q, et al. SENP1-Sirt3 signaling controls mitochondrial protein acetylation and metabolism[J]. Mol Cell, 2019, 75(4): 823-834. e5. DOI:10.1016/j.molcel.2019.06.008 |
| [9] |
GAO G Y, CHEN W W, YAN M J, et al. Rapamycin regulates the balance between cardiomyocyte apoptosis and autophagy in chronic heart failure by inhibiting mTOR signaling[J]. Int J Mol Med, 2020, 45(1): 195-209. DOI:10.3892/ijmm.2019.4407 |
| [10] |
GUSYATINER O, HEGI M E. Glioma epigenetics: from subclassification to novel treatment options[J]. Semin Cancer Biol, 2018, 51: 50-58. DOI:10.1016/j.semcancer.2017.11.010 |
| [11] |
ZHANG H, DAI S H, YANG Y F, et al. Role of sirtuin 3 in degenerative diseases of the central nervous system[J]. Biomolecules, 2023, 13(5): 735. DOI:10.3390/biom13050735 |
| [12] |
DIKALOVA A E, PANDEY A, XIAO L, et al. Mitochondrial deacetylase Sirt3 reduces vascular dysfunction and hypertension while Sirt3 depletion in essential hypertension is linked to vascular inflammation and oxidative stress[J]. Circ Res, 2020, 126(4): 439-452. DOI:10.1161/CIRCRESAHA.119.315767 |
| [13] |
ZHAO S J, GONG J F, WANG Y, et al. Sirtuin 3 regulation: a target to alleviate β-hydroxybutyric acid-induced mitochondrial dysfunction in bovine granulosa cells[J]. J Anim Sci Biotechnol, 2023, 14(1): 18. DOI:10.1186/s40104-022-00825-w |
| [14] |
KIM T S, JIN Y B, KIM Y S, et al. SIRT3 promotes antimycobacterial defenses by coordinating mitochondrial and autophagic functions[J]. Autophagy, 2019, 15(8): 1356-1375. DOI:10.1080/15548627.2019.1582743 |
| [15] |
ONORATI A V, DYCZYNSKI M, OJHA R, et al. Targeting autophagy in cancer[J]. Cancer, 2018, 124(16): 3307-3318. DOI:10.1002/cncr.31335 |
| [16] |
RIZZOLLO F, MORE S, VANGHELUWE P, et al. The lysosome as a master regulator of iron metabolism[J]. Trends Biochem Sci, 2021, 46(12): 960-975. DOI:10.1016/j.tibs.2021.07.003 |
| [17] |
BONAM S R, WANG F J, MULLER S. Lysosomes as a therapeutic target[J]. Nat Rev Drug Discov, 2019, 18(12): 923-948. DOI:10.1038/s41573-019-0036-1 |
| [18] |
MUTVEI A P, NAGIEC M J, HAMANN J C, et al. Rap1-GTPases control mTORC1 activity by coordinating lysosome organization with amino acid availability[J]. Nat Commun, 2020, 11(1): 1416. DOI:10.1038/s41467-020-15156-5 |
| [19] |
JEONG S J, STITHAM J, EVANS T D, et al. Trehalose causes low-grade lysosomal stress to activate TFEB and the autophagy-lysosome biogenesis response[J]. Autophagy, 2021, 17(11): 3740-3752. DOI:10.1080/15548627.2021.1896906 |
| [20] |
ZHOU Y J, ZHOU X T, HUANG X J, et al. Lysosome-mediated cytotoxic autophagy contributes to tea polysaccharide-induced colon cancer cell death via mTOR-TFEB signaling[J]. J Agric Food Chem, 2021, 69(2): 686-697. DOI:10.1021/acs.jafc.0c07166 |
| [21] |
WANG Y, HUANG Y C, CHENG E, et al. LSD1 is required for euchromatic origin firing and replication timing[J]. Signal Transduct Target Ther, 2022, 7(1): 102. DOI:10.1038/s41392-022-00927-x |
| [22] |
PENG P, CHEN Z R, ZHANG X L, et al. Construction and verification of an RNA-binding protein-associated prognostic model for gliomas[J]. Curr Med Sci, 2023, 43(1): 156-165. DOI:10.1007/s11596-022-2694-1 |
| [23] |
PODYACHEVA E, TOROPOVA Y. The role of NAD+, SIRTs interactions in stimulating and counteracting carcinogenesis[J]. Int J Mol Sci, 2023, 24(9): 7925. DOI:10.3390/ijms24097925 |
| [24] |
LIU L G, LI Y, CAO D Y, et al. SIRT3 inhibits gallbladder cancer by induction of AKT-dependent ferroptosis and blockade of epithelial-mesenchymal transition[J]. Cancer Lett, 2021, 510(1): 93-104. DOI:10.1016/j.canlet.2021.04.007 |
| [25] |
LIU G Y, SABATINI D M. mTOR at the nexus of nutrition, growth, ageing and disease[J]. Nat Rev Mol Cell Biol, 2020, 21(4): 183-203. DOI:10.1038/s41580-019-0199-y |
| [26] |
LIU R, ZENG L W, GONG R, et al. mTORC1 activity regulates post-translational modifications of glycine decarboxylase to modulate glycine metabolism and tumorigenesis[J]. Nat Commun, 2021, 12(1): 4227. DOI:10.1038/s41467-021-24321-3 |
| [27] |
SAVINI M, FOLICK A, LEE Y T, et al. Lysosome lipid signalling from the periphery to neurons regulates longevity[J]. Nat Cell Biol, 2022, 24(6): 906-916. DOI:10.1038/s41556-022-00926-8 |
| [28] |
MAHAPATRA K K, MISHRA S R, BEHERA B P, et al. The lysosome as an imperative regulator of autophagy and cell death[J]. Cell Mol Life Sci, 2021, 78(23): 7435-7449. DOI:10.1007/s00018-021-03988-3 |
| [29] |
朱圣宇, 任超, 姚人骐, 等. 溶酶体损伤与细胞死亡: 疾病治疗新靶点[J]. 生理科学进展, 2021, 52(2): 111-116. ZHU S Y, REN C, YAO R Q, et al. Lysosomal injury and cell death: a new target for disease treatment[J]. Prog Physiol Sci, 2021, 52(2): 111-116. DOI:10.3969/j.issn.0559-7765.2021.02.008 |
| [30] |
SUDHAKAR J N, LU H H, CHIANG H Y, et al. Lumenal Galectin-9-Lamp2 interaction regulates lysosome and autophagy to prevent pathogenesis in the intestine and pancreas[J]. Nat Commun, 2020, 11(1): 4286. DOI:10.1038/s41467-020-18102-7 |
| [31] |
WANG S G, NI H M, CHAO X J, et al. Impaired TFEB-mediated lysosomal biogenesis promotes the development of pancreatitis in mice and is associated with human pancreatitis[J]. Autophagy, 2019, 15(11): 1954-1969. DOI:10.1080/15548627.2019.1596486 |
| [32] |
QIAO X B, ZHANG Y X, ZHANG Z, et al. KCNJ15 deficiency promotes drug resistance via affecting the function of lysosomes[J]. Asian J Pharm Sci, 2023, 18(3): 100814. DOI:10.1016/j.ajps.2023.100814 |
| [33] |
WANG S Q, YANG J Y, LIN T T, et al. Excessive production of mitochondrion-derived reactive oxygen species induced by titanium ions leads to autophagic cell death of osteoblasts via the SIRT3/SOD2 pathway[J]. Mol Med Rep, 2020, 22(1): 257-264. DOI:10.3892/mmr.2020.11094 |




