2. 400038 重庆,陆军军医大学(第三军医大学):基础医学院神经生物学教研室;
3. 401120 重庆,重庆医科大学附属第三医院心血管疾病中心
2. Department of Neurobiology, College of Basic Medical Sciences, Army Medical University (Third Military Medical University), Chongqing, 400038;
3. Cardiovascular Disease Center, the Third Affiliated Hospital of Chongqing Medical University, Chongqing, 401120, China
房颤是临床上最常见的心律失常之一,有着高发病率和高病死率[1]。房颤的患病率随年龄增长而增加,在一般人群中约为3%,在80~89岁的人群中可达9%,随着世界人口老龄化,房颤已成为21世纪心血管流行病之一[2]。房颤的发病机制尚未完全明确,目前研究表明,房颤的发生机制主要包括心房“结构重构”和“电重构”,但是影响心房“结构重构”和“电重构”的具体分子机制仍不清楚,针对性的房颤预防和有效的治疗方法仍有待探索。
MEMCZAK等[3]发现了人类基因组中存在超过2 000种环状RNA(circular RNA,circRNA),作为一种不受RNA外切酶影响的封闭环状非编码RNA,它所具有的高丰度、高特异性、高稳定性和高保守性使其成为免疫系统疾病、肿瘤等的新型诊断标志物和热门治疗靶点,在医学各个领域中有着巨大的应用前景[4]。近来有研究表明,circRNA通过竞争性结合miRNA调控下游靶基因翻译表达,参与了许多心血管疾病的发生发展,如动脉粥样硬化、心力衰竭、心肌肥大以及房颤等[5]。本课题组前期研究已发现环状RNA hsa_circ_0099734(小鼠同源mmu_circ_0005019)在房颤患者和对照的心房组织中的表达存在显著差异[6],但其在房颤中的具体作用,尤其是在心房“电重构”中的作用还远未阐明。
离子通道相关基因表达和通道功能改变在心房“电重构”中起重要作用。在经典的心房电重构和房颤动物模型中,均发现了去极化L型钙离子电流(ICa)的减少,复极化钾电流(IK1)、乙酰胆碱依赖钾电流(IK,Ach)、超速激活延迟整流电流(IKur)的增加,以及钙超载、钙传导异常和肌浆网钙离子泄漏等离子通道电流的变化。这些离子通道电流的变化导致了心肌细胞动作电位中延迟后除极的增加、病理性动作电位时程(action potential duration,APD)和有效不应期(effective refractory period,ERP)的缩短与折返,而缩短的APD和ERP又进一步促进了房颤的发生和维持[7]。小电导钙激活钾通道分布在可兴奋细胞中,在神经系统和心肌中有SK1、SK2、SK3 3个亚型,具有钾离子选择、钙离子浓度敏感的特性。动作电位激发后细胞内钙离子浓度增加,使得SK通道被激活,产生IK,Ca,参与细胞动作电位复极化。本课题组前期发现的环状RNA hsa_circ_0099734(小鼠同源mmu_circ_ 0005019)能否通过促进Kcnn3的表达,增强其编码的SK3通道蛋白功能,从而影响心房电重构,尚有待研究。
本研究拟针对环状RNA hsa_circ_0099734的小鼠同源circRNA mmu_circ_0005019开展相关研究,探索其能否通过影响Kcnn3的表达从而参与心房的电重构。本研究拟通过构建细胞模型,观察mmu_circ_0005019对Kcnn3的表达水平、IK,Ca和APD等电生理特性的影响,从而进一步理解hsa_circ_0099734及其小鼠同源circRNA mmu_circ_0005019在房颤中的作用。
1 材料与方法 1.1 材料与试剂HL-1细胞来自AT-1小鼠心房肌细胞永生化细胞系,能够持续分裂和自发收缩,同时保持分化的心肌细胞表型,包括形态学、生化和电生理学特性,因此本研究选用HL-1细胞系。HL-1细胞购于康朗生物科技有限公司(中国上海)。TRIzolTM、转染试剂Lipofectamine2000购于Thermo Scientific公司;Opti-MEMTM培养基、胎牛血清(FBS)购于Gibco公司;DMEM高糖培养基、青霉素-链霉素溶液购于HyClone公司;氯仿、异丙醇以及无水乙醇购于成都科龙公司;RT-qPCR试剂购于TaKaRa公司;Kcnn3和钠钾ATP酶(Na, K-ATPase)一抗抗体购于Abcam公司;二抗抗体购于Abclonal;膜蛋白提取试剂盒购于Abmart;BCA蛋白浓度测定试剂盒和SDS-PAGE电泳液、PBS、EDTA购于碧云天;聚偏二氟乙烯膜(PVDF)购于Bio-Rad,PAGE彩胶快速配成试剂盒购于米鼠生物;超敏发光液(Super ECL Plus)购于葆光生物;实验所用MgATP、Na2GTP、N-methylglucamine、KCl、Hepes、K-gluconate、EGTA、CaCl2、NaH2PO4、Aspartic Acid均购于Sigma公司,蜂毒明肽购于Aladdin公司,葡萄糖、MgCl2购于Macklin公司、磷酸肌酸钠(Na2CP)购于Acmec公司,去甲肾上腺素购于Solarbio公司。
1.2 方法 1.2.1 细胞培养HL-1细胞在高糖完全培养基中培养,培养基中混合10%的胎牛血清以及1%的青霉素-链霉素双抗溶液。细胞孵箱提供温度为37℃,混合5% CO2的无菌环境。细胞在10 cm的培养皿中生长,当达到100%融合时按照1 ∶3传代,防止细胞分化。
1.2.2 构建环状RNAmmu_circ_0005019过表达和干扰细胞模型通过化学合成的方法合成mmu_circ_ 0005019 cDNA序列,将合成后的序列构建到pcDNA3.1质粒中,形成pcDNA3.1-mmu_circ_0005019过表达载体。过表达载体构建完成后,通过Sanger测序比对序列,与目标序列一致。分别转染pcDNA3.1-mmu_circ_0005019过表达载体和pcDNA3.1空质粒载体以构建mmu_circ_0005019过表达组(overexpression,OE)和空质粒组(empty vector,EV),经RT-qPCR检测,过表达组的mmu_circ_0005019表达量相较于空质粒组显著上升,提示过表达载体构建成功。构建针对mmu_circ_0005019的小干扰RNA(small interfering RNA,siRNA)以及阴性对照(negative control,NC),siRNA和NC均由吉玛公司(中国上海)设计合成,分别转染si-1、si-3、NC构建干扰1组、干扰2组和对照组。细胞在6孔板培养24 h后达到50%~70%融合,用Lipofectamine2000转染HL-1细胞,加入质粒2 μg/孔、siRNA 100pmol/孔,同时转染空质粒和NC作为对照。提取转染48 h后的细胞总RNA,采用RT-qPCR检测mmu_circ_0005019和Kcnn3的表达量。使用转染48~72 h内的细胞进行电生理检测。本实验siRNA的序列见表 1。
| siRNA | 序列(5′→3′) |
| si-1 | GCCGGCAUUUACCGUCGAATT |
| si-3 | CCGGCAUUUACCGUCGAACTT |
| NC | UUCUCCGAACGUGUCACGUTT |
1.2.3 Real-time PCR检测
用TRIzol法提取转染了过表达载体和siRNA细胞的总RNA,使用TaKaRa试剂将其逆转录为cDNA,以cDNA为模板进行Real-time PCR扩增,检测目的基因mRNA的表达。将实验每组设置3个复孔,目的基因mRNA的表达运用2-ΔΔCt法计算,内参基因为β-actin。引物序列如表 2。
| 基因 | 序列(5′→3′) |
| Kcnn3 | 上游: GGGTGGTATTAGGTTTGGG |
| 下游: GGGCGGCTCTCTTTTATT | |
| β-actin | 上游: GTGCTATGTTGCTCTAGACTTCG |
| 下游: ATGCCACAGGATTCCATACC |
1.2.4 Western blot检测
在1 mL的细胞质蛋白和膜蛋白缓冲液中加入10 μL蛋白酶抑制剂,依次以2 mL/107细胞比例加入胞浆蛋白缓冲液和0.2 mL/107细胞比例加入膜蛋白缓冲液进行细胞膜蛋白的提取,用BCA法进行蛋白浓度测定。以每孔40 μg的蛋白量上样,以SDS-PAGE凝胶恒压(80 V,20 min和120 V,50 min)条件下电泳,电泳后恒流(300 mA,90 min)转膜,常温条件下封闭液(2.5 g奶粉溶于50 mL PBST) 中封闭1 h,Kcnn3(1 ∶1 000)和Na, K-ATPase(1 ∶1 000) 一抗4 ℃孵育过夜,PBST洗膜3次(10 min/次),二抗(1 ∶10 000) 常温孵育1 h,PBST洗膜3次(10 min/次),ECL法进行显影,用Image lab进行结果分析。
1.2.5 全细胞小电导钙激活钾通道电流记录用1 mL 0.05%胰酶/EDTA溶液消化10 mm培养皿中100%融合的细胞,离心后加2 mL高糖完全培养基稀释再种植在细胞爬片上,待细胞贴壁尚未形成融合即进行IK,Ca记录。
记录IK,Ca的电极外液:N-methylglucamine 140 mmol/L,KCl 4 mmol/L,MgCl2 1 mmol/L,葡萄糖5 mmol/L,HEPES 10 mmol/L,HCl调pH至7.4。电极内液:K-gluconate 144 mmol/L,MgCl2 1.15 mmol/L,EGTA 5 mmol/L,HEPES 10 mmol/L,加入CaCl2至游离钙离子浓度为300 nmol/L,CaCl2浓度由WEBMAXC STANDARD计算得来(https://somapp.ucdmc.ucdavis.edu/pharmacology/bers/maxchelator/webmaxc/webmaxcS.htm),KOH调pH至7.2。
将细胞爬片平放在倒置显微镜(OlympusIX71,日本)上的细胞池中,加入1.5 mL细胞外液并以1.5 mL/min灌流。玻璃微电极由电极拉制仪器(Brown-FlamingP-97,美国)分两步拉制,充灌电极内液后电阻为6~8 Ω,固定于推进器上通过MC2000控制器和MX7600(Siskiyou,美国)微操纵器保持。使用Digidata1440数据采集系统(Molecular Device,美国)记录5 kHz低通滤波的电流。电流信号通过Ag/AgCl电极引导,经由AxonPatch200B放大器通过AD/DA转换板存储于计算机中。使用pClamp10.7软件发放刺激和采集信号,并记录数据和转换图形。由Clampfit软件对数据进行曲线拟合以及图形绘制。
挑选杆状、横纹清晰、形态饱满的细胞,采用全细胞记录膜片钳技术,记录模式为电压钳,电极顶端轻压在细胞表面,用负压使电极与细胞表面形成高阻封接,负压破膜并给电容及串联电阻补偿形成全细胞记录状态,将细胞钳制在-70 mV,给予指令电位从-100~+80 mV,步长20 mV,波宽为500 ms的刺激。记录到稳定电流后,用添加蜂毒明肽的电极外液灌流细胞池3~6 min后再次记录,灌流速度为1.5 mL/min,药物浓度为100 nmol/L。将给药前后的电流相减获得蜂毒明肽敏感性电流,此电流即IK,Ca。记录细胞电容,电流密度(pA/pF)=电流(pA)/电容(pF)。实验温度在28~30 ℃。
1.2.6 动作电位时程记录记录APD所使用的HL-1细胞培养基在原配制基础上加入0.1 mmol/L去甲肾上腺素、2 mmol/L谷氨酰胺,细胞接种到由明胶/纤连蛋白包裹的培养皿中,当细胞达到60%~80%融合时进行APD记录。
记录APD的电极外液:NaCl 138 mmol/L,KCl 4 mmol/L,MgCl2 1 mmol/L,CaCl2 2 mmol/L,Na2H2PO4 0.33 mmol/L,葡萄糖10 mmol/L,HEPES 10 mmol/L,NaOH调pH至7.4。电极内液:Aspartic Acid 120 mmol/L,KCl 20 mmol/L,MgATP 1 mmol/L,CaCl2 0.2 mmol/L,EGTA 5 mmol/L,HEPES 10 mmol/L,Na2CP 3 mmol/L,KOH调pH至7.2。
挑选细胞融合度适中的细胞团块中饱满、与周围细胞联接较好的细胞,采用全细胞记录膜片钳技术,记录模式为电流钳。给予波长为2 ms、波幅为1nA、频率为1Hz的电流,刺激细胞产生动作电位。计算复极化50%和90%时的动作电位时程,即APD50、APD90。实验温度在30~32 ℃。
1.2.7 蜂毒明肽和钙离子浓度的设定由于SK通道3种亚型对蜂毒明肽的敏感性不同,蜂毒明肽阻断SK1(人类)的半数抑制浓度为0.7~100.0 nmol/L,对SK2(人类、大鼠、小鼠)的半数抑制浓度为27~ 140 pmol/L、对SK3的半数抑制浓度为0.63~19.00 nmol/L。过高浓度的蜂毒明肽会对细胞造成损伤,且研究内容主要是针对房颤Kcnn3所编码的SK3通道电流改变,SK1通道参与房颤的可能尚未报道,因此本实验将蜂毒明肽的浓度设定为100 nmol/L,主要对SK2和SK3通道进行阻断。由于SK2通道在本研究中不受影响,因此IK,Ca变化即为SK3通道电流变化。
SK通道作为一个钙离子依赖的离子通道,只有当钙离子浓度足够时才可以产生IK,Ca,本研究中将钙离子浓度设定为300 nmol/L,既能激活SK通道,又不至于钙超载而干扰细胞正常的生理活动[8]。
1.2.8 记录小电导钙激活钾通道电流的电压钳模式设置为了记录细胞中的IK,Ca,将细胞钳制在-70 mV,使细胞中的瞬时外向钾电流失活。将细胞从-100 mV钳制到0 mV是对细胞进行电位去极化,激活钙离子电流并启动细胞内肌浆网对钙离子的释放,然后将细胞钳制至+80 mV以增加钾离子的驱动力,同时也减小了钙离子电流的驱动力。而且细胞外液中不存在钠离子和钙离子,在这个过程中可以记录到非时间依赖性的内向整流钾电流,在减去使用蜂毒明肽对IK,Ca进行特异性阻断记录到的非时间依赖性内向整流钾电流后,得到实验所需要的IK,Ca[8]。
1.3 统计学分析所有实验至少重复3次,数据均服从正态分布,以x±s表示,2组间比较采用独立样本t检验,3组间比较采用单因素方差分析,以P < 0.05为差异有统计学意义。
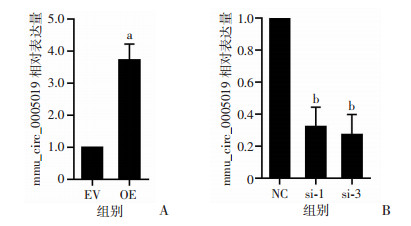
2 结果 2.1 环状RNA mmu_circ_0005019过表达和干扰心肌细胞模型的构建获得环状RNAmmu_circ_0005019过表达和干扰的HL-1心肌细胞模型后,通过RT-qPCR检测mmu_circ_0005019的表达水平。mmu_circ_0005019过表达细胞中circRNA水平显著高于对照组(P < 0.05,图 1A)。mmu_circ_0005019干扰细胞中circRNA水平显著低于对照组(P < 0.05,图 1B)。
|
|
a: P < 0.05,与EV组比较;b: P < 0.05,与NC组比较
A: RT-qPCR检测mmu_circ_0005019过表达后circRNA的表达; B: RT-qPCR检测mmu_circ_0005019敲减后circRNA的表达 图 1 mmu_circ_0005019过表达和干扰心肌细胞模型构建 |
2.2 Mmu_circ_0005019促进Kcnn3表达
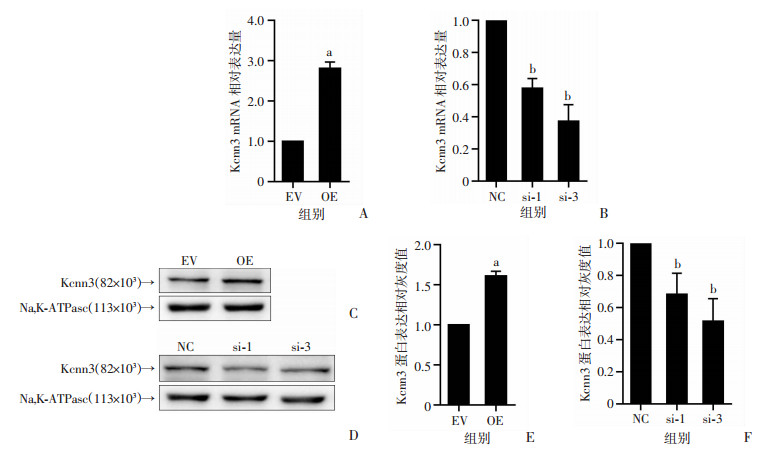
在mmu_circ_0005019过表达和干扰的HL-1心肌细胞模型中,通过RT-qPCR检测Kcnn3的表达水平,Western blot检测细胞膜上Kcnn3编码的通道蛋白表达水平。mmu_circ_0005019过表达细胞中Kcnn3的mRNA和蛋白表达水平显著高于对照组(P < 0.05,图 2)。mmu_circ_0005019干扰细胞中Kcnn3的mRNA和蛋白表达水平显著低于对照组(P < 0.05,图 2)。结果表明,mmu_circ_0005019可能通过促进Kcnn3表达进而影响心肌细胞的功能特性。
|
|
a: P < 0.05, 与EV组比较;b: P < 0.05,与NC组比较
A: RT-qPCR检测mmu_circ_0005019过表达后Kcnn3的mRNA表达水平; B: RT-qPCR检测mmu_circ_0005019敲减后Kcnn3的mRNA表达水平; C、D: Kcnn3蛋白表达水平; E、F:Kcnn3蛋白表达相对灰度值的量化分析 图 2 mmu_circ_0005019对HL-1心肌细胞Kcnn3表达水平的影响 |
2.3 Mmu_circ_0005019增强HL-1细胞的小电导钙激活钾通道电流
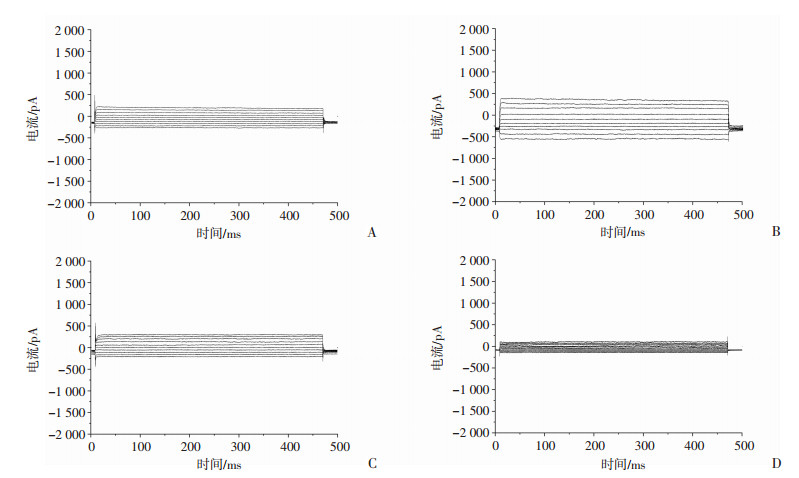
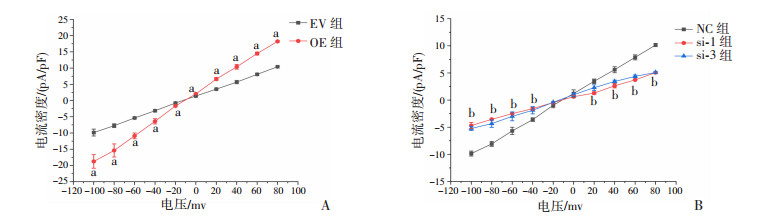
在过表达mmu_circ_0005019的HL-1细胞模型中,用膜片钳检测IK,Ca,电流图形呈现明显的增宽,提示IK,Ca相比空质粒组显著增加,过表达mmu_circ_0005019对IK,Ca有促进的作用;在干扰mmu_circ_0005019的HL-1细胞模型中得到的IK,Ca电流图形呈现明显的压缩,提示IK,Ca比对照组显著减小,干扰mmu_circ_0005019对IK,Ca有抑制作用(图 3)。由于每个细胞表面积和体积存在一定的差异,通过计算细胞IK,Ca的电流密度来比较IK,Ca,电流密度(pA/pF)=电流(pA)/电容(pF),计算得到-100~80 mV的IK,Ca电流密度数值如表 3、4所示。绘制每个电压对应下细胞的电流密度,即电流密度-电压(Ⅰ-Ⅴ)关系曲线。过表达mmu_circ_0005019后电流密度显著增加,干扰mmu_circ_0005019后IK,Ca电流密度显著减小(P < 0.05,图 4)。结果表明,mmu_circ_0005019促进Kcnn3表达后通过增强SK3通道功能产生更大的IK,Ca进而影响心肌细胞电活动。
|
| A: 空质粒组IK,Ca; B: 过表达组IK,Ca; C: 对照组IK,Ca; D: 干扰组IK,Ca 图 3 mmu_circ_0005019对HL-1心肌细胞IK,Ca电流图形的影响 |
| 电压/(mV) | EV组 | OE组 | P值 |
| -100 | -9.86±1.07 | -18.76±2.10 | 0.003 |
| -80 | -7.75±0.58 | -15.38±2.03 | 0.003 |
| -60 | -5.37±0.04 | -10.89±0.89 | < 0.001 |
| -40 | -3.14±0.30 | -6.40±0.81 | 0.003 |
| -20 | -0.76±0.24 | -1.65±0.27 | 0.013 |
| 0 | 1.41±0.22 | 2.05±0.14 | 0.013 |
| 20 | 3.53±0.28 | 6.64±0.46 | 0.001 |
| 40 | 5.69±0.49 | 10.40±0.72 | 0.001 |
| 60 | 8.08±0.29 | 14.49±0.46 | < 0.001 |
| 80 | 10.42±0.01 | 18.22±0.30 | < 0.001 |
| 电压/(mV) | NC组 | si-1组 | P值 | si-3组 | P值 |
| -100 | -9.85±0.46 | -5.23±0.39 | < 0.001 | -4.69±0.57 | < 0.001 |
| -80 | -8.08±0.45 | -4.34±0.68 | < 0.001 | -3.55±0.17 | < 0.001 |
| -60 | -5.68±0.67 | -3.00±0.82 | 0.003 | -2.49±0.08 | 0.001 |
| -40 | -3.60±0.33 | -1.87±0.67 | 0.006 | -1.58±0.26 | 0.003 |
| -20 | -0.95±0.47 | -0.42±0.09 | 0.113 | -0.45±0.16 | 0.140 |
| 0 | 1.22±0.67 | 1.00±0.29 | 0.787 | 0.63±0.22 | 0.252 |
| 20 | 3.47±0.41 | 2.29±0.53 | 0.023 | 1.29±0.25 | 0.001 |
| 40 | 5.60±0.56 | 3.43±0.25 | 0.001 | 2.63±0.39 | < 0.001 |
| 60 | 7.88±0.47 | 4.37±0.26 | < 0.001 | 3.72±0.05 | < 0.001 |
| 80 | 10.15±0.29 | 5.09±0.19 | < 0.001 | 5.07±0.12 | < 0.001 |
|
|
a: P < 0.05,与EV组比较; b: P < 0.05, 与NC组比较
A: 过表达mmu_circ_0005019 IK,Ca电流密度增加;B: 干扰mmu_circ_0005019 IK,Ca电流密度减小 图 4 HL-1细胞mmu_circ_0005019稳定过表达和干扰后IK,Ca电流密度-电压(I-V)关系曲线 |
2.4 Mmu_circ_0005019缩短HL-1细胞的动作电位时程
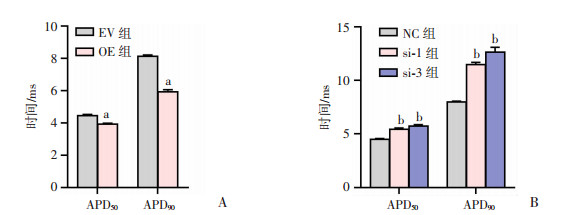
在mmu_circ_0005019过表达和干扰的HL-1细胞模型中,用膜片钳的电流钳模式检测、记录细胞的动作电位时程。在mmu_circ_0005019作用下,动作电位的形状发生变化,记录得到过表达组的APD50为(3.92±0.05)ms,对比空质粒组的APD50[(4.45±0.06)ms]显著缩短;记录得到过表达组的APD90为(5.92±0.11)ms,对比空质粒组的APD90[(8.13±0.06)ms]显著缩短(P < 0.05,图 5、6)。记录得到si-1组的APD50为(5.44±0.10)ms,si-3组的APD50为(5.75±0.10)ms,与NC组的APD50[(4.50±0.06)ms] 相比显著延长;记录得到si-1组的APD90为(11.48±0.17)ms,si-3组的APD90为(12.63±0.37)ms,与NC组的APD90[(8.00±0.05)ms]相比显著延长(P < 0.05,图 5、6)。结果表明,mmu_circ_0005019可能通过加快心肌细胞动作电位中的复极化缩短动作电位时程,从而促使心肌细胞具备触发和维持房颤的电重构生理基础。

|
| A: 空质粒组;B: 过表达组;C: 对照组;D: 干扰组 图 5 mmu_circ_0005019对HL-1心肌细胞动作电位的影响 |
|
|
a: P < 0.05,与EV组比较;b: P < 0.05,与NC组比较
A: 过表达mmu_circ_0005019记录复极化50%和90%的动作电位时程分别记录为APD50和APD90;B: 干扰mmu_circ_0005019记录得到APD50和APD90 图 6 mmu_circ_0005019对HL-1细胞动作电位时程的影响 |
3 讨论
本研究发现hsa_circ_0099734的小鼠同源环状RNA mmu_circ_0005019可以影响Kcnn3的表达并影响心肌细胞的电生理特性。过表达mmu_circ_0005019使IK,Ca电流密度显著增加,APD50、APD90显著缩短;干扰mmu_circ_0005019使IK,Ca电流密度显著减小,APD50、APD90显著延长。
房颤发生和维持机制包括结构重构和电重构,电重构主要表现为窦性心律被异常起搏代替,心房肌APD以及ERP缩短[9],而缩短的心房肌APD和ERP加快了动作电位的再入,促进了房颤的发生和发展。SK通道是钙离子激活钾电流通道家族中唯一在心肌细胞膜上表达,对心脏电生理活动和心脏动作电位形态产生影响的钙离子激活钾电流通道[10]。有研究表明,在持续性房颤患者的心房肌组织中,SK电流密度增加[11]。此外,过表达SK3小鼠模型的心房肌细胞APD显著缩短,发生房性心律失常的概率增加,但在野生型小鼠中无法成功诱导[12]。因此,本研究发现mmu_circ_0005019过表达可促进小鼠心肌细胞SK3通道的编码基因Kcnn3表达,进而使IK,Ca电流密度增加、APD缩短,提示其在房颤的发生中可能起到了促进作用。
CircRNA不易降解且表达稳定,在体内分布广泛且具有组织特异性,在基因的表达调控中发挥重要作用。目前已发现circRNA在多种心血管疾病的发生、发展中起着重要作用。有研究发现mmu_circRNA_000203可消除miR-26b-5p在心脏成纤维细胞中的抗纤维化作用,促进Gata4表达而加重心肌肥大[13]。circNlgn通过上调Gadd45b、Sema4C和RAD50并激活p38和pJNK从而促进心脏纤维化,而沉默circNlgn能够降低阿霉素对心脏细胞活性的影响,抑制阿霉素诱导的心肌纤维化相关分子表达[14]。circRNA MFACR可通过吸附miR-652-3p而下调MTP18的表达,从而抑制心肌梗死后的心肌细胞凋亡;将circRNA HRCR的腺病毒载体注射到异丙肾上腺素诱导的心肌肥厚小鼠体内,可以减弱心肌肥厚,改善心脏功能[5]。目前circRNA对电生理方面的影响较少报道,过表达hsa_circNFXL1_009可以促进人肺动脉平滑肌细胞全细胞钾电流增加,被认为是肺动脉高压的潜在治疗靶点[15]。
由于circRNA的稳定性、保守性和在体液中的高丰度,circRNAs被认为是包括心血管疾病在内的多种疾病的潜在生物标志物[16]。通过对冠心病患者外周血检测,确定hsa_circ_0124644可作为诊断冠心病的生物标志物;hsa_circ_0062960在心力衰竭(heart failure,HF)患者血浆中的表达水平显著高于对照,被认为是潜在的诊断生物标志物[17]。对高血压患者血浆circRNA表达谱进行生物信息学分析,发现hsa_circ_0005870、hsa-circ-0005870、hsa_circ_0037911和hsa_circ_0014243可能作为诊断高血压的生物标志物[18]。
在生命体中,circRNA通过调节转录活动、调控剪切位点、作为蛋白和miRNA的分子海绵以及翻译蛋白质等来影响细胞内活动[4],本研究中mmu_circ_0005019可能作为miR-499-5p的分子海绵,竞争性吸附miR-499-5p,从而调控下游靶基因Kcnn3的表达[19]。QI等[20]在房颤的动物模型中发现SK2、SK3活动加快,IK,Ca增加,证实SK3通道参与了心房电重构;LIU等[21]发现阻断或敲除SK通道可以减小IK,Ca,进而会改变心房肌细胞动作电位的终末期形态,延长APD和ERP,从而预防或终止房颤发作。SK3通道作为心脏电生理活动中的重要组成部分,参与房颤的发生、发展。此外,2个大型全基因组关联研究发现,KCNN3作为SK3通道的编码基因,其基因位点多态性与房颤发病风险显著相关,在小鼠体内过表达Kcnn3,导致心源性猝死和房性心律失常的风险增加[22]。
房颤经典的治疗方法包括药物治疗、射频消融以及电复律。在临床实践中,通常首选药物治疗,即抗心律失常药物。临床上抗心律失常药物除β受体阻滞剂外,其他三类都是针对心脏离子通道的药物,但是绝大多数抗心律失常药物都缺乏特异性,并存在较多不良反应,尤其是有潜在的促心律失常作用,可能使心律失常进一步恶化或促发致命的室性心律失常[23]。针对药物治疗效果不佳的患者,目前主要采用房颤导管消融手术治疗,但是导管消融术后复发率较高,术后1年复发率为30%~40%。目前房颤药物治疗的开发主要集中于通过提高心房特异性来提高安全性,由于既往研究没有发现SK电流对心室的动作电位有实质性影响,因此抑制SK电流可能作为未来治疗房颤的抗心律失常药物的潜在特异性靶点[24]。SK通道阻滞剂在动物模型中表现出明显的抗心律失常作用,有研究建立了猪房颤模型,发现应用SK通道阻滞剂可以转复房颤,并有效防止了房颤的复发,而运用IKur阻滞剂维纳卡兰治疗的效果欠佳,提示SK通道阻滞剂在房颤治疗中的巨大应用前景[25]。目前,在眼科疾病的新药研发中,siRNA和反义寡核苷酸(antisense oligonucleotide,ASO)疗法已经完成体外和动物研究,现已进入临床试验阶段,因此针对siRNA和ASO开发新型药物极具临床转化潜力[26]。本研究表明干扰mmu_circ_0005019有着阻断SK电流的显著作用,提示其可能作为未来开发房颤新型药物的潜在靶点。
虽然本研究探索了circRNA在心肌细胞电生理中的作用,但仍存在一定局限性。首先,由于受到种属的限制,本研究的结论外推到人存在局限性,因此下一步需要构建人源心肌细胞模型,验证hsa_circ_0099734对于心脏电重构的影响。其次,本研究仅在小鼠心肌细胞中开展了体外细胞生物学实验,下一步还需要构建小鼠房颤动物模型,进行体内实验验证mmu_circ_0005019的促房颤效应。
综上所述,环状RNA hsa_circ_0099734的小鼠同源circRNA mmu_circ_0005019能够改变Kcnn3的表达量并影响心肌细胞IK,Ca和APD,可能在房颤发生中起到促进作用。干扰mmu_circ_0005019可以抑制SK电流,可能成为治疗房颤的潜在靶点。
| [1] |
BRUNDEL B J J M, AI X, HILLS M T, et al. Atrial fibrillation[J]. Nat Rev Dis Primers, 2022, 8(1): 1-23. |
| [2] |
SCHNABEL R B, YIN X Y, GONA P, et al. 50 year trends in atrial fibrillation prevalence, incidence, risk factors, and mortality in the Framingham Heart Study: a cohort study[J]. Lancet, 2015, 386(9989): 154-162. |
| [3] |
MEMCZAK S, JENS M, ELEFSINIOTI A, et al. Circular RNAs are a large class of animal RNAs with regulatory potency[J]. Nature, 2013, 495(7441): 333-338. |
| [4] |
LIU C X, CHEN LL. Circular RNAs: characterization, cellular roles, and applications[J]. Cell, 2022, 185(12): 2016-2034. |
| [5] |
LU D C, THUM T. RNA-based diagnostic and therapeutic strategies for cardiovascular disease[J]. Nat Rev Cardiol, 2019, 16(11): 661-674. |
| [6] |
WU N, LI J, CHEN X H, et al. Identification of long non-coding RNA and circular RNA expression profiles in atrial fibrillation[J]. Heart Lung Circ, 2020, 29(7): e157-e167. |
| [7] |
CHEN Y C, VOSKOBOINIK A, GERCHE A, et al. Prevention of pathological atrial remodeling and atrial fibrillation: JACC state-of-the-art review[J]. J Am Coll Cardiol, 2021, 77(22): 2846-2864. |
| [8] |
NAGY N, SZUTS V, HORVÁTH Z, et al. Does small-conductance calcium-activated potassium channel contribute to cardiac repolarization?[J]. J Mol Cell Cardiol, 2009, 47(5): 656-663. |
| [9] |
IWASAKI Y K, NISHIDA K, KATO T, et al. Atrial fibrillation pathophysiology: implications for management[J]. Circulation, 2011, 124(20): 2264-2274. |
| [10] |
DINESS J G, BENTZEN B H, SØRENSEN U S, et al. Role of calcium-activated potassium channels in atrial fibrillation pathophysiology and therapy[J]. J Cardiovasc Pharmacol, 2015, 66(5): 441-448. |
| [11] |
LI M L, LI T, LEI M, et al. Increased small conductance calcium-activated potassium channel (SK2 channel) current in atrial myocytes of patients with persistent atrial fibrillation[J]. Chin J Cardiol, 2011, 39(2): 147-151. |
| [12] |
ZHANG X D, TIMOFEYEV V, LI N, et al. Critical roles of a small conductance Ca2+-activated K+ channel (SK3) in the repolarization process of atrial myocytes[J]. Cardiovasc Res, 2014, 101(2): 317-325. |
| [13] |
LI H, XU J D, FANG X H, et al. Circular RNA circRNA_000203 aggravates cardiac hypertrophy via suppressing miR-26b-5p and miR-140-3p binding to Gata4[J]. Cardiovasc Res, 2020, 116(7): 1323-1334. |
| [14] |
XU J D, DU W W, WU N, et al. The circular RNA circNlgnmediates doxorubicin-inducedcardiac remodeling and fibrosis[J]. Mol Ther Nucleic Acids, 2022, 28: 175-189. |
| [15] |
JIN X, XU Y Y, GUO M, et al. hsa_circNFXL1_009 modulates apoptosis, proliferation, migration, and potassium channel activation in pulmonary hypertension[J]. Mol Ther Nucleic Acids, 2021, 23: 1007-1019. |
| [16] |
ZHAO M N, WANG R J, YANG K M, et al. Nucleic acid nanoassembly-enhanced RNA therapeutics and diagnosis[J]. Acta Pharm Sin B, 2023, 13(3): 916-941. |
| [17] |
WANG L J, XU G E, SPANOS M, et al. Circular RNAs in cardiovascular diseases: regulation and therapeutic applications[J]. Research (Wash D C), 2023, 6: 0038. |
| [18] |
GHAFOURI-FARD S, SHIRVANI-FARSANI Z, HUSSEN B M, et al. The key roles of non-coding RNAs in the pathophysiology of hypertension[J]. Eur J Pharmacol, 2022, 931: 175220. |
| [19] |
WU N, LI C Y, XU B, et al. Circular RNA mmu_circ_0005019 inhibits fibrosis of cardiac fibroblasts and reverses electrical remodeling of cardiomyocytes[J]. BMC Cardiovascular Disorders, 2021, 21(1): 308. |
| [20] |
QI X Y, DINESS J G, BRUNDEL B J, et al. Role of small-conductance calcium-activated potassium channels in atrial electrophysiology and fibrillation in the dog[J]. Circulation, 2014, 129(4): 430-440. |
| [21] |
LIU T, LI T, XU D D, et al. Small-conductance calcium-activated potassium channels in the heart: expression, regulation and pathological implications[J]. Philos Trans R Soc Lond B Biol Sci, 2023, 378(1879): 20220171. |
| [22] |
MAHIDA S, MILLS R W, TUCKER N R, et al. Overexpression of KCNN3 results in sudden cardiac death[J]. Cardiovasc Res, 2014, 101(2): 326-334. |
| [23] |
HEIJMAN J, HOHNLOSER S H, CAMM A J. Antiarrhythmic drugs for atrial fibrillation: lessons from the past and opportunities for thefuture[J]. EP Eur, 2021, 23: ⅱ14-ⅱ22. |
| [24] |
SKIBSBYE L, POULET C, DINESS J G, et al. Small-conductance calcium-activated potassium (SK) channels contribute to action potential repolarization in human atria[J]. Cardiovasc Res, 2014, 103(1): 156-167. |
| [25] |
DINESS J G, KIRCHHOFF J E, SPEERSCHNEIDER T, et al. The KCa2 channel inhibitor AP30663 selectively increases atrial refractoriness, converts vernakalant-resistant atrial fibrillation and prevents its reinduction in conscious pigs[J]. Front Pharmacol, 2020, 11: 159. |
| [26] |
GUPTA A, KAFETZIS K N, TAGALAKIS A D, et al. RNA therapeutics in ophthalmology—translation to clinical trials[J]. Exp Eye Res, 2021, 205: 108482. |




