Aaron Beck首次提出的抑郁症认知模型认为,对信息的负性偏向在抑郁症的形成、发展和维持中起着重要作用[1]。在这个模型中,他强调潜在消极图示(对外部刺激或经验的内部表征)对当前信息处理方式起着重要作用。对于抑郁个体而言,早期的不良生活事件经历使得消极图示形成,潜在的消极图示可能被随后的不良生活事件激活。这种图示一旦被激活,将对自己、周围世界及其未来形成负性的消极的自我参照加工思维模式,使得个体容易产生抑郁。以往研究主要从情绪加工的过度增强和认知控制的功能下降等认知角度来阐明抑郁症负性加工偏向产生的机制,发现杏仁核、扣带回、前额叶等脑区活动异常及功能连接异常与抑郁发生存在紧密联系[2-6]。
近年来,随着对情绪加工与认知控制的深入研究,情绪加工过程进一步探讨注意偏向、解释偏向和记忆偏向在抑郁症中的产生机制[7-8];认知控制功能则进一步探讨更新功能、抑制功能和转换功能在抑郁症中的调控机制[9-12]。尤其当前对大尺度脑网络(large-scale brain networks)和分层级脑网络(hierarchical brain networks)的分析,可以解释认知过程所涉及的重要脑区及之间的关系,被广泛运用于认知神经科学研究[13-14]。在此过程中,该领域已获得许多有价值的研究成果,这对解释抑郁症的发生有很多启示。接下来,本文就抑郁症的负性情绪加工和认知控制的神经机制研究展开详细论述,结合情绪产生与调控的网络层级模型,提出抑郁症双路径层级网络模型,并在此基础上展望未来的研究方向。
1 抑郁症负性情绪加工神经模型的不断发展在Beck最初提出的抑郁症认知模型中,对负性刺激的自下而上的注意偏向、解释偏向、记忆偏向、反刍思维、功能失调的自我参照图式进行了大量研究,发现与抑郁症状的发生和维持有关[15]。随着神经影像学和生物学的发展,Beck等对原有的抑郁模型进行修正,从以下5个方面探讨抑郁症负性情绪加工的神经生物学机制。
1.1 注意偏向无法将注意力分配到适应的情绪线索是抑郁症认知模型的一个核心。对于正常个体而言,注意力通常偏向积极刺激进行加工;而抑郁症患者更倾向于对消极刺激注意力增加,而对积极刺激注意力减少。研究表明,对负性刺激表现出注意偏向时,抑郁症患者的右侧顶叶上皮层(superior parietal cortex, SPC)、腹外侧前额皮质(ventrolateral prefrontal cortex, VLPFC)、前扣带回(anterior cingulate cortex, ACC)和背外侧前额皮质(dorsolateral prefrontal cortex, DLPFC)的活动降低[2, 16]。该认知神经模型中,顶叶上皮层参与注意力凝视的协调变化,腹外侧前额皮质参与对刺激的选择,背外侧前额皮质和前扣带回通过抑制腹外侧前额皮质的活动以促进对负性刺激的脱离。抑郁症患者的顶叶上皮层和腹外侧前额皮质激活不足,表现为倾向于选择负性刺激;背外侧前额皮质和前扣带回激活不足,使得其无法通过调控腹外侧前额皮质而脱离对负性刺激的注意。
1.2 解释偏向一旦从环境中感知到刺激,抑郁症患者则会对其消极方面进行编码加工与归因解释,如遭遇外部挑战性事件时,因认为外部事件难度大,自己无法完成任务,而表现出退缩性行为[17]。研究表明,对负性刺激进行偏向性解释时,抑郁症患者的丘脑、杏仁核、膝下扣带回等脑区出现过度激活[4-5],可能增加其对外界情绪刺激的负面感受性。来自外界刺激的负面信号引起丘脑的过度活跃,从丘脑到杏仁核再到膝下扣带皮层,再传递给高级皮层区域,如前额叶皮层(prefrontal cortex, PFC)。背外侧前额皮质的活动减弱,这可能会削弱背侧前扣带回(dorsal ACC)对皮质下区域的适应性调节能力。该过程将加强抑郁症患者对环境中负性刺激的认识与有意识加工。
1.3 记忆偏向抑郁症患者对负性刺激的注意增强和加工编码会影响其对负性信息的存储与回忆,因此负责记忆偏向的激活脑区与负责注意和解释偏向的脑区可能有重叠。研究发现,在对自我相关的负性事件进行回忆时,抑郁症患者的杏仁核、海马、尾状核和壳核的过度激活;对自我相关的正性事件进行回忆时,其内侧前额皮质(medial prefrontal cortex, MPFC)过度激活。其原因可能在于:抑郁症患者的负性记忆偏向与海马、杏仁核的过度激活有关,触发尾状核和壳核自下而上的调节[18],这可能使得消极性回忆不需要征募前额叶区域的认知控制资源而自动化发生;相比之下,回忆正性事件则需要花费更多的认知资源。
1.4 反刍思维长期的负性刺激会影响个体对自我的评价,从而影响自尊和自我形象,进一步内化,导致抑郁症状的产生。抑郁症状往往会被反复思考的负性想法所强化,尤其是那些不断提醒自身有缺陷的想法,这被称为“反刍思维”。反刍思维与3个因素有关: 改变的情绪和记忆加工、增加的自我参照加工和自上而下的抑制不足。涉及杏仁核、海马、膝下扣带回、内侧前额皮质的过度激活和背外侧前额皮质、腹外侧前额皮质等区域激活减弱。该模型认为,杏仁核、海马和膝下扣带回激活(延长情绪体验),使得内侧前额皮质激活增加(自我参照认知增加)、背外侧前额皮质和腹外侧前额皮质激活减弱(调节情绪刺激的抑制能力降低),抑郁个体产生反刍思维模式。这些神经生理变化持续发生,将导致更大的反刍和更严重的抑郁发作。
1.5 自我参照图式自我参照图式是通过增加负性刺激与自我参照信息的联结而固化形成的[19]。在自我参照加工任务中,抑郁症患者的杏仁核、前扣带回、内侧前额皮质均过度激活[20-21]。负性刺激信号由丘脑沿着认知层级发送,杏仁核活动增加使得其投射区(尤其是前扣带回)活动增加。前扣带回的亚区出现不同程度激活,腹侧过度激活,背侧激活不足。信号传递到前额皮层,内侧前额皮质过度激活,与自我内在表征有关;腹外侧前额皮质激活不足[22],与对情绪加工过程的调控有关[23]。也有研究表明,包括内侧前额皮质、楔前叶、后扣带回、顶叶下皮层和海马在内的默认网络(default mode network, DMN) 过度激活,参与自我参照和内省思维加工[13]。
Beck等提出的抑郁症认知神经模型认为,抑郁症患者在对外部刺激存在注意偏向、解释偏向和记忆偏向时,杏仁核、膝下扣带皮层、尾状核、伏隔核和海马等出现过度激活,背外侧前额皮质、腹外侧前额皮质等脑区出现功能不足,故负性认知加工偏向成为稳定的特质,促使抑郁症状持续存在。就抑郁症负性情绪加工神经模型而言,从刺激输入开始,抑郁患者的功能失调的态度被激活,到出现负性的自动思维,再到产生抑郁的过程,是一个自下而上加工的过程,这些研究忽略了自上而下的认知控制能力不足可能是抑郁持续存在的另一个关键原因[24]。因此,接下来的抑郁症认知控制神经模型研究,将强调抑郁症认知控制对情绪加工实施的自上而下调控过程。
2 抑郁症认知控制神经模型的深入研究认知控制(cognitive control)是指在特定情境中,个体为达到具体的目标和意图,灵活地调动注意资源,动态调整认知和行为的心理过程[25-26],它在外界情绪性刺激加工中占有重要作用。冲突范式是研究认知控制功能的一种典型范式。情绪冲突如“扣动的扳机”,激发负性认知加工模式,促使抑郁情绪与认知方式发生相互作用。从对外部冲突进行加工到对该过程实施认知控制之前,有一个中间过渡阶段——对情绪冲突的监测过程。当监测到外部冲突时,个体的前扣带回出现激活[27]。对于抑郁症患者而言,在完成情绪抑制或冲突任务中,其前扣带回激活不足,说明其监测冲突能力受损[6, 28]。当监测到情绪冲突后,信号传递到负责认知控制的脑区,其对情绪加工过程实施自上而下的认知调控。
近年来,随着对认知控制子成分或功能的研究深入,研究者试图从更新、抑制和转换3种角度,探讨认知控制对情绪加工调控的生物学机制[29-30]。
2.1 更新功能研究认为,在监测到外部冲突后,个体对当前的冲突进行重新认知、建构或理解,使冲突得以解决,这个过程称为任务集重组(task set refiguration)[31]。在任务集重组过程中,为有效地解决问题和实现目标,个体需要编码与当前任务或目标相关的信息为有用的信息,工作记忆中的信息不断更新,不相关的信息将会被替换,只保留任务相关信息[32]。比如在N-back任务中,给被试呈现一系列字母,让其指出当前字母与之前呈现的字母是否相同。结果发现,抑郁症患者表现出更新能力缺陷,其左侧背外侧前额皮质等区域激活不足,并且其与左侧楔前叶的功能连接减弱。左侧背外侧前额皮质等区域属于认知控制网络,楔前叶属于默认模式网络,二者相互抑制,当其功能连接趋于正常化,抑郁症状有所减轻[33]。在一个数字计算记忆任务中,在对数字进行更新计算时,抑郁症患者的前侧前额皮质(anterior prefrontal cortex)和额顶网络(fronto-parietal network)激活不足[9],表现为更新能力不足。
2.2 抑制功能研究认为,认知控制通过增强任务相关刺激的加工促进冲突解决[34]。而Houghton和Tipper (1996)认为,冲突解决是通过认知控制对分心刺激的抑制作用而实现的[35]。当需要抑制或忽视负性刺激干扰时,抑郁症患者的返回抑制和分心抑制能力不足[36],表现为背侧前扣带回(dorsal ACC)和背外侧前额皮质(DLPFC)激活不足[2]。当用经颅电刺激抑郁症患者的左侧DLPFC/右腹内侧前额皮质(ventromedial prefrontal cortex, VMPFC)时,其对悲伤面孔的抑制控制能力得到改善,对任务相关信息的反应更快[37]。也有研究发现,抑郁症患者在被要求忽略负性面部表情或诱导情绪干扰时,其额下回(inferior frontal gyrus, IFG)激活程度降低[10]。经认知行为治疗(cognitive behavioral therapy, CBT)后,完成情绪冲突干扰任务时,个体的双侧额下回(bilateral inferior frontal cortex)、右侧额中回(right middle frontal cortex)等脑区活动增加,抑郁症状有所缓解[38]。说明额下回、额中回等脑区,作为实施认知控制的重要区域,不能像正常人那样能征募认知资源实现对杏仁核等情绪加工脑区的有效抑制[39]。
2.3 转换功能转换是指在不同任务或心理集合之间灵活交替的能力[40],其包括对刺激的不同方面进行交替注意、遵循变化的指令、抑制前一个任务指令并在当前任务中作出适应性反应等过程[41]。比如在情绪面孔转换任务中,被试被要求在不同任务间进行转换,要么回答情绪面孔是正性还是负性的,要么回答不同情绪面孔的数量。正常个体通常可以在不同任务间进行自由转换;而抑郁症患者表现出转移困难[42-44],他们不容易将注意力从其他任务中脱离,集中注意完成解决当前任务,表现为呆板、机械、不灵活、重复性消极思维的特征,难以适应快速变化的环境[45]。Vergara-Lopez等[44]用威斯康星卡片分类任务(wisconsin card sorting test,WCST)、内部转换任务(internal shift task,IST)和情绪卡片分类任务(emotional card sorting test)对抑郁患者进行测试发现,抑郁症的转换功能缺陷与反复出现负性思维存在联系。在Go/No-Go情绪转换任务中,抑郁症患者从情绪性刺激转移注意时,其反应变慢,这在抑郁康复人群中也发现如此[46]。在动物实验中发现,抑郁小鼠的转换功能缺陷可能与背内侧前额皮层(dorsomedial PFC, DMPFC)和眶额叶等前额皮层活动不足有关[47-49]。通过口语流畅测试(phonemic verbal fluency test, VFT)以考察个体对新词分类的转换能力,结果表明,抑郁症患者出现转换能力缺陷,表现为左侧前额皮质(left PFC)的激活不足[11]。
抑郁症认知控制神经模型从更新、抑制、转换的角度,解释了抑郁症认知控制能力不足对抑郁产生的影响,发现在完成更新、抑制、转换任务中,抑郁症患者背外侧前额皮层、背内侧前额皮层、眶额叶等认知控制脑区激活异常,表现为更新任务信息、抑制无关信息和转换注意等能力受损。
综合分析抑郁症情绪加工和认知控制近几十年的研究,发现有两个重要特征:第一,从独立脑区研究到脑网络研究。从最开始强调抑郁症认知行为症状[1] (Beck, 1967),到后来强调大脑单个或几个的感兴趣区作用[2-3],到现在更强调脑区与脑区之间的关系,突出脑网络相互之间的作用关系对抑郁症产生的影响[9, 11]。第二,从笼统的上下位概念到逐级分层概念。抑郁症研究最初强调情绪加工的初级加工(下位概念)和认知控制的高级加工(上位概念),这种分类比较笼统,现有研究更加明确提出“网络层级”的概念,即在情绪加工和认知控制过程中,有2个以上的层级网络将神经信号依次传递。接下来,将通过“网络层级模型”解释抑郁症的产生机制。
3 抑郁症情绪产生与调节“网络层级模型”的出现 3.1 情绪产生与调节的脑网络研究研究发现,情绪的感知、产生和调节过程不只涉及单个或几个存在的独立脑区,而是多个大规模神经网络。Morawetz等通过元分析聚类技术,识别和表征情绪感知、产生和调节的神经活动[14],发现有MAG1~MAG4四个大脑神经网络参与该过程。MAG1主要由背外侧前额皮质在内的额顶叶网络组成,MAG2主要由腹外侧前额皮质在内的前额叶网络组成,这两个脑网络与对外部刺激的重新评价与情绪调节有关。MAG3主要由双侧杏仁核、左侧海马旁、双侧梭状回等皮层下区域组成,主要与情绪刺激的加工与情绪产生有关。MAG4主要由中央后回(postcentral gyrus)、脑岛(insula)、左侧顶叶上叶(superior parietal lobe, SPL)、楔前叶和后扣带回等脑区组成,它可能作为一个中枢,整合来自前额叶网络(MAG1和MAG2)和皮质下网络(MAG3)的信息,以便产生情绪并调节这些反应。
3.2 逐级分层地信号传递根据Smith和Lane提出的“情绪调节六级层次模型”[12],躯体、内脏、脑干等低水平调节处于模型的第一、二级。梭状回、中脑中央灰质(PAG)等处于模型的第三级,参与低级的皮质下情绪产生过程。杏仁核等处于模型的第四级,通常与快速、自动地检测和评估情绪刺激有关。岛叶和腹内侧前额皮质(VMPFC)等处于模型的第五级,负责整合调控内感知觉表征与内部情绪状态。背外侧前额皮质(DLPFC)和腹外侧前额皮质(VLPFC)等位于模型的最高级,负责自上而下的最高调控。这种实施分级监管控制的脑网络是既可分离又相互作用的大尺度网络。
4 抑郁症“双路径层级网络模型”的初步构建综合以往关于抑郁症情绪加工和认知控制研究,结合情绪产生与调节的“网络层级模型”,我们提出抑郁症“双路径层级网络模型”。由该模型可知,抑郁症加工外部刺激遵循“双加工路径”和“三级脑网络群”原则(见图 1)。
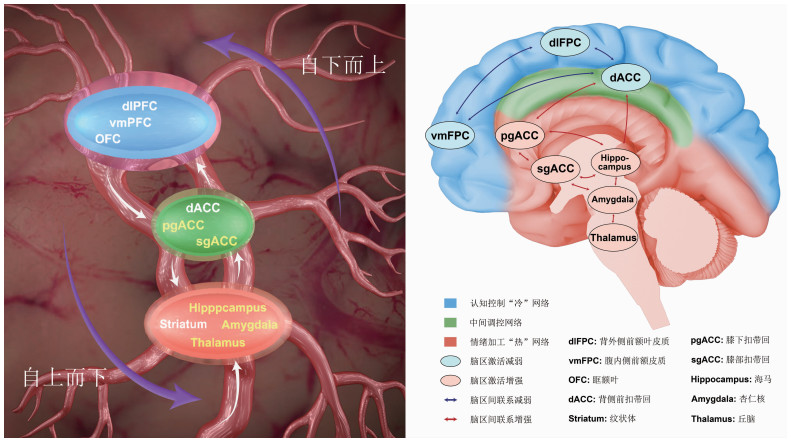
|
| 图 1 抑郁症负性偏向的双路径层级网络模型 |
4.1 双加工路径模型
该模型认为,抑郁症认知神经生物学机制可能涉及两个关键路径: ①自下而上的情绪加工路径。情绪加工路径从杏仁核等边缘系统的过度激活开始,经过膝下扣带皮层、尾状核、壳核、伏隔核和海马,通过背侧前扣带回,到达前额叶皮层,激发认知“更高”等级区域的抑制。通过这种方式,对情绪刺激的过度反应直接影响抑郁个体解释周围环境信息的能力。②自上而下的认知控制路径。认知控制功能与前额叶激活有关,该区域表现为功能的特异性,其中腹外侧前额皮质与偏向性注意有关,腹侧前额皮质与自我表征有关,而背外侧前额皮质与沉思和偏向性加工有关。前额叶区域通过前扣带回和丘脑对皮层下区域实施自上而下的控制。由于抑郁症患者前额叶的认知控制能力不足,无法通过前扣带回对皮质下区域实施有效调控,其不适应反应持续存在,包括杏仁核反应增强(与偏向性注意和加工有关)、尾状核和壳核功能异常(与功能失调的态度和偏向性记忆有关)。
4.2 三级脑网络群由抑郁症双加工路径可见,该模型涉及“热”“中间调节”和“冷”三级脑网络群[50-51]。“热”网络群包括丘脑、杏仁核、海马、前侧扣带回、膝下扣带回、腹内侧前额皮质等脑区,处于脑网络群的第一级;“中间调节”网络群包括背侧前扣带回等脑区,处于脑网络群的第二级;“冷”网络群包括背外侧前额皮质、腹外侧前额皮质等脑区,处于脑网络群的第三级。当负性刺激信号传入杏仁核等敏感区时,其迅速被激活,形成“热”脑网络群(第一级加工);该脑网络群将信号传到前扣带回等中间调节网络,称为“扣带回监控系统”(cingulo-opercular monitoring system)[52]。扣带回监控系统的亚区出现功能分离,腹侧前扣带回通过情绪效价对刺激进行标记,吻侧前扣带回通过自我参考值对刺激进行标记,背侧前扣带回则对这个过程进行监测调控(第二级加工),并将信号传导给更高一级加工区域,即包括背外侧前额皮质、腹外侧前额皮质等在内的“额顶网络”(fronto-parietal networks),发出增加认知控制需求的信号;额顶网络接受信号后,由于其认知控制能力减弱,成为“冷”脑网络群,无法有效实施自上而下地调控(第三级加工)[53],背侧前扣带回等中间调节网络能力不足(第二级加工),抑制“热”脑网络群的能力减弱,“热”脑网络群激活更强(第一级加工)[54-55]。长此以往,“热”脑网络群—“中间调节”脑网络群—“冷”脑网络群,形成“闭环神经回路”,三者相互作用,共同介导抑郁产生。
5 未来与展望目前,关于抑郁症负性情绪加工与认知控制的脑网络机制研究已经取得了一定进展,未来可以从以下几个方面加深认识。首先,研究内容上,在不断丰富情绪加工与认知控制实验证据的基础上,从自下而上和自上而下角度,重点考察情绪加工、中间调节和认知控制脑网络内部、脑网络之间的相互关系对抑郁症产生和发展的作用机制。再次,研究方法上,采用多模态技术的综合运用,比如经颅磁刺激结合脑功能磁共振成像(functional magnetic resonance imaging,fMRI)技术、经颅电刺激结合近红外线成像(functional near-infrared imaging,fNIR)技术、EEG-fMRI融合技术等,通过分区多点刺激的方式,形成“闭环神经回路”[56], 更加精准地找到抑郁症发生的认知神经机制。再次,研究对象上,可以考虑对抑郁的不同亚型进行研究,比如抑郁情绪个体、抑郁症首发个体、重型抑郁症患者、抑郁康复个体。不同抑郁亚型的个体,其抑郁的神经发生机制可能有所不同。
未来的研究将紧紧围绕“抑郁症双路径层级网络模型”,从自下而上和自上而下两条路径,不断验证负性情绪加工与认知控制脑网络之间的相互作用关系,试图找到抑郁症负性认知加工偏向发生的认知神经环路,以期为抑郁症的早期干预与精准化治疗提供实证依据。
| [1] |
STRASBURGER L H. Depression—clinical, experimental, and theoretical aspects[J]. Psychosom Med, 1968, 30(6): 890. |
| [2] |
FALES C L, BARCH D M, RUNDLE M M, et al. Altered emotional interference processing in affective and cognitive-control brain circuitry in major depression[J]. Biol Psychiatry, 2008, 63(4): 377-384. |
| [3] |
LIAO C, FENG Z, ZHOU D, et al. Dysfunction of fronto-limbic brain circuitry in depression[J]. Neuroscience, 2012, 201: 231-238. |
| [4] |
KLUMPP H, KINNEY K L, KENNEDY A E, et al. Trait attentional control modulates neurofunctional response to threat distractors in anxiety and depression[J]. J Psychiatr Res, 2018, 102: 87-95. |
| [5] |
ZHENG R P, CHEN Y, JIANG Y, et al. Dynamic altered amplitude of low-frequency fluctuations in patients with major depressive disorder[J]. Front Psychiatry, 2021, 12: 683610. |
| [6] |
SHEENA M K, JIMMY J, BURKHOUSE K L, et al. Anterior cingulate cortex activity during attentional control corresponds with rumination in depression and social anxiety[J]. Psychiatry Res Neuroimaging, 2021, 317: 111385. |
| [7] |
BECK A T. The evolution of the cognitive model of depression and its neurobiological correlates[J]. Am J Psychiatry, 2008, 165(8): 969-977. |
| [8] |
DISNER S G, BEEVERS C G, BECK A T, et al. Neural mechanisms of the cognitive model of depression[J]. Nat Rev Neurosci, 2011, 12(8): 467-477. |
| [9] |
MA M Y, ZHANG X, ZHANG Y, et al. Childhood maltreatment was correlated with the decreased cortical function in depressed patients under social stress in a working memory task: a pilot study[J]. Front Psychiatry, 2021, 12: 671574. |
| [10] |
KOSTER E H, HOORELBEKE K. Cognitive bias modification for depression[J]. Curr Opin Psychol, 2015, 4: 119-123. |
| [11] |
KAWAKUBO Y, YANAGI M, TSUJII N, et al. Repetition of verbal fluency task attenuates the hemodynamic activation in the left prefrontal cortex: enhancing the clinical usefulness of near-infrared spectroscopy[J]. PLoS One, 2018, 13(3): e0193994. |
| [12] |
SMITH R, LANE R D. The neural basis of one's own conscious and unconscious emotional states[J]. Neurosci Biobehav Rev, 2015, 57: 1-29. |
| [13] |
ZENG C, ROSS B, XUE Z M, et al. Abnormal large-scale network activation present in bipolar Mania and bipolar depression under resting state[J]. Front Psychiatry, 2021, 12: 634299. |
| [14] |
MORAWETZ C, RIEDEL M C, SALO T, et al. Multiple large-scale neural networks underlying emotion regulation[J]. Neurosci Biobehav Rev, 2020, 116: 382-395. |
| [15] |
Scientific foundations of cognitive theory and therapy of depression[J]. J Psychother Pract Res, 2001, 10(4): 286-287.
|
| [16] |
BEEVERS C G, CLASEN P, STICE E, et al. Depression symptoms and cognitive control of emotion cues: a functional magnetic resonance imaging study[J]. Neuroscience, 2010, 167(1): 97-103. |
| [17] |
TEO A R, NELSON S, STRANGE W, et al. Social withdrawal in major depressive disorder: a case-control study of hikikomori in Japan[J]. J Affect Disord, 2020, 274: 1142-1146. |
| [18] |
LIU X, YUAN J Z, GUANG Y, et al. Longitudinal in vivo diffusion tensor imaging detects differential microstructural alterations in the Hippocampus of chronic social defeat stress-susceptible and resilient mice[J]. Front Neurosci, 2018, 12: 613. |
| [19] |
CAUDEK C. Individual differences in cognitive control on self-referenced and other-referenced memory[J]. Conscious Cogn, 2014, 30: 169-183. |
| [20] |
RENNER F, SIEP N, LOBBESTAEL J, et al. Neural correlates of self-referential processing and implicit self-associations in chronic depression[J]. J Affect Disord, 2015, 186: 40-47. |
| [21] |
YOUNG K D, FRIEDMAN E S, COLLIER A, et al. Response to SSRI intervention and amygdala activity during self-referential processing in major depressive disorder[J]. Neuroimage Clin, 2020, 28: 102388. |
| [22] |
LIU P, HAYDEN E P, DOUGHERTY L R, et al. The development of depressogenic self-schemas: associations with children's regional grey matter volume in ventrolateral prefrontal cortex[J]. Dev Psychopathol, 2023, 35(3): 1000-1010. |
| [23] |
KELLER M, ZWEERINGS J, KLASEN M, et al. fMRI neurofeedback-enhanced cognitive reappraisal training in depression: a double-blind comparison of left and right vlPFC regulation[J]. Front Psychiatry, 2021, 12: 715898. |
| [24] |
LEMOULT J, GOTLIB I H. Depression: a cognitive perspective[J]. Clin Psychol Rev, 2019, 69: 51-66. |
| [25] |
BOTVINICK M, BRAVER T, BARCH D, et al. Conflict monitoring and cognitive control[J]. Psychol Rev, 2001, 108(3): 624-652. |
| [26] |
FAN J. An information theory account of cognitive control[J]. Front Hum Neurosci, 2014, 8: 680. |
| [27] |
SHAPIRA-LICHTER I, STRAUSS I, OREN N, et al. Conflict monitoring mechanism at the single-neuron level in the human ventral anterior cingulate cortex[J]. Neuroimage, 2018, 175: 45-55. |
| [28] |
KERNS J G, COHEN J D, MACDONALD A W 3rd, et al. Anterior cingulate conflict monitoring and adjustments in control[J]. Science, 2004, 303(5660): 1023-1026. |
| [29] |
JOORMANN J, TANOVIC E. Cognitive vulnerability to depression: examining cognitive control and emotion regulation[J]. Curr Opin Psychol, 2015, 4: 86-92. |
| [30] |
陈安涛. 认知控制基本功能的神经机制[J]. 生理学报, 2019, 71(1): 149-155. CHEN A T. Neural mechanisms of basic functions of cognitive control[J]. Acta Physiol Sin, 2019, 71(1): 149-155. |
| [31] |
RAY K L, RAGLAND J D, MACDONALD A W, et al. Dynamic reorganization of the frontal parietal network during cognitive control and episodic memory[J]. Cogn Affect Behav Neurosci, 2020, 20(1): 76-90. |
| [32] |
LEVENS S M, GOTLIB I H. Updating positive and negative stimuli in working memory in depression[J]. J Exp Psychol Gen, 2010, 139(4): 654-664. |
| [33] |
TAYLOR J E, YAMADA T, KAWASHIMA T, et al. Depressive symptoms reduce when dorsolateral prefrontal cortex-precuneus connectivity normalizes after functional connectivity neurofeedback[J]. Sci Rep, 2022, 12(1): 2581. |
| [34] |
NOTEBAERT W, VERGUTS T. Cognitive control acts locally[J]. Cognition, 2008, 106(2): 1071-1080. |
| [35] |
HOUGHTON G, TIPPER S P. Inhibitory mechanisms of neural and cognitive control: applications to selective attention and sequential action[J]. Brain Cogn, 1996, 30(1): 20-43. |
| [36] |
戴琴, 冯正直. 抑郁个体对情绪面孔的返回抑制能力不足[J]. 心理学报, 2009, 41(12): 1175-1188. DAI Q, FENG Z. Deficient inhibition of return for emotional faces in depression[J]. Acta Psychol Sin, 2009, 41(12): 1175-1188. |
| [37] |
NEJATI V, MAJIDINEZHAD M, NITSCHE M. The role of the dorsolateral and ventromedial prefrontal cortex in emotion regulation in females with major depressive disorder (MDD): a tDCS study[J]. J Psychiatr Res, 2022, 148: 149-158. |
| [38] |
YANG Z, OATHES D J, LINN K A, et al. Cognitive behavioral therapy is associated with enhanced cognitive control network activity in major depression and posttraumatic stress disorder[J]. Biol Psychiatry Cogn Neurosci Neuroimaging, 2018, 3(4): 311-319. |
| [39] |
DREVETS W C. Orbitofrontal cortex function and structure in depression[J]. Ann N Y Acad Sci, 2007, 1121(1): 499-527. |
| [40] |
RAVIZZA S M, CARTER C S. Shifting set about task switching: behavioral and neural evidence for distinct forms of cognitive flexibility[J]. Neuropsychologia, 2008, 46(12): 2924-2935. |
| [41] |
GRÖNHOLM-NYMAN P, SOVERI A, RINNE J O, et al. Limited effects of set shifting training in healthy older adults[J]. Front Aging Neurosci, 2017, 9: 69. |
| [42] |
LIU H T, FUNKHOUSER C J, LANGENECKER S A, et al. Set shifting and inhibition deficits as potential endophenotypes for depression[J]. Psychiatry Res, 2021, 300: 113931. |
| [43] |
CHEN X, FENG Z Z, WANG T, et al. Internal switching and backward inhibition in depression and rumination[J]. Psychiatry Res, 2016, 243: 342-348. |
| [44] |
VERGARA-LOPEZ C, LOPEZ-VERGARA H I, ROBERTS J E. Testing a "content meets process" model of depression vulnerability and rumination: exploring the moderating role of set-shifting deficits[J]. J Behav Ther Exp Psychiatry, 2016, 50: 201-208. |
| [45] |
ZETSCHE U, BVRKNER P C, SCHULZE L. Shedding light on the association between repetitive negative thinking and deficits in cognitive control-A meta-analysis[J]. Clin Psychol Rev, 2018, 63: 56-65. |
| [46] |
LANGE C, ADLI M, ZSCHUCKE E, et al. Affective set-shifting deficits in patients with major depression in remission[J]. J Psychiatr Res, 2012, 46(12): 1623-1626. |
| [47] |
HOLMES A, WELLMAN C L. Stress-induced prefrontal reorganization and executive dysfunction in rodents[J]. Neurosci Biobehav Rev, 2009, 33(6): 773-783. |
| [48] |
PARK J, WOOD J, BONDI C, et al. Anxiety evokes hypofrontality and disrupts rule-relevant encoding by dorsomedial prefrontal cortex neurons[J]. J Neurosci, 2016, 36(11): 3322-3335. |
| [49] |
HEISLER J M, MORALES J, DONEGAN J J, et al. The attentional set shifting task: a measure of cognitive flexibility in mice[J]. J Vis Exp, 2015(96): 51944. |
| [50] |
CL N, DC H, LALLY N, et al. The neural basis of hot and cold cognition in depressed patients, unaffected relatives, and low-risk healthy controls: an fMRI investigation[J]. J Affect Disord, 2020, 274: 389-398. |
| [51] |
SALEHINEJAD M A, GHANAVATI E, RASHID M H A, et al. Hot and cold executive functions in the brain: a prefrontal-cingular network[J]. Brain Neurosci Adv, 2021, 5: 23982128211007769. |
| [52] |
PIRES L, LEITÃO J, GUERRINI C, et al. Cognitive control during a spatial Stroop task: comparing conflict monitoring and prediction of response-outcome theories[J]. Acta Psychol (Amst), 2018, 189: 63-75. |
| [53] |
HOPMAN H J, CHOY H Y, HO W S, et al. The effects of repetitive transcranial magnetic stimulation antidepressant response on cold cognition: a single-arm prospective longitudinal study[J]. Neuropsychiatr Dis Treat, 2021, 17: 1647-1658. |
| [54] |
HAN K, CHAPMAN S B, KRAWCZYK D C. Neuroplasticity of cognitive control networks following cognitive training for chronic traumatic brain injury[J]. Neuroimage Clin, 2018, 18: 262-278. |
| [55] |
DONG S Y, CHOI J, PARK Y, et al. Prefrontal functional connectivity during the verbal fluency task in patients with major depressive disorder: a functional near-infrared spectroscopy study[J]. Front Psychiatry, 2021, 12: 659814. |
| [56] |
SCANGOS K W, MAKHOUL G S, SUGRUE L P, et al. State-dependent responses to intracranial brain stimulation in a patient with depression[J]. Nat Med, 2021, 27(2): 229-231. |




