心肌细胞肥大在心脏受到各种刺激时产生,而在对心肌细胞刺激长期存在情况下,往往会导致心肌肥厚(cardiac hypertrophy,CH)[1]。CH可分为生理性和病理性,生理性心肌肥厚主要是由于运动、怀孕等因素所导致,如适当的运动可使心肌细胞增大,加强心肌细胞抗凋亡的能力,从而保护心脏组织,是一种有益的、可逆的CH;而病理性心肌肥厚的发生常与肥胖、糖尿病、高血压、心肌缺血缺氧等疾病相关,当心肌细胞处于持续的病理性刺激下,导致心肌细胞无法维持正常功能而产生代偿性肥厚,而持续的心肌肥厚则会造成心力衰竭,甚至会导致猝死,给患者健康造成威胁[2-3]。目前还没有治疗的特效药,故阐明CH的发病机制,找到对CH具有调节作用的关键靶点十分重要。
E26转化特异性因子(E26 transformation-specific,ETS)家族包含30多个成员,是细胞内较大转录调控因子家族之一,具有促进细胞分化、增殖、抑制凋亡和细胞间相互作用等功能[4]。而弗莱德白血病病毒整合位点-1(Friend leukemia virus integration-1,FLI-1)作为ETS家族的转录因子,可能与细胞增生、凋亡、肿瘤发生及血管形成有关[5]。已知FLI-1降低可诱导心脏肥大和纤维化的发生[6]。且FLI-1能够在肿瘤细胞中通过调节Klotho的表达而抑制肿瘤生长[7]。Klotho作为近年来发现的具有抗衰老作用的基因,不仅具有调节氧化应激、钙磷代谢及钙离子通道的作用,而且还能对心血管系统功能进行调控[8]。研究证实,体内Klotho表达降低会导致心肌细胞肥大和心脏纤维化增加,从而导致心力衰竭[9]。Klotho可通过调节胰岛素生长因子-1(insulin-like growth factor-1,IGF-1)通路从而减轻高血压、心肌肥大及心肌纤维化等心脏不良症状[10]。而胰岛素生长因子-1受体(insulin-like growth factor-1 receptor,IGF-1R)/Gi/PLC途径与CH的形成密切相关,IGF-1R作为胰岛素生长因子受体,能够通过激活Gi促进PCL表达,最终导致CH的形成。但目前还未见FLI-1作用IGF-1R/Gi/PLC途径在CH的相关报道,故本研究建立心肌细胞(H9c2)肥大模型,在H9c2肥大细胞中过表达FLI-1和沉默Klotho,探究FLI-1通过Klotho介导IGF-1R/Gi/PLC途径对心肌细胞肥大的影响。
1 材料与方法 1.1 细胞株和主要试剂大鼠心肌细胞(H9c2)购自武汉普诺赛生命科技有限公司;DMEM高糖培养基购自塞维尔生物科技有限公司;胎牛血清购自上海龙田生物科技有限公司;双抗、胰酶购自Biosharp公司;异丙肾上腺素盐酸盐购自上海麦克林生化科技股份有限公司;Annexin V-APC/PI双染细胞凋亡检测试剂盒购自南京凯基生物科技发展有限公司;RiboFectTMCP Transfection Kit购自广州锐博生物科技有限公司;LipofectamineTM 2000 Transfection Reagent购自美国赛默飞世尔科技公司;Bax、Bcl-2、BNP、IGF-1R、NPPA、PLCG1、β-MHC、β-actin等兔克隆抗体购自武汉爱博泰克生物科技有限公司;Caspase3、生物素化山羊抗兔IgG(H+L)购自美国affinity公司;cleaved-Caspase3兔克隆抗体购自美国Cell Signaling Technology公司;GNAI1兔克隆抗体购自英国Abcam公司。
1.2 细胞培养将H9c2细胞冻存管从液氮罐中取出,在37 ℃水浴锅中融化细胞,离心,在超净工作台中弃上清后加入含有10%胎牛血清和1%双抗的DMEM培养基,混匀后加入培养瓶中,置于37 ℃,5%CO2培养箱中培养,待细胞生长至生长对数期时,进行传代,将细胞转入超净工作台中,用PBS洗涤2次,加入胰酶消化25 s,后弃胰酶加入带血清的培养基终止消化,将细胞吹打下来后加入培养基并以1 ∶2的比例进行传代培养。
1.3 心肌细胞肥大模型的构建将H9c2细胞以3×105/孔接种于6孔板中,在细胞中加入浓度为10 μmol/L的异丙肾上腺素(isoproterenol,ISO),37 ℃,5% CO2孵育24 h,建立H9c2细胞肥大模型[11],根据细胞凋亡率和心肌细胞肥大面积判定建模成功与否。
1.4 细胞分组及转染为验证FLI-1对心肌细胞凋亡的影响,将细胞分为对照组、模型组、模型+NC Vector组、模型+pcDNA-FLI-1组;为验证沉默Klotho介导FLI-1过表达对心肌细胞凋亡的影响,将细胞分为对照组、模型+NC Vector+NC siRNA组、模型+NC Vector+Klotho siRNA组、模型+pcDNA-FLI-1+NC siRNA组和模型+pcDNA-FLI-1+Klotho siRNA组。对照组不做任何处理;模型组建立H9c2细胞肥大模型;模型+NC Vector组、模型+ pcDNA-FLI-1组按照转染试剂盒说明书分别转染FLI-1的空载体及质粒;模型+NC Vector+NC siRNA组、模型+NC Vector+Klotho siRNA组、模型+pcDNA-FLI-1+NC siRNA组和模型+pcDNA-FLI-1+Klotho siRNA组等分别转染FLI-1的空载体及FLI-1质粒和Klotho siRNA,培养48 h。
1.5 流式细胞术检测细胞凋亡吸取细胞上清至对应离心管中备用,将各组细胞用PBS洗涤,用不含EDTA的胰酶消化,依次加入收集的细胞上清终止消化并将细胞收集各组细胞,250×g离心弃上清,加入PBS洗涤并将悬液转入1.5 mL EP管中,250×g离心弃上清,加入500 μL的Binding Buffer对细胞重悬,后依次加入5 μL Annexin V和PI混匀,室温避光反应15 min,用流式细胞仪进行检测。用CytExpert软件分析流式凋亡结果。
1.6 鬼笔环肽染色观测细胞肥大将各组细胞弃上清,4%的多聚甲醛固定15 min后PBS洗涤3次,用0.5% Triton X-100透化10 min,PBS洗涤3次;滴加山羊血清封闭液室温孵育20 min;然后用FITC-鬼笔环肽室温避光孵育30 min,倒置荧光显微镜观察结果,采用Image J软件测量心肌细胞表面积,以反映心肌细胞肥大程度。
1.7 Western blot检测蛋白表达水平对各组H9c2细胞用蛋白试剂盒提取总蛋白,用BAC蛋白定量试剂盒进行蛋白定量,后通过SDS-凝胶电泳、转膜、封闭,后加入稀释后的一抗(BNP 1 ∶2 000;NPPA 1 ∶2 700;β-MHC 1 ∶2 000;Bax 1 ∶2 000;Caspase3 1 ∶1 000;Bcl-2 1 ∶2 000;cleaved-Caspase3 1 ∶1 000、IGF-1R 1 ∶2 000;GNAI1 1 ∶10 000;PLCG1 1 ∶2 000;β-actin 1 ∶50 000),4 ℃孵育过夜,加入二抗[生物素化山羊抗兔IgG(H+L)],室温孵育2~3 h,ECL显色试剂盒显色后用凝胶成像仪拍照。以β-actin作为内参,计算目的蛋白的相对表达量。
1.8 统计学分析采用SPSS 17.0统计软件进行分析。计量资料以x±s表示,两两比较采用t检验,多样本均数间比较采用单因素方差分析,以P < 0.05表示差异有统计学意义。
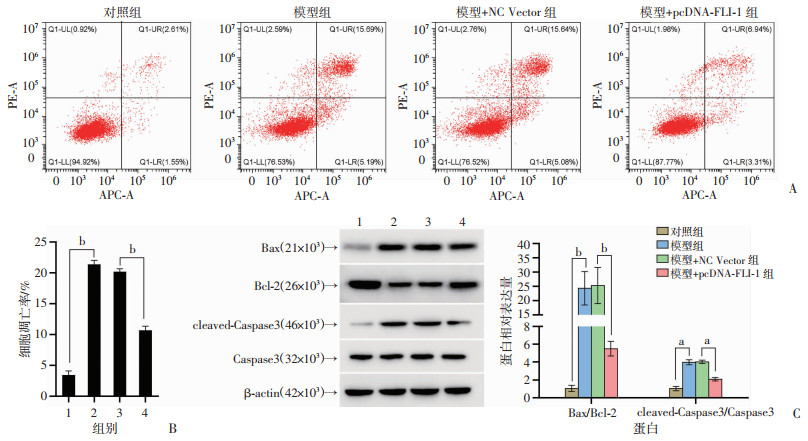
2 结果 2.1 FLI-1对ISO诱导的H9c2细胞的影响 2.1.1 FLI-1对心肌细胞凋亡的影响流式细胞术检测FLI-1对H9c2细胞凋亡的影响见图 1A、B,与对照组相比,模型组H9c2细胞凋亡率增加(P < 0.01);与模型+NC Vector组相比,模型+pcDNA-FLI-1组H9c2细胞凋亡率降低(P < 0.01)。Western blot检测结果显示,与对照组相比,模型组细胞中Bax/Bcl-2、cleaved-Caspase3/Caspase 3等凋亡相关蛋白表达增加(P < 0.05或P < 0.01,图 1C);与模型+NC Vector组相比,模型+pcDNA-FLI-1组细胞中Bax/Bcl-2、cleaved-Caspase3/Caspase 3等凋亡相关蛋白表达降低(P < 0.05或P < 0.01,图 1C)。
|
|
1:对照组;2:模型组;3:模型+NC Vector组;4:模型+pcDNA-FLI-1组;a:P < 0.05,b:P < 0.01 A、B:流式细胞仪检测各组细胞凋亡;C:Western blot检测各组细胞凋亡相关蛋白表达及半定量分析 图 1 FLI-1降低ISO诱导的H9c2细胞凋亡 |
2.1.2 FLI-1对心肌细胞肥大的影响
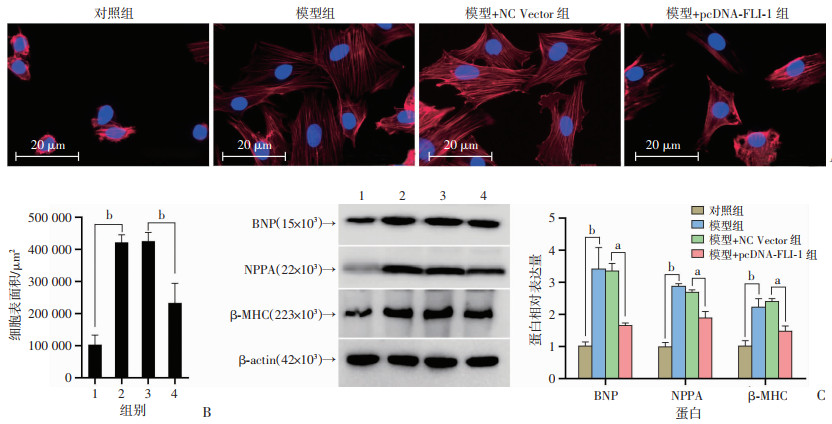
鬼笔环肽染色检测各组H9c2细胞的肥大程度见图 2A、B,与对照组相比,模型组H9c2细胞表面积增大(P < 0.01),与模型+NC Vector组相比,模型+pcDNA-FLI-1组H9c2细胞表面积降低,恢复为正常细胞大小(P < 0.01)。Western blot检测结果显示,与对照组相比,模型组细胞中BNP、NPPA和β-MHC等肥大相关蛋白的表达显著增加(P < 0.01,图 2C);与模型+NC Vector组相比,模型+pcDNA-FLI-1组细胞中BNP、NPPA和β-MHC等肥大相关蛋白的表达降低(P < 0.05,图 2C)。
|
|
1:对照组;2:模型组;3:模型+NC Vector组;4:模型+pcDNA-FLI-1组;a:P < 0.05,b:P < 0.01 A:鬼笔环肽染色观察细胞肥大程度;B:各组心肌细胞表面积分析;C:Western blot检测肥大相关因子蛋白表达及半定量分析 图 2 FLI-1对心肌细胞肥大的影响 |
2.1.3 FLI-1对ISO诱导的H9c2细胞中IGF-1R/Gi/PLC途径活性的影响
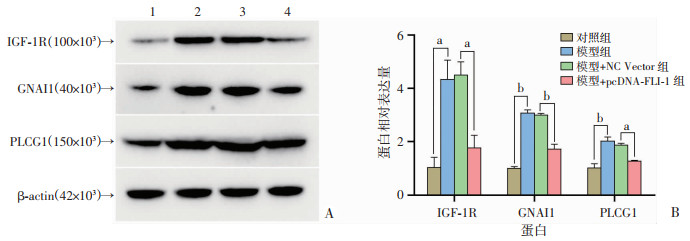
结果见图 3,与对照组相比,模型组H9c2细胞中IGF-1R、GNAI1和PLCG1表达增加(P < 0.05或P < 0.01);与模型+NC Vector组相比,模型+pcDNA-FLI-1组细胞中IGF-1R、GNAI1和PLCG1表达降低(P < 0.05或P < 0.01)。
|
| A:Western blot检测结果 1:对照组;2:模型组;3:模型+NC Vector组;4:模型+pcDNA-FLI-1组;B:半定量分析 a:P < 0.05,b:P < 0.01 图 3 FLI-1抑制ISO诱导的H9c2细胞中IGF-1R/Gi/PLC表达 |
2.2 沉默Klotho介导FLI-1过表达对心肌细胞的影响 2.2.1 沉默Klotho介导FLI-1过表达对心肌细胞凋亡的影响
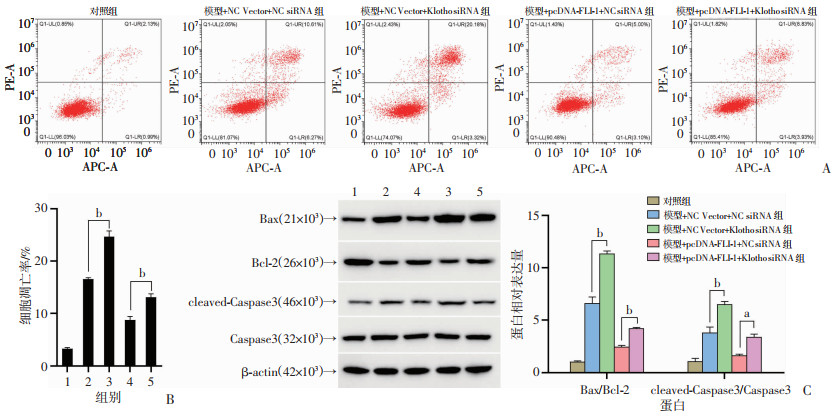
流式细胞术检测沉默Klotho介导FLI-1过表达对心肌细胞凋亡结果见图 4A、B,与模型+NC Vector+NC siRNA组相比,模型+NC Vector+Klotho siRNA组H9c2细胞凋亡率增加(P < 0.01);与模型+pcDNA-FLI-1+NC siRNA组相比,模型+pcDNA- FLI-1+Klotho siRNA组H9c2细胞凋亡率增加(P < 0.01)。Western blot检测结果显示,与模型+NC Vector+NC siRNA组相比,模型+NC Vector+Klotho siRNA组细胞中Bax/Bcl-2、cleaved-Caspase3/Caspase 3等凋亡相关蛋白表达增加(P < 0.05,图 4C);与模型+pcDNA-FLI-1+NC siRNA组相比,模型+pcDNA-FLI-1+Klotho siRNA组细胞中Bax/Bcl-2、cleaved-Caspase3/Caspase 3等凋亡相关蛋白表达增加(P < 0.05或P < 0.01,图 4C)。
|
|
1:对照组;2:模型+NC Vector+NC siRNA组;3:模型+NC Vector+Klotho siRNA组;4:模型+pcDNA-FLI-1+NC siRNA组;5:模型+pcDNA-FLI-1+Klotho siRNA组;a:P < 0.05,b:P < 0.01 A:流式细胞仪检测细胞凋亡;B:各组凋亡率分析;C:Western blot检测细胞凋亡相关蛋白表达及半定量分析 图 4 沉默Klotho介导FLI-1过表达对心肌细胞凋亡的影响 |
2.2.2 沉默Klotho介导FLI-1过表达对心肌细胞肥大的影响
鬼笔环肽染色检测各组H9c2细胞的肥大程度见图 5A、B,与模型+NC Vector+NC siRNA组相比,模型+NC Vector+Klotho siRNA组H9c2细胞表面积增大(P < 0.05),与模型+pcDNA-FLI-1+NC siRNA组相比,模型+pcDNA-FLI-1+Klotho siRNA组H9c2细胞表面积增大(P < 0.01)。Western blot检测结果显示,与模型+NC Vector+NC siRNA组相比,模型+NC Vector+Klotho siRNA组细胞中BNP、NPPA和β-MHC等肥大相关蛋白的表达显著增加(P < 0.01,图 5C);与模型+pcDNA-FLI-1+NC siRNA组相比,模型+pcDNA-FLI-1 +Klotho siRNA组细胞中BNP、NPPA和β-MHC等肥大相关蛋白的表达增加(P < 0.05或P < 0.01,图 5C)。
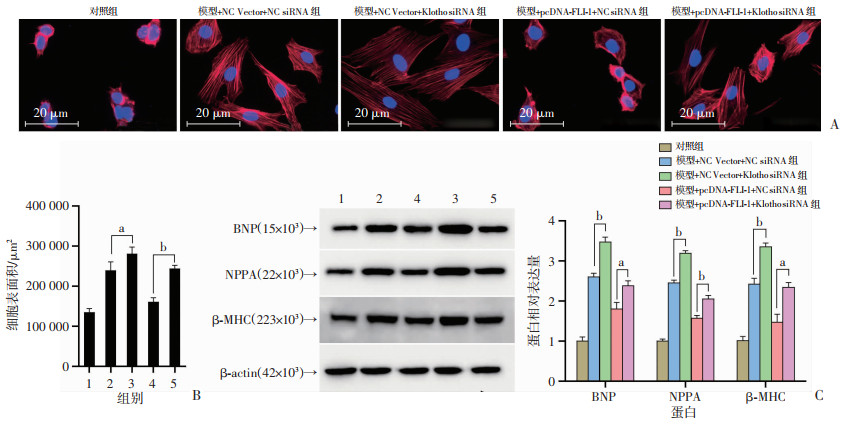
|
|
1:对照组;2:模型+NC Vector+NC siRNA组;3:模型+NC Vector+Klotho siRNA组;4:模型+pcDNA-FLI-1+NC siRNA组;5:模型+pcDNA-FLI-1+Klotho siRNA组;a:P < 0.05,b:P < 0.01 A:鬼笔环肽染色观察细胞肥大程度;B:各组心肌细胞表面积分析;C:Western blot检测肥大相关蛋白的表达及半定量分析 图 5 沉默Klotho介导FLI-1过表达对心肌细胞肥大的影响 |
2.2.3 沉默Klotho介导FLI-1过表达对IGF-1R/Gi/PLC途径活性的影响
结果见图 6,与模型+NC Vector+NC siRNA组相比,模型+NC Vector+Klotho siRNA组细胞中IGF-1R、GNAI1和PLCG1表达增加(P < 0.05);与模型+pcDNA-FLI-1+NC siRNA组相比,模型+pcDNA-FLI-1+Klotho siRNA组细胞中IGF-1R、GNAI1和PLCG1表达增加(P < 0.05)。
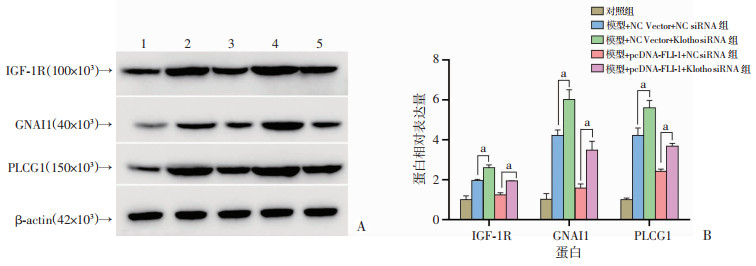
|
| A:Western blot检测结果 1:对照组;2:模型+NC Vector+NC siRNA组;3:模型+pcDNA-FLI-1+NC siRNA组;4:模型+NC Vector+Klotho siRNA组;5:模型+pcDNA-FLI-1+Klotho siRNA组;B:半定量分析 a:P < 0.05 图 6 沉默Klotho介导FLI-1过表达对IGF-1R/Gi/PLC途径活性的影响 |
3 讨论
心肌肥大是造成心血管疾病如高血压、主动脉狭窄和冠状动脉缺血等疾病发生的关键因素,作为心脏的一种代谢性补偿途径,会增加心脏氧气消耗,引起冠状动脉供氧不足,导致心衰的发生[12]。其发生过程中常伴随着胎儿基因(BNP、NPPA和β-MHC)表达、心脏收缩功能障碍及心肌间质纤维化增加[13]。心肌肥大可由多种因素诱导,ISO作为制备心肌肥大模型的常用药物,能够通过激动心脏β受体而导致心肌细胞发生氧化应激、炎症因子及细胞凋亡增加,造成心肌细胞肥大[14]。本研究通过在心肌细胞中加入ISO建立心肌细胞肥大模型,结果显示模型组心肌细胞中细胞凋亡及心肌肥大程度增加,表示建模成功。
FLI-1在多种癌症细胞(乳腺癌、白血病、淋巴瘤和骨髓瘤等)中起着重要作用,与细胞的增殖、凋亡、血管生成及免疫调节相关。近来研究证实,FLI-1与心血管疾病密切相关,如TANAKA等[15]研究证实在小鼠体内FLI-1表达缺失会导致小鼠心肌细胞的凋亡和细胞死亡。在心肌肥大的过程中往往伴随着心肌细胞凋亡,心肌细胞能够通过凋亡的形式清除受损细胞来维持细胞平衡,包含Bcl-2和Caspases家族[16]。Bcl-2主要通过线粒体凋亡途径维持促凋亡(如Bax)/抗凋亡(如Bcl-2)因子的平衡来对凋亡进行调节[17]。Caspases作为凋亡的执行者,当其在内源性通路中激活会导致PARP降解,最终诱导凋亡的发生[18]。故验证FLI-1对心肌细胞肥大及凋亡的作用十分重要,本研究通过对心肌细胞肥大和凋亡指标检测结果显示,FLI-1过表达后,心肌细胞中肥大(BNP、NPPA和β-MHC)及凋亡(Bax/Bcl-2、cleaved-Caspase3/Caspase3)等相关蛋白的表达降低,表示过表达FLI-1具有降低心肌细胞肥大及凋亡的作用。
Klotho是一种抗衰老基因,主要在肾脏远端小管上皮细胞和脑脉络丛中表达。研究证实Klotho具有调节心肌肥大的作用。研究表明,Klotho可通过抑制TGF-β1通路减轻小鼠心肌肥大、纤维化及心脏功能障碍[19]。Klotho缺乏加重异丙肾上腺素诱导的病理性心肌肥大和重塑,而Klotho过表达缓解异丙肾上腺素诱导的心脏病理改变,并改善其长期存活率[20]。Klotho可调节FGF信号、胰岛素样生长因子-1受体(IGF-1R)和Wnt等通路的激活[21]。其中IGF-1R与心脏的生理生长有关,可参与生理性和病理性心脏肥大,当细胞中IGF-1R含量增加时会通过调节下游因子促进心肌细胞肥大加剧[22]。本研究结果显示沉默Klotho的表达后,心肌细胞中IGF-1R、GNAI1和PLCG1表达增加,表明沉默Klotho的表达会逆转过表达FLI-1对细胞肥大的治疗作用,从而增加心肌细胞肥大程度。
综上所述,本研究提示FLI-1可能通过上调Klotho来抑制IGF-1R/Gi/PLC表达,减轻心肌细胞凋亡及心肌细胞肥大,为心肌肥大的治疗提供潜在的治疗靶点。
| [1] |
OLDFIELD C J, DUHAMEL T A, DHALLA N S. Mechanisms for the transition from physiological to pathological cardiac hypertrophy[J]. Can J Physiol Pharmacol, 2020, 98(2): 74-84. |
| [2] |
LIU B Y, LI L, LIU G L, et al. Baicalein attenuates cardiac hypertrophy in mice via suppressing oxidative stress and activating autophagy in cardiomyocytes[J]. Acta Pharmacol Sin, 2021, 42(5): 701-714. |
| [3] |
WAN M X, YIN K K, YUAN J, et al. YQFM alleviated cardiac hypertrophy by apoptosis inhibition and autophagy regulation via PI3K/AKT/mTOR pathway[J]. J Ethnopharmacol, 2022, 285: 114835. |
| [4] |
WANG Y F, HUANG Z, SUN M Y, et al. ETS transcription factors: Multifaceted players from cancer progression to tumor immunity[J]. Biochim Biophys Acta Rev Cancer, 2023, 1878(3): 188872. |
| [5] |
BEN-DAVID Y, GAJENDRAN B, SAMPLE K M, et al. Current insights into the role of Fli-1 in hematopoiesis and malignant transformation[J]. Cell Mol Life Sci, 2022, 79(3): 163-171. |
| [6] |
HALLER S T, KENNEDY D J, SHIDYAK A, et al. Monoclonal antibody against marinobufagenin reverses cardiac fibrosis in rats with chronic renal failure[J]. Am J Hypertens, 2012, 25(6): 690-696. |
| [7] |
XIE B, HU F, LI M, et al. FLI-1 mediates tumor suppressor function via Klotho signaling in regulating CRC[J]. Cell Biol Int, 2020, 44(7): 1514-1522. |
| [8] |
PRUD'HOMME G J, KURT M, WANG Q H. Pathobiology of the klotho antiaging protein and therapeutic considerations[J]. Front Aging, 2022, 3: 931331. |
| [9] |
CHEN K, WANG S, SUN Q W, et al. Klotho deficiency causes heart aging via impairing the Nrf2-GR pathway[J]. Circ Res, 2021, 128(4): 492-507. |
| [10] |
李宝善, 马厚勋, 王艳娇, 等. Klotho基因转导延缓自发性高血压大鼠高血压进程及改善其心脏损害的作用研究[J]. 中华医学遗传学杂志, 2012, 29(6): 662-668. LI B S, MA H X, WANG Y J, et al. Klotho gene attenuates the progression of hypertension and heart damage in spontaneous hypertensive rats[J]. Chin J Med Genet, 2012, 29(6): 662-668. |
| [11] |
邱雨美, 尹史帝, 董伟, 等. 薯蓣皂苷对异丙肾上腺素诱导H9c2心肌细胞肥大的保护作用[J]. 中药药理与临床, 2022, 38(2): 94-99. QIU Y M, YIN S D, DONG W, et al. Protective effect of dioscin on isoproterenol-induced hypertrophy of H9c2 cardiomyocytes[J]. Pharmacol Clin Chin Mater Med, 2022, 38(2): 94-99. |
| [12] |
REN Z N, YU P, LI D D, et al. Single-cell reconstruction of progression trajectory reveals intervention principles in pathological cardiac hypertrophy[J]. Circulation, 2020, 141(21): 1704-1719. |
| [13] |
PROTSENKO Y L, BALAKIN A A, KUZNETSOV D A, et al. Contractility of right ventricular myocardium in male and female rats during physiological and pathological hypertrophy[J]. Bull Exp Biol Med, 2017, 162(3): 303-305. |
| [14] |
SUN T L, LI W Q, TONG X L, et al. Xanthohumol attenuates isoprenaline-induced cardiac hypertrophy and fibrosis through regulating PTEN/AKT/mTOR pathway[J]. Eur J Pharmacol, 2021, 891: 173690. |
| [15] |
TANAKA M, YAMAGUCHI S, YAMAZAKI Y, et al. Somatic chromosomal translocation between Ewsr1 and Fli1 loci leads to dilated cardiomyopathy in a mouse model[J]. Sci Rep, 2015, 5: 7826. |
| [16] |
CHENG Y, SHEN A L, WU X Y, et al. Qingda Granule attenuates angiotensin Ⅱ-induced cardiac hypertrophy and apoptosis and modulates the PI3K/AKT pathway[J]. Biomedecine Pharmacother, 2021, 133: 111022. |
| [17] |
BRUCKHEIMER E M, CHO S H, SARKISS M, et al. The Bcl-2 gene family and apoptosis[M]// AL-RUBEAI M. Apoptosis. Berlin, Heidelberg: Springer Berlin Heidelberg, 1998: 75-105. DOI: 10.1007/bfb0102306.
|
| [18] |
FAN T J, HAN L H, CONG R S, et al. Caspase family proteases and apoptosis[J]. Acta Biochim Biophys Sin (Shanghai), 2005, 37(11): 719-727. |
| [19] |
DING J Q, TANG Q, LUO B H, et al. Klotho inhibits angiotensin Ⅱ-induced cardiac hypertrophy, fibrosis, and dysfunction in mice through suppression of transforming growth factor-β1 signaling pathway[J]. Eur J Pharmacol, 2019, 859: 172549. |
| [20] |
XIE J, CHA S K, AN S W, et al. Cardioprotection by Klotho through downregulation of TRPC6 channels in the mouse heart[J]. Nat Commun, 2012, 3: 1238. |
| [21] |
ZHOU X X, FANG X S, JIANG Y J, et al. Klotho, an anti-aging gene, acts as a tumor suppressor and inhibitor of IGF-1R signaling in diffuse large B cell lymphoma[J]. J Hematol Oncol, 2017, 10(1): 37. |
| [22] |
OCK S, HAM W, KANG C W, et al. IGF-1 protects against angiotensin Ⅱ-induced cardiac fibrosis by targeting αSMA[J]. Cell Death Dis, 2021, 12(7): 688. |




