2. 431600 武汉,湖北省分子诊断重点实验室
2. Hubei Provincial Key Laboratory of Molecular Diagnosis, Wuhan, Hubei Province, 431600, China
肝肺综合征(hepatopulmonary syndrome, HPS)是在慢性肝病基础上出现的晚期肺部并发症,主要表现为肺微血管扩张、动静脉分流、病理性肺血管新生(pathological pulmonary angiogenesis, PPA),进而导致肺部血氧困难,造成患者出现严重的低氧血症,临床预后极差[1-2]。其中,慢性肝硬化导致的病理性因子大量释放入血作用于肺脏组织是PPA的主要因素,机制不清,亟待研究[3-5]。探讨其血管新生发生机制,探寻有效的干预靶点,采用有效的药物或者干预措施减少PPA的进展,可能是减轻HPS患者缺氧症状的有效策略。
血管新生过程需要依赖内皮细胞的群体迁移,即内皮细胞群相互协调朝着一致的方向做集体迁移[6-7]。细胞迁移通常始于对细胞外刺激的响应,而细胞极性形成是迁移的结构基础,迁移细胞被高度极化表现为信号分子、细胞骨架、中心体、高尔基体和膜定向运输的不对称分布,随即产生细胞突触端。细胞在突出端引导下沿着迁移方向进行动态伸展,其分子机制尚不清楚。α-TAT1, 又称微管乙酰化转移酶1(alpha tubulin acetyltransferase 1,α-TAT1),通过对微管K40位点进行乙酰化修饰,增加对生物机械应力的抵抗力,促进聚合微管的稳定性[8]。有研究报道显示,小鼠水平敲除α-TAT1后可减弱神经发育过程中皮质神经元的迁移能力,表明α-TAT1在迁移过程中发挥重要作用[9]。前期的研究过程中,我们发现HPS血清能显著刺激内皮细胞的迁移能力[10],然而,α-TAT1在PPA中的具体作用机制仍不清楚。因此本研究拟采用siRNA干扰沉默α-TAT1, 观察内皮细胞在HPS血清刺激下迁移极性和成血管能力的变化,明确α-TAT1是HPS中PPA发生发展的关键分子。
1 材料与方法 1.1 实验动物实验动物为雄性健康SD大鼠,8周龄,体质量200~220 g,购于宜昌三峡大学动物中心,大鼠饲养为SPF级,室温维持在24~26 ℃,可自由摄食和饮水。本实验获得华中科技大学动物伦理委员会批准(2020年),所有操作都遵循《实验动物保护条例》。
1.2 主要试剂α-TAT1兔来源单克隆抗体购于美国Invitrogen公司;Ace-α-tubulin兔来源单克隆抗体购于美国Abcam公司;CD31小鼠来源单克隆抗体购于美国CST公司;GM130兔来源单克隆抗体购于美国CST公司;Tubulin兔来源多克隆抗体、Alexa-Fluor 488驴抗兔IgG和Alexa-Fluor 555驴抗小鼠IgG购于广州碧云天生物科技有限公司;Matrigengel购于上海ABW公司;HRP标记辣根过氧化物酶二抗、Western blot试剂盒购于武汉赛维尔生物公司;诺考达唑购于美国MedChemexpress公司;α-TAT1-siRNA、siRNA NC购于广州锐博生物技术有限公司。
1.3 大鼠胆总管结扎模型(common bile duct ligation, CBDL)HPS动物模型采用CBDL法构建,大鼠模型构建前1 d晚上进行禁食,次日实验中2%~3%七氟烷进行吸入麻醉。麻醉起效后,腹部皮肤消毒铺巾,无菌手术器械暴露腹腔,寻找十二指肠,游离胆总管,随后用3-0不可吸收线结扎肝门部和十二指肠部胆总管,并剪断两结扎点之间的胆总管,假手术组(Sham组)大鼠只进行胆总管游离。随后肠道还纳,注入青霉素80万单位,进行关腹。手术结束后将大鼠放置电温毯上,等待自然苏醒,按计划继续饲养2周或4周。
1.4 大鼠血清收集Sham和HPS大鼠分别采用七氟烷麻醉后,腹部皮肤碘伏消毒,无菌手术器械暴露腹腔,寻找游离腹主动脉,22G采血针置入动脉管腔,收集血液,即刻进行动脉血气分析,其余血液4 ℃过夜,直至血清充分析出,离心10 min(3 000 r/min)后取上清液,-80 ℃保存备用。
1.5 HE染色观察肺组织形态肺组织固定24 h后石蜡包埋,厚度10 μm, 进行HE染色,光镜下观察拍照,并进行分析。
1.6 公开数据库和在线分析网站α-TAT1相关单细胞转录组数据来源于Tabula Muris网站。使用在线分析网站(https://tabula-muris.ds.czbiohub.org/)下载肺组织数据集进行基因表达分析。
1.7 细胞培养及转染复苏HUVECs细胞,用ECM培养液, 内含1%内皮细胞生长因子、1%双抗和10%的胎牛血清,37 ℃、5% CO2恒温培养。收集对数生长期的HUVECs细胞并接种于6孔板(Western blot实验)或者放置有细胞爬片的12孔培养板(细胞免疫荧光实验)中,继续培养待贴壁细胞长满底部面积的50%~60%时进行转染。细胞分为4组: Sham血清+siRNA NC组、Sham血清+siRNA α-TAT1组、HPS血清+siRNA NC组、HPS血清+siRNA α-TAT1组。siRNA转染操作严格按试剂盒说明书进行,其中转染效率检测分组为siRNA对照组(S-NC)、1号α-TAT1干扰RNA(S-1#)、2号α-TAT1干扰RNA(S-2#)、3号α-TAT1干扰RNA(S-3#)。转染结束后继续恒温培养6 h,更换培养基并继续培养。细胞转染后48 h进行后续实验,包括划痕实验、高尔基体定位分析、体外成血管实验。
1.8 细胞划痕实验待HUVECs融合度达到100%,取200 μL TIP头垂直于细胞平面,在细胞层面上进行划痕,无菌PBS洗细胞3次,更换新鲜含1%血清培养基。将细胞放入37 ℃ 5% CO2培养箱培养。24 h取出细胞,显微镜下观察并拍照。使用Image J软件打开图片后,随机划取6~8条水平线,计算细胞间距离的均值。迁移率=(初始时间点细胞两侧平均距离-终点细胞两侧平均距离)/初始时间点细胞两侧平均距离。
1.9 免疫荧光染色组织免疫荧光:Sham组大鼠和HPS组大鼠麻醉后经左心灌流,4 ℃预冷的PBS冲净循环血液,之后4%多聚甲醛进行灌流直至大鼠四肢僵硬,肺脏颜色透明,取出肺脏,继续浸泡在4%多聚甲醛进行外固定24 h,蔗糖梯度脱水后进行冰冻切片。切片在室温下使用0.5% Triton X-100和10%山羊血清进行破膜和封闭处理,兔抗大鼠α-TAT1 (1 ∶200)和小鼠抗大鼠CD31(1 ∶200)一抗4 ℃孵育过夜。次日切片用PBS洗涤3次,Alexa-Fluor 488共轭驴抗兔IgG和Alexa-Fluor 555共轭驴抗小鼠IgG混匀后在37 ℃下孵育1 h,再用DAPI染色5 min。使用荧光显微镜采集图像,分析CD31阳性细胞中α-TAT1的荧光强度。
细胞免疫荧光:取出12孔板,吸去培养基,PBS清洗3次,进行破膜和封闭处理,兔抗人α-Tubulin或兔抗人GM130一抗4 ℃孵育过夜,次日吸去一抗,PBS清洗3次,Cy3共轭驴抗兔IgG或Alexa-Fluor 555共轭驴抗兔IgG混匀后在37 ℃下孵育1 h进行荧光二抗染色1 h,PBS清洗3次, DAPI复染, 取出细胞爬片进行封片,荧光显微镜下进行观察拍照。
1.10 Western blot检测细胞实验中去除各组培养基,每孔加入150 μL RIPA蛋白裂解液(含蛋白酶抑制剂和磷酸酶抑制剂),置于冰上裂解30 min, 高速离心取上清液,取得细胞总蛋白,用BCA蛋白定量试剂盒测定蛋白浓度,调整蛋白浓度后,按照每孔20 μg蛋白上样,电泳结束后转到PVDF膜上,5%BSA封闭后用相应的一抗、二抗孵育,PBST清洗后ECL显影拍照。通过Image J软件分析各组条带灰度值,并进行统计分析。
1.11 微管稳定性测试12孔板中细胞转染48 h,之后各组条件下继续培养22 h,加入诺考达唑10 μmol/L(微管聚合抑制剂)处理, 培养2 h,收集细胞爬片进行细胞免疫荧光染色(α-Tubulin一抗,1 ∶500;Cy3标记荧光二抗,1 ∶500), 封片后荧光显微镜下观察聚合微管的强度变化。
1.12 高尔基体核周定位分析细胞划痕后继续在各组条件下培养24 h, 多聚甲醛固定细胞,之后通过细胞免疫荧光观察高尔基体(GM130一抗,1 ∶400;Alexa-Fluor 555标记荧光二抗,1 ∶500)在细胞核周的分布状态,以细胞核为中心,以细胞迁移方向为基准,高尔基体主体在细胞突出端120°范围内视为具备迁移极性,之后统计划痕处第1排细胞中迁移极性阳性细胞的百分比,以此反映细胞迁移极性的水平。阳性细胞百分比越高,细胞迁移极性越强。
1.13 体外成血管实验将提前解冻的Matrigengel用预冷枪头混匀,冰上操作,EP管提前预冷,12孔板提前预冷,每孔加入200 μL基质胶,在37 ℃孵箱放置30 min进行基质胶固化。将提前进行细胞转染的HUVECs消化,制成悬液,每孔加入5×105个细胞,37 ℃孵箱孵育,6 h后镜下观察并拍照。采用Image J中Angiogenesis Analyzer插件对成管长度、成环数量结果进行统计分析。
1.14 统计学分析采用GraphPad Prism 6.0软件进行分析,计量资料以x±s表示,多组间比较用单因素方差分析,P < 0.05为差异有统计学意义。
2 结果 2.1 α-TAT1在小鼠肺血管内皮细胞中低表达为了明确在正常肺组织中血管内皮细胞α-TAT1的表达情况,通过Tabula在线数据库分析α-TAT1基因在小鼠肺组织各细胞亚群中的表达水平。如图 1所示,α-TAT1表达阳性细胞数在肺组织中各类细胞中整体占比较低,包括支气管纤毛柱状上皮、基质细胞、肺泡上皮细胞、肺血管内皮细胞等,其中α-TAT1表达阳性细胞占内皮细胞总数约5.63% (图 1A、B)。分析α-TAT1基因在肺组织各细胞亚群中的相对表达值发现,α-TAT1在支气管纤毛柱状细胞中表达值最高,而肺血管内皮细胞表达值较低(图 1C、D)。以上结果在一定程度上提示,在血管静息状态下肺血管内皮细胞中α-TAT1呈低表达状态。
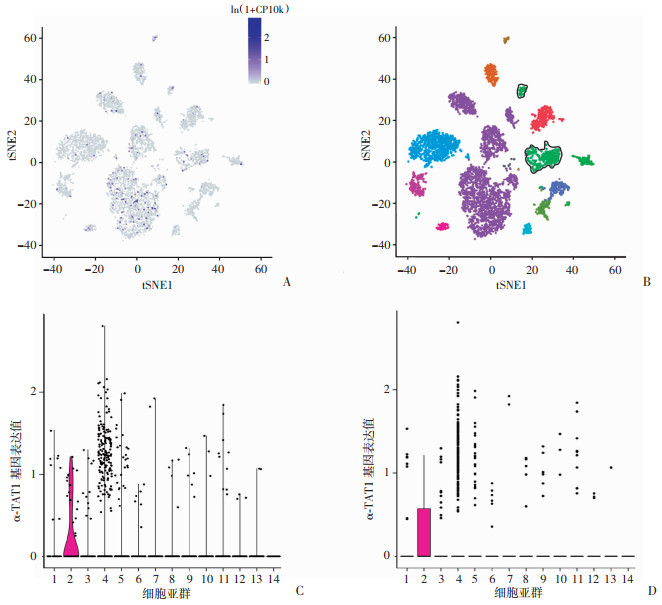
|
|
1:NA细胞;2:支气管纤毛柱状细胞;3:2型肺泡细胞;4:基质细胞;5:内皮细胞;6:骨髓细胞;7:白细胞;8:B淋巴细胞;9:肺泡巨噬细胞;10:T淋巴细胞;11:自然杀伤细胞;12:经典单核细胞;13:非经典单核细胞;14:肥大细胞 A:α-TAT1基因在各亚群细胞中的表达;B:α-TAT1在肺组织各亚群细胞中的分类;C:α-TAT1基因在各亚群细胞中的表达小提琴统计;D:α-TAT1基因在各亚群细胞中的表达箱形统计 图 1 单细胞测序结果分析α-TAT1基因在小鼠肺组织各细胞亚群中的表达水平和相对表达值 |
2.2 HPS模型的构建
本研究采用经典的CBDL法构建HPS模型。肺HE染色结果提示,相比Sham组,2周HPS组可见肺泡间隔增厚,肺泡间隔内可见炎症细胞浸润,部分肺泡间隔断裂。4周HPS组肺泡间隔增宽,挤压部分肺泡腔,肺泡间隔断裂,肺泡腔和肺泡间隔均可见大量炎症细胞浸润。动脉血气分析结果提示,2周HPS和4周HPS后血氧分压(PaO2)显著下降(P < 0.01),表明大鼠出现低氧血症,以上结果提示HPS建模成功(图 2)。

|
| A: 各组大鼠肺HE染色;B: 各组大鼠氧分压情况 a: P < 0.01 图 2 HPS大鼠不同时期肺组织的病理变化(x±s) |
2.3 HPS大鼠肺血管内皮细胞中α-TAT1的表达增高
在体的免疫荧光共定位结果表明,相比Sham组,2周和4周HPS组中CD31阳性内皮细胞中α-TAT1的表达量显著增加,呈时间依赖性增高(P < 0.01,图 3A)。采用体外细胞模型,配制含10% Sham血清和10% HPS血清的ECM培养基分别添加到HUVECs中培养0、12、24 h(图 3B)。Western blot结果显示,相比Sham组,HPS组血清可以促进HUVECs中α-TAT1表达,且呈时间依赖性增高(P < 0.01,图 3C)。结果提示内皮细胞中α-TAT1在HPS病理刺激下表达水平增高,可能是HPS病理性血管新生中诱导肺内皮细胞迁移的重要因素。

|
|
a: P < 0.01 A:免疫荧光检测Sham、2周HPS和4周HPS组大鼠肺血管内皮细胞中α-TAT1的表达,箭头示内皮细胞;B: 体外模型中大鼠血清刺激实验示意图;C:Western blot检测Sham大鼠血清和4周HPS大鼠血清刺激对HUVECs中α-TAT1表达的影响 图 3 HPS大鼠肺血管内皮细胞中α-TAT1的表达(n=3, x±s) |
2.4 沉默α-TAT1可降低HPS血清刺激下HUVECs的微管乙酰化水平和微管的稳定性
为了验证α-TAT1是否能影响HPS血清诱导的HUVECs迁移增强效应,采用siRNA方式敲低α-TAT1的表达水平来观察迁移能力变化。siRNA转染48 h后进行Western blot实验,结果显示:与siRNA NC组相比,siRNA α-TAT1 1#、siRNA α-TAT1 2#组中蛋白下调不明显,siRNA α-TAT1 3#组下调显著(P < 0.01),因此选用siRNA α-TAT1 3#进行下一步实验(图 4A)。之后采用Western blot检测Ace-α-tubulin表达变化,结果提示,HPS血清刺激下,相比siRNA NC组,siRNA α-TAT1组中Ace-α-tubulin表达水平显著下降(P < 0.01),表明微管乙酰化水平降低(图 4B)。同时采用诺考达唑预处理,检测各组中微管聚合水平,结果显示,HPS血清刺激下,相比siRNA NC组,siRNA α-TAT1组中聚合微管水平减弱(P < 0.01),提示稳定性显著下降(图 5)。以上结果表明α-TAT1基因的沉默有效性,且能降低HUVECs的微管乙酰化水平和微管的稳定性。
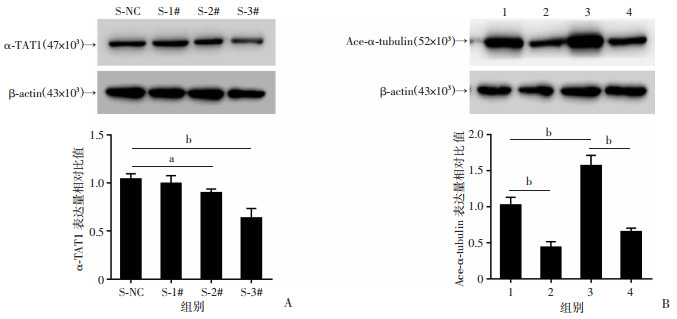
|
|
a: P < 0.05, b: P < 0.01 A: Western blot检测不同siRNA α-TAT1在HUVECs中的沉默效率S-NC: si-RNA对照组;S-1#: 1号α-TAT1干扰RNA;S-2#: 2号α-TAT1干扰RNA;S-3#: 3号α-TAT1干扰RNA;B: Western blot检测siRNA α-TAT1干预后HUVECs中微管乙酰化的表达水平1:Sham血清+siRNA NC组;2:Sham血清+siRNA α-TAT1组; 3: HPS血清+siRNA NC组;4: HPS血清+siRNA α-TAT1组 图 4 沉默α-TAT1对HPS中内皮细胞微管乙酰化的影响(n=3, x±s) |
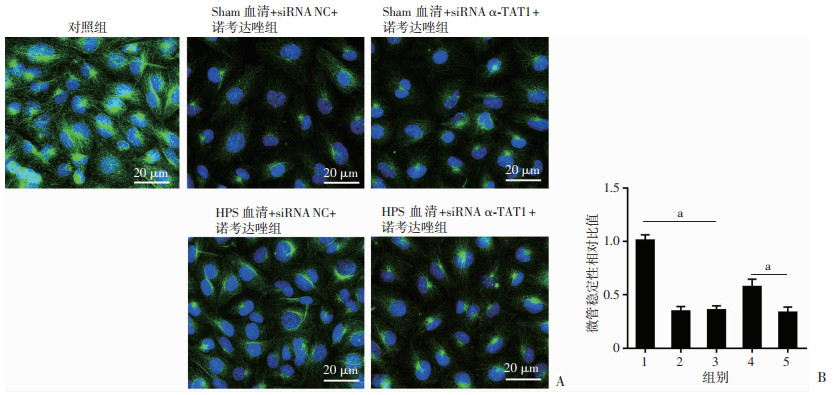
|
| A:细胞免疫荧光检测各组中HUVECs在诺考达唑处理后微管聚合水平; B:微管稳定性分析 1: 对照组;2: Sham血清+siRNA NC+诺考达唑组;3:Sham血清+siRNA α-TAT1+诺考达唑组; 4: HPS血清+siRNA NC+诺考达唑组; 5: HPS血清+siRNA α-TAT1+诺考达唑组; a : P < 0.01 图 5 沉默α-TAT1对HPS中内皮细胞微管稳定性的影响(n=3, x±s) |
2.5 沉默α-TAT1可降低HPS血清刺激下HUVECs的迁移极性和迁移能力
由于细胞划痕可以诱导划痕处的细胞具有迁移的空间和能力,因此采用细胞免疫荧光和细胞划痕的方法分析划痕处细胞的迁移极性等生物学行为。结果提示,在HPS刺激下,相比siRNA NC组,siRNA α-TAT1组内皮细胞中高尔基体分布于核周突出端的阳性比例由70.6%下降到32.1%,差异具有统计学意义(P < 0.01,图 6)。同时采用划痕实验检测迁移能力,结果表明,siRNA α-TAT1组内皮细胞迁移率下降,差异具有统计学意义(P < 0.01,图 7)。
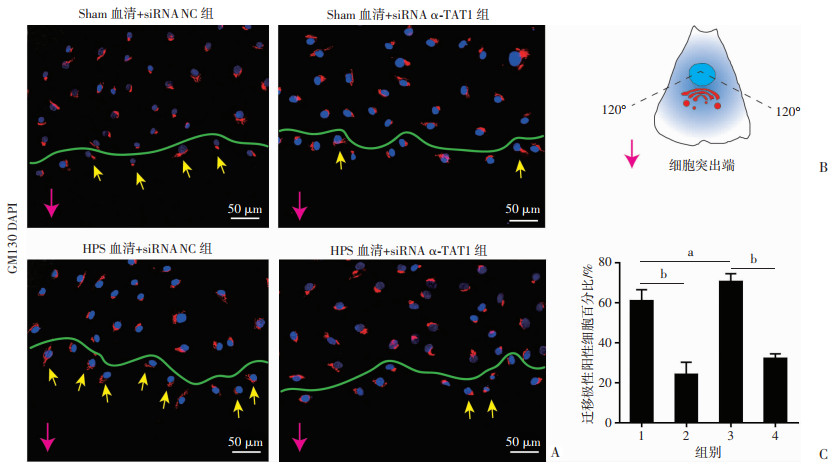
|
|
1:Sham血清+siRNA NC组;2:Sham血清+siRNA α-TAT1组; 3: HPS血清+siRNA NC组; 4: HPS血清+siRNA α-TAT1组; 黄色箭头:迁移极性阳性细胞;粉色箭头:细胞迁移方向;绿色分界线:细胞划痕处第一排细胞分界线;a: P < 0.05,b: P < 0.01 A: 细胞免疫荧光检测各组HUVECs中GM130在核周分布情况;B: 高尔基体分布示意图,高尔基体主体在细胞突出端120°范围内视为具备迁移极性;C: 细胞划痕处第一排HUVECs具有迁移极性的细胞百分比统计 图 6 沉默α-TAT1对HPS血清刺激下HUVECs的迁移极性影响(n=5, x±s) |

|
| A: 细胞划痕实验结果;B: 细胞迁移率 1:Sham血清+siRNA NC组;2:Sham血清+siRNA α-TAT1组;3:HPS血清+siRNA NC组;4:HPS血清+siRNA α-TAT1组;a: P < 0.01 图 7 沉默α-TAT1对HPS血清刺激下HUVECs迁移能力的影响(n=11, x±s) |
2.6 沉默α-TAT1可抑制HPS血清刺激下HUVECs的成血管能力
采用体外成管实验检测内皮细胞成血管能力变化,结果提示,在HPS刺激下,相比siRNA NC组,siRNA α-TAT1组中HUVECs成管长度和数量均显著下降, 差异具有统计学意义(P < 0.01,图 8)。

|
|
1:Sham血清+siRNA NC组;2:Sham血清+siRNA α-TAT1组;3:HPS血清+siRNA NC组;4:HPS血清+siRNA α-TAT1组;a: P < 0.05, b: P < 0.01 A: 各组成管实验结果(×100);B: 各组成管长度相对比值;C: 各组成环数量 图 8 沉默α-TAT1对HPS血清刺激下HUVECs成血管能力的影响(n=7, x±s) |
3 讨论
本课题前期研究发现肺微血管内皮细胞(pulmonary microvascular endothelial cells, PMVECs)在HPS血清刺激下迁移能力显著加强,与COX-2、PTEN、CDC42的异常表达及激活有关[10-11]。无论是单一或者集体模式的细胞迁移,细胞都会产生移动极性,其特征是蛋白质、细胞器和脂质的不对称分布和形状,以及细胞两端的差异活动,其迁移极性高效而快速形成是迁移能力提升的主要因素,进而可以促进新生血管的延伸和分支形成[12]。在细胞迁移过程中,高尔基体会在细胞突出端产生极化反应,通过分析高尔基体的定位可以判断细胞是否产生迁移极性。另外,骨架动力排列、机械张力、信号分子的胞内扩散参与了迁移极性的形成和维持[13]。这些不同的机制有效结合在一起,促进了细胞在迁移时能够保持稳定的极性。然而,在HPS病理条件刺激下,调控肺血管内皮细胞迁移极性的机制尚不明确,需要进一步探索。
大量文献报道,微管可以通过翻译后修饰来控制微管结构的相关特性,从而进行组装和拆卸等过程,比如乙酰化、甲基化、谷氨酸化、酪氨酸化[14-15]。其中,微管乙酰化修饰在细胞迁移中发挥重要作用,可能与促进高尔基体再定位到细胞突出端和囊泡快速运输等过程有关[16]。α-TAT1是一种使α微管蛋白中的K40位点产生乙酰化的酶,有助于维持微管的稳定性,可以促进高尔基体依赖的囊泡运输,加快迁移突出端微丝网状结构和粘着斑复合物的形成。在转移性乳腺癌研究中,α-微管蛋白乙酰化水平升高与预后不良相关[17]。在结肠癌研究中,αTAT1表达的增加促进了癌细胞的侵袭[18],这些结论表明,α-TAT1介导的微管稳定性可能促进了细胞迁移。本研究发现4周HPS大鼠肺血管内皮细胞α-TAT1表达显著升高,同时体外实验中采用HPS血清刺激内皮细胞进行干预,也验证了这样的结果,以上结果均表明α-TAT1可能参与了PPA的发生发展。本研究进一步试图探究HPS中α-TAT1的过表达与病理性血管新生的相关性。在功能实验中,本研究利用siRNA技术在HUVECs中下调α-TAT1的表达,并检测了内皮细胞的迁移极性水平、迁移能力以及成血管能力的改变。结果显示,HUVECs中沉默α-TAT1可有效降低微管乙酰化水平,同时减低了微管的稳定性。近期的一项研究表明,微管发生乙酰化后,由于静电干扰的产生,αK40环的运动受到限制,减少了微管分子蛋白间的横向接触,这种结构上的横向接触减少增加了微管结构的柔韧性[19]。这一结论与先前研究保持一致,认为K40位点乙酰化介导的微管横向相互作用的减弱是对细胞极性形成和维持的一种保护机制,可以防止先前存在破损的微管在重复应力作用下发生大面积的损伤,从而避免微管的完全断裂[8, 20]。同时本研究还表明,通过下调α-TAT1可以抑制HUVECs的迁移极性以及成血管水平。因此在HPS病理条件刺激下,内皮细胞中α-TAT1的过表达增加了微管结构乙酰化水平,促进了微管结构的稳定性,提示α-TAT1在HPS介导的内皮细胞迁移行为中扮演了关键作用。
综上所述,本研究证实了HPS中内皮细胞α-TAT1处于高表达状态,并与病理性血管新生具有密切关系,其作用可能与通过维持内皮细胞中微管结构的稳定性和增强迁移极性快速形成有关。因此在后续研究中我们将重点关注α-TAT1在HPS中发挥的复杂作用,为寻找治疗HPS更为有效的靶点提供新的理论基础。
| [1] |
GANDHI K D, TAWEESEDT P T, SHARMA M, et al. Hepatopulmonary syndrome: an update[J]. World J Hepatol, 2021, 13(11): 1699-1706. |
| [2] |
赖静, 陈林, 李才溢, 等. 布雷他汀改善高位胆总管结扎术大鼠肺炎性损伤的研究[J]. 陆军军医大学学报, 2022(8): 757-764. LAI J, CHEN L, LI C Y, et al. Blebbistatin ameliorates pneumonic injury after high common bile duct ligation in rats[J]. J Army Med Univ, 2022(8): 757-764. |
| [3] |
KAWUT S M, KROWKA M J, FORDE K A, et al. Impact of hepatopulmonary syndrome in liver transplantation candidates and the role of angiogenesis[J]. Eur Respir J, 2022, 60(2): 2102304. |
| [4] |
LIU H Y, GU H J, GU L L, et al. CX3CR1 regulates angiogenesis and activation of pro-angiogenic factors and triggers macrophage accumulation in experimental hepatopulmonary syndrome model[J]. Gastroenterol Hepatol, 2021, 44(2): 115-124. |
| [5] |
CHEN L, HAN Y, LI Y J, et al. Hepatocyte-derived exosomal miR-194 activates PMVECs and promotes angiogenesis in hepatopulmonary syndrome[J]. Cell Death Dis, 2019, 10(11): 853. |
| [6] |
MARGADANT C. Positive and negative feedback mechanisms controlling tip/stalk cell identity during sprouting angiogenesis[J]. Angiogenesis, 2020, 23(2): 75-77. |
| [7] |
KIM Y H, CHOI J, YANG M J, et al. A MST1-FOXO1 cascade establishes endothelial tip cell polarity and facilitates sprouting angiogenesis[J]. Nat Commun, 2019, 10(1): 838. |
| [8] |
XU Z J, SCHAEDEL L, PORTRAN D, et al. Microtubules acquire resistance from mechanical breakage through intralumenal acetylation[J]. Science, 2017, 356(6335): 328-332. |
| [9] |
LI L, WEI D, WANG Q, et al. MEC-17 deficiency leads to reduced α-tubulin acetylation and impaired migration of cortical neurons[J]. J Neurosci, 2012, 32(37): 12673-12683. |
| [10] |
TANG X, LIU C, CHEN L, et al. Cyclooxygenase-2 regulates HPS patient serum induced-directional collective HPMVEC migration via PKC/Rac signaling pathway[J]. Gene, 2019, 692: 176-184. |
| [11] |
GAO J, YU H F, BAI X H, et al. Loss of cell polarity regulated by PTEN/Cdc42 enrolled in the process of hepatopulmonary syndrome[J]. J Cell Mol Med, 2019, 23(8): 5542-5552. |
| [12] |
VAIDŽIULYTE K, MACÉ A S, BATTISTELLA A, et al. Persistent cell migration emerges from a coupling between protrusion dynamics and polarized trafficking[J]. Elife, 2022, 11: e69229. |
| [13] |
SEETHARAMAN S, ETIENNE-MANNEVILLE S. Cytoskeletal crosstalk in cell migration[J]. Trends Cell Biol, 2020, 30(9): 720-735. |
| [14] |
MAGIERA M M, BODAKUNTLA S, ŽIAK J, et al. Excessive tubulin polyglutamylation causes neurodegene-ration and perturbs neuronal transport[J]. EMBO J, 2018, 37(23): e100440. |
| [15] |
JANKE C, MAGIERA M M. The tubulin code and its role in controlling microtubule properties and functions[J]. Nat Rev Mol Cell Biol, 2020, 21(6): 307-326. |
| [16] |
CHIU S C, HUANG Y J, WEI T W, et al. The PRMT5/HURP axis retards Golgi repositioning by stabilizing acetyl-tubulin and Golgi apparatus during cell migration[J]. J Cell Physiol, 2022, 237(1): 1033-1043. |
| [17] |
BOGGS A E, VITOLO M I, WHIPPLE R A, et al. α-Tubulin acetylation elevated in metastatic and basal-like breast cancer cells promotes microtentacle formation, adhesion, and invasive migration[J]. Cancer Res, 2015, 75(1): 203-215. |
| [18] |
OH S, YOU E, KO P, et al. Genetic disruption of tubulin acetyltransferase, αTAT1, inhibits proliferation and invasion of colon cancer cells through decreases in Wnt1/β-catenin signaling[J]. Biochem Biophys Res Commun, 2017, 482(1): 8-14. |
| [19] |
ESHUN-WILSON L, ZHANG R, PORTRAN D, et al. Effects of α-tubulin acetylation on microtubule structure and stability[J]. Proc Natl Acad Sci USA, 2019, 116(21): 10366-10371. |
| [20] |
PORTRAN D, SCHAEDEL L, XU Z J, et al. Tubulin acetylation protects long-lived microtubules against mechanical ageing[J]. Nat Cell Biol, 2017, 19(4): 391-398. |




