椎间盘退行性病变是一种常见的慢性骨科疾病,对中老年人的生活质量造成了极大的负面影响。椎间盘退变主要表现为腰痛,影响了世界上约40%的人口[1]。在中国,60岁以上的老人中90%以上患有或曾患有椎间盘退变,给社会和整个国家带来了重大的经济负担。然而,目前对椎间盘退行性病变的病理生理学机制的了解十分匮乏,对此疾病的治疗主要是采用药物或手术对症治疗,但这些方法都无法从疾病的发生发展机制上着手,只能缓解临床症状,难以阻止或逆转退变的进程,因此了解椎间盘退变的发病机制至关重要。据文献报道,髓核细胞是椎间盘退变的始发因素[2],因此,对髓核细胞功能状态的研究对揭示椎间盘退行性病变的病理生理学机制至关重要。
椎间盘是人体中最大的无血管组织。虽然软骨终板的外围区域和纤维环的外1/3处可能会有极少数的血管渗入,但这些血管均不能渗透入髓核组织中。髓核基本处于一个缺氧的微环境,髓核细胞生理状态下需要的氧气主要是通过自由扩散到达髓核区域。正是因为这种氧气的扩散机制,椎间盘组织具有一个显著氧浓度梯度,其中髓核中心区的氧分压明显低于周围区域[3]。另一项研究也表明,由于椎间盘退变过程中软骨终板通透性的丧失而增强,退变椎间盘组织的氧分压低于正常[4]。因此,研究髓核细胞不同程度缺氧环境下的凋亡状态及其机制很有必要。研究表明,一些化合物可以用来模拟物理缺氧,如二价金属或者铁络合剂[5]。CoCl2已经用于多种细胞系来模拟缺氧环境,它可以通过取代Fe2+抑制PHD来达到缺氧的效果。
赖氨酰氧化酶(lysyl oxidase,LOX)是一种铜依赖的胺氧化酶,对组织的发育和成熟至关重要。研究表明,LOX蛋白广泛存在于人体的许多组织中,在心脏、胎盘、睾丸、肺、子宫和肾脏中检测到LOX高表达[6]。它对细胞增殖、衰老、诱导氧化应激、细胞外基质的重塑及辅助肿瘤细胞逃逸等过程都具有重要作用。研究发现,LOX能够抑制TNF-α诱导髓核细胞的凋亡[7]。然而,LOX在椎间盘缺氧条件下的作用却未见报道。本研究通过探讨LOX在缺氧诱导的髓核细胞凋亡中的调控作用,为研究椎间盘退变机制提供新的思路。
1 材料与方法 1.1 动物和试剂30只8周龄SD大鼠购自重庆腾鑫比尔公司,其中15只用来构建动物模型,另外15只用来提取大鼠原代髓核细胞。2、8及20月龄的SD大鼠各3只,购自重庆腾鑫比尔公司用于影像学比较。BAPN试剂购自美国MedChemExpress公司,pcDNA3.1(+)-LOX重组质粒购自中国上海生工公司,LOX抗体购自美国Abcam公司,Bcl2抗体购自武汉三鹰公司,用辣根过氧化物酶(HRP)标记的抗兔或抗鼠抗体来自碧云天公司。本研究通过陆军军医大学实验动物福利伦理审查委员会审核批准(AMUWEC2019277)。
1.2 原代髓核细胞的分离及培养SD大鼠15只,体质量150~220 g,8周龄,以大剂量戊巴比妥钠(>150 mg/kg)腹腔注射处死,在无菌条件下仔细取出尾锥。用眼科钳分离中心的凝胶样髓核组织,然后用0.2%的Ⅱ型胶原酶在37 ℃下消化1 h,释放髓核细胞。过滤后,将髓核细胞转移到添加10%胎牛血清和1%抗生素的DMEM-F12培养基中。髓核细胞在37 ℃、5%CO2、2%O2条件下培养,每隔2 d更换1次完整的培养液。所有细胞实验均使用第4代细胞。
1.3 药物处理及分组按照文献[8]的方法建立髓核细胞缺氧凋亡模型。CoCl2的使用剂量分别为0、50、100、200、300 μmol/L。BAPN是一种特异性的LOX蛋白抑制剂,可以靶向抑制LOX蛋白的活性位点,并降低LOX蛋白的表达。本研究中使用的BAPN浓度为300 μmol/L[9]。CoCl2与BAPN处理细胞的时间均为24 h。
1.4 LOX过表达稳定细胞株的建立pcDNA3.1(+)-LOX重组质粒购自上海生工,髓核细胞以5×105/孔接种于6孔板中,培养过夜。每孔加入4 μg质粒与10 μL lipofectamine2000转染试剂,pcDNA3.1(+)质粒作阴性对照。无血清培养基培养5 h后换完全培养基培养,24 h后加入抗生素G418筛选阳性细胞。1周后筛选稳定细胞系继续传代培养。
1.5 Western blot检测髓核细胞或髓核组织的蛋白质提取液在含有磷酸酶和蛋白酶抑制剂的裂解缓冲液中冰上裂解30 min后收获。用碧云天公司生产的BCA蛋白分析试剂测定总蛋白浓度。蛋白质提取液经8%或12%的SDS-PAGE凝胶分离蛋白,并将其转移到免疫印迹的PVDF膜上。用5%的脱脂牛奶在室温封闭1 h,然后与一抗(1 ∶1 000)4 ℃孵育过夜。用TBST洗涤3次,每次15 min。漂洗后,用辣根过氧化物酶(HRP)标记的抗兔或抗鼠抗体在室温下孵育1 h。再次用TBST洗涤3次,每次15 min。最后,将膜在暗室中曝光以显示条带。根据GAPDH的表达对基因表达进行标准化。使用Image J对结果进行量化。
1.6 细胞凋亡检测首先收集漂浮细胞和贴壁细胞,然后离心5 min。去掉上清液,加入195 μL Annexin V-PE结合液,轻轻地重新悬浮细胞。加入5 μL Annexin V-PE或APC染液,轻轻混合。加入10 μL 7-AAD或DAPI染液,轻轻搅拌。在室温20~25 ℃的黑暗中孵化15 min。然后用Gallios流式细胞仪进行分析。
1.7 核磁共振检测不同年龄段大鼠以大剂量戊巴比妥钠(>150 mg/kg) 腹腔注射处死,2 h内完成核磁共振检测。检测让大鼠保持水平俯卧姿势,尾巴直立在核磁共振设备上。采用3.0T系统(填充时间为2 000 ms,回声时间为80 ms,扫描厚度为2.5 mm)获得T2加权横断面图像。
1.8 椎间盘退变模型的建立及药物处理选择15只大鼠,分为空白对照组(n=5)、安慰剂组(n=5)、BAPN组(n=5)。禁食12 h,禁水4 h后,用2%(质量体积比)的戊巴比妥钠(40 mg/kg)麻醉。首先将12号针缓慢插入安慰剂组与BAPN组大鼠腰椎间盘(Co6),深度0.3 cm,轻轻旋转半周,建立椎间盘退变模型。将20 μL PBS注入安慰剂组,20 μL BAPN(100 μg/mL)注入BAPN组。术后0、2周和4周行X线检测椎间盘高度。
1.9 X线拍摄及DHI%测量利用X线测量大鼠椎间盘高度,根据文献[10]的方法计算DHI%评估大鼠鼠尾退变程度。所有大鼠术后2周和4周行X线检测。让大鼠保持水平俯卧姿势,尾巴直立在X线照相设备(GE)上。在准直器到胶片的距离为66 cm,穿透力为35 kV,曝光时间为63 ms的条件下进行X射线检查。检查结果由3名研究人员分别单独计算椎体及椎间盘高度,并使用Image J对结果进行量化分析。
1.10 统计学分析用SPSS 10.0软件进行统计学分析,计量资料以x±s表示,组间比较采用t检验或单因素方差分析。P<0.05为差异有统计学意义。
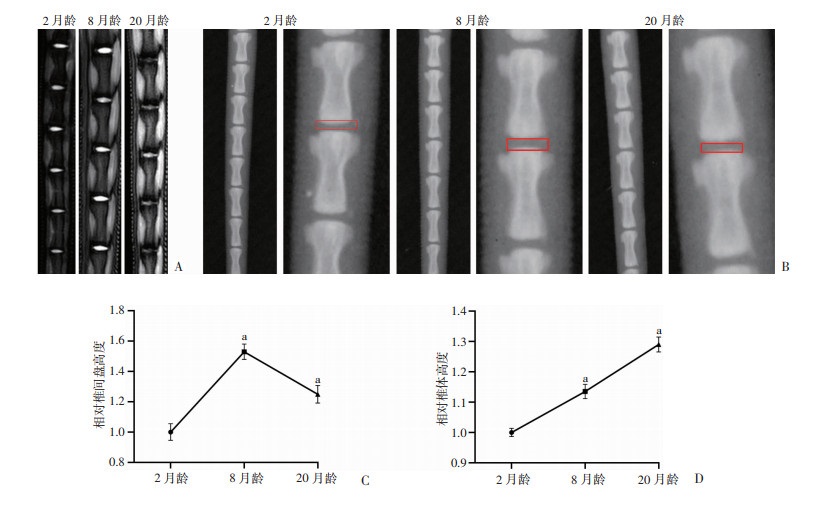
2 结果 2.1 大鼠椎间盘随着年龄增加而退变采用MRI与X线检测椎间盘退变,MRI提示,与8月龄大鼠相比,20月龄的椎间盘T2信号出现降低(图 1A)。在X线中发现,随着年龄的增加,大鼠尾椎椎体高度逐渐增加(P<0.01,图 1B、D),但椎间盘高度在8月龄大鼠明显增加(P<0.01),但20月龄却有减少的趋势(P<0.01,图 1B、C)。从影像学上证实了大鼠的椎间盘发生了年龄相关性椎间盘退变。
|
|
A:2、8及20月龄大鼠核磁共振比较;B:2、8及20月龄大鼠X线及局部放大图 a:P<0.01,与2月龄比较 C:2、8及20月龄X线相对椎间盘高度;D:2、8及20月龄X线尾椎相对椎体高度 图 1 不同年龄大鼠椎间盘退变情况 |
2.2 椎间盘髓核中LOX表达随年龄增加而降低
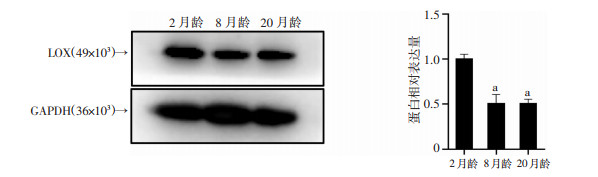
采用Western blot检测不同年龄段大鼠椎间盘中LOX蛋白的含量,结果显示,与2月龄相比,8月龄及20月龄椎间盘髓核组织中LOX的蛋白表达均明显降低(P<0.01,图 2),表明LOX蛋白可能在椎间盘的年龄相关性退变进程中发挥重要的作用。
|
| a:P<0.01,与2月龄比较 图 2 不同年龄大鼠椎间盘LOX蛋白表达 |
2.3 CoCl2建立髓核细胞缺氧凋亡模型
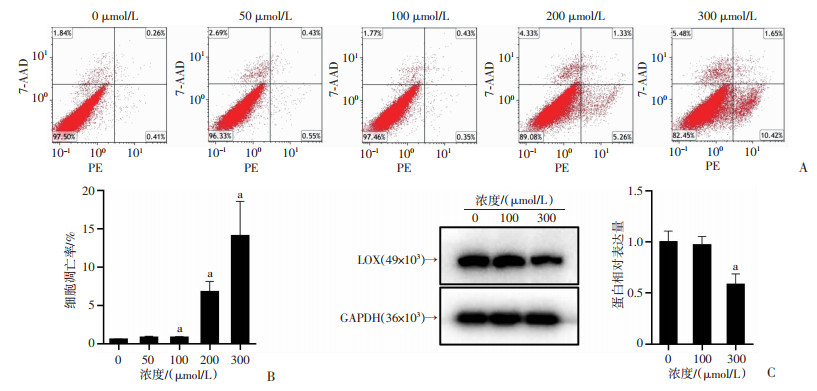
建立髓核细胞的CoCl2缺氧模型。通过流式细胞术,证明随着CoCl2浓度的提高,在100、200、300 μmol/L浓度下,髓核细胞的凋亡比例增加(P<0.05,图 3A、B)。Western blot实验也证实,在300 μmol/L CoCl2处理下,LOX蛋白发生下调(P<0.01,图 3C)。上述结果表明,随着缺氧程度的加重,髓核细胞凋亡增加,并伴随有LOX蛋白表达的下调,这提示LOX蛋白参与缺氧诱导的髓核细胞凋亡过程。
|
|
a:P<0.05,与0 μmol/L比较 A:流式细胞术检测不同浓度CoCl2处理后髓核细胞的凋亡比例;B:凋亡结果统计;C:Western blot检测不同浓度CoCl2处理下髓核细胞LOX表达量及半定量统计 图 3 不同浓度CoCl2对髓核细胞凋亡及LOX蛋白表达的影响 |
2.4 抑制LOX蛋白可加重髓核细胞缺氧凋亡
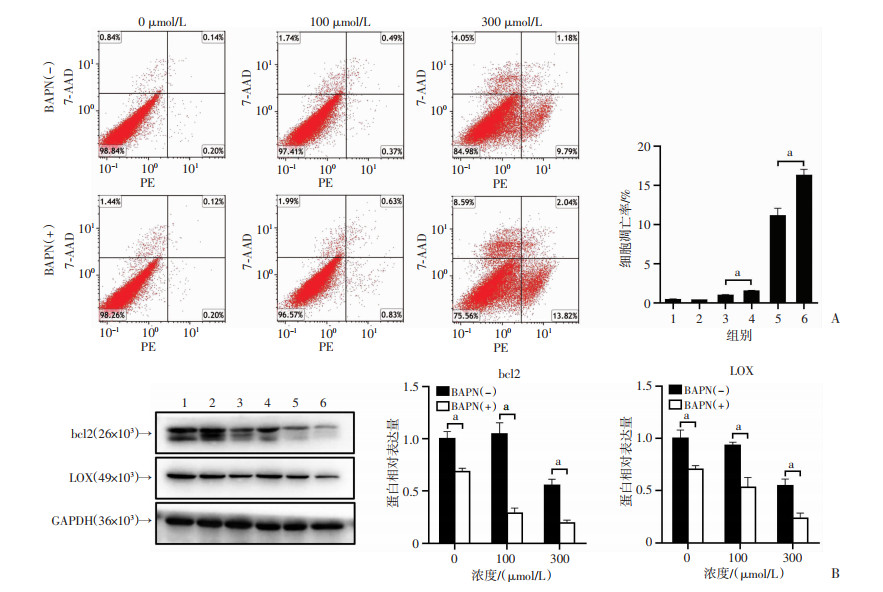
在100或300 μmol/L CoCl2处理组,BAPN明显增加了髓核细胞的凋亡比例(P<0.01,图 4A)。进一步通过Western blot检测其中LOX蛋白和抗凋亡基因bcl2的表达。在各组中,BAPN均明显降低LOX蛋白的表达(P<0.01),在100或300 μmol/L CoCl2处理组中,凋亡相关蛋白bcl2也随之降低(P<0.01,图 4B)。
|
|
1:0 μmol/L CoCl2+0 μmol/L BAPN;2:100 μmol/L CoCl2+0 μmol/L BAPN;3:300 μmol/L CoCl2+0 μmol/L BAPN;4:0 μmol/L CoCl2+300 μmol/L BAPN;5:100 μmol/L CoCl2+300 μmol/L BAPN;6:300 μmol/L CoCl2+300 μmol/L BAPN;a:P<0.01 A:流式细胞术检测不同浓度CoCl2处理下髓核细胞凋亡情况及统计分析;B:Western blot检测不同浓度CoCl2处理下髓核细胞LOX蛋白及凋亡相关蛋白bcl2的表达及统计分析 图 4 抑制LOX蛋白表达后髓核细胞在不同浓度CoCl2处理下的凋亡结果 |
2.5 过表达LOX蛋白可加重髓核细胞缺氧凋亡
为了进一步研究LOX蛋白在髓核细胞是否可以抵抗髓核细胞的缺氧凋亡,构建LOX过表达髓核细胞。pcDNA3.1(+)-LOX重组质粒酶切产物(NheI/BamHI)预期大小为1 524 bp和5 428 bp,琼脂糖凝胶电泳条带符合预期结果(图 5A)。进一步观察到在严重缺氧中增强LOX蛋白的表达后,髓核细胞凋亡率明显减少(P<0.01,图 5B、D)。通过Western blot实验检测其中LOX蛋白和抗凋亡基因bcl2的表达,结果显示,与pcDNA3.1(+)组相比,pcDNA3.1(+)-LOX组中LOX蛋白的表达明显上升(P<0.05)。常氧条件下,过表达LOX后,凋亡相关蛋白bcl2无统计学差异。但随着缺氧程度的增加,过表达LOX后凋亡相关蛋白bcl2明显上调(P<0.05,图 5C)。
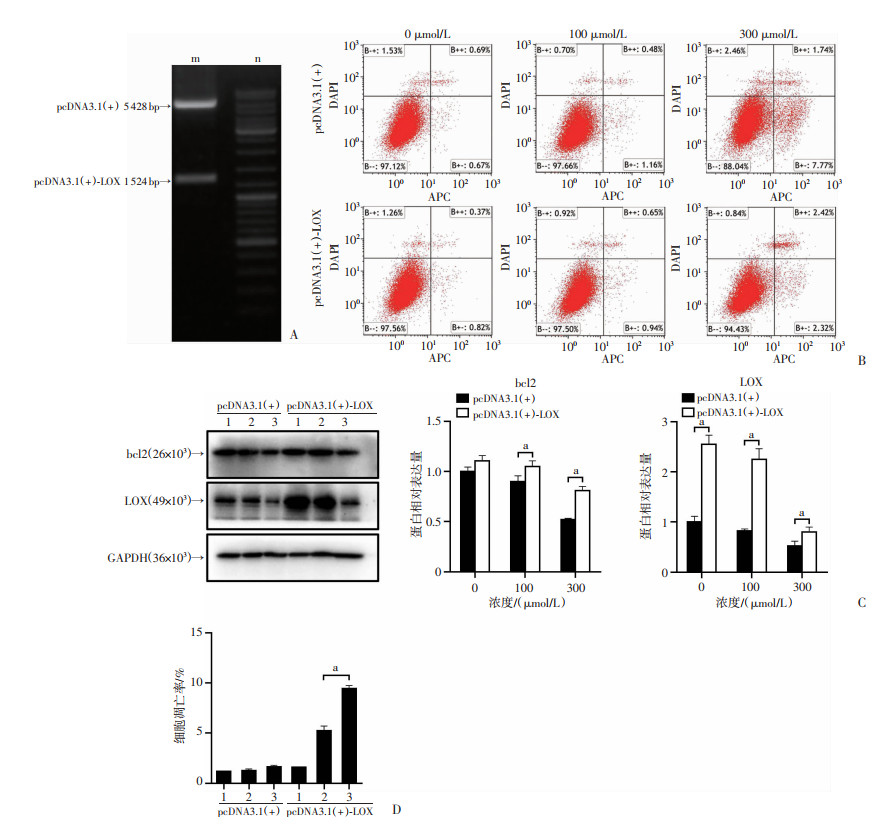
|
|
1:0 μmol/L CoCl2;2:100 μmol/L CoCl2;3:300 μmol/L CoCl2;a:P<0.05 A:电泳结果 m:DNA标准;n:pcDNA3.1(+)-LOX重组质粒酶切产物(NheI/BamHI);B:流式细胞术检测不同浓度CoCl2处理下髓核细胞凋亡情况;C:Western blot检测不同浓度CoCl2处理下髓核细胞LOX蛋白及凋亡相关蛋白bcl2的表达和统计分析;D:流式细胞术检测不同浓度CoCl2处理下髓核细胞凋亡统计分析 图 5 过表达LOX蛋白后髓核细胞在不同缺氧条件下的凋亡结果 |
|
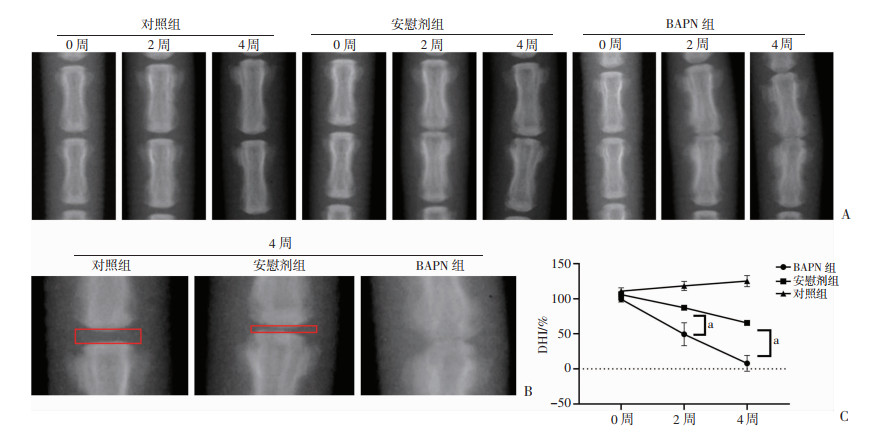
| A:不同处理大鼠术前,术后2、4周X线片;B:术后4周X线片局部放大图;C:DHI%统计结果 a:P<0.05 图 6 不同处理大鼠术前,术后2、4周X线片及DHI%统计 |
2.6 抑制LOX蛋白后加重椎间盘退变
对照组大鼠鼠尾椎间盘DHI%在2周与4周测量时均发生上升,主要为椎体生长导致;安慰剂组在2周时鼠尾椎间盘DHI%出现下降,并在4周时继续降低,为针刺诱导的椎间盘退变导致。BAPN组在2周时鼠尾椎间盘DHI%明显下降,甚至4周时部分实验组出现融合。与安慰剂组相比,BAPN组大鼠鼠尾椎间盘退变程度更加剧烈,表明LOX蛋白在椎间盘退变中可能发挥了一定作用,利用BAPN抑制LOX蛋白表达可以加速椎间盘的退变。
3 讨论椎间盘退变的患病率随着年龄的增长逐渐增加,严重影响老年人生活质量。相似的研究发现,小鼠的DHI随年龄稳步下降[11]。细胞外基质的降解是椎间盘退变的主要标志,而髓核中这些基质成分的合成随着年龄的改变具有不同的合成状态。聚集素的生物合成和Ⅱ型前胶原含量在5岁时达到高峰,然后开始出现下降,变性的Ⅱ型胶原在5岁后增加[12]。随着年龄的增加,髓核中髓核细胞的数量和细胞外基质的合成代谢出现下降,这可能是椎间盘年龄相关性退变的病因。本研究发现随着年龄的增加,椎间盘中LOX蛋白出现下降,提示LOX蛋白可能参与了椎间盘年龄相关性的退变过程。
由于缺乏血管的植入,椎间盘髓核细胞处于一个物质交换能力差、氧浓度低的环境中。这种低氧环境对髓核细胞的存活、生长、代谢调节和基质合成均发挥一定作用。髓核细胞可以在常规的低氧环境下保持存活[13]。但有研究发现,椎间盘退变后,其内部的氧分压会进一步降低[14]。在这种情况下,髓核细胞是否仍能保持生理活性呢?为了进一步研究缺氧对髓核细胞生存状态的影响,本研究利用CoCl2的缺氧模型证实了髓核细胞在轻微的低氧环境下仍能保持生理活性。研究发现,随着缺氧的加重,细胞凋亡逐渐增加。严重缺氧环境下LOX蛋白表达明显降低,同时降低LOX蛋白表达后明显上调了髓核细胞在缺氧条件下的细胞凋亡。在此基础上,本研究构建LOX过表达的稳定髓核细胞系,发现其在缺氧环境下细胞凋亡率明显下降,表明在严重缺氧环境中,LOX蛋白参与了髓核细胞凋亡的调节。
髓核细胞的凋亡将导致髓核基质成分的缺失和生理完整性的破坏,进而降低髓核的机械性能,并导致了椎间盘退行性病变。GRUBER等[15]使用外科标本证明了退变的椎间盘组织中有较高的细胞凋亡率。髓核细胞的凋亡和随后的细胞外基质变性是椎间盘退行性病变发生发展的关键步骤。大量的研究已经证明LOX与纤维化性疾病密切相关[16]。而椎间盘退变中,髓核组织中聚集素和胶原蛋白水平的降低会使髓核脱水,进而出现纤维化。因此,我们猜想LOX在同为纤维化性疾病的椎间盘退变中可能发挥着作用。在此基础上,本研究发现LOX参与了缺氧诱导的大鼠髓核细胞的凋亡过程。细胞凋亡导致了椎间盘中功能细胞的减少,进而加速了椎间盘的退变进程。
随着大鼠的衰老,衰老的髓核细胞大量分泌促炎因子,包括TNF-α、IL-1β、IL-17、IL-6、COX-2趋化因子,可促进相邻NP细胞的衰老和免疫细胞的浸润,这使得退变NP组织中的炎症微环境进一步加剧[17]。肿瘤坏死因子-α可显著降低LOX蛋白的表达[7],导致衰老的椎间盘中LOX蛋白表达降低。同时,ERLER等[18]发现LOX启动子中的HRE是HIF1-α的下游靶点,椎间盘退行性病变的早期通常都会表现出HIF1-α表达的失调[19],这可能也是衰老的椎间盘中LOX蛋白表达降低的原因。总之,在大鼠的衰老过程中,LOX蛋白可能受炎症因子及HIF1-α的调节而减少,进而加速了椎间盘的退变。但其具体机制尚未见报道,这也是我们进一步的研究方向。
综上所述,本研究证实LOX参与了椎间盘年龄相关性退变进程,体外建立了CoCl2细胞缺氧模型,构建了LOX过表达的稳定髓核细胞株,证实LOX蛋白可影响严重缺氧诱导的髓核细胞凋亡,动物体内实验进一步验证抑制LOX可加速椎间盘退变的进程。
| [1] |
ZHANG S, HU B, LIU W, et al. The role of structure and function changes of sensory nervous system in intervertebral disc-related low back pain[J]. Osteoarthr Cartil, 2021, 29(1): 17-27. DOI:10.1016/j.joca.2020.09.002 |
| [2] |
PRIYADARSHANI P, LI Y, YAO L. Advances in biological therapy for nucleus pulposus regeneration[J]. Osteoarthr Cartilage, 2016, 24(2): 206-212. DOI:10.1016/j.joca.2015.08.014 |
| [3] |
FENG G J, JIN X B, HU J, et al. Effects of hypoxias and scaffold architecture on rabbit mesenchymal stem cell differentiation towards a nucleus pulposus-like phenotype[J]. Biomaterials, 2011, 32(32): 8182-8189. DOI:10.1016/j.biomaterials.2011.07.049 |
| [4] |
RICHARDSON S M, KNOWLES R, TYLER J, et al. Expression of glucose transporters GLUT-1, GLUT-3, GLUT-9 and HIF-1α in normal and degenerate human intervertebral disc[J]. Histochem Cell Biol, 2008, 129(4): 503-511. DOI:10.1007/s00418-007-0372-9 |
| [5] |
DAVID B T, CURTIN J J, BROWN J L, et al. Treatment with hypoxia-mimetics protects cultured rat Schwann cells against oxidative stress-induced cell death[J]. Glia, 2021, 69(9): 2215-2234. DOI:10.1002/glia.24019 |
| [6] |
KIM Y, BOYD C D, CSISZAR K. A new gene with sequence and structural similarity to the gene encoding human lysyl oxidase[J]. J Biol Chem, 1995, 270(13): 7176-7182. DOI:10.1074/jbc.270.13.7176 |
| [7] |
ZHAO R Z, LIU W Q, WANG M Y, et al. Lysyl oxidase inhibits TNF-α induced rat nucleus pulposus cell apoptosis via regulating Fas/FasL pathway and the p53 pathways[J]. Life Sci, 2020, 260: 118483. DOI:10.1016/j.lfs.2020.118483 |
| [8] |
GAO X X, LIU C H, HU Z L, et al. The biological effect of cobalt chloride mimetic-hypoxia on nucleus pulposus cells and the comparability with physical hypoxia in vitro[J]. Front Biosci (Landmark Ed), 2021, 26(10): 799-812. DOI:10.52586/4989 |
| [9] |
PAYNE S L, FOGELGREN B, HESS A R, et al. Lysyl oxidase regulates breast cancer cell migration and adhesion through a hydrogen peroxide-mediated mechanism[J]. Cancer Res, 2005, 65(24): 11429-11436. DOI:10.1158/0008-5472.CAN-05-1274 |
| [10] |
MA C J, LIU X, CHE L, et al. Stem cell therapies for intervertebral disc degeneration: immune privilege reinforcement by Fas/FasL regulating machinery[J]. Curr Stem Cell Res Ther, 2015, 10(4): 285-295. DOI:10.2174/1574888x10666150416114027 |
| [11] |
VINCENT K F, BUNDOCK J, DONA C P G, et al. Loss of lumbar disc height with age and its impact on pain and sensitivity associated behaviors in mice[J]. Eur Spine J, 2023, 32(3): 848-858. DOI:10.1007/s00586-023-07545-3 |
| [12] |
ANTONIOU J, STEFFEN T, NELSON F, et al. The human lumbar intervertebral disc: evidence for changes in the biosynthesis and denaturation of the extracellular matrix with growth, maturation, ageing, and degeneration[J]. J Clin Invest, 1996, 98(4): 996-1003. DOI:10.1172/JCI118884 |
| [13] |
BIBBY S R S, URBAN J P G. Effect of nutrient deprivation on the viability of intervertebral disc cells[J]. Eur Spine J, 2004, 13(8): 695-701. DOI:10.1007/s00586-003-0616-x |
| [14] |
LI Y J, LIU S, PAN D Y, et al. The potential role and trend of HIF-1α in intervertebral disc degeneration: friend or foe? (Review)[J]. Mol Med Rep, 2021, 23(4): 239. DOI:10.3892/mmr.2021.11878 |
| [15] |
GRUBER H E, JR HANLEY E N. Analysis of aging and degeneration of the human intervertebral disc. Comparison of surgical specimens with normal controls[J]. Spine, 1998, 23(7): 751-757. DOI:10.1097/00007632-199804010-00001 |
| [16] |
MANNAERTS I, SCHROYEN B, VERHULST S, et al. Gene expression profiling of early hepatic stellate cell activation reveals a role for Igfbp3 in cell migration[J]. PLoS One, 2013, 8(12): e84071. DOI:10.1371/journal.pone.0084071 |
| [17] |
VAN DEURSEN J M. The role of senescent cells in ageing[J]. Nature, 2014, 509(7501): 439-446. DOI:10.1038/nature13193 |
| [18] |
ERLER J T, BENNEWITH K L, NICOLAU M, et al. Lysyl oxidase is essential for hypoxia-induced metastasis[J]. Nature, 2006, 440(7088): 1222-1226. DOI:10.1038/nature04695 |
| [19] |
SILAGI E S, SCHIPANI E, SHAPIRO I M, et al. The role of HIF proteins in maintaining the metabolic health of the intervertebral disc[J]. Nat Rev Rheumatol, 2021, 17(7): 426-439. DOI:10.1038/s41584-021-00621-2 |




