肺癌是导致癌症相关死亡的主要因素之一,每年约有180万人死于肺癌[1]。非小细胞肺癌(non-small cell lung cancer,NSCLC)约占肺癌的85%,主要包含肺腺癌与肺鳞癌2种病理学分型。其中,肺腺癌占NSCLC的50%左右[2]。近20年来,尽管靶向治疗及免疫治疗带来了肺腺癌临床治疗实践的革新,但肺腺癌患者5年生存率的提高仍然有限[3]。因此,寻找新的肺腺癌治疗靶点至关重要。
Holliday交叉识别蛋白(Holliday junction recognition protein,HJURP)是着丝粒蛋白-A (centromere protein-A, CENP-A)的分子伴侣。基于人细胞的研究证实,HJURP紧密调控染色体分离及细胞分裂过程[4]。KATO等[5]报道HJURP对肿瘤细胞有调控作用,证实其在癌细胞染色体稳定性和存活中起维持作用。研究表明,HJURP基因与多种癌症的不良预后相关,如膀胱癌[6]、前列腺癌[7]等。HJURP对肿瘤发生发展起促进作用,例如,HJURP可以通过介导p21失稳导致肝细胞癌增殖增加[8];HJURP可以通过上调鞘氨醇激酶1(sphingosine kinase 1,SPHK1)促进肝细胞癌肿瘤细胞上皮间质转化[9]。
既往研究表明,高表达HJURP与肺腺癌患者预后不良密切相关[10-11]。然而,HJURP对肺腺癌肿瘤细胞增殖调控作用仍不清楚。因此,本研究首先探讨肺腺癌中HJURP的表达情况及其与患者预后之间的相关性,并以2种典型的肺腺癌细胞系为对象,观测HJURP基因表达对于肺腺癌细胞增殖水平的影响,探讨FOXM1对HJURP的调控作用及机制,以期为基于HJURP的肺腺癌治疗策略提供新的理论依据。
1 材料与方法 1.1 材料 1.1.1 细胞株人肺腺癌细胞系H1299及SPC-A1,均从上海中科院细胞库购买获得。
1.1.2 组织样本临床样本(包括肿瘤组织及配对正常肺组织样本)收集自2019年2月至2020年5月火箭军特色医学中心胸外科接受肺癌根治术的NSCLC患者,共17例。样本采用液氮速冻后置于-80 ℃冰箱保存。患者年龄58~71岁,中位年龄为65岁。患者在术前未接受任何治疗。获取的样本组织有肺腺癌12例(男性7例,女性5例)、肺鳞癌5例(男性4例,女性1例)。本研究得到中国人民解放军火箭军特色医学中心伦理委员会批准(KY209002),且所有患者知情同意。
1.1.3 主要仪器与试剂Lipofectamine 2000转染试剂购自美国Thermo Fisher Scienticfic公司;HJURP-RNAi-慢病毒靶点序列:GUAUUGGAGUGUCUACAGA(中国吉凯基因公司),载体信息:hU6-MCS-Ubiquitin-EGFP-IRES-puromycin;HJURP敲低siRNA1序列1:GUAUUGGAGUGUCUACAGA;HJURP敲低siRNA1序列2:GACUAAUAAAGGAAAGAAA;FOXM1敲低siRNA1序列:CCAACAAUGCUAAUAUUCACA;FOXM1敲低siRNA2序列:GGAUCAAGAUUAUUAACCA;兔抗人FOXM1抗体(克隆号D3F2B)购自美国CST公司;Click-iT Plus EdU Alexa Fluor 647流式细胞分析检测试剂盒购自美国Thermo Fisher Scienticfic公司;Gallios流式细胞仪购自美国Beckman公司。
1.2 方法 1.2.1 细胞系培养细胞均用富含10%胎牛血清(美国Gibco公司)和100 U/mL青-链霉素的DMEM(美国Gibco公司)培养基培养于含有5%CO2的37 ℃细胞培养箱中。细胞系定期进行支原体污染检测。
1.2.2 瞬时转染将细胞接种于6孔板中,当细胞融合度达到50%左右时,按照Lipofectamine 2000转染试剂说明书进行转染。48~72 h后,收集细胞用于后续实验。
1.2.3 HJURP敲低的稳转细胞系的构建将H1299细胞接种于24孔板中,当细胞融合度达到40%左右,按照MOI=10加入Control-RNAi-慢病毒或HJURP-RNAi-慢病毒,加入transGP转染试剂,过夜后予细胞换液。3 d后加入嘌呤霉素(4 μg/mL)进行药物筛选,至细胞稳定传代后用于后续实验。
1.2.4 FOXM1过表达细胞系的构建将SPC-A1细胞接种于24孔板中,当细胞融合度达到约40%时,按照MOI=5加入HJURP-过表达慢病毒,加入transGP转染试剂,过夜后予细胞换液。3 d后加入嘌呤霉素(4 μg/mL)进行筛选,至细胞稳定传代后用于后续实验。
1.2.5 5-乙炔基-2’-脱氧尿苷(5-ethynyl-2-deoxyuridine, EdU)摄取实验将H1299细胞或SPC-A1细胞分别接种于24孔板中,当细胞融合度达到约60%时,将培养基替换为含EdU(10 μmol/L)的DMEM完全培养基,2 h后消化细胞,按照Click-iT Plus EdU Alexa Fluor 647的说明书进行操作,最后进行流式细胞术检测。
1.2.6 染色质免疫沉淀(chromatin immunoprecipitation,ChIP)实验通过超声将染色质处理成200~800 bp的片段。ChIP实验步骤按照EZ-ChIP试剂盒(美国Millipore公司)进行。采用兔抗人FOXM1抗体。HJURP启动子序列的引物为:正向序列5′-TCAAATA-GGAGACTCCGCCC-3′;反向序列5′-TTTGAAAGGCC-CAATCAGTGC-3′。
1.2.7 公共数据库分析提取癌症基因组图谱(the cancer genome atlas, TCGA)数据库中HJURP在肺癌与正常肺组织中差异表达的数据,通过UCSC Xena(https://xenabrowser.net/)进行分析,并对HJURP与FOXM1转录水平进行相关性分析。生存分析通过Kaplan-Meier Plotter (KM-plot)(http://kmplot.co-m/analysis/)及UALCAN(http://ualcan.path.uab.EdU/analysis.html)预后数据库进行分析。肿瘤细胞系测序数据(Cancer Cell Line Encyclopedia, CCLE)下载自Cbioportal(http://www.cbi-oportal.org/)。人肺腺癌肿瘤组织及相应正常组织的HJURP免疫组化染色下载自人蛋白图谱(Human Protein Atlas, HPA)数据库(https://www.proteinatlas.org/)。HJURP表达相关性分析采用基因表达谱互作分析(Gene Expression Profiling Interactive Analysis, GEPIA)数据库进行(http://gepia.cancer-pku.cn/index.html)。
1.2.8 裸鼠皮下移植瘤实验选用6~8周龄的雌性BALB/c裸鼠(n=6),体质量18~20 g(中国华阜康公司)。小鼠分为Sh-Control组(n=3)及Sh-HJURP组(n=3),分别于皮下注射Sh-Con或Sh-HJURP的H1299稳转细胞株(5×106/小鼠,100 μL预冷PBS)。荷瘤后第15天处死小鼠,拍照记录肿瘤大小并以游标卡尺沿2个垂直轴测量肿瘤直径,分别记为a(较长直径)与b(较短直径)。按照公式[肿瘤体积V=0.5×a(mm)×b(mm)×b(mm)]计算肿瘤大小。
1.2.9 Western blot检测RIPA裂解细胞提取总蛋白,以BCA法检测蛋白浓度。加入标准浓度上样缓冲液后,100 ℃水浴法蛋白变性5 min。取20 μg蛋白上样进行十二烷基磺酸钠-聚丙烯酰氨凝胶电泳,湿法转膜至PVDF膜上,5%BSA封闭30 min后,一抗分别采用兔抗人HJURP多克隆抗体(美国Proteintech公司,抗体浓度1∶2 000)及小鼠抗人β-actin抗体(美国Proteintech公司,克隆号2D4H5,抗体浓度1∶5 000),4 ℃孵育过夜。次日洗膜后HRP偶联二抗孵育1 h。洗膜后以ECL化学发光法进行显影。
1.2.10 总RNA提取及实时定量PCR检测(quantitative real-time PCR,RT-qPCR)50 mg左右NSCLC肿瘤组织或正常组织剪至长径约1 mm的小组织块后转至陶瓷研磨器(高温湿热法灭活RNA酶预处理)中。加入0.5 mL左右液氮将组织块冻硬后进行研磨,加入1 mL TRIzol,按标准方案提取RNA,并以NanoDrop分光光度计对RNA浓度和纯度进行检测。反转录采用PrimeScript RT reagent Kit(日本TaKaRa公司)进行,荧光定量PCR采用TB Green Premix Ex Taq Ⅱ(日本TaKaRa公司)进行。引物序列见表 1。
| 基因名称 | 引物序列(5′→3′) | 产物长度/bp | |
| 正向 | 反向 | ||
| ACTB | CATGTACGTTGCTATCCAGGC | CTCCTTAATGTCACGCACGAT | 250 |
| HJURP | GATTCAAAAAGCGGTGAGGTCG | AGTCACACGTACATCCCTTCC | 198 |
| FOXM1 | ATACGTGGATTGAGGACCACT | TCCAATGTCAAGTAGCGGTTG | 175 |
1.2.11 双荧光素酶报告基因实验
根据HJURP启动子区域FOXM1结合位点分析结果, 选择启动子区域-200~-1 bp片段进行双荧光素酶报告基因实验。其中对照组(PROMOTOR-WT)为-200~-1 bp全长序列,实验组(PROMOTOR-MUT)为缺失FOXM1结合位点(TCCTGCCTCCTTTTGG)的序列,将这2段序列分别构建到双荧光素酶载体上(pmirGLO载体,北京擎科生物科技公司合成)。将合成的质粒与FOXM1-siRNA1或FOXM1-siControl同时转入293T细胞中,48 h后,根据双荧光素酶报告基因检测试剂盒说明书(美国Promega公司)进行检测。
1.3 数据处理与统计学分析流式数据采用FlowJo V10处理,采用GraphPad Prism 9.0软件进行数据分析,采用SPSS 26.0软件进行统计分析。数据以x±s表示,两组间比较采用双尾学生t检验,多组间比较采用单因素方差分析,并采用Bonferroni法矫正α后进行后续分析。相关性分析采用Pearson相关性分析进行。影响预后的因素采用单因素及多因素Cox回归分析,生存分析采用Kaplan-Meire分析,并采用对数秩检验检测其统计学差异。α=0.05。
2 结果 2.1 HJURP在肺腺癌组织中高表达通过RT-qPCR检测组织样本中HJURP的转录水平,发现肺腺癌中HJURP的mRNA水平显著高于正常组织(P < 0.05,图 1A);而肺鳞癌中HJURP的mRNA水平与正常组织差异无统计学意义(图 1B)。分析TCGA数据库HJURP在肺癌组织与正常肺组织中的表达情况,结果发现在肺腺癌和肺鳞癌中,HJURP转录水平均显著高于正常肺组织样本(P < 0.05,图 1C、D)。进一步检测HPA数据库及本中心的肺腺癌肿瘤组织与正常组织样本的HJURP蛋白表达(图 1E、F),结果显示:肺腺癌组织中HJURP蛋白表达水平较正常组织更高。
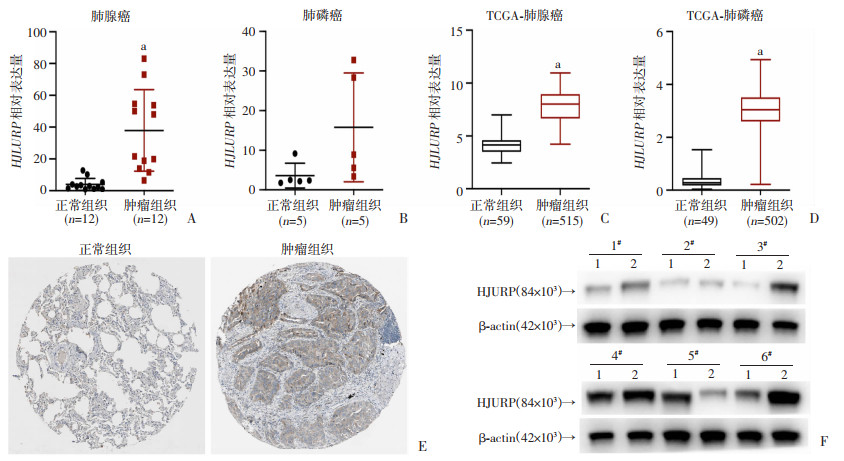
|
|
a: P < 0.05,与正常组织比较 A:本中心肺腺癌患者正常与癌组织样本HJURP转录水平(n=12);B:本中心肺鳞癌患者正常与癌组织样本HJURP转录水平(n=5);C:TCGA数据库中肺腺癌正常组织与癌组织样本HJURP转录水平(n正常=59, n肿瘤=515);D:TCGA数据库中肺鳞癌正常组织与癌组织样本HJURP转录水平(n正常=49, n肿瘤=502);E:免疫组化检测HPA数据库中肺腺癌组织与正常肺组织HJURP蛋白表达;F:Western blot检测本中心肺腺癌组织与正常组织HJURP蛋白表达水平 1#~6#:样本编号;1:正常组织;2:肿瘤组织 图 1 HJURP在肺腺癌样本中高表达 |
2.2 HJURP高表达肺腺癌患者预后不良
为了进一步探究HJURP高表达与肺腺癌及肺鳞癌总体生存率的关系,分析UALCAN及KM-plot公共数据库中HJURP的mRNA水平与肺腺癌及肺鳞癌群体预后的关系。基于UALCAN数据库中的TCGA数据的分析表明,在肺腺癌中,HJURP高表达队列呈现了较差的生存水平(P < 0.05,图 2A)。与此类似,基于KM-plot数据库的分析也表明,HJURP高表达队列呈现了较差的生存水平(HR=1.94, 95%CI:1.66~2.15, P < 0.05,图 2B)。为明确HJURP的转录水平是否是肺腺癌患者的影响预后的独立因素,纳入患者年龄、性别、病理分期与HJURP的mRNA水平等因素进行Cox单因素及多因素回归分析。结果显示HJRUP的mRNA高表达为肺腺癌患者的影响预后的独立因素(P < 0.05, 表 2)。然而基于UALCAN-TCGA(图 2C)及KM-plot(HR=1.23, 95%CI:1.01~1.50,图 2D)数据库的分析表明,肺鳞癌中HJURP的表达与患者的不良预后的联系较弱。以上结果表明:肿瘤组织中HJURP的mRNA高表达是肺腺癌患者的影响预后的独立因素,HJURP高表达的肺腺癌患者总生存期较短。而在肺鳞癌中,HJURP的表达与患者预后无关,故后续研究聚焦于肺腺癌。
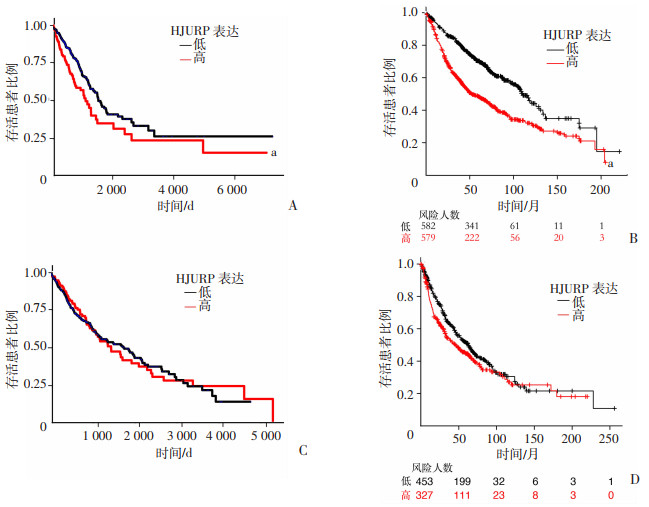
|
|
a: P < 0.05,与HJURP低表达组比较 A:UALCAN-TCGA数据库中HJURP高/低表达肺腺癌患者生存曲线分析;B:KM-plot数据中 HJURP高/低表达肺腺癌患者生存曲线分析;C:UALCAN-TCGA数据库中HJURP高/低表达肺鳞癌患者生存曲线分析;D:KM-plot数据中HJURP高/低表达肺鳞癌患者生存曲线分析 图 2 HJURP高表达肺腺癌患者预后不良 |
| 临床特征 | 单因素Cox回归 | 多因素Cox回归 | |||
| HR(95%CI) | P值 | HR(95%CI) | P值 | ||
| 男性 | 0.976(0.846~1.127) | 0.744 | 1.034(0.892~1.197) | 0.658 | |
| 年龄≥65岁 | 0.814(0.610~1.086) | 0.162 | 0.779(0.582~1.041) | 0.092 | |
| HJURP高表达 | 1.274(1.101~1.473) | 0.001 | 1.508(1.120~2.029) | 0.007 | |
| 病理分期/期 | |||||
| Ⅰ | 0.278(0.161~0.480) | < 0.001 | 0.275(0.158~0.479) | < 0.001 | |
| Ⅱ | 0.594(0.340~1.037) | 0.067 | 0.581(0.331~1.019) | 0.058 | |
| Ⅲ | 0.955(0.541~1.686) | 0.874 | 0.880(0.494~1.565) | 0.663 | |
2.3 HJURP敲低抑制肺腺癌肿瘤细胞体外增殖
为探究HJURP在肺腺癌肿瘤细胞增殖调控中的影响,采用Si-Control、Si-HJURP-1或Si-HJURP-2分别转染H1299和SPC-A1细胞系,并在HJURP的转录水平和蛋白水平进行了验证(P < 0.05,图 3A、B, E、F)。通过EdU摄取实验分别对2个细胞系进行增殖检测。结果表明HJURP敲低导致H1299及SPC-A1细胞系的增殖受到抑制(P < 0.05,图 3C、D, G、H)。
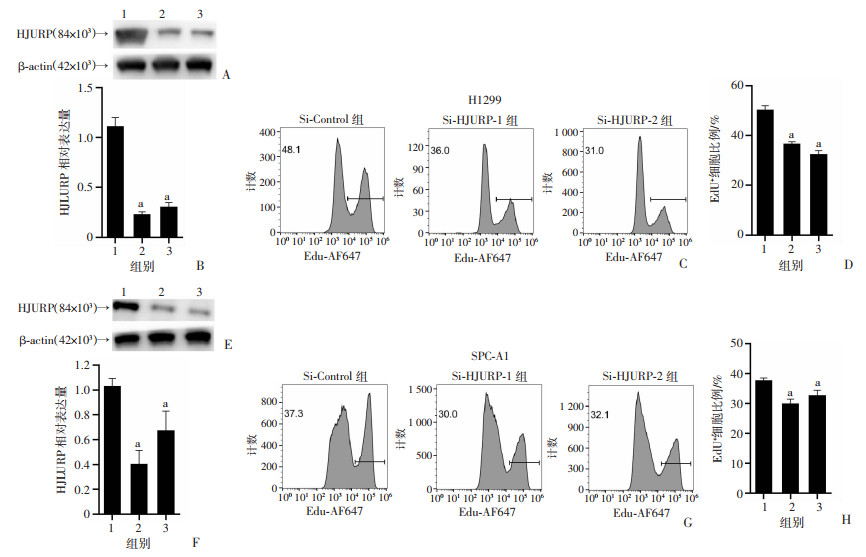
|
|
1: Si-Control组;2: Si-HJURP-1组;3: Si-HJURP-2组;a:P < 0.05,与Si-Control组比较 A~D:H1299细胞;E~H:SPC-A1细胞;A、E:Western blot检测HJURP蛋白水平; B、F: RT-qPCR检测HJURP转录水平;C、D、G、H:EdU摄取实验代表性流式细胞术结果及阳性细胞比例统计分析结果 图 3 HJURP敲低的肺腺癌细胞增殖水平下调 |
2.4 HJURP过表达促进肺腺癌肿瘤细胞增殖
采用慢病毒过表达HJURP方法构建HJURP过表达SPC-A1细胞株(HJURP-OE组)与对照SPC-A1细胞株(Control组),并通过RT-qPCR及Western blot进行验证(P < 0.05,图 4A、B)。EdU摄取实验结果表明,HJURP-OE组的细胞增殖水平显著高于Control组(P < 0.05,图 4C、D)。提示高表达HJURP可以显著促进肺腺癌细胞系增殖。
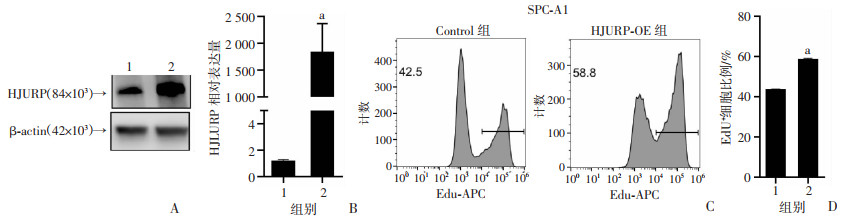
|
|
1: Control组;2: HJURP-OE组;a: P < 0.05,与Control组比较 A:Western blot检测HJURP蛋白水平;B:RT-qPCR检测HJURP转录水平;C、D:EdU摄取实验代表性流式细胞术结果及阳性细胞比例统计分析 图 4 HJURP过表达的肺腺癌细胞增殖能力增强 |
2.5 HJURP敲低抑制肺腺癌裸鼠皮下肿瘤生长
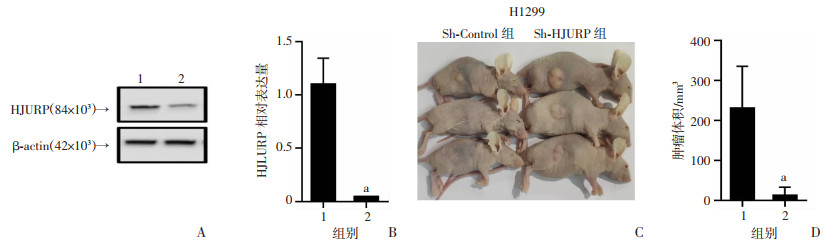
为进一步明确HJURP在体内对肺腺癌生长的影响,构建慢病毒介导的HJURP敲低(Sh-HJURP)及对照病毒转染(Sh-Con)的H1299稳转细胞株。在确认成功敲低HJURP后(P < 0.05,图 5A、B),采用裸鼠皮下成瘤实验验证HJURP敲低对肿瘤体内生长的影响。结果显示,与Sh-Control组比较,Sh-HJURP组小鼠的肿瘤生长受到显著抑制(P < 0.05,图 5C、D)。以上结果表明,HJURP敲低能够显著抑制肺腺癌细胞在裸鼠体内的生长。
|
|
1: Sh-Control组;2: Sh-HJURP组;a: P < 0.05,与Sh-Control组比较 A:Western blot检测HJURP蛋白水平;B:RT-qPCR检测HJURP转录水平;C:裸鼠成瘤15 d后肿瘤大体观察图片;D:裸鼠成瘤15 d后肿瘤体积分析(n=3) 图 5 HJURP敲低抑制肺腺癌裸鼠皮下肿瘤生长 |
2.6 肺腺癌肿瘤组织中FOXM1与HJURP转录水平密切相关
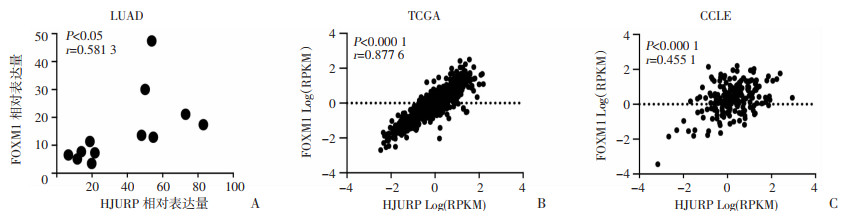
为了探索HJURP的上游调控机制,通过GEPIA网站(http://gepia.cancer-pku.cn/index.html)检测肺腺癌中与HJURP转录水平相关性最高的前100个基因。其中,HJURP与转录因子FOXM1呈显著正相关。采用Pearson相关性分析本中心肺腺癌患者肿瘤组织样本及TCGA-肺腺癌数据库资料,发现HJURP与FOXM1呈显著正相关(P < 0.05,P < 0.001,图 6A、B)。由于肿瘤组织样本中不仅仅包含肿瘤细胞,还包含大量的间质细胞,可能存在潜在偏倚。进一步采用CCLE数据库分析肺癌细胞系中HJURP与FOXM1的相关性。结果显示,HJURP与FOXM1呈显著正相关(P < 0.001,图 6C)。以上结果表明,肺腺癌肿瘤组织中,FOXM1转录水平与HJURP转录水平密切相关。提示FOXM1可能是HJURP的上游调控分子。
|
| A:本中心肺腺癌组织样本中FOXM1与HJURP的表达相关性(n=12);B:TCGA数据库中肺腺癌组织样本中FOXM1与HJURP的表达相关性(n=515);C:CCLE数据库中肺癌细胞系中FOXM1与HJURP的表达相关性(n=198) 图 6 肺腺癌肿瘤组织中FOXM1与HJURP的相关性分析 |
2.7 FOXM1直接调控HJURP表达
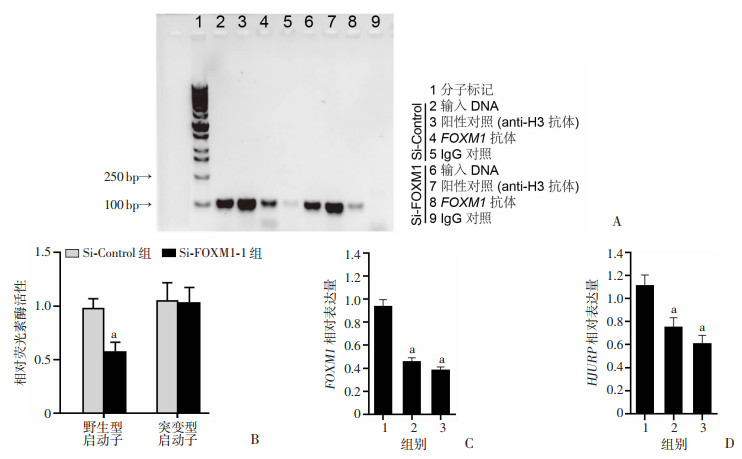
ChIP实验结果显示,HJURP上游启动子序列与FOXM1蛋白共沉淀(图 7A),表明FOXM1为HJURP上游调控分子。双荧光素酶报告基因实验结果显示,在表达HJURP野生型启动子的293T细胞中,Si-FOXM1-1组显著下调HJURP启动子转录活性。而在表达HJURP突变型启动子的293T细胞中,Si-FOXM1-1组对HJURP启动子转录活性无影响。提示FOXM1作为转录因子能够直接与HJURP启动子区域结合(P < 0.05,图 7B)。为了验证FOXM1对HJURP转录调控的影响,采用SiRNA技术敲低了SPC-A1细胞系中FOXM1的表达水平(图 7C)。结果显示:FOXM1的敲低导致了HJURP转录水平的显著下降(P < 0.05,图 7D)。以上结果提示:HJURP的表达受到转录因子FOXM1的紧密调控。
|
|
1: Si-Control组;2: Si-FOXM1-1组;3: Si-FOXM1-2组;a: P < 0.05,与Si-Control组比较 A:ChiP-PCR实验检测FOXM1与HJURP结合;B:FOXM1与HJURP结合的双荧光素酶报告基因实验;C:RT-qPCR检测FOXM1的转录水平;D:RT-qPCR检测HJURP的转录水平 图 7 FOXM1对HJURP的表达的调控作用 |
3 讨论
HJURP是近年来发现的一个原癌基因,在多种肿瘤的发生发展中发挥重要作用。肿瘤中HJURP的过表达被认为与癌细胞染色体的不稳定性有关,其作用机制可能涉及有丝分裂缺陷[5]。在肝细胞癌中,HJURP在肿瘤组织中高表达,并且与肝细胞癌患者预后密切相关。基于肝细胞癌细胞系的体外实验证实,HJURP对肿瘤细胞的增殖调控主要通过影响MAPK及ERK1/2信号通路,从而导致P21蛋白稳定性下降,促进肝细胞癌发生发展[8]。基于膀胱癌的研究发现,HJURP促进肿瘤细胞增殖及迁移,可能是通过调节PPARγ-SIRT1通路影响肿瘤细胞代谢来实现其促进肿瘤发生发展作用的[6]。基于人乳腺癌的研究显示,HJURP主要通过调控YAP1/NDRG1信号影响乳腺癌细胞增殖[12]。以上结果提示,HJURP促进肿瘤生长的作用是在多瘤种中广泛存在的。然而,关于HJURP是否影响肺腺癌发生发展,以及HJURP的上游调控机制均不清楚。
本研究利用肺腺癌患者组织样本及TCGA、HPA数据库样本,发现HJURP在肿瘤组织中高表达。并且证实HJURP高表达是影响肺腺癌患者预后的独立因素,提示HJURP可作为判断肺腺癌患者预后的生物标志物。进一步通过体内实验和体外实验证实,HJURP正向调控肺腺癌细胞的体外增殖及体内生长。当敲低肿瘤细胞系的HJURP表达时,肿瘤细胞的体外增殖及体内生长受到显著抑制。本研究证实HJURP正向调控肿瘤细胞增殖,并且HJURP的表达受到转录因子FOXM1的调控。
FOXM1是一个转录因子,既往肿瘤方面的研究认为其主要与肿瘤转移[13-14]、免疫微环境的调控[15]有关。本实验结果直接表明HJURP启动子区域DNA片段与FOXM1蛋白共沉淀。双荧光素酶报告基因实验结果进一步证实,FOXM1作为转录因子能够直接与HJURP启动子区域结合。研究证实,FOXM1直接结合CENP-A进行转录调控[16],而CENP-A自身与HJURP也有紧密的相互作用[17]。因此,推测FOXM1、HJURP与CENP-A可能相互协同,共同促进肺腺癌发生发展。深入探索三者之间的交互作用,可能为肺腺癌肿瘤细胞的增殖调控机制提供更多线索。
分析TCGA和KM-plot公共数据库发现,高表达HJURP与肺腺癌患者不良预后相关。此前基于NSCLC的研究显示,HJURP的表达水平与NSCLC患者的临床分期有关[5, 18]。此外,另一项研究发现,通过系统性的生信分析,HJURP与NSCLC患者不良预后密切相关[10],与本研究结果相近。
本研究尚有局限之处:由于TCGA数据库临床信息的可及性问题,对生存分析Cox回归纳入的临床因素仅包括性别、年龄、临床分期、HJURP表达等因素,仍有一些可能的偏倚因素未纳入分析(如吸烟史、突变基因情况、PD-L1表达情况等)。
综上所述,HJURP在多种肿瘤中发挥促癌作用,提示其可能作为重要的癌基因,参与调控与肿瘤细胞恶性特征相关的重要信号通路,其表达受到上游转录因子FOXM1的调控。并且,肺腺癌肿瘤组织中HJURP的表达与患者不良预后密切相关。
| [1] |
SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. |
| [2] |
XIA C F, DONG X S, LI H, et al. Cancer statistics in China and United States, 2022: profiles, trends, and determinants[J]. Chin Med J (Engl), 2022, 135(5): 584-590. |
| [3] |
LIU S Y M, ZHENG M M, PAN Y, et al. Emerging evidence and treatment paradigm of non-small cell lung cancer[J]. J Hematol Oncol, 2023, 16(1): 40. |
| [4] |
DUNLEAVY E M, ROCHE D, TAGAMI H, et al. HJURP is a cell-cycle-dependent maintenance and deposition factor of CENP-a at centromeres[J]. Cell, 2009, 137(3): 485-497. |
| [5] |
KATO T, SATO N, HAYAMA S, et al. Activation of Holliday junction recognizing protein involved in the chromosomal stability and immortality of cancer cells[J]. Cancer Res, 2007, 67(18): 8544-8553. |
| [6] |
CAO R, WANG G, QIAN K Y, et al. Silencing of HJURP induces dysregulation of cell cycle and ROS metabolism in bladder cancer cells via PPARγ-SIRT1 feedback loop[J]. J Cancer, 2017, 8(12): 2282-2295. |
| [7] |
LAI W J, ZHU W A, XIAO C T, et al. HJURP promotes proliferation in prostate cancer cells through increasing CDKN1A degradation via the GSK3β/JNK signaling pathway[J]. Cell Death Dis, 2021, 12(6): 583. |
| [8] |
CHEN T C, HUANG H C, ZHOU Y, et al. HJURP promotes hepatocellular carcinoma proliferation by destabilizing p21 via the MAPK/ERK1/2 and AKT/GSK3β signaling pathways[J]. J Exp Clin Cancer Res, 2018, 37(1): 193. |
| [9] |
CHEN T C, ZHOU L F, ZHOU Y, et al. HJURP promotes epithelial-to-mesenchymal transition via upregulating SPHK1 in hepatocellular carcinoma[J]. Int J Biol Sci, 2019, 15(6): 1139-1147. |
| [10] |
WANG L, QU J L, LIANG Y, et al. Identification and validation of key genes with prognostic value in non-small-cell lung cancer via integrated bioinformatics analysis[J]. Thorac Cancer, 2020, 11(4): 851-866. |
| [11] |
CHEN L, ZENG C, YAN L M, et al. Prognostic value of Holliday junction-recognizing protein and its correlation with immune infiltrates in lung adenocarcinoma[J]. Oncol Lett, 2022, 24: 232. |
| [12] |
MAO M S, JIA Y L, CHEN Y X, et al. HJURP regulates cell proliferation and chemo-resistance via YAP1/NDRG1 transcriptional axis in triple-negative breast cancer[J]. Cell Death Dis, 2022, 13(4): 1-12. |
| [13] |
KHAN P, SIDDIQUI J A, KSHIRSAGAR P G, et al. microRNA-1 attenuates the growth and metastasis of small cell lung cancer through CXCR4/FOXM1/RRM2 axis[J]. Mol Cancer, 2023, 22(1): 1. |
| [14] |
KOPANJA D, CHAND V, O'BRIEN E, et al. Transcriptional repression by FoxM1 suppresses tumor differentiation and promotes metastasis of breast cancer[J]. Cancer Res, 2022, 82(13): 2458-2471. |
| [15] |
MADHI H, LEE J S, CHOI Y E, et al. FOXM1 inhibition enhances the therapeutic outcome of lung cancer immunotherapy by modulating PD-L1 expression and cell proliferation[J]. Adv Sci (Weinh), 2022, 9(29): e2202702. |
| [16] |
RENAUD-PAGEOT C, QUIVY J P, LOCHHEAD M, et al. CENP-a regulation and cancer[J]. Front Cell Dev Biol, 2022, 10: 907120. |
| [17] |
LI L, YUAN Q, CHU Y M, et al. Advances in holliday junction recognition protein (HJURP): structure, molecular functions, and roles in cancer[J]. Front Cell Dev Biol, 2023, 11: 1106638. |
| [18] |
WEI Y, OUYANG G L, YAO W X, et al. Knockdown of HJURP inhibits non-small cell lung cancer cell proliferation, migration, and invasion by repressing Wnt/β-catenin signaling[J]. Eur Rev Med Pharmacol Sci, 2019, 23(9): 3847-3856. |




