2. 730050 兰州,中国人民解放军联勤保障部队第九四〇医院基础医学实验室;
3. 730050 兰州,甘肃省干细胞与基因药物重点实验室
2. Basic Medical Laboratory, No.940 Hospital of PLA Joint Logistic Support Force, Lanzhou, Gansu Province, 730050;
3. Gansu Provincial Key Laboratory of Stem Cells and Gene Drug, Lanzhou, Gansu Province, 730050, China
近年来,骨折成为了一种普遍的健康问题,其发病率日渐攀升,受到广泛关注[1]。骨折本身的愈合时间漫长,加速愈合是临床医师的梦想,也是军事医学的迫切需要[2],尤其在西北高原环境下会导致骨折延迟愈合降低士兵作战能力[3]。临床中多数骨折愈合时间较长,骨折后常见的并发症,包括休克、重要脏器和组织损伤等可引起严重的全身反应甚至危及生命[4],骨折后延迟愈合和骨不连等严重影响治疗效果[5],这些问题会给社会和患者带来严重的负担。随着现代医学的发展,仍有5%~10%的骨折后骨不连发生率,因此急需找到促进愈合的办法[6]。
中草药中能治疗骨折的药物众多,补骨脂就是其中的一种。补骨脂性苦、辛、温,归脾、肾经,有补肾、强筋骨、止血、解毒等功效,适用于治疗肾虚腰痛、骨折、骨质疏松等[7-8]。补骨脂中具有香豆素类、黄酮类、单萜酚类成分,其中异补骨脂素(isopsoralen, ISO)是补骨脂有效成分之一[9-10]。本课题组前期研究发现,异补骨脂素具有促进大鼠骨髓基质干细胞增殖和成骨性分化的作用,同时还能促进成骨细胞的增殖和分化[11-12]。基于前期研究成果,提出异补骨脂素可以促进骨折愈合的假说,旨在从分子水平上研究补骨脂的作用机制,并通过不同时间点,观察骨折断端愈合及塑形情况,来证明异补骨脂素促进骨折愈合的作用,并进一步研究其作用机制。
1 材料与方法 1.1 实验动物2月龄雄性C57BL/6小鼠共计50只,体质量为(20±2)g,购自斯贝福(北京)生物技术有限公司,许可证编号:SCXK(京)2019-0010。饲养于中国人民解放军联勤保障部队第九四〇医院实验动物中心[SYXK(军) 2017-0047],室温20~25 ℃,12 h间隔照明,适应性喂养7 d,小鼠每日自由摄食及饮水,实验经联勤保障部队第九四〇医院伦理委员会审查符合动物伦理(2022KYLL185)。
1.2 药品与试剂异补骨脂素(ISO)购自宝鸡辰光生物科技有限公司(批号:HI018117,纯度98%),通用型组织固定液、EDTA脱钙液、HE染液套装、DAB显色试剂盒购自武汉塞维尔生物科技有限公司(批号:G1101-500ML、G1105-500ML、G1003、G1212-200T),高效RIPA裂解液(组织/细胞)、SDS-PAGE凝胶制备试剂盒购自北京索莱宝科技有限公司(批号:R0010、P1200),β-actin、Runx2、Collagen Ⅰ、BMP2、OSX抗体、ECL双敏化学发光试剂购自江苏亲科生物有限公司(批号:AF7018、AF4770、AF7001、DF6034、AF7580、KF005),VEGF抗体购自圣克鲁斯生物技术公司(批号:sc-7269),山羊抗鼠IgG-HRP抗体、山羊抗兔IgG-HRP抗体购自巴傲得生物科技有限公司(批号:BS12478、BS13278),骨碱性磷酸酶(bone alkaline phosphatase,BALP)和Ⅰ型前胶原氨基端原肽(procollagen Type Ⅰ N-terminal peptide,PINP)ELISA检测试剂盒购自泉州睿信生物(批号:RX202907M、RX203163M),Microfil血管造影剂购自Flow Tech(批号:MV-122 Yellow)。
1.3 实验仪器NMC-100型Micro-CT购自平生医疗科技,全波长酶标测试仪购自Epoch Biotek,Scientz-48L冷冻型高通量组织研磨器购自宁波新芝生物科技有限公司,MiniChemiTM580型化学发光成像分析系统购自森西赛智,DP71型正置显微镜购自奥林巴斯。
1.4 动物模型参照文献中的方法稍做改进建立右侧小鼠胫骨骨折模型[13],1%戊巴比妥钠(40 mg/kg)麻醉小鼠,待小鼠完全麻醉后取右侧卧位备皮消毒,自右侧膝关节开始沿胫骨外侧前缘作1 cm大小切口,将无菌4.5号注射器针头从胫骨平台插入髓腔后回退针头,使用11号手术刀片在胫骨前外侧最高点垂直下压造成横断骨折,重新将针头插入胫骨固定,确认对位对线良好后剪去多余部分,清洗缝合。造模完成后立即拍摄X线确定造模成功。
1.5 分组及给药将造模成功的小鼠按随机数字表法分为模型(Model)组和异补骨脂素治疗(ISO)组,每组25只。实验期间各组小鼠均采用灌胃给药,ISO组灌服剂量为40 mg/kg,Model组灌服等体积生理盐水。每日1次,连续给药28 d。
1.6 检测方法 1.6.1 Micro-CT分析分别于2组小鼠服药7、14、21、28 d后每组随机处死3只小鼠,取出骨折侧胫骨取下内固定置于通用型组织固定液保存。使用NMC-200型Micro-CT扫描仪扫描分析,扫描条件为管压90 kV,管流50 μA,扫描区域以胫骨平台为起点往下4.5 mm。使用Avatar v1.6软件(PINGSENG Healthcare Inc.) 进行重建和分析,选取骨折线上下各1.5 mm部分为ROI区域,量化BV/TV。
1.6.2 HE染色观察各组小鼠骨组织形态的改变将各组服药7、14、21、28 d后固定完成的骨折侧胫骨进行脱钙处理并石蜡包埋,切片厚度为8 μm,进行HE染色,常规脱蜡,梯度复水,浸入苏木精溶液中5 min,分化液分化数秒,移入伊红液中浸染5 min,梯度脱水,透明,封片后置于显微镜下观察。
1.6.3 ELISA检测血清中BALP和PINP的含量各组小鼠服药14 d后每组随机抓取6只腹主动脉采血,离心收集上清液备用,按照说明书使用ELISA试剂盒测定BALP和PINP的含量,在450 nm波长下测定光密度,计算样品的浓度值。
1.6.4 Western blot分析各组小鼠服药14 d后每组随机处死3只小鼠,迅速取下骨折侧胫骨,剔除多余肌肉筋膜组织,以骨折断端为中心向两端分别剪下约80 mg骨组织。使用组织研磨器研磨组织,加入裂解液300 μL,反复混匀后置于4 ℃冰箱中裂解1 h,离心30 min,完成后收集上清液。使用BCA方法测定蛋白质含量,520 nm波长处用酶标仪测定光密度,计算出蛋白浓度,加入5×蛋白上样缓冲液水浴锅98 ℃变性15 min。上样,电泳,电转,封闭2 h,分别加入Runx2(1 ∶2 000)、Collagen Ⅰ(1 ∶ 000)、BMP2(1 ∶2 000)、OSX(1 ∶2 000)、VEGF(1 ∶1 000)和β-actin(1 ∶20 000)一抗4 ℃过夜,次日TBST洗涤后根据来源加入山羊抗兔IgG-HRP抗体(1 ∶20 000)和山羊抗鼠IgG-HRP抗体(1 ∶20 000),室温孵育1.5 h,TBST洗涤后加入ECL化学发光液孵育2 min后使用化学发光成像分析系统曝光,用Image J软件对结果进行量化分析。
1.6.5 胫骨血管造影各组小鼠服药28 d后每组随机抓取3只小鼠,麻醉后将小鼠四肢及头部固定于手术台上,沿腹正中线将腹部和胸骨剪开,彻底暴露心脏后进行灌注。注射器针头刺入左心室,匀速灌注含低分子肝素钠的生理盐水20 mL,右心耳完全充盈时剪破右心耳,直至从右心耳流出的生理盐水为无色透明。接着灌注4%多聚甲醛,至肢体僵硬固定完全。最后灌注Microfil造影剂,当肝脏可见明显黄色纹路时灌注成功。将灌注成功后的小鼠放置于4 ℃冰箱过夜。次日将胫骨取出,置于组织固定液中固定24 h后脱钙,脱钙完成后进行Micro-CT扫描及重建,使用Avatar v1.6软件对ROI区域的血管体积分数和血管直径进行量化分析。
1.6.6 免疫组化染色检测VEGF表达量将各组服药7 d的石蜡切片进行免疫组化染色,常规脱蜡,梯度复水,抗原修复20 min,封闭,加入VEGF一抗(1 ∶800)4 ℃过夜。次日滴加含0.3%H2O2的TBS孵育30 min,加入二抗室温孵育1 h,滴加新鲜配制的DAB显色液作用10 min,复染细胞核,梯度脱水,透明,封片后置于显微镜下观察。用Image J软件对结果进行量化分析。
1.7 统计学分析用GraphPad Prism9.3.1软件进行数据分析,本实验所有数据为定量资料,符合正态分布的数据以x±s表示,两组间采用配对样本t检验,若数据服从正态分布但方差不齐,则采用t’检验。若数据不服从正态分布,则采用秩和检验。以P<0.05为差异有统计学意义。
2 结果 2.1 Micro-CT扫描Micro-CT扫描结果如图 1所示,小鼠服药7 d后,可观察到Model组骨折断处出现吸收现象,ISO组断处同样出现吸收现象,同时伴有桥梁骨痂的形成;服药14 d后,可观察到Model组外骨痂部分相连但骨折断端仍较为明显,ISO组外骨痂已从骨折两端横过髓腔形成封闭骨痂,且通过剖面图可见较为丰富的新生骨小梁;服药21 d后,可观察到Model组新生骨小梁逐渐增多,断端形成的连接较为薄弱,ISO组形成的骨痂逐渐被板层骨替代,编织骨结构间缝隙减小;服药28 d后,Model组从外侧可观测到骨痂正处于塑形阶段,ISO组编织骨已逐渐清除,已形成较为坚固的骨皮质。骨折ROI区域骨体积分数(BV/TV)量化结果如表 1所示:服药7 d后,ISO组的BV/TV高于Model组,但差异无统计学意义;服药14 d后,ISO组的BV/TV明显高于Model组(P < 0.05);服药21 d后,ISO组的BV/TV明显低于Model组(P < 0.05);服药28 d后,ISO组的BV/TV明显低于Model组(P < 0.05)。
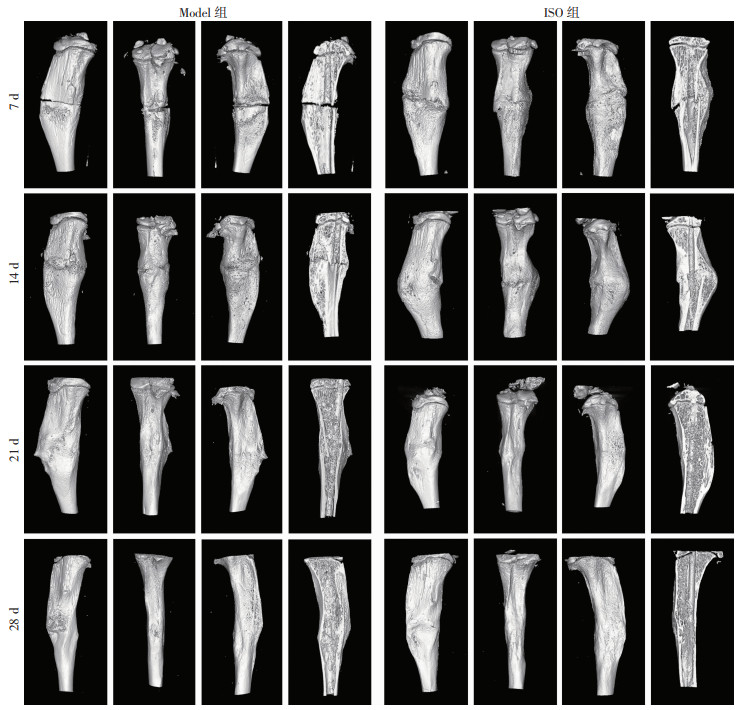
|
| 图 1 服药7、14、21、28 d后胫骨三维重建结果(胫骨外侧面、内侧面、背侧面以及纵截面) |
| 组别 | 7 d | 14 d | 21 d | 28 d |
| Model组 | 0.195±0.007 | 0.289±0.016 | 0.189±0.007 | 0.127±0.004 |
| ISO组 | 0.217±0.010 | 0.466±0.046 | 0.143±0.005 | 0.101±0.006 |
| t | 2.530 | 5.151 | 7.812 | 5.061 |
| P | 0.065 | 0.007 | 0.001 | 0.007 |
2.2 骨痂HE染色形态学观察
HE染色结果如图 2所示,服药7 d后,可观察到Model组断端周围出现大量炎性细胞,形成部分纤维组织,ISO组可观察到大量软骨细胞及炎性细胞聚集在骨折断端;服药14 d后,可观察到Model组断处软骨细胞及炎性细胞交织存在,ISO组部分软骨细胞已逐渐矿化成为编织骨,且编织骨内存在大量造血组织细胞;服药21 d后,可观察到Model组软骨组织减少,可见大面积形态不规则的编织骨,ISO组仅能在编织骨中观察到矿化软骨残存且骨折断端已被编织骨松散的连接;服药28 d后,可观察到Model组编织骨正在向板层骨转变,排列已渐趋规则,ISO组已出现连续板层骨,板层骨内仍可见残留编织骨灶,多余骨痂已被吸收。
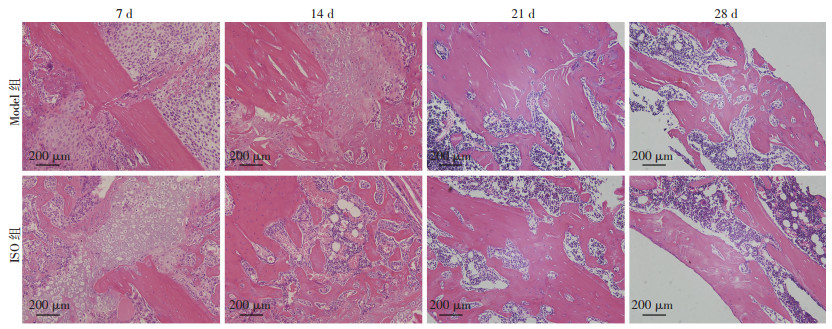
|
| 图 2 服药7、14、21、28 d后骨痂形态学染色观察 |
2.3 血清骨代谢指标
服药14 d后,小鼠血清骨代谢指标如表 2所示,ISO组血清中BALP和PINP含量均显著高于Model组(P < 0.05)。
| 组别 | BALP | PINP |
| Model组 | 4.493±0.712 | 6.323±0.810 |
| ISO组 | 17.059±2.052 | 24.303±6.230 |
| t | 3.794 | 2.469 |
| P | 0.004 | 0.033 |
2.4 骨形成蛋白表达情况
服药14 d胫骨骨折部位蛋白表达结果如图 3、表 3所示,ISO组的Collagen Ⅰ、Runx2、BMP2和OSX蛋白的表达量均明显高于Model组(P < 0.05)。
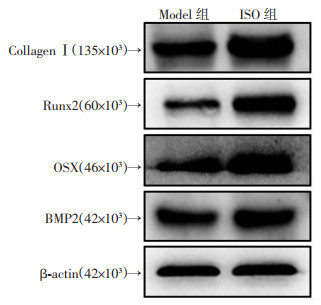
|
| 图 3 Western blot检测服药14 d骨形成蛋白表达 |
| 组别 | Collagen Ⅰ/β-actin | Runx2/β-actin | OSX/β-actin | BMP2/β-actin |
| Model组 | 0.861±0.009 | 0.523±0.002 | 0.719±0.008 | 0.821±0.027 |
| ISO组 | 1.008±0.001 | 1.028±0.008 | 1.043±0.003 | 0.942±0.021 |
| t | 22.240 | 83.670 | 56.110 | 4.977 |
| P | < 0.01 | < 0.01 | < 0.01 | 0.008 |
2.5 胫骨血管造影
服药28 d胫骨血管造影结果如图 4所示,各组骨折处血管均有一定程度的连接,Model组骨折断端血管较为稀疏,血管直径较小,未能完全贯通骨折断端。ISO组血管已基本恢复正常状态,贯通程度较高,血管较粗,且密集程度高。量化结果如表 4所示:服药28 d,ISO组血管体积分数显著高于Model组(P < 0.05),ISO组血管直径显著高于Model组(P < 0.05)。
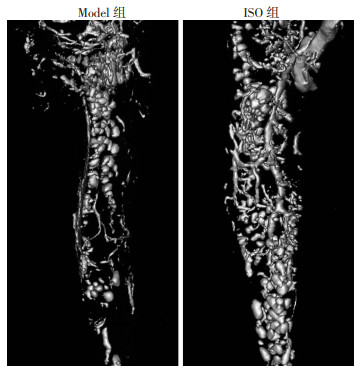
|
| 图 4 服药28 d胫骨血管造影三维重建结果 |
| 组别 | 血管直径/mm | 血管体积分数/% |
| Model组 | 0.071±0.001 | 15.558±0.853 |
| ISO组 | 0.094±0.001 | 39.013±0.673 |
| t | 21.140 | 30.490 |
| P | < 0.01 | < 0.01 |
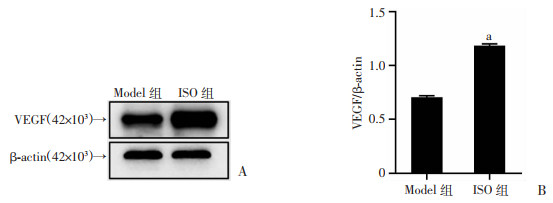
2.6 异补骨脂素对各组小鼠VEGF蛋白表达的影响
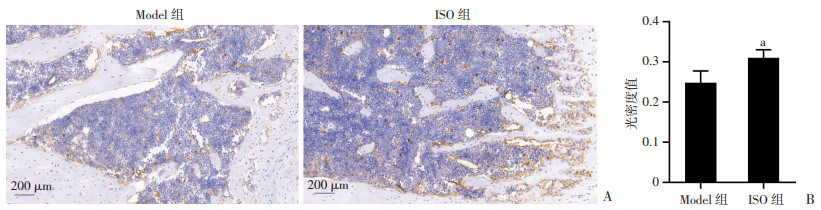
骨组织中VEGF蛋白表达结果如图 5所示,ISO组小鼠胫骨中的VEGF表达量明显高于Model组(P < 0.05)。免疫化染色结果如图 6所示,棕黄色即为阳性区域,聚集于编织骨与软骨交界处,光密度值量化结果显示ISO组VEGF表达量明显高于Model组(P < 0.05)。
|
| A:Western blot检测各组VEGF蛋白的表达;B:蛋白相对表达量分析(n=3) a:P<0.05,与Model组比较 图 5 服药14 d VEGF蛋白表达 |
|
| A:VEGF免疫组化染色;B:VEGF免疫组化染色光密度值量化分析(n=3) a:P<0.05,与Model组比较 图 6 服药14 d VEGF免疫组化染色结果 |
3 讨论 3.1 异补骨脂素促进骨折断端重建
骨折愈合是指断端组织自我修复的反应,本实验使用Micro-CT并结合HE染色对骨折部位7、14、21、28 d这几个重要时间点进行分析,发现在第7天时,ISO加速了软骨细胞的增殖,而Model组骨折处还充斥着大量炎性细胞,提示ISO可能在愈合早期具有抗炎作用。同样田展松[14]的研究结果发现,异补骨脂素可以激活CD9/gp130/STAT3信号通路,并降低炎症因子的表达,说明异补骨脂素早期促进骨折愈合与其抗炎作用相关。第14天,ISO加速了软骨细胞的肥大矿化并促进了新生血管的生成,而Model组断处较为明显且软骨细胞及炎性细胞依旧较多,提示ISO能促进软骨细胞增殖,加快造血组织进入。张赐童[15]的研究发现,软骨细胞能通过FoxO1上调VEGFA的启动子活性,促进血管的形成,进而发挥促进骨折愈合的作用,进一步佐证了以上结论。第21天,ISO组已进入骨重塑阶段,骨折断端已被编织骨连接且骨痂有一定程度的吸收,逐渐出现板层骨,而Model组依旧可见大面积形态不规则的编织骨,结合14 d的结果,说明ISO组第14天骨痂生长达到高峰,14~21 d内,ISO组骨痂开始吸收并且吸收更快,而Model组的进程明显慢于ISO组。第28天,ISO组多余骨痂已被大量吸收出现连续板层骨,形成坚实骨皮质,而Model组刚开始进入骨重塑阶段。综合以上结果说明ISO组在软骨细胞增殖、编织骨形成、造血组织进入、编织骨钙化和板层骨形成这一动态过程中均快于Model组。
3.2 异补骨脂素促进骨形成成骨细胞能合成分泌骨基质并且使骨基质矿化,随着骨基质的不断产生和矿化形成骨质,使骨折两端形成连接。因此可通过比较Model组和ISO组的成骨细胞活性来探讨ISO促进骨折愈合作用。研究表明,骨转换标志物可直接反映成骨细胞和破骨细胞的活动[16],其中BALP是成骨细胞分化的标志物,其功能是催化磷酸盐在体内的水解反应,生成无机磷和酒石酸盐等物质,促进矿化沉积[17];PINP由成骨细胞分泌,反映成骨细胞活性及新骨生成速率,并且其检测结果不受食物、昼夜节律以及激素等干扰因素的影响,因此作为骨形成生化指标已被广泛应用于临床[18]。通过Micro-CT及HE染色结果,发现14 d为骨痂生长的高峰期,因此本实验选择服药14 d后的小鼠检测血清骨形成生化指标的含量来反映ISO对骨形成的影响,结果表明在小鼠骨折第14天时ISO组的骨形成显著高于Model组,说明异补骨脂素加快了骨重建的进程,通过调节成骨细胞的活性,促进骨形成中骨基质的矿化,对骨折愈合具有积极的作用。
骨折愈合进程中有大量的蛋白和细胞因子发挥着重要调控作用,骨折愈合过程中Collagen Ⅰ的表达情况会影响骨痂的生长速度和骨折愈合的质量。Runx2在软骨细胞、成骨细胞和多能间质细胞的增殖、成熟和分化中均扮演着关键角色[19]。OSX可以有选择性地控制多种与成骨有关的基因的转录,以促进细胞成骨分化[20]。BMP2能够吸引并诱导不同区域的间充质细胞分化为骨细胞,同时在骨折后期也参与破骨细胞的分化和骨重建[21]。基于此,对小鼠14 d新生骨痂内的骨形成蛋白进行分析,发现ISO组骨痂内骨形成蛋白表达情况比Model组更加活跃。
以上结果均说明在骨折愈合前期,异补骨脂素促进了成骨细胞的活性,促进了相关骨形成蛋白的表达,加快了骨重建的进程。
3.3 异补骨脂素加快断端血供恢复在骨折愈合的过程中,新生血管的形成和发育是非常关键的[22]。当骨折发生时,局部的血管网络也会受到破坏,这就需要新的血管来代替原来的受损部分,以维持局部的供氧和营养[23]。VEGF通过促进血管通透性形成血管生成的临时基质,并促进血管内皮细胞迁移和增殖,来促进血管生成。本实验采用血管造影量化其血管密度及直径,来观察骨折愈合后期胫骨内血管重建的情况。通过观察血管造影结果,发现Model组愈合进程较慢,仍处于新生血管的时期,已形成的血管较少,血管直径较小。而ISO组愈合速度快,已形成丰富的血管,并且贯通骨折部位,血管已基本恢复正常状态,说明ISO加快恢复骨折部位血液供应,进而加速骨折愈合进程。
同时选择骨重建高峰期的14 d,进一步对小鼠骨痂组织中VEGF蛋白表达含量进行分析,同时用免疫组织化学染色对第14天小鼠骨痂组织中VEGF进行定位,发现VEGF广泛分布于骨折断端,且ISO组的表达量显著高于Model组。同时在服药14 d的HE染色中也观察到ISO组的编织骨内存在大量血细胞,说明骨痂内已有新生血管的生成。此现象与VEGF的情况相互印证,更进一步说明了异补骨脂素在促进骨形成的同时也加快了造血组织的进入,促进了骨折愈合的进程。
综上所述,异补骨脂素可以提高成骨细胞活性,提高相关骨形成蛋白的表达量,加快造血组织进入来促进骨折愈合。本研究通过观察不同时间点骨折断端愈合及塑形情况,证明异补骨脂素促进骨折愈合的作用并进一步研究其作用机制,为多种中药活性分子组合、开发新型复方中药奠定基础。
| [1] |
FRALICK M, KIM S C, SCHNEEWEISS S, et al. Fracture risk after initiation of use of canagliflozin[J]. Ann Intern Med, 2019, 170(3): 155. |
| [2] |
杜阳阳, 黄欣, 杨海晨. 军事训练中士兵下肢应力性骨折的成因、预防及康复[J]. 中国体育科技, 2023, 59(9): 33-40. DU Y Y, HUANG X, YANG H C. Causes, prevention and rehabilitation of stress fractures in the lower limbs of soldiers in military training[J]. China Sport Sci Technol, 2023, 59(9): 33-40. |
| [3] |
柏鑫, 樊佳, 侯雪峰, 等. 脉冲电磁场对模拟高原环境下大鼠骨折愈合的影响[J]. 解放军医药杂志, 2021, 33(5): 13-18. BAI X, FAN J, HOU X F, et al. Effect of pulsed electromagnetic field on fracture healing in rats at simulated plateau environment[J]. Med Pharm J Chin PLA, 2021, 33(5): 13-18. |
| [4] |
SALHOTRA A, SHAH H N, LEVI B, et al. Mechanisms of bone development and repair[J]. Nat Rev Mol Cell Biol, 2020, 21(11): 696-711. |
| [5] |
MICK P, FISCHER C. Delayed fracture healing[J]. Semin Musculoskelet Radiol, 2022, 26(3): 329-337. |
| [6] |
XU G P, ZHANG X F, SUN L, et al. Current and future uses of skeletal stem cells for bone regeneration[J]. World J Stem Cells, 2020, 12(5): 339-350. |
| [7] |
李想. 基于网络药理学探讨异补骨脂素治疗骨质疏松的作用机制[D]. 呼和浩特: 内蒙古医科大学, 2021. LI X. Discussion on the mechanism of isopsoralen in the treatment of osteoporosis based on network pharmacology[D]. Hohhot: Inner Mongolia Medical University, 2021. |
| [8] |
尚延春, 张海英, 柴巍巍. 异补骨脂素改善骨质疏松大鼠骨代谢的作用探讨[J]. 中国骨质疏松杂志, 2021, 27(2): 220-224. SHANG Y C, ZHANG H Y, CHAI W W. Exploration of the effect of isopsoralen on bone metabolism in osteoporotic rats[J]. Chin J Osteoporos, 2021, 27(2): 220-224. |
| [9] |
ZHUANG X M, ZHONG Y H, XIAO W B, et al. Identification and characterization of psoralen and isopsoralen as potent CYP1A2 reversible and time-dependent inhibitors in human and rat preclinical studies[J]. Drug Metab Dispos, 2013, 41(11): 1914-1922. |
| [10] |
李想, 王剑, 岑利民, 等. 异补骨脂素影响骨代谢研究进展及其药物安全性[J]. 中国骨质疏松杂志, 2021, 27(11): 1637-1640. LI X, WANG J, CEN L M, et al. Research progress of the effect of isopsoralen on bone metabolism and the drug safety[J]. Chin J Osteoporos, 2021, 27(11): 1637-1640. |
| [11] |
明磊国, 陈克明, 葛宝丰, 等. 异补骨脂素对体外培养大鼠成骨细胞增殖分化成熟的影响[J]. 中药材, 2011, 34(3): 404-408. MING L G, CHEN K M, GE B F, et al. Effect of isopsoralen on the proliferation and differentiate of osteoblasts in vitro[J]. J Chin Med Mater, 2011, 34(3): 404-408. |
| [12] |
明磊国, 葛宝丰, 陈克明, 等. 异补骨脂素对体外培养骨髓间充质干细胞增殖与成骨性分化的研究[J]. 中国中药杂志, 2011, 36(15): 2124-2128. MING L G, GE B F, CHEN K M, et al. Effects of isopsoralen on bone marrow stromal stem cells differentiate and proliferate in vitro[J]. China J Chin Mater Med, 2011, 36(15): 2124-2128. |
| [13] |
温轩, 谢杨丽, 苏楠, 等. 小鼠胫骨稳定性骨折模型制作及评价[J]. 第三军医大学学报, 2013, 35(5): 404-407. WEN X, XIE Y L, SU N, et al. Preparation and evaluation of mouse model of stable tibial fracture[J]. J Third Mil Med Univ, 2013, 35(5): 404-407. |
| [14] |
田展松. 异补骨脂素调节巨噬细胞极化在骨关节炎中的抗炎作用机制研究[D]. 重庆: 陆军军医大学, 2021. TIAN Z S. Angelicin alleviates post-trauma osteoarthritis progression by regulating macrophage polarization via STAT3 signaling pathway[D]. Chongqing: Army Medical University, 2021. |
| [15] |
张赐童. 软骨细胞通过转录因子FoxO1促进骨折愈合中血管的形成[D]. 长春: 吉林大学, 2019. ZHANG C T. Chondrocytes promote the formation of blood vessels in fracture healing through transcription factor FoxO1[D]. Changchun: Jilin University, 2019. |
| [16] |
《中国骨质疏松杂志》骨代谢专家组. 骨代谢生化指标临床应用专家共识(2023修订版)[J]. 中国骨质疏松杂志, 2023, 29(4): 469-476. Bone Metabolism Expert Group of Chinese Journal of Osteoporosis. Expert consensus on clinical application of biochemical indicators of bone metabolism (2023 Revision)[J]. Chin J Osteoporos, 2023, 29(4): 469-476. |
| [17] |
LI C, ARMSTRONG J P, PENCE I J, et al. Glycosylated superparamagnetic nanoparticle gradients for osteochondral tissue engineering[J]. Biomaterials, 2018, 176: 24-33. |
| [18] |
MCKAY R, BOSSÉ D, GRAY K, et al. Radium-223 dichloride in combination with vascular endothelial growth factor-targeting therapy in advanced renal cell carcinoma with bone metastases[J]. Clin Cancer Res, 2018, 24: 4081-4088. |
| [19] |
谌超, 付桂仙, 杨明晓, 等. Runx2在骨关节炎发生发展中的作用[J]. 中国现代医学杂志, 2022, 32(15): 67-72. CHEN C, FU G X, YANG M X, et al. Role of Runx2 in development of osteoarthritis[J]. China J Mod Med, 2022, 32(15): 67-72. |
| [20] |
OKI Y, ONO H, MOTOHASHI T, et al. Dedifferentiated follicular granulosa cells derived from pig ovary can transdifferentiate into osteoblasts[J]. Biochem J, 2012, 447(2): 239-248. |
| [21] |
郑潇飞. BMP-2在骨骼生长发育中的作用及研究进展[J]. 海南医学, 2023, 34(7): 1047-1051. ZHENG X F. Role and research progress of bone morphogenetic protein 2 in bone growth and development[J]. Hainan Med J, 2023, 34(7): 1047-1051. |
| [22] |
ISHIHARA J, ISHIHARA A, STARKE R D, et al. The heparin binding domain of von Willebrand factor binds to growth factors and promotes angiogenesis in wound healing[J]. Blood, 2019, 133(24): 2559-2569. |
| [23] |
DULAK J, DESHANE J, JOZKOWICZ A, et al. Heme oxygenase-1 and carbon monoxide in vascular pathobiology[J]. Circulation, 2008, 117(2): 231-241. |




