2. 530000 南宁,广西医科大学第一附属医院营养科;
3. 518000 广东 深圳,南方医科大学深圳医院临床肿瘤科;
4. 100015 北京,中国食品发酵工业研究院有限公司,北京市蛋白功能肽工程技术研究中心
2. Department of Nutrition, First Affiliated Hospital of Guangxi Medical University, Nanning, Guangxi Zhuang Autonomous Region, 530000;
3. Department of Oncology, Shenzhen Hospital of Southern Medical University, Shenzhen, Guangdong Province, 518000;
4. Beijing Engineering Research Center of Protein and Functional Peptides, China National Research Institute of Food and Fermentation Industries Co. Ltd., Beijing, 100015, China
恶性肿瘤的发病率和死亡率居高不下,是威胁人类健康的重要原因之一,其中约有1/5恶性肿瘤患者死于肿瘤相关营养不良及其并发症[1]。恶性肿瘤患者随着疾病进展,常出现神经性厌食、进食下降、低蛋白血症、代谢紊乱、肌肉萎缩、进行性体质量下降等表征,营养状况进一步恶化,最终形成癌性恶液质[2]。恶液质患者会出现骨骼肌减少、蛋白质代谢异常、血浆蛋白质水平降低等,欧洲肠外肠内营养学会(European Society for Parenteral and Enteral Nutrition, ESPEN)和中华医学会肠外肠内营养学分会(Chinese Society for Parenteral and Enteral Nutrition, CSPEN)建议[3]口服营养补充(oral nutritional supplement, ONS)增加营养不良肿瘤患者的口服摄入量;ONS可以明显改善肿瘤患者的营养状况和生活质量[4],是一种安全、有效的营养治疗方式。目前临床对肿瘤患者开展的肠内营养治疗主要以整蛋白型肠内营养为主。海洋生物活性肽因其来源广泛、特异性强、毒副作用小等独特优势,越来越多的研究证明其有抗炎、抗氧化、抗肿瘤等生物活性[5],具有广阔的应用前景,但鲜有研究报道海洋生物活性肽对恶性肿瘤患者营养状况的影响。基于此,本研究拟通过肠内营养联合海洋生物活性肽干预,评价其联合常规ONS对改善肿瘤化疗患者营养状况的协同效应, 提出合理的营养供给方案。
1 资料与方法 1.1 研究对象该研究于2021年9-11月在南方医科大学深圳医院和广西医科大学第一附属医院进行。本研究在人群征募前,已得到南方医科大学深圳医院伦理委员会的批准(NYSZYYE20200024),并在中国临床试验中心注册(ChiCTR2100041637)。共纳入确诊消化系统肿瘤患者108例为研究对象,其中南方医科大学深圳医院36例,广西医科大学第一附属医院72例。纳入标准:病理证实的消化系统恶性肿瘤;第7版AJCC/UICC分期Ⅰ~Ⅳ期;NRS2002≥3分;年龄≥18岁;功能状态评分(performance status,PS)≤2;无放化疗禁忌证;放化疗后食欲尚可,可以经口进食者。排除标准:年龄 < 18岁;依从性差,不能长期坚持者;生命体征不稳定;重度肝肾功能不全的患者;过敏体质者;研究前1个月内曾患有急慢性感染性疾病、外伤或手术;正参加其他研究的患者;研究人员认为其他原因不适合研究者:如急性腹泻等。剔除标准:患者失访或主观原因不能配合研究者。终止标准:患者死亡。
1.2 分组采用随机数字表法将108例患者分为对照组、ONS组、ONS+活性肽组。根据其入院先后顺序,以随机数字表上任意位置作为起点,规定向右依次读取随机数,得到的数除以3,余数为0的是对照组,余数为1的是ONS组,余数为2的是ONS+活性肽组,至分组结束。本研究采用双盲法,由第三方人员对患者进行随机分组,后期营养制剂发放也由第三方人员执行。3组均接受营养会诊及饮食指导(由临床营养科医师完成),建议患者均衡膳食。ONS组另接受加餐口服营养液(oral nutritional supplements, ONS),ONS+活性肽组在ONS基础上联合18 g/d(3条/d)海洋生物活性肽(由中国食品发酵工业研究院有限公司提供),持续整个研究过程。ONS营养成分:商品化整蛋白型肠内营养配方(Ensure®安素,美国雅培制药有限公司),营养成分表:每100 g可提供热量450 kcal, 蛋白质15.9 g,每次50 g/d, 用200 mL温开水冲服,3次/d,由营养科肠内营养配制室集中配制,营养液的配制严格按照相关规章进行,每餐次新鲜配制,充分保证食品安全。具体流程见图 1。
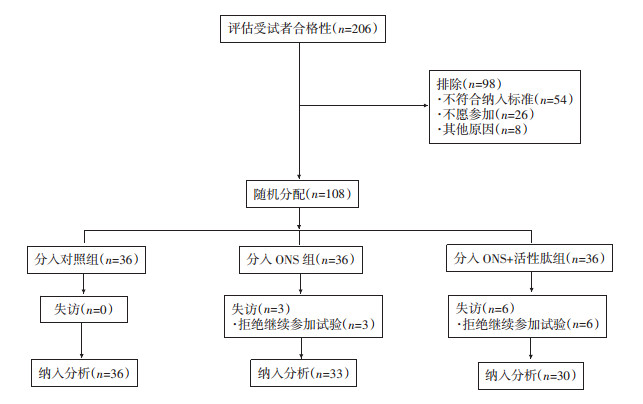
|
| 图 1 随机对照试验进展流程图 |
1.3 观察指标
比较3组患者的一般临床资料, 主要包括年龄、性别、身高、营养风险筛查采用NRS2002评分、营养评估采用主观整体营养评估量表(patient-generated subjective global assessment, PG-SGA)[6]。主要观察指标包括3组患者基线和2个月后的体质量、体质量指数(body mass index, BMI)、肌肉量、脂肪量、上臂肌围、小腿围、腰围、臀围、握力。体质量、BMI、肌肉量、脂肪量的测量采用日本TANITA人体成分分析仪(型号:MC-980MA)。采用卷尺测量上臂肌围、小腿围、腰围、臀围。上臂肌围测量方法:患者上臂自然下垂,肌肉放松,取肩峰至尺骨鹰嘴突连线中点处测量;小腿围测量方法:患者两足分立与肩同宽,测试者站在受试者的侧面,经腓肠肌最粗处(小腿最粗处)水平绕行一周,量其围度;腰围测量方法:患者取垂直站立姿势,双足自然分开30 cm左右,使体质量均匀分布,平稳呼吸,避免吸气,检查者用软尺在髂前上棘和第12肋下缘连线的中点,沿水平方向围绕腹部一周,保持软尺各部分处于水平位置,紧贴而不压迫皮肤进行测量;臀围测量方法:患者两腿并拢直立,两臂自然下垂,卷尺水平放在前面的耻骨联合和背后臀大肌最凸处,测得其围度。握力水平的测量:采用CAMRY EH101型电子握力计(广东香山衡器集团股份有限公司)测量。指导患者用优势手进行测量,根据患者手型进行适当调整握距,握力计勿与身体和衣物接触,嘱患者竭力握握力计,研究者读取握力计表盘显示数据。次要观察指标为生化指标,包括血清白细胞计数、红细胞计数、血红蛋白、白蛋白、总蛋白水平,采用德国罗氏自动生化分析仪及配套试剂检测各生化指标, 试剂批间和批内变异度小于10%。
1.4 统计学分析采用SPSS 29. 0统计软件进行数据处理, 连续变量符合正态分布和方差齐性, 以x±s表示,两组间比较采用独立样本t检验, 组内前后比较采用配对样本t检验或Wilcoxon符号秩和检验,3组间的比较采用单因素方差分析或H检验。P < 0.05认为差异有统计学意义。
2 结果 2.1 各组患者的一般资料分析最终99例完成临床随访纳入研究,其中对照组36例、ONS组33例、ONS+活性肽组30例。99例患者年龄(51.79±13.22)岁。3组患者的一般临床资料具有可比性(P>0.05),见表 1。
| 项目 | 对照组(n=36) | ONS组(n=33) | ONS+活性肽组(n=30) | F值 | P值 |
| 年龄/岁 | 52.19±11.15 | 50.21±15.26 | 53.03±13.38 | 0.380 | 0.685 |
| 性别 | 5.402 | 0.067 | |||
| 男 | 15(42) | 19(58) | 21(70) | ||
| 女 | 21(58) | 14(42) | 9(30) | ||
| 身高/cm | 159.44±8.55 | 162.91±6.72 | 162.63±7.66 | 2.236 | 0.112 |
| 肿瘤构成 | 1.860 | 0.990 | |||
| 胆囊恶性肿瘤 | 6(17) | 5(15) | 5(17) | ||
| 降结肠恶性肿瘤 | 5(14) | 4(12) | 5(17) | ||
| 结肠恶性肿瘤 | 5(14) | 3(15) | 5(17) | ||
| 食管恶性肿瘤 | 8(22) | 9(21) | 6(20) | ||
| 胃恶性肿瘤 | 7(19) | 8(24) | 5(17) | ||
| 直肠恶性肿瘤 | 5(14) | 4(12) | 4(13) | ||
| 肿瘤分期 | 0.265 | 0.876 | |||
| Ⅰ~Ⅱ | 19(53) | 16(48) | 14(47) | ||
| Ⅲ~Ⅳ | 17(47) | 17(52) | 16(53) | ||
| PG-SGA | 1.436 | 0.838 | |||
| 0~1分 | 0 | 0 | 0 | ||
| 2~3分 | 1(2) | 0 | 1(3) | ||
| 4~8分 | 16(45) | 14(42) | 11(37) | ||
| ≥9分 | 19(53) | 19(58) | 18(60) | ||
2.2 各组患者主要观察指标的比较
如表 2所示,3组患者入院时的NRS2002评分、PG-SGA评分、能量摄入、蛋白质摄入、体质量、BMI、肌肉量、体脂肪量、上臂肌围、小腿围和握力水平比较, 差异无统计学意义(P>0.05)。ONS组及ONS+活性肽组随访8周的NRS2002评分、PG-SGA评分显著低于对照组,能量摄入及蛋白质摄入显著高于对照组,而ONS+活性肽组体质量、BMI、肌肉量、体脂肪量、小腿围和握力较对照组有明显升高, 差异均有统计学意义(P < 0.05)。对照组8周PG-SGA评分较入院时有明显升高,体质量、BMI、体脂肪量、上臂肌围、小腿围、握力水平有下降趋势明显, 差异均有统计学意义(P < 0.05)。ONS组8周体质量、BMI、肌肉量、上臂肌围、小腿围、握力变化不明显(P>0.05), 但NRS2002评分、PG-SGA评分有显著下降,体脂肪量有增加趋势(P < 0.05)。ONS+活性肽组8周的NRS2002评分、PG-SGA评分显著低于入院时,体质量、BMI、肌肉量和体脂肪量均有明显增加(P < 0.05);上臂肌围、握力水平保持平稳(P>0.05),但小腿围较入院时有显著增长(P < 0.05)。此外,与ONS组相比,ONS+活性肽组8周的蛋白质摄入明显增多,PG-SGA评分有显著下降(P < 0.05)。
| 项目 | 对照组(n=36) | ONS组(n=33) | ONS+活性肽组(n=30) | F值 | P值 |
| NRS2002评分/分 | |||||
| 入院时 | 3.36±0.83 | 3.83±0.85 | 3.62±0.77 | 1.864 | 0.161 |
| 8周 | 3.53±0.74 | 2.46±0.39ab | 2.33±0.45ab | 4.491 | 0.007 |
| t值 | -0.899 | 4.804 | 3.696 | ||
| P值 | 0.372 | 0.006 | 0.001 | ||
| PG-SGA评分/分 | |||||
| 入院时 | 10.42±3.91 | 10.18±1.75 | 11.77±1.36 | 1.210 | 0.202 |
| 8周 | 13.03±2.93a | 8.21±1.71ab | 8.90±1.61abc | 7.855 | 0.035 |
| t值 | -2.495 | 2.619 | 2.019 | ||
| P值 | 0.015 | 0.043 | 0.042 | ||
| 能量摄入/kcal | |||||
| 入院时 | 998.31±118.45 | 987.73±125.42 | 976.60±139.40 | ||
| 8周 | 881.60±113.11a | 1 459.20±112.12ab | 1 536.90±83.06ab | 1.094 | 0.339 |
| t值 | 2.293 | -1.145 | -1.223 | 6.689 | 0.002 |
| P值 | 0.025 | 0.031 | 0.016 | ||
| 蛋白质摄入/g | |||||
| 入院时 | 26.86±6.07 | 26.96±6.98 | 26.37±5.28 | 0.946 | 0.392 |
| 8周 | 24.03±5.59 | 48.98±5.43ab | 57.67±5.81abc | 14.245 | 0.005 |
| t值 | 1.356 | -1.377 | -1.240 | ||
| P值 | 0.179 | 0.002 | 0.004 | ||
| 体质量/kg | |||||
| 入院时 | 53.38±6.21 | 53.29±5.66 | 53.93±6.19 | 1.073 | 0.346 |
| 8周 | 51.65±6.25 | 53.50±4.72 | 54.66±3.96ab | 0.566 | 0.035 |
| t值 | 4.894 | -1.457 | -3.052 | ||
| P值 | 0.031 | 0.156 | 0.004 | ||
| BMI/(kg/m2) | |||||
| 入院时 | 20.99±2.58 | 20.89±2.14 | 20.54±2.02 | 4.487 | 0.407 |
| 8周 | 19.31±2.53b | 20.96±2.77 | 21.02±2.30ab | 0.907 | 0.014 |
| t值 | 4.786 | -3.019 | -1.558 | ||
| P值 | 0.015 | 0.491 | 0.039 | ||
| 肌肉量/kg | |||||
| 入院时 | 38.28±3.74 | 38.06±2.96 | 38.42±2.05 | 2.348 | 0.309 |
| 8周 | 37.28±3.50 | 39.25±2.31a | 40.42±2.40ab | 2.456 | 0.029 |
| t值 | 0.006 | -0.514 | 0.016 | ||
| P值 | 0.695 | 0.611 | 0.017 | ||
| 体脂肪量/kg | |||||
| 入院时 | 9.35±1.06 | 9.04±1.19 | 9.82±1.26 | 4.334 | 0.092 |
| 8周 | 8.78±1.22b | 9.92±1.26ab | 10.85±1.08ab | 0.369 | 0.013 |
| t值 | 4.532 | -2.393 | -2.609 | ||
| P值 | 0.015 | 0.023 | 0.016 | ||
| 上臂肌围/cm | |||||
| 入院时 | 23.12±2.84 | 23.50±3.07 | 23.11±2.63 | 0.675 | 0.511 |
| 8周 | 22.61±2.98b | 23.44±2.93 | 23.57±2.74 | 1.405 | 0.250 |
| t值 | 1.005 | 0.091 | -0.121 | ||
| P值 | 0.023 | 0.721 | 0.372 | ||
| 小腿围/cm | |||||
| 入院时 | 30.48±2.01 | 30.57±2.06 | 30.29±1.64 | 2.159 | 0.121 |
| 8周 | 29.22±2.36b | 30.89±1.59 | 31.90±1.47ab | 3.257 | 0.042 |
| t值 | 0.953 | 1.337 | -1.597 | ||
| P值 | 0.047 | 0.196 | 0.021 | ||
| 握力/kg | |||||
| 入院时 | 23.60±1.44 | 23.92±1.53 | 23.96±1.71 | 0.331 | 0.848 |
| 8周 | 20.06±1.47b | 23.12±1.68a | 23.64±1.49a | 0.874 | 0.026 |
| t值 | 1.037 | -1.023 | -0.590 | ||
| P值 | 0.037 | 0.314 | 0.559 | ||
| a:P<0.01,与入院时比较;b:P<0.01,与对照组比较;c:P<0.01,与ONS组比较 | |||||
2.3 各组患者次要观察指标的比较
如表 3所示,3组患者入院时的腰围、臀围、血清白细胞计数、红细胞计数、血红蛋白、白蛋白和总蛋白水平比较, 差异无统计学意义(P>0.05)。与对照组相比,ONS组及ONS+活性肽组随访8周的腰围、臀围、白蛋白和总蛋白水平均显著高于对照组, 差异有统计学意义(P < 0.05)。对照组8周白细胞计数较入院时有上升趋势、白蛋白有下降趋势(P < 0.05), ONS组8周总蛋白有升高趋势(P < 0.05), ONS+活性肽组8周总蛋白和白蛋白均有升高趋势(P < 0.05)。
| 项目 | 对照组(n=36) | ONS组(n=33) | ONS+活性肽组(n=30) | F值 | P值 |
| 腰围/cm | |||||
| 入院时 | 77.65±4.18 | 77.61±3.48 | 77.41±3.56 | 6.323 | 0.435 |
| 8周 | 75.17±4.48 | 77.25±4.80a | 77.67±3.29a | 3.518 | 0.034 |
| t值 | 0.544 | -2.097 | -0.508 | ||
| P值 | 0.044 | 0.209 | 0.616 | ||
| 臀围/cm | |||||
| 入院时 | 87.77±6.58 | 87.98±7.75 | 87.26±7.38 | 6.139 | 0.445 |
| 8周 | 86.72±7.88 | 87.37±6.13a | 87.37±6.93a | 3.208 | 0.003 |
| t值 | 0.395 | -1.752 | -0.210 | ||
| P值 | 0.043 | 0.089 | 0.835 | ||
| 白细胞计数/(×109/L) | |||||
| 入院时 | 5.43±0.85 | 5.98±0.35 | 5.70±0.47 | 1.562 | 0.215 |
| 8周 | 6.30±0.35 | 6.15±0.85 | 6.18±0.34 | 0.191 | 0.846 |
| t值 | -1.309 | -0.448 | -0.029 | ||
| P值 | 0.013 | 0.658 | 0.977 | ||
| 红细胞计数/(×1012/L) | |||||
| 入院时 | 3.87±0.32 | 3.69±0.22 | 3.67±0.29 | 0.759 | 0.471 |
| 8周 | 3.82±0.16 | 3.63±0.31 | 3.68±0.32 | 1.150 | 0.321 |
| t值 | 0.903 | 0.795 | 1.060 | ||
| P值 | 0.373 | 0.433 | 0.300 | ||
| 血红蛋白/(g/L) | |||||
| 入院时 | 112.21±15.32 | 112.07±11.27 | 112.30±12.51 | 3.160 | 0.047 |
| 8周 | 111.13±14.19 | 113.17±13.47 | 113.39±10.59 | 1.843 | 0.164 |
| t值 | 0.631 | 0.522 | -0.257 | ||
| P值 | 0.532 | 0.305 | 0.299 | ||
| 总蛋白/(g/L) | |||||
| 入院时 | 67.70±6.06 | 67.21±7.26 | 67.53±6.79 | 0.089 | 0.915 |
| 8周 | 66.97±6.98 | 69.02±7.12ab | 69.27±6.86ab | 0.462 | 0.031 |
| t值 | 1.099 | -0.744 | -0.575 | ||
| P值 | 0.279 | 0.027 | 0.029 | ||
| 白蛋白/(g/L) | |||||
| 入院时 | 37.57±5.09 | 37.36±5.05 | 37.81±4.95 | 2.937 | 0.578 |
| 8周 | 36.24±5.44 | 37.54±5.25a | 39.23±3.21ab | 1.444 | 0.016 |
| t值 | 2.008 | -0.238 | -1.449 | ||
| P值 | 0.025 | 0.813 | 0.029 | ||
| a:P<0.01,与入院时比较;b:P<0.01,与对照组比较 | |||||
3 讨论
恶性肿瘤严重危害人类生命健康,是全世界的一个主要死因。根据世界卫生组织2022年的估计,2020年近1 000万例(或近六分之一)死亡由恶性肿瘤导致。随着疾病的进展,肿瘤患者是营养不良高发人群[7],40%~80%存在营养不良,50%~80%存在恶液质,20%直接死于营养不良。
整蛋白是大分子物质,具有非常复杂的结构,必须经过消化才能吸收和利用。而肽尤其是低聚肽、短肽和氨基酸,均属小分子物质,易于消化吸收和利用。研究证实,短肽具有加强上皮细胞屏障、提高黏液和抗菌蛋白产生、促进黏膜下层免疫细胞分化等作用[8]。研究报道,围术期补充短肽型肠内营养制剂可提高患者白蛋白水平,改善患者营养状况,缩短住院时间[9]。从海洋生物蛋白的水解物中发现其结构组成特殊, 具有低毒、高效抗肿瘤活性的活性肽,是开发新型抗肿瘤药物的有效途径之一[10-11]。但是,海洋生物活性肽干预改善化疗期肿瘤患者营养状况的人群实验尚未见报道。本项目从人群研究着手,通过相关性分析、膳食途径干预以及内源性水平提升3种手段,综合评价海洋生物活性肽对恶性肿瘤患者的保护效应。该保护效应可为指导恶性肿瘤从膳食途径改善营养不良和免疫力提供理论依据。
ONS是一种有效、无创的营养治疗措施, 适用于能够摄入一些食物但摄入不足以满足全部营养需求的患者。一项前瞻性随机对照试验纳入接受化疗的结直肠癌患者,ONS的摄入显著提高其营养状态,ONS组患者的体质量和BMI在90 d内均呈现明显地增加,但是肌肉量无统计学差异[12]。另一项人群实验提示,在围术期给予短肽型肠内营养制剂可有效防止瘦体质量的流失[13]。本研究结果显示,海洋生物活性肽联合常规ONS干预可明显稳定体质量并提升肌肉量。此外,既往研究提示,化疗可导致肿瘤患者身体功能减弱, 影响白蛋白的合成能力,低白蛋白水平严重影响肠道喂养的耐受性,可能是肿瘤患者术后无复发生存率和总生存率降低的重要因素[14-15]。与对照组相比,海洋生物活性肽联合常规ONS干预对白蛋白水平的提升具有显著意义。对上臂肌围、小腿围、腰围、臀围、握力等的测量简单、方便、快捷且经济,可作为恶性肿瘤患者长期营养管理的监测指标[16-18]。一项荟萃分析报道,握力水平与癌症的死亡率和发病率相关,对住院患者的预后有重要意义[19]。另有研究提示,成人低上臂肌围(22~24 cm)与几种不良健康结局有关[20-21]。本研究的患者基线时上臂肌围均小于24 mm,提示肿瘤患者本身具有较高的健康风险,对3组患者身体围度的监测发现,与基线相比,对照组患者的各项围度均呈下降趋势,提示随着疾病的进展和治疗的开展,肿瘤患者的营养风险持续增高,但在ONS联合海洋生物活性肽干预下,肿瘤患者的各项围度无明显下降变化,且ONS联合海洋生物活性肽干预能显著增加小腿围。
综上所述,在恶性肿瘤患者接受放化疗治疗期间,海洋生物活性肽联合常规ONS干预的患者,其体质量、BMI、肌肉量、体脂肪量、血清白蛋白、小腿围较入院时有明显增长,提示给予合理营养干预在改善肿瘤患者生活质量,延长生命方面具有正面效应。但本研究可能存在干预时间短、病例选择偏倚、观察指标较少等局限性,故海洋生物活性肽联合常规ONS干预对肿瘤患者营养状况的改善及临床结局的影响,还有待进一步的研究。
作者贡献声明 周蕊实施研究、采集数据、分析/解释数据、起草文章;刘妍、冯惠仪、刘硒碲、卢婵、刘亚静和阳静实施研究、采集数据;刘文颖、张新雪和付少委进行技术或材料支持;林兵、胡炜倩数据统计分析;张勇胜进行行政、技术或材料支持,对文章的知识性内容作批评性审阅、指导;朱翠凤获取研究经费、酝酿和设计实验,对文章的知识性内容作批评性审阅、指导
| [1] |
SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA A Cancer J Clin, 2021, 71(3): 209-249. |
| [2] |
DA FONSECA G W P, SATO R, DE NAZARÉ NUNES ALVES M J, et al. Current advancements in pharmacotherapy for cancer cachexia[J]. Expert Opin Pharmacother, 2023, 24(5): 629-639. |
| [3] |
ARENDS J, BACHMANN P, BARACOS V, et al. ESPEN guidelines on nutrition in cancer patients[J]. Clin Nutr, 2017, 36(1): 11-48. |
| [4] |
MENG Q Y, TAN S J, JIANG Y, et al. Post-discharge oral nutritional supplements with dietary advice in patients at nutritional risk after surgery for gastric cancer: a randomized clinical trial[J]. Clin Nutr, 2021, 40(1): 40-46. |
| [5] |
CHAKNIRAMOL S, WIERSCHEM A, CHO M G, et al. Physiological and clinical aspects of bioactive peptides from marine animals[J]. Antioxidants, 2022, 11(5): 1021. |
| [6] |
JAGER-WITTENAAR H, OTTERY F D. Assessing nutritional status in cancer: role of the Patient-Generated Subjective Global Assessment[J]. Curr Opin Clin Nutr Metab Care, 2017, 20(5): 322-329. |
| [7] |
MARSHALL K M, LOELIGER J, NOLTE L, et al. Prevalence of malnutrition and impact on clinical outcomes in cancer services: a comparison of two time points[J]. Clin Nutr, 2019, 38(2): 644-651. |
| [8] |
ZHANG J, YU W Q, WEI T, et al. Effects of short-peptide-based enteral nutrition on the intestinal microcirculation and mucosal barrier in mice with severe acute pancreatitis[J]. Mol Nutr Food Res, 2020, 64(5): 1901191. |
| [9] |
APOSTOLOPOULOS V, BOJARSKA J, CHAI T T, et al. A global review on short peptides: frontiers and perspectives[J]. Molecules, 2021, 26(2): 430. |
| [10] |
XING H B, TONG M T, JIANG N Y, et al. Antitumour bioactive peptides isolated from marine organisms[J]. Clin Exp Pharmacol Physiol, 2017, 44(11): 1077-1082. |
| [11] |
RUIZ-RUIZ F, MANCERA-ANDRADE E I, IQBAL H M N. Marine-derived bioactive peptides for biomedical sectors: a review[J]. Protein Pept Lett, 2017, 24(2): 109-117. |
| [12] |
杨鑫, 朱明炜, 修典荣, 等. 口服营养补充疗法对结直肠癌术后辅助化疗患者营养状态及生活质量的影响: 一项多中心前瞻性随机对照研究[J]. 中华胃肠外科杂志, 2020, 23(6): 566-571. YANG X, ZHU M W, XIU D R, et al. Effect of an oral nutritional supplementation on nutritional status and quality of life in patients with colorectal cancer and postoperative adjuvant chemotherapy: a multi-center prospective randomized control trial[J]. Chin J Gastrointest Surg, 2020, 23(6): 566-571. |
| [13] |
COMAS MARTÍNEZ M, FIDILIO MELI E, PALMAS CANDIA F, et al. Protein supplementation with short peptides prevents early muscle mass loss after roux-en-Y-gastric bypass[J]. Nutrients, 2022, 14(23): 5095. |
| [14] |
XU S S, LI S, XU H X, et al. Haemoglobin, albumin, lymphocyte and platelet predicts postoperative survival in pancreatic cancer[J]. World J Gastroenterol, 2020, 26(8): 828-838. |
| [15] |
VISWESHWAR N, JAGLAL M, SOKOL L, et al. Chemotherapy-related anemia[J]. Ann Hematol, 2018, 97(2): 375-376. |
| [16] |
SRINIVASARAGHAVAN N, VENKETESWARAN M V, BALAKRISHNAN K, et al. Comparison of nutrition screening tools and calf circumference in estimating the preoperative prevalence of malnutrition among patients with aerodigestive tract cancers—a prospective observational cohort study[J]. Support Care Cancer, 2022, 30(8): 6603-6612. |
| [17] |
PAGOTTO V, DOS SANTOS K F, MALAQUIAS S G, et al. Calf circumference: clinical validation for evaluation of muscle mass in the elderly[J]. Rev Bras Enferm, 2018, 71(2): 322-328. |
| [18] |
JOCHEMS S H J, WOOD A M, HÄGGSTRÖM C, et al. Waist circumference and a body shape index and prostate cancer risk and mortality[J]. Cancer Med, 2021, 10(8): 2885-2896. |
| [19] |
STORCK L J, USTER A, GAFNER L, et al. Effect of combined therapies including nutrition and physical exercise in advanced cancer patients: a pooled analysis[J]. Front Nutr, 2023, 10: 1063279. |
| [20] |
KIM Y J, HIRATSUKA Y, SUH S Y, et al. Performance of mid-upper arm circumference and other prognostic indices based on inflammation and nutrition in oncology outpatients: a tertiary cancer center study[J]. Ann Palliat Med, 2022, 11(10): 3171-3180. |
| [21] |
ZHUANG C L, ZHANG F M, XU H X, et al. Reference values of low body mass index, mid-upper arm circumference, and calf circumference in cancer patients: a nationwide multicenter observational study[J]. Nutrition, 2022, 99/100: 111688. |




