高龄妊娠是指分娩年龄≥35岁的妊娠,此时期的孕产妇称之为高龄孕产妇(advanced maternal aged, AMA)。随着现代人生活方式的改变,女性接受教育程度的增高以及辅助生殖技术的完善,我国高龄妊娠率呈增加趋势。流行病学调查发现,父亲高龄与子代智力无明显相关性,而高龄孕妇对子代智力发育存在负面影响[1]。因此,高龄妊娠对子代神经发育的影响成为社会关注的焦点。既往有研究通过morris水迷宫实验发现,高龄妊娠子代存在明显的学习认知能力下降[2]。然而,高龄妊娠导致子代神经发育障碍的机制尚不清楚。
纤毛是突出于真核细胞表面的、以微管为结构基础的类似“触角”的细胞器,能感知、募集并介导细胞外信号进入胞内。纤毛分为两大类:运动纤毛和不动纤毛。其中不动纤毛又称为初级纤毛,是中心粒衍生的感觉细胞器,存在于大多数哺乳动物细胞中,包括星形胶质细胞和神经元[3]。其在胚胎早期发育和胚胎干细胞分化过程中发挥着重要作用,与中枢神经系统发育也有着密切联系。初级纤毛发育障碍可引起多种纤毛病,其中神经发育异常是主要突出表型之一[4]。LRRK2突变小鼠模型中可出现星形胶质细胞和神经元初级纤毛缺失,并引起帕金森病[5]。另外有研究发现,采用LP17可抑制脂多糖对神经元初级纤毛及其神经元活动的损害,进而缓解神经炎症诱导的抑郁症[6]。
同时,初级纤毛也是个体发育过程中大量信号通路如Hedgehog、WNT等的转导中心[7]。AKHSHI等[8]在2021年的研究中发现Sonic Hedgehog通路中激活Smo的配体可以通过肝脏激酶B1(liver kinase B1, LKB1)/单磷酸腺苷酸活化蛋白激酶(adenosine monophosphate activated protein kinase, AMPK)诱导自噬清除初级纤毛生成所必需的OFD1卫星池,导致初级纤毛生成功能损伤。细胞凋亡在神经发育和神经退行性疾病中扮演着重要角色,而LKB1/AMPK作为公认的机体调控凋亡通路之一,在帕金森病、阿尔茨海默症等神经系统相关疾病的发病和病情进展中发挥着关键作用。有研究指出,激活LKB1/AMPK信号通路时,可促进自噬从而抑制氧糖剥夺所导致的神经细胞相关凋亡发生[9]。
本研究通过构建高龄妊娠及适龄妊娠子代SD大鼠模型,比较不同时间点两组脑海马神经元形态、星形胶质细胞和/或神经元初级纤毛、细胞凋亡以及LKB1/AMPK通路相关指标,探究高龄妊娠子代是否存在脑海马相关细胞初级纤毛发生功能缺陷和凋亡异常,并探讨两者与LKB1/AMPK信号通路可能的关系,旨在进一步探讨高龄妊娠子代神经发育障碍的潜在机制。
1 材料与方法 1.1 材料 1.1.1 实验动物采用无特定病原体(specific pathogen free, SPF)级健康3月龄雄性SD大鼠(体质量360~400 g)、12月龄雌性SD大鼠(体质量400~500 g)以及3月龄雌性SD大鼠(体质量230~270 g)各6只[由重庆医科大学动物实验中心提供,许可证号:SCXK(渝)2022-0010]。置于SPF级环境中进行饲养。提供标准饲料,自由饮食饮水,不限制活动,室内温度控制在(22±3)℃,明亮/黑暗环境周期为12 h/12 h。在动物转运、饲养和实验过程中,符合重庆医科大学附属儿童医院实验动物伦理委员会所制定的伦理学标准。
1.1.2 主要实验仪器和试剂电泳仪、垂直板蛋白电泳槽、电转移装置、ChemiDoc Touch成像系统均购自美国Bio-Rad公司;荧光显微镜购自日本尼康公司;石蜡切片机购自德国leica公司;尼氏染色液-亚甲蓝法、DAPI染色液均购自北京雷根生物技术有限公司;抗ADP核糖基化因子相似蛋白-13B(anti-ADP-ribosylation factor-like protein 13B, ARL13B)小鼠单克隆抗体购自英国Abcam公司;星形胶质细胞胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP)兔多克隆抗体、神经元特异核蛋白抗原(neuronal nuclei/neuron-specific protein, NeuN)兔多克隆抗体均购自美国GeneTex公司;鞭毛内运输蛋白88(intraflagellar transport 88, IFT88)兔单克隆抗体、磷酸化单磷酸腺苷酸活化蛋白激酶(phospho-adenosine monophosphate activated protein kinase, p-AMPK)兔多克隆抗体、β-actin小鼠单克隆抗体、HRP标记山羊抗小鼠IgG抗体、HRP标记山羊抗兔IgG抗体、山羊抗小鼠IgG抗体-FITC均购自成都正能生物技术有限责任公司;磷酸化肝脏激酶B1(phospho-liver kinase B1, p-LKB1)兔多克隆抗体购自美国CST公司;LKB1兔多克隆抗体、AMPKα2小鼠单克隆抗体、BAX兔单克隆抗体、BCL-2小鼠单克隆抗体、山羊抗兔IgG抗体-TRITC均购自杭州华安生物技术有限公司;磷酸化哺乳动物雷帕霉素靶蛋白(phospho-mammalian target of rapamycin, p-mTOR)小鼠单克隆抗体、mTOR小鼠单克隆抗体均购自武汉三鹰生物技术有限公司;TUNEL试剂盒购自武汉赛维尔生物科技有限公司。
1.2 方法 1.2.1 实验动物模型将12月龄SD雌鼠(相当于人≥35岁)与3月龄SD雄鼠2∶1交配产下的子代作为高龄(advanced maternal age, AMA)组,将3月龄SD雌鼠(相当于人适龄生育年龄)与3月龄SD雄鼠2∶1交配产下的子代作为适龄(control, Ctl)组。于子代出生后第14、28、60天(分别以P14、P28、P60表示)处死两组子代(P14体质量:18~25 g;P28体质量:60~90 g;P60体质量:180~250 g,各时间点每组14只,均雌雄各半),留取完整大脑和分离出的海马作为研究标本,观察两组子代不同发育期的相关变化。
1.2.2 HE染色实验观察海马神经元形态实验鼠经心脏灌注4%多聚甲醛,留取完整大脑脱水后行石蜡包埋,使用石蜡切片机切出厚度为4 μm的冠状海马备用,按梯度酒精进行脱蜡。苏木精浸染30 min,流动自来水冲洗2 min,1%盐酸酒精浸泡3 s,流水冲洗1 min,饱和碳酸锂浸泡5 s,流水冲洗1 min,伊红浸染20 s,流水冲洗2 min,按梯度酒精脱水,二甲苯透明后封片。在80倍和200倍光学显微镜下观察海马神经元形态变化情况。
1.2.3 尼氏染色(亚甲蓝法)观察海马神经元尼氏体脑片制备同1.2.2。将脱蜡后的切片根据尼氏染色试剂盒进行操作,酒精脱水,二甲苯透明后封片。在80倍光学显微镜下观察海马整体神经元尼氏体表达情况,在400倍光学显微镜下观察海马神经元内尼氏体变化情况,同时每张脑片在CA1区、CA3区、DG区各取1个400倍光镜视野进行神经元计数。
1.2.4 免疫荧光ARL13B与GFAP、ARL13B与NeuN共定位,单标ARL13B计算初级纤毛发生率以及长度脑片制备同1.2.2。将脱蜡后的切片置于预热好的柠檬酸钠-EDTA抗原修复液中,95 ℃水浴孵育15 min进行高温抗原修复。使用0.01 mol/L PBS漂洗切片,用组化笔画出闭合的圆圈以标记脑片位置,在每张脑片上滴加100 μL封闭液,于室温下封闭1 h。使用封闭液配制ARL13B一抗溶液(浓度1∶500),并滴加在脑片上,置于4 ℃冰箱孵育24 h。次日采用0.01 mol/L PBS溶液配制二抗溶液(羊抗小鼠-FITC,浓度1∶300),室温避光条件下孵育2 h(需与GFAP和NeuN免疫荧光双标的脑片再次于室温下封闭2 h后,分别孵育GFAP、NeuN一抗溶液,浓度均为1∶100,4 ℃过夜,次日室温避光条件下孵育对应二抗溶液2 h,羊抗兔-TRITC,浓度1∶100)。使用0.01 mol/L PBS溶液配制DAPI溶液,室温避光条件下孵育15 min。漂洗后采用抗荧光淬灭剂封片,置于暗盒保存。采用免疫荧光显微镜进行观察,DAPI标记细胞核,ARL13B标记神经细胞初级纤毛,GFAP标记星形胶质细胞,NeuN标记神经元。观察ARL13B与GFAP、ARL13B与NeuN是否存在共定位表达,统计两组各时间点ARL13B的发生率和长度(对目标区域细胞初级纤毛发生率:随机海马视野内ARL13B阳性细胞数/该视野内细胞总数;初级纤毛长度:采用Image J软件测量随机海马视野内ARL13B阳性标志物的长短)。
1.2.5 Western blot检测IFT88、BAX、BCL-2、LKB1、AMPK、mTOR蛋白表达于P14、P28、P60给予两组大鼠腹腔注射戊巴比妥(0.05 mL/10 g),待大鼠深度麻醉后,处死,挖出大脑,分离出海马,每侧海马组织单独存放于冻存管中,使用总蛋白提取试剂盒提取蛋白,并采用BCA法检测蛋白浓度。根据上样量(30 μg),选择相应SDS-PAGE loading buffer加入已测浓度的蛋白中,振荡充分混匀,100 ℃煮蛋白5 min,冷却至室温后,分装并储存于-80 ℃中。制备SDS-PAGE凝胶,采用SDS-PAGE电泳后,通过电转将蛋白从凝胶上转移到PVDF膜上。以TBST进行洗膜,使用5%脱脂奶粉封闭1 h,孵育β-actin、IFT88、BAX、BCL-2、LKB1、AMPKα2、mTOR一抗4 ℃冰箱过夜;5%无脂肪酸BSA封闭2 h,孵育p-LKB1(Ser428)、p-AMPK(Thr172)、p-mTOR(Ser2448)一抗4 ℃冰箱过夜(除β-actin浓度为1∶5 000外,其余一抗浓度均为1∶1 000)。次日室温下孵育相应二抗(浓度1∶5 000)1 h。采用ECL化学发光显影液显影,注意避光操作和现用现配。使用蛋白成像系统曝光并拍摄照片,采用Image Lab软件对其显影图像的蛋白灰度值进行分析。
1.2.6 TUNEL染色海马神经细胞观察凋亡情况脑片制备同1.2.2。切片修复,破膜滴加buffer常温孵育,随后根据TUNEL试剂盒说明书进行操作,DAB显色,流水冲洗,复染细胞核,按梯度酒精脱水后封片。其中,细胞核固缩、染色体凝集呈棕褐色的细胞即为凋亡细胞。在80倍光学显微镜下观察整体海马情况,在400倍光学显微镜下观察海马CA1区、CA3区、齿状回(DG)区的凋亡神经细胞,每组随机选择6个视野计数正常神经细胞和凋亡神经细胞,取平均值,计算细胞凋亡率[凋亡细胞数/(凋亡细胞数+正常细胞数)×100%]。
1.3 统计学分析使用GraphPad Prism 9.0 (GraphPad Software, USA)对数据进行统计分析,计量资料以平均值±标准误
HE染色后,光镜下观察AMA组和Ctl组P14、P28、P60大鼠脑海马区神经元形态变化(图 1)。结果显示,在上述各时间点上,Ctl组海马组织形态以及结构正常,神经元排列整齐,着色均匀,细胞核以及核仁大小正常;与Ctl组相比,AMA组海马形态基本正常,CA1、CA3区可见神经元排列紊乱且稀疏,着色深浅不一,部分神经元形态发生改变,DG区可见大量空泡状的肿胀神经元。
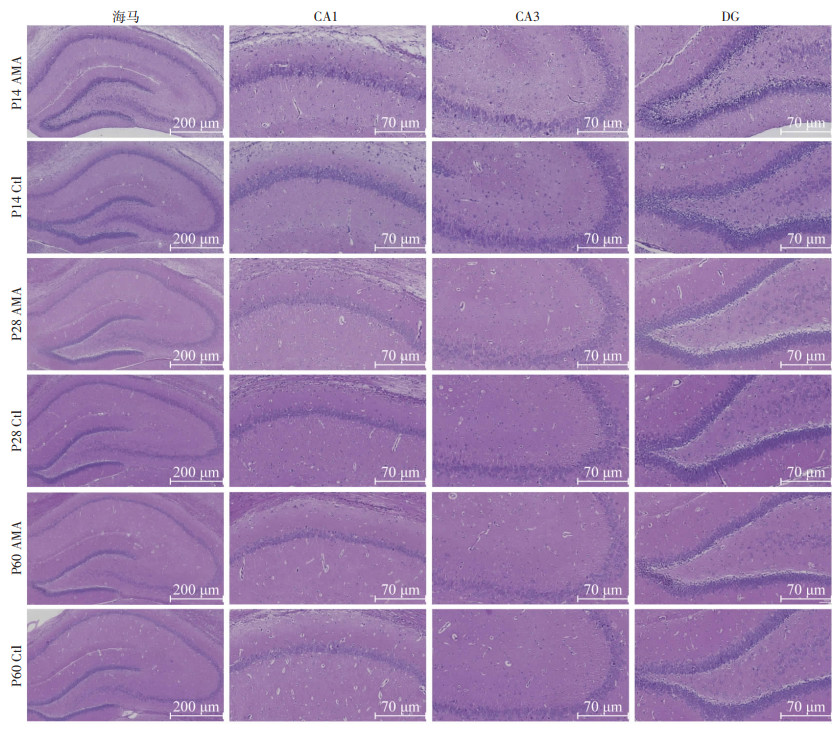
|
| 图 1 HE染色观察生后不同时间点两组子代脑海马神经元形态 |
尼氏染色后,同样在光镜下观察两组P14、P28、P60大鼠脑海马区神经元内尼氏体变化。结果显示,与Ctl组相比,AMA组在前述3个时间点海马神经元排列紊乱,尼氏体着色较浅(图 2A)。在进一步放大的图 2B中,可见尼氏体是位于神经元细胞核两侧深蓝色呈斑块状的嗜碱性颗粒,AMA组在各时间点尼氏体的数量较Ctl组减少、尼氏体着色较Ctl组更浅。统计结果发现,两组神经元数量均随年龄的增长而下降,AMA组在前述3个时间点海马神经元数量均较Ctl组减少,并在P14时差异具有统计学意义(P < 0.05,图 2C)。
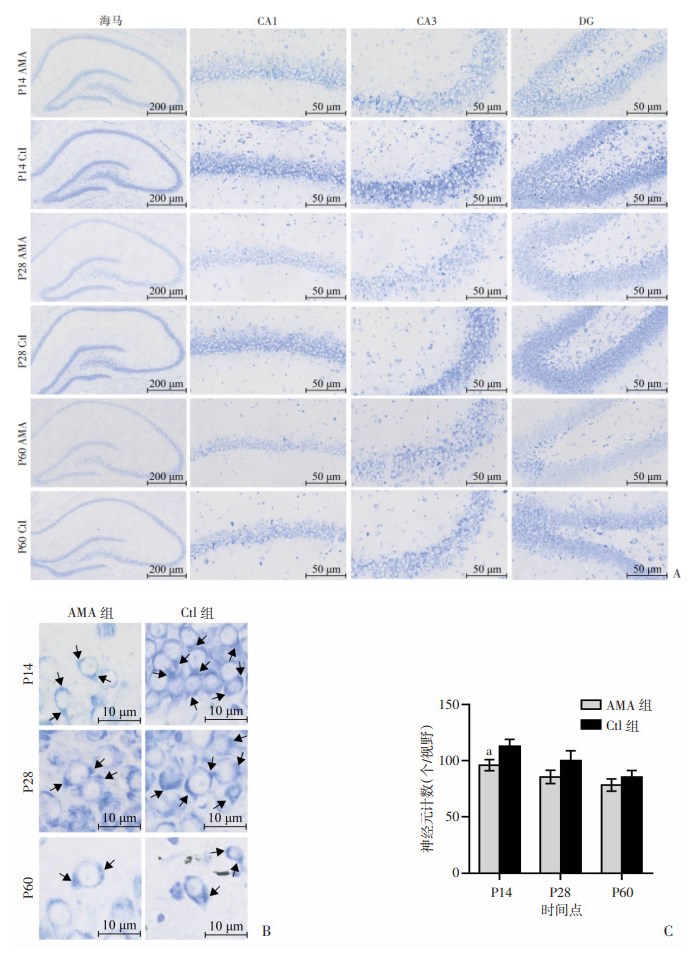
|
| A:生后不同时间点两组子代海马神经元尼氏染色图像;B:尼氏体图像分析黑色箭头所指深蓝色呈斑块状的嗜碱性颗粒即为尼氏体;C:海马CA1、CA3、DG区400倍视野下神经元数量统计分析 a: P < 0.05,与同时间点Ctl组比较 图 2 尼氏体情况形态及尼氏染色观察生后不同时间点两组子代脑海马神经元 |
2.2 两组子代脑海马星形胶质细胞和神经元初级纤毛的变化
ARL13B与星形胶质细胞标志物GFAP存在共定位(图 3A),提示ARL13B存在于脑海马星形胶质细胞上;另外,ARL13B与神经元标志物NeuN也存在共定位(图 3B),提示ARL13B也存在于脑海马神经元上。ARL13B标记的初级纤毛呈点状或丝状,位于星形胶质细胞和神经元的膜表面。通过免疫荧光检测ARL13B蛋白表达,了解两组子代大鼠海马区整体初级纤毛变化情况,以ARL13B阳性细胞发生率和ARL13B长度反映初级纤毛的发生和结构的形成以及生长能力。图 4结果显示,AMA组和Ctl组ARL13B初级纤毛长度均随年龄的增长而增加;在P14、P28时,AMA组ARL13B初级纤毛发生率、长度均明显低于和短于Ctl组(P < 0.05和/或P < 0.01)。
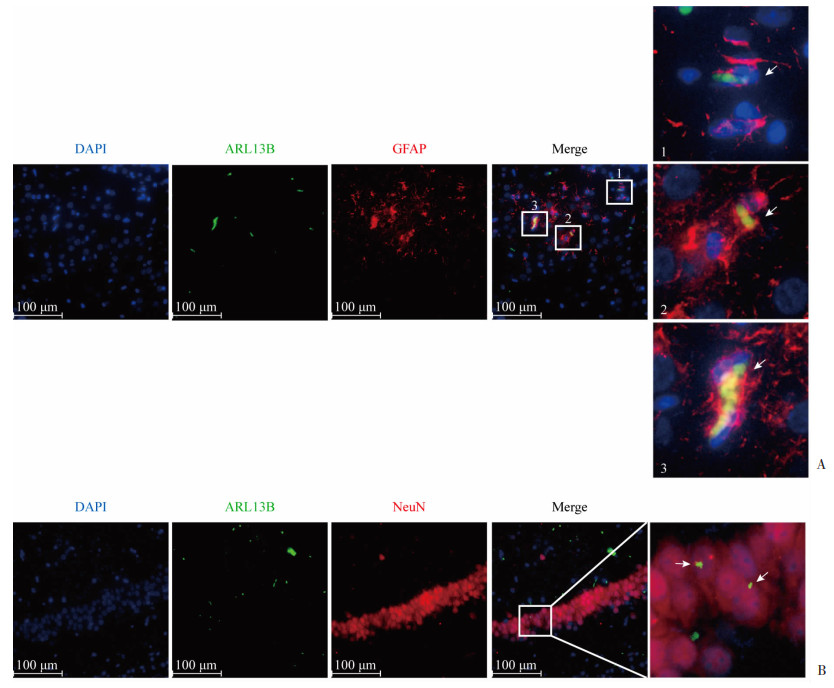
|
| A:子代海马ARL13B与GFAP免疫荧光双标观察;B:子代海马ARL13B与NeuN免疫荧光双标观察 图 3 子代脑海马ARL13B与GFAP、ARL13B与NeuN共定位情况 |
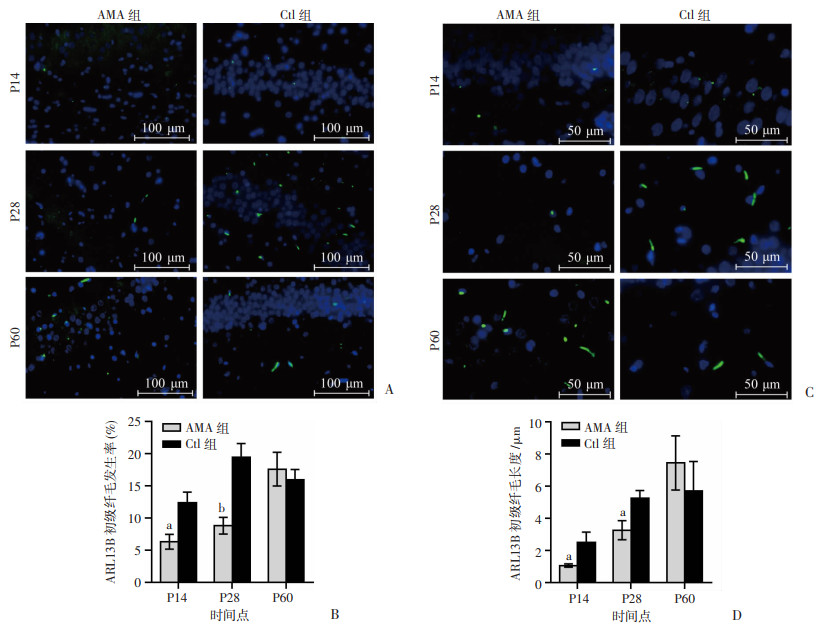
|
|
a: P < 0.05,b: P < 0.001,与同时间点Ctl组比较 A:各时间点两组海马内ARL13B初级纤毛免疫荧光染色图像(观察发生率变化);B:各时间点两组海马ARL13B发生率统计结果;C:各时间点两组海马内ARL13B初级纤毛免疫荧光染色图像(观察长度变化);D:各时间点两组海马ARL13B长度统计结果 图 4 生后不同时间点两组子代脑海马ARL13B初级纤毛发生率和长度变化 |
2.3 两组子代脑海马初级纤毛蛋白IFT88表达变化
Western blot检测不同时间点两组脑海马IFT88的表达,图 5显示,在P14和P28时,AMA组IFT88表达均低于Ctl组,两组的差异在P14有统计学意义(P < 0.01)。结合前述免疫荧光ARL13B染色结果,提示高龄妊娠子代脑发育期早期海马存在初级纤毛发生和功能缺陷。
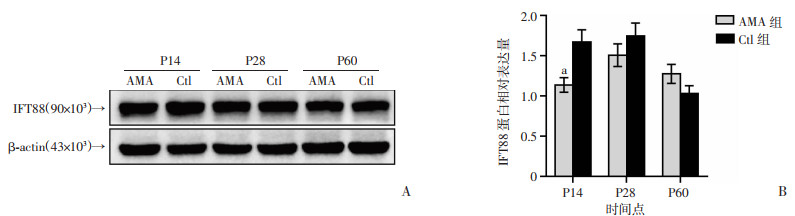
|
| A:Western blot检测海马IFT88蛋白表达;B:IFT88蛋白相对表达量 a: P < 0.01,与同时间点Ctl组比较 图 5 生后不同时间点两组子代脑海马初级纤毛相关蛋白IFT88表达变化 |
2.4 两组子代脑海马内细胞凋亡的情况
TUNEL染色结果显示,光镜下形态皱缩、核固缩、染色体凝集呈棕褐色的细胞即为凋亡细胞(图 6A)。AMA组与Ctl组海马内细胞凋亡率均随年龄的增长而减少,且在各观察时间点上AMA组海马内细胞凋亡率均较Ctl组高,两组在P14差异具有统计学意义(P < 0.05,图 6B)。
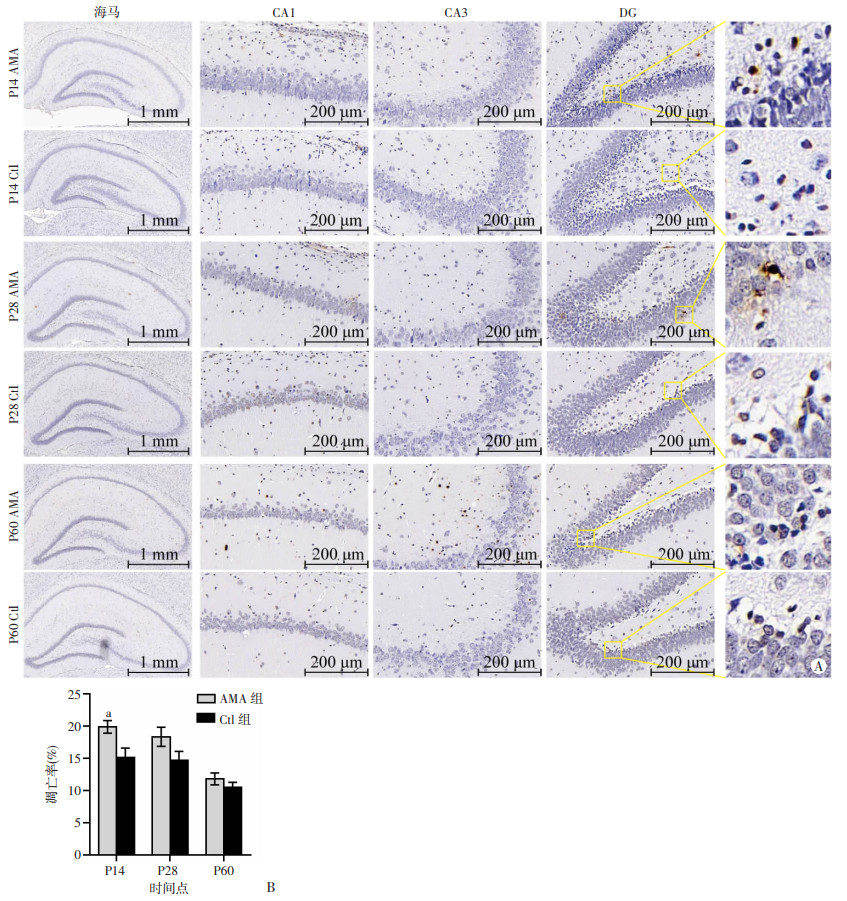
|
| A:各时间点两组海马内细胞TUNEL染色图像;B:各时间点两组海马内细胞凋亡率统计结果 a: P < 0.05,与同时间点Ctl组比较 图 6 生后不同时间点两组子代脑海马神经细胞凋亡变化 |
2.5 两组子代脑海马凋亡蛋白BAX、BCL-2的变化
Western blot检测结果发现(图 7),在P14时,AMA组海马BAX表达水平明显高于Ctl组(P < 0.001),BCL-2表达显著低于Ctl组(P < 0.01)。结合TUNEL染色提示,在幼年早期,高龄妊娠子代脑海马存在凋亡激活。
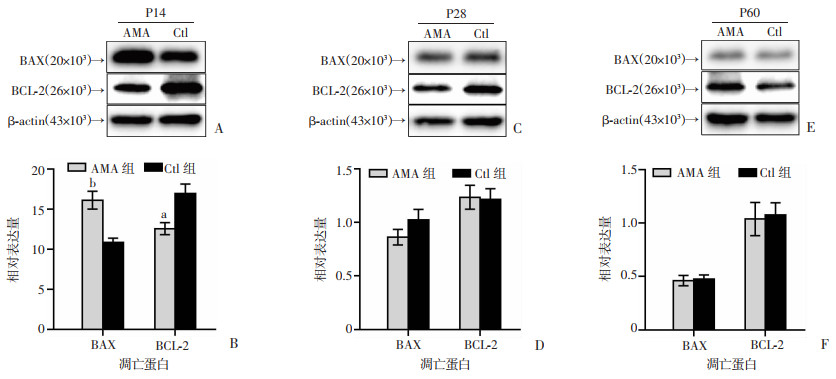
|
|
a: P < 0.01,b:P < 0.001,与Ctl组比较 A:P14两组海马BAX和BCL-2蛋白表达;B:P14时BAX和BCL-2蛋白相对表达量;C:P28两组海马BAX和BCL-2蛋白表达;D:P28时BAX和BCL-2蛋白相对表达量;E:P60两组海马BAX和BCL-2蛋白表达;F:P60时BAX和BCL-2蛋白相对表达量 图 7 生后不同时间点两组子代脑海马凋亡蛋白BAX和BCL-2表达变化 |
2.6 两组子代脑海马p-LKB1/LKB1、p-AMPK/AMPK、p-mTOR/mTOR蛋白表达变化
Western blot检测不同时间点两组脑海马区LKB1/AMPK通路相关蛋白的磷酸化变化。结果发现(图 8),在3个观察时间点中,AMA组磷酸化AMPK表达均高于Ctl组,在P28、P60差异具有统计学意义(P均 < 0.01);AMA组磷酸化mTOR表达在3个时间点也均低于Ctl组,仅在P60差异具有统计学意义(P < 0.05);同时,AMA组磷酸化LKB1表达在P14时明显低于Ctl组(P < 0.05)。
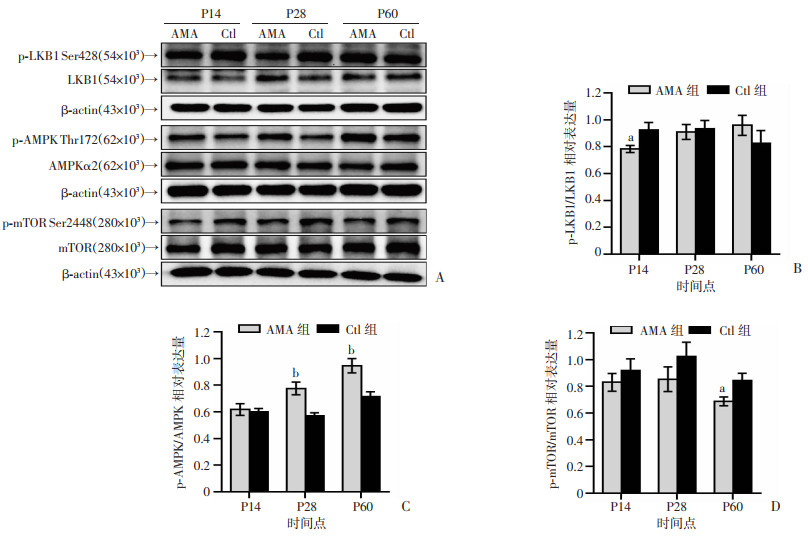
|
|
a: P < 0.05,b: P < 0.01,与同时间点Ctl组比较 A:各时间点两组海马p-LKB1、LKB1、p-AMPK、AMPK、p-mTOR、mTOR蛋白表达;B:p-LKB1蛋白相对表达量;C:p-AMPK蛋白相对表达量;D:p-mTOR蛋白相对表达量 图 8 生后不同时间点两组子代脑海马LKB1/AMPK通路蛋白表达变化 |
3 讨论
尽管高龄妊娠带来的不良影响尚无明确界定,但本研究发现在幼年期,高龄妊娠子代脑海马神经元受损,星形胶质细胞和神经元初级纤毛存在发生功能缺陷和生长功能抑制,细胞凋亡存在异常激活。另外,高龄妊娠子代脑海马在各年龄期均存在LKB1/AMPK通路的异常活化。异常活化。
神经细胞异常是神经发育缺陷的主要原因之一[10]。海马是尚处于发育期大脑中最易受到损伤的脑区[11],因而海马区神经细胞的改变情况是衡量神经发育情况的重要指标。既往研究发现,高龄妊娠子代脑海马区神经干细胞不仅增殖能力明显下降[12],而且迁移、向神经元以及星形胶质细胞分化的能力也明显受到抑制。本研究中HE以及尼氏染色观察子代脑海马神经元形态数量及其胞内尼氏体的变化,发现在不同时间点(P14、P28、P60),高龄妊娠大鼠子代脑海马的神经元形态、排列结构以及其胞内尼氏体数量着色分布存在异常,且在P14时AMA组神经元数量明显少于Ctl组。提示高龄妊娠子代幼年早期脑海马存在明显的神经元损伤。那么,这种神经元的损伤与什么相关呢?
初级纤毛在神经发育过程发挥重要调控功能,因此其损伤也可导致神经发育发生异常。在成熟的大脑中,星形胶质细胞和神经元都含有单个初级纤毛[13],大量研究为了探讨初级纤毛在神经发育中的作用,采用免疫荧光标记相关标志物,以观察星形胶质细胞和神经元上初级纤毛[13-14]的变化情况。ARL13B是属于ADP核糖基化因子家族和单体小GTP酶Ras超家族的纤毛蛋白[15],能够在包括星形胶质细胞和神经元在内的许多细胞中选择性表达[16]。本研究中尝试了ARL13B分别与星形胶质细胞标志物GFAP和神经元标志物NeuN进行免疫荧光共定位检测,结果发现,ARL13B在星形胶质细胞和神经元上均有分布。有研究发现,破坏ARL13B后会出现纤毛蛋白运输异常和纤毛长度变短[17],并损伤神经元之间的连接[18]。IFT88蛋白作为鞭毛内运输系统中的关键蛋白,是纤毛形成所需的必要成分[19]。STEIDL等[20]研究发现,Ift88敲除的细胞中会表现出纤毛发生缺陷和更短的初级纤毛。本研究通过免疫荧光和Western blot检测发现,与Ctl组相比,在发育幼年期的P14、P28时间点,高龄妊娠子代脑海马星形胶质细胞和神经元ARL13B发生率明显降低,且其长度明显缩短;IFT88蛋白表达水平明显下降或有下降趋势,结果提示高龄妊娠子代在幼年期存在脑海马星形胶质细胞和神经元初级纤毛发生功能的缺陷和生长功能的抑制。
本研究TUNEL染色实验发现,在子代幼年期,AMA组在海马内细胞凋亡率明显高于Ctl组,证实细胞凋亡是高龄妊娠子代神经元损伤的形式之一。细胞凋亡是生长发育过程中细胞自主有序的程序性死亡,Bax、Bcl-2是目前已知调控细胞凋亡最重要的2个基因,BCL-2的过度表达可通过延长细胞生存而阻止细胞凋亡的发生,而BAX可拮抗BCL-2对细胞的保护效应促进细胞发生凋亡。使用氩气预处理损伤神经细胞,可下调BAX表达、上调BCL-2表达,防止神经细胞凋亡[21]。本研究发现,高龄妊娠子代幼年期脑海马在细胞凋亡增加的同时伴有BAX蛋白表达水平的增高和BCL-2蛋白表达水平明显降低,提示高龄妊娠子代脑海马存在细胞凋亡的异常激活,可能是神经元损伤的重要原因之一。
初级纤毛可通过多种通路调控细胞凋亡。AMPK是调控凋亡的重要分子[22],在应激状态下,LKB1介导的MAP依赖性途径是导致AMPK活化的主要原因。LKB1作为AMPK上游激酶,在各种细胞中,当其被活化后转移到纤毛基体时,可使同样定位在纤毛基体的AMPKα亚基上Thr172位点发生磷酸化,从而激活AMPK[23]。目前已知的研究中,LKB1磷酸化表达的高低与激活LKB1的结论不尽相同,但几乎所有研究都表明激活LKB1可激活AMPK。AMPK是mTOR上游的调节因子,AMPK激活后可影响mTOR等自噬过程中关键调控分子发生磷酸化,从而调控细胞凋亡过程。WIDJAJA等[24]的研究证实,在肝细胞和上皮细胞中,IL-11可抑制LKB1/AMPK通路从而上调mTOR磷酸化表达,导致mTOR活化;同时也有大量研究发现,激活AMPK抑制mTOR时,mTOR磷酸化表达下降其细胞自噬活化[25-26],而凋亡受到抑制[27];在大鼠脊髓损伤模型中, 使用白藜芦醇干预后发现可通过AMPK信号通路促进细胞自噬及抑制凋亡,从而发挥神经保护作用[28]。在本研究Western blot检测LKB1/AMPK通路相关蛋白中发现,与Ctl组相比,AMA组P14和P28的LKB1磷酸化表达下降,在P14时差异具有统计学意义,同时间点其下游AMPK磷酸化表达上升,并在P28时具有显著性差异,mTOR磷酸化表达下降,因此推测在幼年期,高龄妊娠子代脑海马存在LKB1/AMPK通路的活化;而在P60时,高龄妊娠子代LKB1磷酸化表达有升高趋势,AMPK磷酸化表达明显上升,同时mTOR磷酸化明显下降。这提示在成年期,高龄妊娠子代也同样存在LKB1/AMPK通路的活化。上述结果表明,高龄妊娠子代脑海马从幼年期到成年期可能均存在LKB1/AMPK通路的异常活化,但不同时期LKB1/AMPK通路异常活化的机制存在差异,可能与幼年早期子代大鼠脑功能发育不全有关。
本研究结果显示,高龄妊娠子代LKB1/AMPK通路活化后mTOR磷酸化下降,但凋亡活性却出现上调,与既往LKB1/AMPK通路对凋亡影响的研究结论相反[25, 27]。结合本研究海马神经元形态数量观察、初级纤毛相关实验,提示高龄妊娠子代脑海马星形胶质细胞和神经元初级纤毛功能缺陷和凋亡异常不仅与LKB1/AMPK通路相关,还可能受到其他途径调控。研究提示凋亡与自噬有着密切的关系[25, 27]。mTOR作为细胞自噬上游通路的汇合点,是自噬调节两大复合体之一[29]。mTOR和凋亡标志物间还存在大量其他自噬调控分子[30]。因此推测,高龄妊娠子代在mTOR下游和BAX、BCL-2上游间可能存在其他途径通过抑制自噬的启动和自噬小体的形成,下调自噬功能,从而激活凋亡。我们后续的实验,将会通过对初级纤毛以及下游LKB1/AMPK通路进行上调或下调等方法,同时检测自噬相关指标,探讨初级纤毛以及LKB1/AMPK通路在高龄妊娠子代脑海马中对神经细胞凋亡的调控机制。
综上所述,高龄妊娠子代脑海马中神经元损伤、星形胶质细胞和神经元初级纤毛功能缺陷、凋亡异常激活可能与LKB1/AMPK通路有关。我们推测,在幼年期尤其是幼年早期,高龄妊娠子代脑海马星形胶质细胞和神经元初级纤毛功能缺陷可能通过LKB1/AMPK通路调控神经细胞凋亡导致神经元损伤进而使子代脑功能发育异常。本研究为高龄妊娠导致幼年期子代神经发育障碍的潜在机制提供了新思路,但其具体作用机制还有待深入研究和探索。
| [1] |
MYRSKYLÄ M, SILVENTOINEN K, TYNELIUS P, et al. Is later better or worse? Association of advanced parental age with offspring cognitive ability among half a million young Swedish men[J]. Am J Epidemiol, 2013, 177(7): 649-655. |
| [2] |
MAO W J, WU Z Y, YANG Z H, et al. Advanced maternal age impairs spatial learning capacity in young adult mouse offspring[J]. Am J Transl Res, 2018, 10(3): 975-988. |
| [3] |
STERPKA A, YANG J, STROBEL M, et al. Diverged morph- ology changes of astrocytic and neuronal primary cilia under reactive insults[J]. Mol Brain, 2020, 13(1): 28. |
| [4] |
SUCIU S K, CASPARY T. Cilia, neural development and disease[J]. Semin Cell Dev Biol, 2021, 110: 34-42. |
| [5] |
KHAN S S, SOBU Y, DHEKNE H S, et al. Pathogenic LRRK2 control of primary cilia and Hedgehog signaling in neurons and astrocytes of mouse brain[J]. Elife, 2021, 10: e67900. |
| [6] |
FU A H, QIAO F, FENG H, et al. Inhibition of TREM-1 ameliorates lipopolysaccharide-induced depressive-like behaviors by alleviating neuroinflammation in the PFC via PI3K/Akt signaling pathway[J]. Behav Brain Res, 2023, 449: 114464. |
| [7] |
ANVARIAN Z, MYKYTYN K, MUKHOPADHYAY S, et al. Cellular signalling by primary cilia in development, organ function and disease[J]. Nat Rev Nephrol, 2019, 15(4): 199-219. |
| [8] |
AKHSHI T, TRIMBLE W S. A non-canonical Hedgehog pathway initiates ciliogenesis and autophagy[J]. J Cell Biol, 2021, 220(1): e202004179. |
| [9] |
ZHAO D Y, YU D D, REN L, et al. Ligustilide protects PC12 cells from oxygen-glucose deprivation/reoxygenation-induced apoptosis via the LKB1-AMPK-mTOR signaling pathway[J]. Neural Regen Res, 2020, 15(3): 473-481. |
| [10] |
BERSANI I, PIERSIGILLI F, GAZZOLO D, et al. Heart rate variability as possible marker of brain damage in neonates with hypoxic ischemic encephalopathy: a systematic review[J]. Eur J Pediatr, 2021, 180(5): 1335-1345. |
| [11] |
苏晓英, 周飞仁, 都跃. 重复异丙酚麻醉通过mTOR通路诱导大鼠海马细胞凋亡及自噬[J]. 中国老年学杂志, 2023, 43(2): 481-486. SU X Y, ZHOU F R, DU Y. Repeated propofol anesthesia induces apoptosis and autophagy in rat hippocampal cells through mTOR pathway[J]. Chin J Gerontol, 2023, 43(2): 481-486. |
| [12] |
李彩芳. 高龄母鼠子代海马区神经干细胞增殖特性的研究[D]. 郑州: 郑州大学, 2015. LI C F. Study on proliferation characteristics of neural stem cells in hippocampus of offspring of aged female rats[D]. Zhengzhou: Zhengzhou University, 2015. |
| [13] |
STERPKA A, CHEN X M. Neuronal and astrocytic primary cilia in the mature brain[J]. Pharmacol Res, 2018, 137: 114-121. |
| [14] |
周晓春, 王珊珊, 安云鹤. 海马神经元初级纤毛染色技术探索[J]. 生物学杂志, 2016, 33(3): 107-109, 129. ZHOU X C, WANG S S, AN Y H. The research of staining technology of primary cilium in hippocampal neurons[J]. J Biol, 2016, 33(3): 107-109, 129. |
| [15] |
CANTAGREL V, SILHAVY J L, BIELAS S L, et al. Mutations in the cilia gene ARL13B lead to the classical form of Joubert syndrome[J]. Am J Hum Genet, 2008, 83(2): 170-179. |
| [16] |
KASAHARA K, MIYOSHI K, MURAKAMI S, et al. Visual- ization of astrocytic primary cilia in the mouse brain by immunofluorescent analysis using the cilia marker Arl13b[J]. Acta Med Okayama, 2014, 68(6): 317-322. |
| [17] |
GIGANTE E D, TAYLOR M R, IVANOVA A A, et al. ARL13B regulates sonic Hedgehog signaling from outside primary cilia[J]. Elife, 2020, 9: e50434. |
| [18] |
HIGGINBOTHAM H, EOM T Y, MARIANI L E, et al. ARL13b in primary cilia regulates the migration and placement of interneurons in the developing cerebral cortex[J]. Dev Cell, 2012, 23(5): 925-938. |
| [19] |
PALA R, ALOMARI N, NAULI S. Primary cilium-dependent signaling mechanisms[J]. Int J Mol Sci, 2017, 18(11): 2272. |
| [20] |
STEIDL M E, NIGRO E A, NIELSEN A K, et al. Primary cilia sense glutamine availability and respond via asparagine synthetase[J]. Nat Metab, 2023, 5(3): 385-397. |
| [21] |
SCHEID S, LEJARRE A, WOLLBORN J, et al. Argon preconditioning protects neuronal cells with a Toll-like receptor-mediated effect[J]. Neural Regen Res, 2023, 18(6): 1371-1377. |
| [22] |
HARDIE D G, ROSS F A, HAWLEY S A. AMPK: a nutrient and energy sensor that maintains energy homeostasis[J]. Nat Rev Mol Cell Biol, 2012, 13(4): 251-262. |
| [23] |
MA W F, DUAN X C, HAN L, et al. Vanillic acid alleviates palmitic acid-induced oxidative stress in human umbilical vein endothelial cells via adenosine monophosphate-activated protein kinase signaling pathway[J]. J Food Biochem, 2019, 43(7): e12893. |
| [24] |
WIDJAJA A A, VISWANATHAN S, WEI TING J G, et al. IL11 stimulates ERK/P90RSK to inhibit LKB1/AMPK and activate mTOR initiating a mesenchymal program in stromal, epithelial, and cancer cells[J]. iScience, 2022, 25(8): 104806. |
| [25] |
HAN D D, JIANG L L, GU X L, et al. SIRT3 deficiency is resistant to autophagy-dependent ferroptosis by inhibiting the AMPK/mTOR pathway and promoting GPX4 levels[J]. J Cell Physiol, 2020, 235(11): 8839-8851. |
| [26] |
LI Y J, CHEN Y Y. AMPK and autophagy[J]. Adv Exp Med Biol, 2019, 1206: 85-108. |
| [27] |
WANG X C, JIA J P. Magnolol improves Alzheimer's disease-like pathologies and cognitive decline by promoting autophagy through activation of the AMPK/mTOR/ULK1 pathway[J]. Biomed Pharmacother, 2023, 161: 114473. |
| [28] |
ZHAO H S, CHEN S R, GAO K, et al. Resveratrol protects against spinal cord injury by activating autophagy and inhibiting apoptosis mediated by the SIRT1/AMPK signaling pathway[J]. Neuroscience, 2017, 348: 241-251. |
| [29] |
JUNG C H, JUN C B, RO S H, et al. ULK-Atg13-FIP200 complexes mediate mTOR signaling to the autophagy machinery[J]. MBoC, 2009, 20(7): 1992-2003. |
| [30] |
YAN J Q, PORCH M W, COURT-VAZQUEZ B, et al. Activation of autophagy rescues synaptic and cognitive deficits in fragile X mice[J]. Proc Natl Acad Sci USA, 2018, 115(41): E9707-E9716. |




