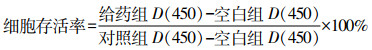肌少症是由衰老、营养不良、代谢紊乱等因素引起的骨骼肌质量下降和肌力减退的老年性疾病,导致跌倒、骨折甚至死亡的风险增加,同时会引起一系列并发症,严重影响老年人的身心健康和生活质量[1]。2型糖尿病(type 2 diabetes mellitus,T2DM)患者因葡萄糖利用障碍导致脂肪分解增加,继而引起高游离脂肪酸血症等脂代谢紊乱;研究发现T2DM合并高游离脂肪酸血症会加重肌肉功能障碍,从而使老年患者肌少症发生率升高[1-4]。
骨骼肌是糖脂代谢的主要器官,对于血糖的稳定至关重要;而骨骼肌对糖脂的利用依赖于线粒体功能的正常发挥。线粒体既是细胞的能量工厂,也是细胞内信号的传导中心;线粒体稳态破坏导致细胞合成代谢等过程的能量供应发生障碍,影响MyHC蛋白的合成,导致肌管发育不良;同时线粒体稳态的破坏导致活性氧的过量积累,引起一系列不良反应,促进了T2DM肌少症的发生[5-7]。自噬是细胞对受损细胞器进行选择性清除的主要机制,其中线粒体自噬通过调控线粒体融合和裂变,维持线粒体稳态,对于调节细胞的生长、氧化应激与凋亡至关重要[8]。高游离脂肪酸导致的骨骼肌自噬紊乱是线粒体损害的主要原因,在成人T2DM患者肌肉功能障碍的病理生理过程中发挥重要作用。因此,改善骨骼肌线粒体自噬紊乱、维持线粒体稳态是目前治疗T2DM肌少症的重要方法[9]。
研究发现,雌激素可通过其受体调节骨骼肌细胞生长和再生[10];同时雌激素可以对小鼠骨骼肌线粒体发挥保护效应[11]。雌马酚(equol,Eq)是大豆异黄酮(soy isoflavone,SI)通过肠道菌群作用产生的体内代谢产物,具有和雌激素相似的化学结构,且活性强于SI,可以调节糖脂代谢,改善炎症氧化应激等反应,同时能避免合成雌激素不良反应的发生[12-13]。研究表明,膳食中添加SI可以促进骨骼肌细胞的线粒体生物发生,提示Eq可能对线粒体功能具有一定的调节作用[14]。然而,目前国内外关于Eq对T2DM肌少症的干预效应尚不清楚。本研究利用棕榈酸(palmitic acid,PA)诱导L6细胞肌管萎缩模拟T2DM肌少症病变,观察Eq的作用效果,同时结合自噬抑制剂3-甲基腺嘌呤(3-methyladenine,3-MA)干预探究其可能的作用机制。
1 材料与方法 1.1 试剂与器材微量台式低温离心机、全波长多功能酶标仪购自赛默飞世尔科技有限公司,倒置荧光显微镜购自日本奥林巴斯公司,超灵敏凝胶成像系统购自美国GE公司,激光共聚焦显微镜购自德国ZEISS公司,高频电泳仪购自美国Bio-Rad公司,超声破碎仪购自昆山禾创超声仪器有限公司。s-雌马酚购自上海大赛璐药物手性技术有限公司,DMEM高糖培养基、青霉素-链霉素混合液、胎牛血清、胰蛋白酶-EDTA溶液购自武汉普赛诺生命科技有限公司,自制棕榈酸溶液[15],葡萄糖测试盒购自南京建成生物工程研究所,PAGE凝胶快速配成试剂盒购自西安米鼠生物科技有限公司,超敏ECL化学发光试剂盒、CCK-8试剂盒、RIPA裂解液、BCA蛋白定量试剂盒、线粒体红色荧光探针、MyHC一抗购自上海碧云天生物技术有限公司,p62抗体、线粒体融合蛋白2(mitochondrial fusion protein 2,MFN2)一抗购自英国Abcam公司,动力相关蛋白1(dynamin related protein1,DRP1)一抗购自美国CST公司,LC3B一抗购自上海艾比玛特生物医药有限公司,苏木精染色液、伊红染色液、兔GAPDH抗体、过氧化物酶偶联的二抗购自上海生工生物工程股份有限公司,3-MA购自武汉爱博泰克生物技术有限公司。
1.2 细胞培养传代培养:复苏L6细胞(陆军军医大学营养与食品安全研究中心提供),培养在10%FBS、100 kU/L双抗的DMEM培养基中,置于5%CO2、37 ℃的细胞培养箱中孵育。当细胞融合度达80%时,0.125%胰酶消化2 min,调整细胞数为5×104/mL,按1 ∶3传代。
诱导L6细胞向肌管细胞分化:待细胞贴壁达80%时,0.125%胰酶消化细胞,调整细胞数为1×104/孔,2 mL/孔,接种于6孔培养板。细胞贴壁24 h换含1%FBS、100 kU/L双抗的DMEM培养基诱导分化(3~5) d,每隔24 h换液,当细胞呈规则排列的梭形有肌管出现时,即得到成熟的骨骼肌细胞。
1.3 Eq、PA对L6细胞增殖能力的影响实验设空白组、对照组、不同浓度Eq或PA药物处理组,其中空白组为不含药物及细胞的培养基、对照组为含细胞的完全培养基。将生长至80%的L6细胞以5×104/mL接种于96孔板,100 μL/孔,设5个复孔,置于细胞培养箱。培养24 h后,每孔加入10 μL CCK-8试剂, 细胞培养箱中反应1 h, 置酶标仪中测定波长450 nm处光密度值[D(450)]。
1.4 细胞分组及干预根据1.3确定的Eq、PA干预浓度,将分化后的细胞分为对照组、模型组(PA)、干预组(PA+Eq)和自噬抑制剂组(PA+Eq+3-MA),在PA(0.250 mmol/L)、Eq(1.0 μmol/L)和3-MA (1 mmol/L)作用24 h后分别收集培养基及细胞进行检测。
1.5 葡萄糖消耗实验将分化后的L6细胞分别于6、12、24 h收集培养基,离心后取上清液加入到96孔板中,按葡萄糖测试盒操作说明检测各组培养液中葡萄糖含量,进一步计算葡萄糖消耗量。
1.6 HE染色将L6细胞接种于6孔板,待分化完成后按上述分组干预24 h后,用PBS漂洗2次;4%多聚甲醛固定10 min;0.3%曲拉通透膜10 min;PBS漂洗2次,苏木精染色30 min;PBS漂洗2次,盐酸乙醇溶液分色数秒后,使用PBS漂洗2次;伊红染液染色1 min,使用无水乙醇漂洗1次后在倒置显微镜下观察并采集图像。使用Image J软件对分化好的随机5个肌管直径进行测量,测量直径时避开细胞核。
1.7 透射电镜将分化好的L6细胞按上述分组培养24 h后收集细胞,1 000 r/min,离心5 min,弃去上层培养基,缓慢加入2.5%戊二醛放于4 ℃冰箱固定过夜。1%锇酸后固定后用梯度浓度的乙醇脱水、环氧树脂包埋、超薄切片、染色,继而透射电镜观察,并采集图片。
1.8 线粒体荧光探针标记线粒体将诱导分化后的L6细胞,使用0.125%胰酶消化离心后调整细胞数为1×104/mL,按1 mL/孔,接种于玻底培养皿,待细胞贴壁24 h后,将细胞分为对照组、模型组、干预组和抑制剂组,按上述干预方法培养24 h后,按照线粒体荧光探针试剂盒操作说明进行线粒体染色。染色完成后置于激光共聚焦显微镜下观察并拍照。
1.9 Western blot检测将干预24 h的各组细胞收集于1.5 mL离心管中,裂解细胞提取全蛋白;使用BCA蛋白定量试剂盒进行蛋白定量,加入蛋白上样缓冲液,95 ℃煮样5 min。使用Western blot检测各组MyHC、p62、MFN2、DRP1、LC3和GAPDH的表达情况。显影后用Image J软件对条带进行分析。
1.10 统计学分析采用SPSS 20.0统计软件进行分析,使用GraphPad Prism 9软件作图,计量资料以x±s表示,组间比较采用单因素方差分析,两两比较采用t检验。P<0.05被认为差异具有统计学意义。
2 结果 2.1 雌马酚、棕榈酸对L6细胞活力的影响当雌马酚浓度为100.0 μmol/L时雌马酚明显影响L6细胞增殖能力,细胞存活率小于85%;当浓度为0.1~10.0 μmol/L时,细胞存活率接近100%,见图 1A;后续实验雌马酚浓度选择1.0 μmol/L。PA浓度为0.125 mmol/L时,细胞活力与对照组差异无统计学意义(P>0.05),当PA浓度>0.250 mmol/L时,细胞活力明显下降(P<0.05),见图 1B,后续实验PA浓度选择0.250 mmol/L。
|
|
a:P<0.05与对照组比较 A:Eq对L6细胞活力影响;B:PA对L6细胞活力影响 图 1 Eq、PA对L6细胞活力的影响 |
2.2 雌马酚对L6细胞葡萄糖摄取能力的影响
干预6 h,与模型组比较,对照组、干预组和抑制剂组葡萄糖消耗量无明显差异(P>0.05), 与干预组相比,抑制剂组葡萄糖消耗量明显降低(P<0.05);干预12、24 h,与模型组比较,对照组和干预组葡萄糖消耗量明显增加(P<0.05),Eq对细胞葡萄糖消耗量的作用可被3-MA有效抑制,见表 1。
| 组别 | 6 h | 12 h | 24 h |
| 对照组 | 2.05±0.49 | 4.90±0.69a | 7.72±0.32a |
| 模型组 | 1.52±0.29 | 3.33±0.67 | 5.07±0.44 |
| 干预组 | 1.93±0.41 | 4.81±0.51a | 7.57±0.67a |
| 抑制剂组 | 1.22±0.44b | 2.94±1.23b | 5.70±0.72b |
| a:P<0.05,与模型组比较;b:P<0.05,与干预组比较 | |||
2.3 Eq对L6细胞肌管发育的影响
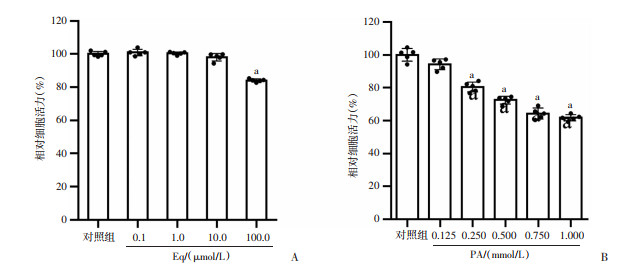
与模型组比较,对照组、干预组肌管直径增加(P<0.05), MyHC蛋白表达上升(P<0.05),而自噬抑制剂组肌管直径、MyHC蛋白表达与模型组差异均无统计学意义(P>0.05);与干预组比较,自噬抑制剂组肌管直径明显减小(P<0.05), MyHC蛋白表达明显降低(P<0.05), 见图 2。
|
|
1:对照组;2:模型组;3:干预组;4:抑制剂组;a:P<0.05,与模型组比较;b: P<0.05,与干预组比较 A~D:分别为HE染色观察对照组、模型组、干预组和抑制剂组L6细胞肌管发育;E:各组细胞肌管直径对比;F:Western blot检测结果;G: MyHC半定量分析 图 2 各组细胞HE染色、细胞肌管直径及MyHC蛋白表达水平比较 |
2.4 雌马酚干预对L6细胞自噬的影响
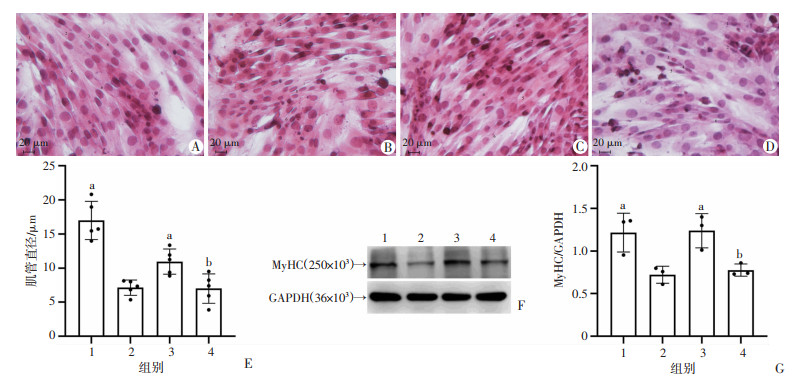
与对照组比较,模型组自噬小体数量较少,线粒体肿胀明显,线粒体形态偏圆,线粒体长短径比值明显降低(P<0.05),与模型组比较,Eq干预后细胞自噬小体增多,线粒体肿胀减轻、呈长杆状、结构较完整,线粒体长短径比值明显升高(P<0.05);Eq对细胞线粒体自噬的作用可被3-MA有效抑制,见图 3。
|
| A~D:分别为透射电镜观察对照组、模型组、干预组和抑制剂组细胞线粒体形态学变化;E: 各组细胞线粒体长短对比 1:对照组;2:模型组;3:干预组;4:抑制剂组; a:P<0.05,与模型组比较;b: P<0.05,与干预组比较 图 3 各组细胞线粒体透射电镜结果及线粒体长短径比值变化 |
2.5 Eq对L6细胞线粒体动力学的影响
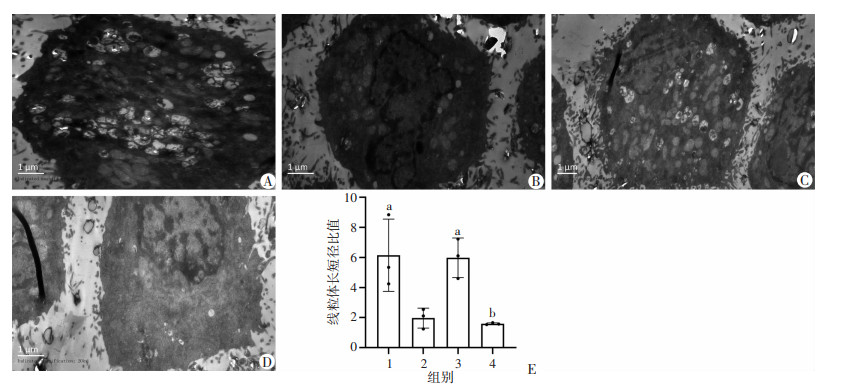
干预24 h后,对照组细胞线粒体多为长杆状,线粒体相互融合长条状,而模型组细胞线粒体呈颗粒状,碎片化;经Eq干预后细胞杆状线粒体数量增多且相互融合,而颗粒状线粒体数量减少;Eq对细胞线粒体动力学的效应可被3-MA有效抑制,见图 4。
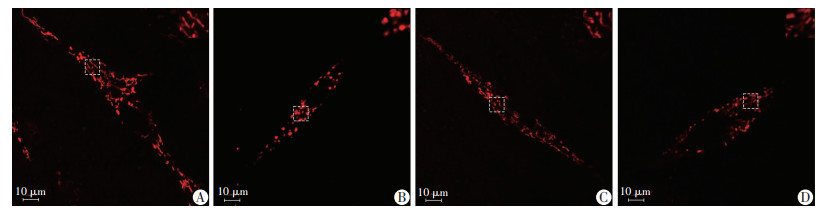
|
| A~D:分别为对照组、模型组、干预组和抑制剂组;右上角图像为方框区域放大4倍图像 图 4 各组细胞线粒体荧光探针染色结果 |
2.6 Eq对L6细胞MFN2、DRP1、LC3-Ⅰ、LC3-Ⅱ和p62蛋白表达的影响
与对照组比较,模型组细胞MFN2蛋白表达水平降低(P<0.05),而p62、DRP1蛋白表达水平与LC3-Ⅰ/LC3-Ⅱ比值升高(P<0.05);与模型组比较,Eq干预后细胞MFN2蛋白表达水平升高(P<0.05),而p62、DRP1蛋白表达水平与LC3-Ⅰ/LC3-Ⅱ比值降低(P<0.05);Eq对细胞目的蛋白表达的调控作用可被3-MA有效抑制,见图 5。
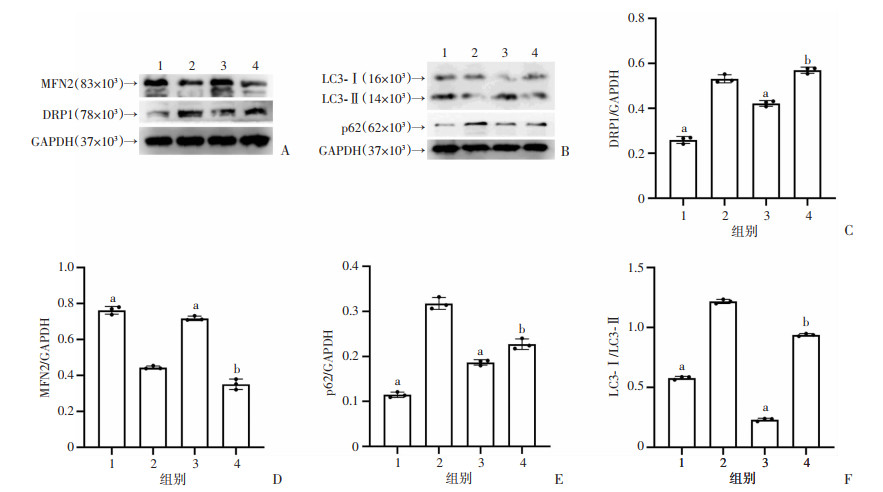
|
|
1:对照组;2:模型组;3:干预组;4:抑制剂组;a: P<0.05,与模型组比较;b:P<0.05,与干预组比较 A、B:Western blot检测分析;C~E:分别为DRP1、MFN2、p62半定量分析:F:LC3-Ⅰ/LC3-Ⅱ比值 图 5 各组细胞DRP1、MFN2、LC3-Ⅰ、LC3-Ⅱ和p62蛋白表达水平比较 |
3 讨论
人口老龄化进程加速以及T2DM发病率的增加使老年人T2DM肌少症患病率呈逐年上升趋势,这种疾病的日益流行将会给广大老年患者带来巨大的医疗负担和较差的生活质量[1-3]。针对T2DM肌少症的防治研究对广大老年人具有重要现实意义。本研究通过0.25 mmol/L PA诱导L6细胞肌管萎缩,观察Eq的干预效应并进一步探讨其作用机制,为T2DM肌少症探索更好的治疗手段提供实验依据。
T2DM肌少症的发病机制目前尚未阐明,部分研究指出高血糖是导致2型糖尿病肌少症的主要原因,同时也有研究显示高游离脂肪酸对2型糖尿病肌少症具有重要影响[16-17]。本研究发现,与单纯的高糖条件(对照组)相比,高糖高脂条件下(模型组)L6细胞肌管直径明显减小、肌管萎缩明显,与LEE等[18]的研究结果一致;通过检测细胞葡萄糖消耗量和MyHC蛋白表达发现,模型组细胞葡萄糖利用能力较对照组下降,同时MyHC蛋白表达降低,其可能的原因是高糖高脂环境下L6细胞葡萄糖利用能力下降会限制ATP的生成,从而使细胞的合成代谢过程受到影响并引起MyHC合成降低,最终导致肌管萎缩,而Eq干预可有效逆转这一过程。
线粒体是细胞的能量工厂,线粒体损伤将导致能量的合成效率下降,从而对细胞产生不良影响,在细胞代谢紊乱时,线粒体可通过动力学上的变化来适应能量的改变。MFN2和DRP1是反映线粒体动力学的关键指标,二者水平的动态改变使线粒体发生融合和裂变的变化,是维持线粒体稳态的关键环节[19]。正常情况下,线粒体相互融合呈长杆状,有利于提高能量的产生效率;而线粒体裂变在一定程度内增加有利于受损线粒体被及时清除,如果受损的线粒体不能及时清除,裂变的线粒体会释放过量活性氧,最终会导致细胞凋亡。本研究发现,与对照组相比,模型组细胞线粒体融合降低、裂变增加,同时MFN2蛋白表达水平降低,而DRP1蛋白表达水平升高;经Eq干预后细胞线粒体融合增加、裂变减少,同时MFN2蛋白表达水平升高,而DRP1蛋白表达水平降低。
目前细胞已进化出线粒体质量控制的多种机制用于维持线粒体稳态,自噬是其中最关键的途径[20]。自噬是细胞选择性清除线粒体等受损细胞器的机制,通过及时清除受损的线粒体可避免受损线粒体进一步释放活性氧造成细胞的再次损伤,有利于维持线粒体稳态[21]。线粒体自噬受多种信号通路调节,其中由PINK1/帕金森蛋白介导的线粒体自噬是其中的经典途径。PINK1是一种E3泛素连接酶,在线粒体受损早期,线粒体膜电位下降,PINK1在受损线粒体表面积累,招募帕金森蛋白和p62,促进LC3Ⅰ向LC3Ⅱ转化增加,促进自噬体形成,使功能失调的线粒体降解,避免了细胞的凋亡[22-23]。本研究发现,与对照组相比,模型组细胞自噬下降,同时p62蛋白表达水平和LC3-Ⅰ/LC3-Ⅱ比值升高;经Eq干预后细胞自噬增强,同时p62蛋白表达水平和LC3-Ⅰ/LC3-Ⅱ比值降低。
为明确Eq对L6细胞肌管萎缩的干预效应是否与自噬有关,本研究利用自噬抑制剂3-MA干预后发现,与Eq干预组相比,抑制剂组细胞自噬下降,线粒体融合降低、裂变增加,MFN2蛋白表达水平降低,而p62、DRP1蛋白表达水平和LC3-Ⅰ/LC3-Ⅱ比值升高;同时细胞葡萄糖利用能力下降,MyHC蛋白表达降低,肌管直径减小、肌管萎缩明显。以上结果说明Eq通过促进线粒体自噬调节了线粒体动力学变化,从而改善线粒体功能,并进一步改善PA诱导的L6细胞萎缩。
雌激素受体在肌肉能量代谢、收缩功能、骨骼肌生长和线粒体生物发生上起重要作用,骨骼肌上雌激素受体表达丰富的ERα和ERβ受体,通过激活骨骼肌ERβ可有效调节线粒体功能进而改善糖脂代谢和骨骼肌功能[24-27]。Eq主要通过与雌激素受体结合发挥生物学效应[28],因此Eq调控自噬、改善肌管萎缩的效应可能与雌激素受体有关,需要在以后的研究中进一步证实。
综上所述,Eq可有效改善PA诱导的L6细胞肌管萎缩,其部分机制可能与Eq通过自噬减轻线粒体裂变、维持线粒体稳态、增加细胞葡萄糖利用能力有关,但其具体的作用机制仍需要进一步深入研究。同时,本研究结论是基于体外实验结果,其在动物包括人体中的具体效应仍有待证实。Eq作为一种副作用小的天然化合物,在未来有可能成为治疗T2DM肌少症的理想植物化合物。
| [1] |
FU J L, SUN L N, MU Z J, et al. Free fatty acids are associated with muscle dysfunction in Chinese adults with type 2 diabetes[J]. Endocrine, 2022, 77(1): 41-47. |
| [2] |
IZZO A, MASSIMINO E, RICCARDI G, et al. A narrative review on sarcopenia in type 2 diabetes mellitus: prevalence and associated factors[J]. Nutrients, 2021, 13(1): 183. |
| [3] |
ANAGNOSTIS P, GKEKAS N K, ACHILLA C, et al. Type 2 diabetes mellitus is associated with increased risk of sarcopenia: a systematic review and meta-analysis[J]. Calcif Tissue Int, 2020, 107(5): 453-463. |
| [4] |
AL SAEDI A, DEBRUIN D A, HAYES A, et al. Lipid metabolism in sarcopenia[J]. Bone, 2022, 164: 116539. |
| [5] |
BELLANTI F, BUGLIO A L, VENDEMIALE G. Mitochondrial impairment in sarcopenia[J]. Biology, 2021, 10(1): 31. |
| [6] |
CRUZ-JENTOFT A J, SAYER A A. Sarcopenia[J]. Lancet, 2019, 393(10191): 2636-2646. |
| [7] |
HESSELINK M K C, SCHRAUWEN-HINDERLING V, SCHRAUWEN P. Skeletal muscle mitochondria as a target to prevent or treat type 2 diabetes mellitus[J]. Nat Rev Endocrinol, 2016, 12(11): 633-645. |
| [8] |
NG M Y W, WAI T, SIMONSEN A. Quality control of the mitochondrion[J]. Dev Cell, 2021, 56(7): 881-905. |
| [9] |
BERGMAN R N, ADER M. Free fatty acids and pathogenesis of type 2 diabetes mellitus[J]. Trends Endocrinol Metab, 2000, 11(9): 351-356. |
| [10] |
TORRES M J, RYAN T E, LIN C T, et al. Impact of 17β-estradiol on complex Ⅰ kinetics and H2O2 production in liver and skeletal muscle mitochondria[J]. J Biol Chem, 2018, 293(43): 16889-16898. |
| [11] |
SEKO D, FUJITA R, KITAJIMA Y, et al. Estrogen receptor β controls muscle growth and regeneration in young female mice[J]. Stem Cell Rep, 2020, 15(3): 577-586. |
| [12] |
JACKSON R L, GREIWE J S, SCHWEN R J. Emerging evidence of the health benefits of S-equol, an estrogen receptor β agonist[J]. Nutr Rev, 2011, 69(8): 432-448. |
| [13] |
SETCHELL K D R, CLERICI C, LEPHART E D, et al. S-equol, a potent ligand for estrogen receptor beta, is the exclusive enantiomeric form of the soy isoflavone metabolite produced by human intestinal bacterial flora[J]. Am J Clin Nutr, 2005, 81(5): 1072-1079. |
| [14] |
YOSHINO M, NAKA A, SAKAMOTO Y, et al. Dietary isoflavone daidzein promotes Tfam expression that increases mitochondrial biogenesis in C2C12 muscle cells[J]. J Nutr Biochem, 2015, 26(11): 1193-1199. |
| [15] |
杨宁宁, 王佑民, 陈冬, 等. 棕榈酸致大鼠L6肌细胞胰岛素抵抗与JNK1活化的关系[J]. 安徽医科大学学报, 2012, 47(3): 241-244. YANG N N, WANG Y M, CHEN D, et al. Association of JNK1 activation with palmitic acid-induced insulin resistance in L6 rat muscle cells[J]. Acta Univ Med Anhui, 2012, 47(3): 241-244. |
| [16] |
IZZO A, MASSIMINO E, RICCARDI G, et al. A narrative review on sarcopenia in type 2 diabetes mellitus: prevalence and associated factors[J]. Nutrients, 2021, 13(1): 183. |
| [17] |
DE FREITAS M M, DE OLIVEIRA V L P, GRASSI T, et al. Difference in sarcopenia prevalence and associated factors according to 2010 and 2018 European consensus (EWGSOP) in elderly patients with type 2 diabetes mellitus[J]. Exp Gerontol, 2020, 132: 110835. |
| [18] |
LEE H, LIM J Y, CHOI S J. Oleate prevents palmitate-induced atrophy via modulation of mitochondrial ROS production in skeletal myotubes[J]. Oxidative Med Cell Longev, 2017, 2017: 1-11. |
| [19] |
FEALY C E, GREVENDONK L, HOEKS J, et al. Skeletal muscle mitochondrial network dynamics in metabolic disorders and aging[J]. Trends Mol Med, 2021, 27(11): 1033-1044. |
| [20] |
YU L, CHEN Y, TOOZE S A. Autophagy pathway: cellular and molecular mechanisms[J]. Autophagy, 2018, 14(2): 207-215. |
| [21] |
TANIDA I. Autophagosome formation and molecular mechanism of autophagy[J]. Antioxid Redox Signal, 2011, 14(11): 2201-2214. |
| [22] |
TEREŠAK P, LAPAO A N, SUBIC N, et al. Regulation of PRKN-independent mitophagy[J]. Autophagy, 2022, 18(1): 24-39. |
| [23] |
PICKLES S, VIGIÉ P, YOULE R J. Mitophagy and quality control mechanisms in mitochondrial maintenance[J]. Curr Biol, 2018, 28(4): R170-R185. |
| [24] |
KLINGE C M. Estrogenic control of mitochondrial function[J]. Redox Biol, 2020, 31: 101435. |
| [25] |
IKEDA K, HORIE-INOUE K, INOUE S. Functions of estrogen and estrogen receptor signaling on skeletal muscle[J]. J Steroid Biochem Mol Biol, 2019, 191: 105375. |
| [26] |
KLINGE C M. Estrogenic control of mitochondrial function and biogenesis[J]. J Cell Biochem, 2008, 105(6): 1342-1351. |
| [27] |
RIBAS V, DREW B G, ZHOU Z Q, et al. Skeletal muscle action of estrogen receptor α is critical for the maintenance of mitochondrial function and metabolic homeostasis in females[J]. Sci Transl Med, 2016, 8(334): 334ra54. |
| [28] |
MAYO B, VÁZQUEZ L, FLÓREZ A B. Equol: a bacterial metabolite from the daidzein isoflavone and its presumed beneficial health effects[J]. Nutrients, 2019, 11(9): 2231. |