2. 400042 重庆,陆军特色医学中心战伤休克与输血研究室,创伤与化学中毒全国重点实验室
2. State Key Laboratory of Trauma and Chemical Poisoning, Department of War Wound Shock and Transfusion, Army Medical Center of PLA, Chongqing, 400042, China
脓毒症或脓毒性休克是临床常见危重症,病死率高达30%~70%[1]。血管低反应性是严重脓毒症主要的病理生理特征,指动脉血管对去甲肾上腺素等血管活性药物[2]的反应性降低或者不反应,是导致顽固性低血压,组织灌流不足,进一步发展为多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS),甚至死亡的重要原因。改善血管反应性对提高严重脓毒症患者的救治成功率、降低病死率至关重要[3]。前期针对血管低反应性发生机制进行的试验发现RhoA/ROCK[4]、PKCα[5]、ERK[6]等通道可调控钙敏感性,但临床上缺少改善脓毒症血管钙敏感性的治疗措施。
丙泊酚(2,6-二异丙基苯酚)是一种静脉注射γ-氨基丁酸激动剂类镇静药,具有易于滴定、起效快、消除迅速、药代动力学良好的优点,临床上广泛应用于重症监护患者的持续镇静[7]。除了其本身的镇静作用外,已有文献报道丙泊酚还可以纠正脓毒性休克大鼠的代谢性酸中毒以及减轻细胞因子反应,提高脓毒症患者的存活率[8]。而丙泊酚对脓毒性休克血管低反应性是否具有改善作用,尚不清楚。
据此,本研究采用盲肠结扎穿孔术(cecal ligation and puncture,CLP)复制脓毒症大鼠模型,探讨丙泊酚对脓毒症血管低反应性的改善作用,同时观察RhoA/Rho激酶(RhoA/ROCK)、蛋白激酶Cα(PKCα)、三磷酸肌醇(IP3)以及细胞缝隙连接在其中的作用,为丙泊酚临床应用于改善脓毒症患者血管低反应性奠定基础。
1 材料与方法 1.1 实验仪器与设备离体器官灌流系统、八通道生理记录仪、微血管张力测定仪均购自澳大利亚AD Instrument公司。
1.2 药物与试剂丙泊酚购自中国力邦制药公司,去甲肾上腺素(NE)购自中国远大医药公司,乙酰胆碱(Ach)购自中国生工生物公司:分别由复方氯化钠溶液稀释为1 mg/mL、10-2 mol/L、10-3 mol/L,分装后,丙泊酚保存于4 ℃,NE和Ach保存于-20 ℃。ROCK抑制剂Y-27632购自美国MedChemE xpress公司,PKCα抑制剂GO6976购自美国Sigma-Aldrich公司,IP3抑制剂2-APB购自APExBIO公司,细胞缝隙连接抑制剂甲氯灭酸钠(Movens)购自美国InvivoChem公司:由双蒸水稀释为10-4、10-4、10-3、10-2 mol/L,分装后保存于-20 ℃。K-H液配制(mmol/L):NaC12 7、KCI 4.7、NaHCO3 25、KH2PO4 1.03、MgSO4 0.45、葡萄糖11.1、CaCl2 2.5,双蒸水定容,pH=7.4;高钾液配制(mmoL/L):KCl 120、NaHCO3 25、KH2PO4 1.03、MgSO4 0.45、葡萄糖11.1、CaCl2 2.5,双蒸水定容,pH=7.4;无钙K-H液配制(mmoL/L):NaC12 7、KCI 120、NaHCO3 25、KH2PO4 1.03、MgSO4 0.45、葡萄糖11.1,双蒸水定容,pH=7.4;无钙高钾液配制(mmoL/L):KCl 120、NaHCO3 25、KH2PO4 1.03、MgSO4 0.45、葡萄糖11.1,双蒸水定容,pH=7.4。
1.3 实验动物、分组方案与脓毒症模型制备SPF级SD大鼠(陆军特色医学中心实验动物中心)96只,雌雄不拘,体质量200~220 g,于实验前12 h禁食,可自由饮水。其中,24只大鼠按随机数字表法分为假手术组、脓毒症组和丙泊酚治疗组,每组8只,用于探索丙泊酚对脓毒症血管低反应性的作用。其次,40只大鼠采用随机数字表法分为假手术组、脓毒症组、丙泊酚治疗组、丙泊酚+Y-27632组以及丙泊酚+GO6976组(n=8),取肠系膜上动脉用于研究丙泊酚对脓毒症大鼠血管钙敏感性的作用及其与RhoA/ROCK和PKCα的关系。此外,32只大鼠根据随机数字表法分为丙泊酚+Y-27632组、丙泊酚+GO6976组、丙泊酚+2-APB组和丙泊酚+Movens组(n=8),取肠系膜上动脉用于探究丙泊酚改善脓毒症大鼠血管低反应性与RhoA/ROCK、PKCα、IP3以及细胞缝隙连接的关系。
脓毒症组取SD大鼠称体质量,按45 mg/kg戊巴比妥钠腹腔注射麻醉后,腹部消毒,开腹后暴露盲肠,使粪便在盲肠末端压缩充盈,在距末端0.6 cm处用无菌4号细线结扎,采用三角锥贯穿已结扎的盲肠段的中央,随后将盲肠按照原来的位置送回腹腔,逐层缝合,放回笼中,自由饮水15 h后用于实验。丙泊酚组大鼠按照上述方法建立脓毒症模型后,腹腔注射10 mg/kg丙泊酚,12 h后再次腹腔注射10 mg/kg丙泊酚,3 h后用于实验。假手术组大鼠不进行盲肠结扎穿孔,其余操作同1.3一致。
各实验组大鼠麻醉固定后,做断颈处理,取胸主动脉(thoracic artery,TA)、肺动脉(lung artery,LA)、肠系膜上动脉主干(superior mesenteric artery,SMA)、股动脉(femoral artery,FA)、肾动脉(renal artery,RA)以及小动脉(肠系膜上动脉三级分支,small artery,SA),清除周围结缔组织,制成2~3 mm长血管环后用于血管收缩反应性和钙敏感性测定。
1.4 离体血管环反应性测定将所取动脉血管环挂于注有K-H液的离体器官灌流系统的37 ℃恒温浴槽中,持续充入95% O2和5% CO2混合气体,给予预张力0.5 g,每0.5 h更换1次K-H液,平衡2 h后加入高钾液诱导血管预收缩,待血管收缩达到平台期后更换为K-H液,再平衡1 h,观察血管环对NE的收缩反应,血管环张力通过张力传感器连接至八通道生理记录仪记录。
血管环对NE的反应性用浓度累计(1×10-9、1×10-8、1×10-7、1×10-6、1×10-5、1×10-4 mol/L)法测定,记录不同NE浓度下各血管环产生的最大收缩力。读取加高钾液前的基础张力值为F1,高钾液刺激后血管环收缩达到平台期的张力值为F2,加入NE前的基础张力值为F1’,不同NE浓度刺激后血管环收缩达到平台期的张力值为F2’,以(F2’-F1’)/(F2-F1)×100%为量化标准,作量-效曲线,采用Emax(血管收缩反应曲线最高点,即最大收缩反应性)以及量-效曲线评价血管对NE的收缩反应性。
根据血管内径的不同,本研究采用微血管张力记录仪测定肾动脉、股动脉和小动脉(肠系膜上动脉三级分支)的血管张力。分离肠系膜上动脉的三级分支动脉需将腹腔内肠道及其结缔组织一并取下后浸泡于K-H液中,在显微镜下采用眼科镊和眼科剪轻柔剥除三级分支血管周围结缔组织,剪取2~3 mm血管段。将所取肾动脉、股动脉以及小动脉血管环挂于注有K-H液的37 ℃恒温离体器官灌流槽中,持续充入95% O2和5% CO2混合气体,根据Power Lab软件的拟合曲线调节每个血管环最适宜的预张力,每15 min更换1次K-H液,平衡1 h后加入高钾液诱导血管预收缩,待血管收缩达到平台期后更换为K-H液,再平衡0.5 h,观察血管环对NE的收缩反应,血管环张力通过张力传感器连接至微血管张力测定仪记录。不同部位血管收缩反应性的变化采用百分比反映,脓毒症后的变化程度=(正常组Emax-脓毒症组Emax)/正常组Emax,丙泊酚处理后的变化程度=(丙泊酚组Emax-脓毒症组Emax)/(正常组Emax-脓毒症组Emax)。
丙泊酚+Y-27632组、丙泊酚+GO6976组、丙泊酚+2-APB组和丙泊酚+Movens组采用丙泊酚组大鼠SMA观察非钙依赖通路抑制剂、ROCK抑制剂Y-27632以及PKCα抑制剂GO6976、钙依赖通路抑制剂、IP3抑制剂2-APB和细胞缝隙连接抑制剂Movens对丙泊酚改善严重脓毒症血管收缩反应性的作用,加入高钾液诱导血管预收缩,换用K-H液,直至收缩曲线达平衡后,分别采用终浓度为10-6 mol/L的Y-27632、10-6 mol/L的GO6976、10-5 mol/L的2-APB以及10-4mol/L的Movens与血管环共孵育20 min,其余操作同1.4一致。加入抑制剂后,血管环收缩反应性的变化采用百分比反映,变化程度=(丙泊酚组Emax-丙泊酚+抑制剂组Emax)/(丙泊酚组Emax-脓毒症组Emax)。
1.5 血管环钙敏感性测定将所取SMA血管环挂于注有无钙K-H液的离体器官灌流槽的25 ℃恒温浴槽中,持续充入95% O2和5% CO2混合气体,给予预张力0.5 g,每20 min更换1次K-HS,平衡1 h,待张力曲线平稳后,换用无钙高钾液孵育1 h,15 min换液1次,待张力曲线平稳后,观察血管环对Ca2+的收缩反应,血管环张力通过张力传感器连接至八通道生理记录仪记录。
血管环的钙敏感性用浓度累计法测定,使所用的Ca2+终浓度分别为3×10-5、1×10-4、3×10-4、1×10-3、2×10-3、6×10-3、1×10-2、3×10-2mol/L,记录不同Ca2+浓度下血管环产生的最大收缩力,以张力/血管环质量(g/mg) 为量化标准,作量-效曲线,采用Emax以及量-效曲线评价血管的钙敏感性。钙敏感性的变化采用百分比反映,脓毒症后的变化程度=(正常组Emax-脓毒症组Emax)/正常组Emax,丙泊酚处理后的变化程度=(丙泊酚组Emax-脓毒症组Emax)/(正常组Emax-脓毒症组Emax)。
采用丙泊酚+Y-27632组和丙泊酚+GO6976组观察Y-27632以及GO6976对丙泊酚改善严重脓毒症血管钙敏感性的影响,需分离取下丙泊酚治疗组大鼠SMA,换用无钙高钾液,直至收缩曲线达平衡后,分别采用终浓度为10-6 mol/L的Y-27632和10-6 mol/L的GO6976与血管环共孵育20 min,其余操作同1.5一致,观察血管环对Ca2+的收缩反应性。加入抑制剂后,血管环收缩反应性的变化采用百分比反映,变化程度= (丙泊酚组Emax-丙泊酚+抑制剂组Emax)/(丙泊酚组Emax-脓毒症组Emax)。
1.6 统计学分析采用SPSS 11.0统计软件进行分析,数据均以x±s表示,各组间均数行单因素方差分析,加丙泊酚和各抑制剂前后均数行两样本t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 丙泊酚可显著改善脓毒症大鼠血管反应性为初步观察丙泊酚对脓毒症血管低反应性的改善作用,实验分别取胸主动脉、肺动脉、肠系膜上动脉、股动脉、肾动脉以及小动脉进行研究。结果发现,与假手术组相比,脓毒症组大鼠所有血管的反应性均显著降低,表现为对去甲肾上腺素的量-效曲线均右移,Emax显著降低(图 1)。不同部位血管的降低程度不同,其中肠系膜上动脉降低最为显著,幅度达51.42%(P < 0.05),肾动脉降低幅度最小,仅29.52%(P < 0.05),胸主动脉、肺动脉、股动脉以及小动脉的降低程度均在30%~40%(P < 0.05)。给予丙泊酚可明显提高脓毒症大鼠血管对NE的收缩反应性,表现为各部位血管的量-效曲线均左移,Emax显著增加(图 1),但不同部位血管的恢复程度不同,其中股动脉恢复程度最高,接近90%(P < 0.05),胸主动脉和肠系膜上动脉三级分支恢复80%以上(P < 0.05),肺动脉恢复70%以上(P < 0.05),肠系膜上动脉和肾动脉恢复60%以上(P < 0.05)。
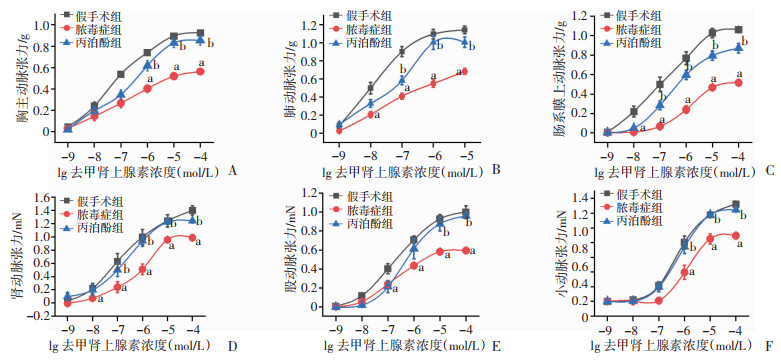
|
|
a:P < 0.01,与假手术组比较;b:P < 0.01,与脓毒症组比较 A~F:丙泊酚对脓毒症大鼠胸主动脉、肺动脉、肠系膜上动脉、肾动脉、股动脉以及肠系膜三级分支动脉收缩反应性的影响 图 1 丙泊酚对脓毒症大鼠血管收缩反应性的作用(n=8,x±s) |
2.2 丙泊酚对脓毒症血管钙敏感性的改善作用及其与RhoA/ROCK、PKCα的关系
由于脓毒症大鼠SMA对NE的血管反应性降低幅度最大(图 1),故本研究采用SMA观察丙泊酚对严重脓毒症血管钙敏感性的影响。实验结果发现,与假手术组相比,脓毒症组大鼠SMA对钙的敏感性呈降低趋势,表现为量-效曲线右移,Emax降低40.84%(P < 0.05)。丙泊酚处理后,SMA的钙敏感性较脓毒症组显著增加,升高幅度达60.95%(P < 0.05,图 2)。

|
|
a:P < 0.01,与假手术组比较;b:P < 0.01,与脓毒症组比较;c: P < 0.01,与丙泊酚组比较 A、C:Y-27632和GO6976对丙泊酚增加脓毒症大鼠血管钙敏感性的影响;B、D:Y-27632和GO6976对丙泊酚增加脓毒症大鼠血管最大钙敏感性(Emax)的影响 图 2 Y-27632和GO6976对丙泊酚增加脓毒症大鼠血管钙敏感性的作用(n=8,x±s) |
本研究进一步利用ROCK抑制剂Y-27632和PKCα抑制剂GO6976观察对丙泊酚治疗改善严重脓毒症大鼠血管钙敏感性的影响。结果表明,对比于丙泊酚组,丙泊酚+Y-27632组的量-效曲线右移(图 2A),钙敏感性显著降低(P < 0.05,图 2B),降低幅度为146.95%;丙泊酚+GO6976组的钙敏感性也呈降低趋势(图 2C),降低幅度为88.63%,与丙泊酚治疗组间差异有统计学意义(P < 0.05,图 2D)。结果提示,丙泊酚治疗改善严重脓毒症的血管低反应性可能与改善血管钙敏感性有关。
2.3 PKCα、RhoA/ROCK、IP3以及细胞缝隙连接在丙泊酚改善脓毒症血管低反应性中的作用本研究利用GO6976和Y-27632观察非钙依赖信号通路PKCα或RhoA/ROCK是否与丙泊酚改善脓毒症血管低反应性有关。采用GO6976和Y-27632分别与离体SMA共孵育的研究结果表明,与丙泊酚组相比,丙泊酚+Y-27632组收缩反应曲线明显右移,Y-27632可显著抑制丙泊酚对脓毒症大鼠血管低反应性的改善作用,Emax减低40.79%(P < 0.05);而丙泊酚+GO6976组虽收缩反应曲线左移,但Emax未表现出统计学差异(图 3A~D)。结果提示,丙泊酚改善脓毒症血管低反应性可能与通过RhoA/ROCK通路改善钙敏感性有关。

|
|
a:P < 0.01,与假手术组比较;b:P < 0.01,与脓毒症组比较;c: P < 0.01,与丙泊酚组比较 A、C、E、G:GO6976、Y-27632、2-APB及Movens对丙泊酚改善脓毒症大鼠血管收缩反应性的影响;B、D、F、H:GO6976、Y-27632、2-APB、Movens对丙泊酚改善脓毒症大鼠最大血管收缩反应性(Emax)的影响 图 3 GO6976、Y-27632、2-APB及Movens对丙泊酚改善脓毒症大鼠血管收缩反应性的作用(n=8,x±s) |
采用IP3抑制剂2-APB观察了IP3是否也参与丙泊酚改善脓毒症血管低反应性,结果发现,相较于丙泊酚组,丙泊酚+2-APB组收缩反应曲线未见明显位移(图 3E),血管最大收缩反应性(Emax)未见显著改变(图 3F),2-APB对丙泊酚改善脓毒症大鼠血管低反应性无显著改变作用。结果提示,丙泊酚改善脓毒症血管低反应性的作用可能与IP3无关。
采用细胞缝隙连接抑制剂Movens阻断血管细胞缝隙连接传递,验证丙泊酚对严重脓毒症血管低反应性的改善作用是否与细胞的缝隙连接有关。结果表明,与丙泊酚组相比,细胞缝隙连接抑制剂Movens作用于离体血管后,血管对低浓度(10-9~10-6 mol/L)NE的反应性无显著变化,而对较高浓度(10-5~10-4 mol/L) NE的反应性显著减低(图 3G),Emax降低幅度达169.90%(P < 0.05,图 3H)。表明在高浓度NE时,细胞间的缝隙连接可能参与丙泊酚对脓毒症血管收缩反应性的改善作用。
3 讨论 3.1 脓毒症大鼠血管低反应性在不同组织器官的差异及其相关因素分析严重脓毒症或脓毒性休克是临床常见危重症。脓毒性休克存在血管低反应性,即血管对升压药物的反应降低或无反应,血管低反应性的存在是导致休克后期血压难以回升以及患者死亡的主要原因之一[9]。本研究发现,严重脓毒症大鼠各组织器官血管的反应性降低程度不同,其中肠系膜上动脉降低幅度最大,其次为股动脉,而肾动脉降低幅度最小。血管α1肾上腺素受体(α1-AR)表达水平的差异与血管对NE反应性的组织依赖性差异密切相关,α1-AR分布越密集,对NE的反应性越敏感[10]。另外,动脉血管内皮和中层平滑肌分布比例不同也与血管功能的差异有关,中层平滑肌纤维越多,对血压的调节越敏感。我们推测,肠系膜上动脉的α1-AR分布较少,平滑肌纤维较丰富,因此脓毒症时,血管对NE的反应性降低在肠系膜上动脉最为显著,可能与机体的重要器官功能保护而导致的血流重分布有关,而具体机制如何尚需进一步研究。
3.2 丙泊酚在改善脓毒症血管低反应性中的作用丙泊酚在临床应用广泛,由于其突出的药代动力学优点,是重症监护病房最常用的镇静药物。近期已有文献报道丙泊酚可显著提高脓毒症的生存率[11],改善脓毒症大鼠内皮功能障碍并减少血管超氧化物产生,同时对大鼠内毒素血症具有抗炎作用[12]。本研究结果表明,丙泊酚对严重脓毒症大鼠各部位的血管低反应性均有治疗作用,各器官恢复程度不同,其中尤以股动脉和小血管的恢复比例最大,而肾动脉的恢复比例最小,这可能有助于保证机体的血液供应,减轻脓毒症对器官功能造成的损伤。
3.3 丙泊酚通过RhoA/ROCK通路提高脓毒症大鼠血管钙敏感性,从而改善血管低反应性RhoA是小G蛋白Rho亚家族成员之一,同时,有研究表明,休克后血管平滑肌细胞钙失敏是血管低反应性发生的重要因素之一[13]。严重脓毒症时SMA血管环的钙敏感性显著减低,丙泊酚对严重脓毒症血管钙敏感性具有显著改善作用,而这种改善作用可被ROCK抑制剂Y-27632和PKCα抑制剂GO6976显著抑制。前期研究证实RhoA/ROCK通路参与调节休克血管低反应性。本研究发现,ROCK抑制剂Y-27632可显著抑制丙泊酚治疗组大鼠的离体血管对NE的收缩反应性,而IP3抑制剂2-APB和PKCα拮抗剂GO6976不减低丙泊酚治疗组大鼠离体血管对NE的收缩反应性。这说明可能是RhoA/ROCK途径,而非PKCα或IP3途径,参与丙泊酚对严重脓毒症血管低反应性的改善作用。综上,PKCα参与丙泊酚对严重脓毒症血管的钙敏感性调节,但并不参与丙泊酚治疗改善严重脓毒症血管对NE的反应性;而RhoA/ROCK不仅参与丙泊酚对严重脓毒症血管反应性的改善作用,还涉及丙泊酚对严重脓毒症血管钙敏感性的增加。小GTP酶Rho参与Ca2+敏感性增强依赖性血管收缩[14],RhoA/ROCK通过诱导肌球蛋白轻链(MLC20)磷酸化,调控血管收缩。因此,我们推测丙泊酚治疗可能通过调节钙敏感性改善严重脓毒症血管的低反应性,而这种钙敏感性调节机制偏向于非钙依赖的RhoA/ROCK通路,而不是钙依赖的PKCα通路。
3.4 细胞缝隙连接在丙泊酚改善脓毒症血管低反应性中的作用另有研究表明,内皮细胞缝隙连接参与血管对血管活性药物反应的调节[15],内皮和平滑肌之间可通过缝隙连接进行物质交换,从而使缝隙连接间接控制血管张力[16]。在本实验中,缝隙连接抑制剂Movens可显著抑制丙泊酚对严重脓毒症血管低反应性的治疗作用,证明血管细胞缝隙连接可能也参与丙泊酚对严重脓毒症血管反应性的恢复作用的调节,但这种调节作用仅在较高浓度(10-5~10-4 mol/L)NE时最为显著。之前的研究结果表明,细胞间缝隙连接参与了休克后血管收缩反应的调节,而缝隙连接功能失活可使ROCK活性降低[17-18]。因此我们推测,细胞缝隙连接和RhoA/ROCK通路在不同浓度NE诱导血管收缩过程中具有协同作用。在NE浓度较低时,主要经α1肾上腺素受体激活RhoA/ROCK通路发挥促血管收缩作用,此时细胞缝隙连接作用不显著;NE浓度较高时,主要通过细胞缝隙连接传递细胞间信号激活RhoA/ROCK通路促进血管收缩,但具体机制如何尚需进一步研究。
3.5 本研究存在的局限性首先,NE的正常生理浓度为615~3 240 pmol/L,危重症患者的急救浓度为5.9×10-3~11.8×10-3μmol/L,本研究中使用的NE终浓度为10-3~10 μmol/L,远远高于正常人和患者的血浆浓度,因此并不是临床急救用药浓度。在临床上,NE用于回升血压,以维持患者的脑与冠状动脉血流灌注,此时血管的收缩幅度微小;而在本研究中,NE主要用于诱导离体血管出现可被外置设备检测到的收缩幅度,这种收缩幅度出现在患者体内十分危险。尽管本实验室的前期研究证明该浓度梯度在离体血管环收缩反应性测定中是可行的[19-20],LIAO等[21]、WILLIAMS等[22]和NGUYEN等[23]也使用该浓度梯度进行了内毒素大鼠离体血管反应性的研究,但丙泊酚是否可改善脓毒症患者血管对临床急救浓度NE的反应性尚不可知。其次,本研究未深入探讨相关的作用机制,比如RhoA/ROCK和PKCα在丙泊酚改善脓毒症大鼠血管低反应性的作用中是否存在交互作用尚不清楚。再者是缺乏临床患者的应用数据支持,未能明确丙泊酚在临床脓毒症患者体内是否发挥改善血管低反应性的作用。因此接下来可以在较大动物体内验证本研究结果,同时探索细胞水平的分子机制,阐明丙泊酚改善脓毒症血管低反应性的具体机制,为在临床患者的应用提供支持性证据。
总之,本研究初步证实了丙泊酚可通过作用于非钙依赖的RhoA/ROCK通路调节钙敏感性,从而改善严重脓毒症大鼠的血管低反应性,恢复严重脓毒症大鼠器官组织的灌注。
| [1] |
CHRISTAKI E, OPAL S M. Is the mortality rate for septic shock really decreasing?[J]. Curr Opin Crit Care, 2008, 14(5): 580-586. |
| [2] |
GUARIDO K L, GONÇALVES R P M, JÚNIOR A G, et al. Increased activation of the Rho-A/Rho-kinase pathway in the renal vascular system is responsible for the enhanced reactivity to exogenous vasopressin in endotoxemic rats[J]. Crit Care Med, 2014, 42(6): e461-e471. |
| [3] |
EVANS L, RHODES A, ALHAZZANI W, et al. Surviving sepsis campaign: International Guidelines for Management of Sepsis and Septic Shock 2021[J]. Intensive Care Med, 2021, 47(11): 1181-1247. |
| [4] |
LI T, LIU L M, XU J, et al. Changes of Rho kinase activity after hemorrhagic shock and its role in shock-induced biphasic response of vascular reactivity and calcium sensitivity[J]. Shock, 2006, 26(5): 504-509. |
| [5] |
YANG G M, LI T, XU J, et al. PKC plays an important mediated effect in arginine vasopressin induced restoration of vascular responsiveness and calcium sensitization following hemorrhagic shock in rats[J]. Eur J Pharmacol, 2010, 628(1-3): 148-154. |
| [6] |
YANG G M, LI T, XU J, et al. Mitogen-activated protein kinases regulate vascular reactivity after hemorrhagic shock through myosin light chain phosphorylation pathway[J]. J Trauma Acute Care Surg, 2013, 74(4): 1033-1043. |
| [7] |
DEVLIN J W, ROBERTS R J. Pharmacology of commonly used analgesics and sedatives in the ICU: benzodiazepines, propofol, and opioids[J]. Anesthesiol Clin, 2011, 29(4): 567-585. |
| [8] |
MARLER J, MOHRIEN K, KIMMONS L A, et al. Effects of propofol on vasopressor use in patients with sepsis and severe sepsis: a pilot study[J]. J Crit Care, 2016, 35: 155-160. |
| [9] |
BOFFA J J, ARENDSHORST W J. Maintenance of renal vascular reactivity contributes to acute renal failure during endotoxemic shock[J]. J Am Soc Nephrol, 2005, 16(1): 117-124. |
| [10] |
GERICKE A, MARTINKA P, NAZARENKO I, et al. Impact of α1-adrenoceptor expression on contractile properties of vascular smooth muscle cells[J]. Am J Physiol Regul Integr Comp Physiol, 2007, 293(3): R1215-R1221. |
| [11] |
BAO H G, LI S. Effects of propofol on the outcomes of rats with Sepsis[J]. J Surg Res, 2011, 168(1): e111-e115. |
| [12] |
TAKEMOTO Y. Dose effects of propofol on hemodynamic and cytokine responses to endotoxemia in rats[J]. J Anesth, 2005, 19(1): 40-44. |
| [13] |
DUAN C Y, YANG G M, LI T, et al. Advances in vascular hyporeactivity after shock: the mechanisms and managements[J]. Shock, 2015, 44(6): 524-534. |
| [14] |
GONG M C, ⅡZUKA K, NIXON G, et al. Role of guanine nucleotide-binding proteins: ras-family or trimeric proteins or both: in Ca2+ sensitization of smooth muscle[J]. Proc Natl Acad Sci USA, 1996, 93(3): 1340-1345. |
| [15] |
KAMERITSCH P, POGODA K, RITTER A, et al. Gap junctional communication controls the overall endothelial calcium response to vasoactive agonists[J]. Cardiovasc Res, 2012, 93(3): 508-515. |
| [16] |
POGODA K, KAMERITSCH P, MANNELL H, et al. Connexins in the control of vasomotor function[J]. Acta Physiol(Oxf), 2019, 225(1): e13108. |
| [17] |
MING J, LI T, ZHANG Y, et al. Regulatory effects of megj on vascular reactivity following hemorrhagic shock in rats[J]. Shock, 2008, 1. |
| [18] |
XU J, LI T, YANG G M, et al. Pinacidil pretreatment improves vascular reactivity after shock through PKCα and PKCε in rats[J]. J Cardiovasc Pharmacol, 2012, 59(6): 514-522. |
| [19] |
YANG G M, PENG X Y, WU Y, et al. Involvement of connexin 43 phosphorylation and gap junctional communication between smooth muscle cells in vasopressin-induced ROCK-dependent vasoconstriction after hemorrhagic shock[J]. Am J Physiol Cell Physiol, 2017, 313(4): C362-C370. |
| [20] |
XU J, LIU L M. Role of calcium desensitization in vascular hyporeactivity in hemorrhagic shock[J]. Chin Crit Care Med, 2005, 17(1): 20-23. |
| [21] |
LIAO M H, SHIH C C, TSAO C M, et al. RhoA/Rho-kinase and nitric oxide in vascular reactivity in rats with endotoxaemia[J]. PLoS One, 2013, 8(2): e56331. |
| [22] |
WILLIAMS J, BOGWU J, OYEKAN A. The role of the RhoA/Rho-kinase signaling pathway in renal vascular reactivity in endothelial nitric oxide synthase null mice[J]. J Hypertens, 2006, 24(7): 1429-1436. |
| [23] |
NGUYEN DINH CAT A, CALLERA G E, FRIEDERICH-PERSSON M, et al. Vascular dysfunction in obese diabetic db/db mice involves the interplay between aldosterone/mineralocorticoid receptor and Rho kinase signaling[J]. Sci Rep, 2018, 8(1): 2952. |




