2. 400038 重庆,陆军军医大学(第三军医大学)药学与检验医学系临床微生物与免疫学教研室;
3. 430070 武汉,解放军中部战区总医院呼吸与危重症医学科;
4. 400038 重庆,陆军军医大学(第三军医大学)创伤与化学中毒全国重点实验室
2. Department of Clinical Microbiology and Immunology, Faculty of Pharmacy and Medical Laboratory, Army Medical University (Third Military Medical University), Chongqing, 400038;
3. Department of Respiratory and Critical Care Medicine, General Hospital of Center Theater of PLA, Wuhan, Hubei Province, 430070, China;
4. State Key Laboratory of Trauma and Chemical Poisoning, Army Medical University (Third Military Medical University), Chongqing, 400038
类鼻疽伯克霍尔德菌(Burkholderia pseudomallei,简称类鼻疽菌)是高致死性热带传染病类鼻疽(melioidosis) 的病原菌,随着全球气候的变化、交通的便利、经贸文化交流的频繁,其人群感染发生率逐年增高,估计目前全球年发病数165 000例,年病死89 000例[1-2]。类鼻疽菌感染可累及身体几乎所有器官和组织,导致急性败血症比例约占60%,病死率超30%,慢性感染病程可迁延数年甚至数十年[3]。同时,鉴于类鼻疽菌的高耐药性和无疫苗使用,WHO将其列为B类生物战剂,美国疾病控制与预防中心(CDC)将其归为Ⅰ类病原体[4],加强类鼻疽菌感染防控与临床诊治新策略的研究迫在眉睫[5]。
内质网是真核细胞合成蛋白质、脂质和贮存钙离子的主要细胞器。当细胞内出现内质网腔内错误折叠、未折叠蛋白聚集或钙离子平衡紊乱等状况时,细胞会通过调节内质网功能维持其内环境稳态,从而触发内质网应激(endoplasmic reticulum stress, ERS)[6]。牛磺熊去氧胆酸(tauroursodeoxycholic acid,TUDCA)是熊胆汁的有效成分,由牛磺酸与熊去氧胆酸在肝脏内缩合而成,目前美国FDA已批准TUDCA用于临床治疗胆囊胆固醇结石、胆管炎、肝硬化等肝脏相关疾病。除此以外,TUDCA还被报道对流感病毒、心血管疾病、骨关节炎、肾病等疾病具有改善作用[7-9]。最近有研究表明,TUDCA还可通过抑制ERS,有效保护肝细胞和恢复葡萄糖稳态,在肥胖、胰岛素抵抗和糖尿病的发病机制中发挥关键作用[10]。本研究以类鼻疽菌感染RAW264.7细胞为模型,研究TUDCA通过调节巨噬细胞ERS诱导的凋亡,促进类鼻疽菌胞内清除的作用及机制,为探索新的类鼻疽有效治疗方案提供理论指导。
1 材料与方法 1.1 菌株、细胞及主要试剂类鼻疽菌BPC006由本实验室鉴定并保存;RAW264.7细胞保存于本室;胎牛血清、DMEM培养基、HEPES培养基、Opti-MEMTM培养基购买自Gibco公司;PlatinumTM SYBRTM Green qPCR SuperMix-UDG、RNaseZapTM RNase去污溶液、TRIzolTM试剂、LipofectamineTM 3000 Transfection Reagent、SuperSignalTM West Pico PLUS化学发光底物、Silencer siRNA、PierceTM BCA蛋白检测试剂盒购买自Thermo Fisher公司;逆转录试剂盒PrimeScriptTM RT reagent Kit with gDNA Eraser购买自TaKaRa公司;β-actin、CHOP、Caspase-3、Caspase-12等蛋白抗体购买自Invitrogen公司;PVDF膜、Cell Counting Slides购买自BIO-RAD公司;TUDCA购买自Solarbio公司;4-PBA购买自Sigma公司;FITC Annexin V Apoptosis Detection Kit购买自BD Biosciences公司;MTT细胞增殖及细胞毒性检测试剂盒购买自Beyotime公司。
1.2 Annexin-V/PI双染法及流式细胞术检测细胞凋亡设置未感染组、TUDCA(0、20、100、200 μmol/L) 处理条件下的类鼻疽菌感染组。感染前各孔加入相应工作浓度的TUDCA预处理RAW264.7细胞24 h。挑取已验证的BPC006单克隆菌落于LB培养基中,200 r/min摇床培养过夜。次日,加入BPC006菌液(感染复数MOI=10)共孵育1 h,弃去培养基,加入PBS清洗3次,再加入含250 μg/mL卡那霉素和相应工作浓度TUDCA的DMEM完全培养基,继续培养至8 h后,加入800 μL 0.25%胰酶消化后收集细胞,PBS洗细胞2次;加入1×Binding Buffer重悬细胞,调节细胞浓度为1×106个/mL,取100 μL细胞悬液至1.5 mL EP管中,每管避光加入FITC Annexin V和Propidium Iodide各5 μL,混匀后室温孵育15 min;各管中加入400 μL的1×Binding Buffer,避光混匀后使用BD cytoflex流式细胞仪测定结果。
设置未感染组和类鼻疽菌感染组,分别在PBS、TUDCA和4-PBA的处理条件下进行实验。感染前根据分组分别加入PBS或100 μmol/L的TUDCA或250 μmol/L的4-PBA预处理RAW264.7细胞24 h。感染及收样方法同上。
设置siC对照组和siCHOP干扰组,在PBS或TUDCA处理条件下进行实验。根据分组使用LipofectamineTM 3000 Transfection Reagent将siRNA转染入RAW264.7细胞中,转染过夜后,加入100 μmol/L TUDCA处理RAW264.7细胞24 h,感染及收样方法同上。
1.3 MTT检测细胞增殖RAW264.7细胞铺板至96孔板,使用100 μmol/L的TUDCA或250 μmol/L的4-PBA预处理24 h,设置感染组和非感染组,感染方式同上。弃培养基,使用PBS洗细胞2次,每孔加入10 μL MTT溶液,混匀后将96孔板置于细胞培养箱中孵育4 h。弃去上清,每孔加入100 μL Formazan溶解液,置于摇床上低俗震荡10 min至Formazan结晶全部溶解,使用酶标仪于490 nm波长处检测各孔光密度值,以反映细胞增殖情况。
1.4 Western blot实验设置siC对照组和siCHOP干扰组,提取各组RAW264.7细胞总蛋白,BCA法测定蛋白浓度,加入5×SDS上样buffer并调节蛋白浓度一致后加入金属浴加热变性,保存于-20 ℃。取20 μg总蛋白样品上样进行SDS-PAGE电泳,半干转法将胶上的蛋白转移至PVDF膜,5%脱脂奶粉室温封闭2 h,加入一抗4 ℃孵育过夜,TBST洗膜3次,加入二抗室温孵育2 h,TBST洗膜3次,使用Bio-Rad化学发光分子成像仪采集结果。
分别在未感染、类鼻疽菌感染、类鼻疽菌感染加TUDCA处理条件下进行实验。根据分组使用LipofectamineTM 3000 Transfection Reagent将siRNA转染入RAW264.7细胞中,转染12 h后,加入100 μmol/L TUDCA处理RAW264.7细胞24 h,类鼻疽菌感染、收样及Western blot检测方法同上。
1.5 qRT-PCR检测mRNA表达设置siC对照组和siCHOP干扰组,使用TRIzol提取细胞总RNA,并测定RNA浓度及纯度。使用TaKaRa逆转录试剂盒,以10 μL的反应体系将提取的mRNA逆转录为cDNA,反应条件为7 ℃ 15 min;85 ℃ 5 s。使用20 μL的SYBR Green荧光PCR反应体系进行qRT-PCR检测CHOP mRNA的表达水平,反应条件为95 ℃预变性1 min;95 ℃ 5 s,进行40个循环;用2-ΔΔCt的方法计算结果。引物序列CHOP: 上游引物5′-GAGCCAGAATAACAGCCGGA-3′, 下游引物5′-CAAGGTGAAAGGCAGGGACT-3′, β-actin: 上游引物5′-CTGAGCACACAGCTGGACTG-3′, 下游引物5′-AAGCTGGTGGTACCTGATGC-3′。
1.6 细菌胞内生存实验设置siC对照组和siCHOP干扰组,在PBS或TUDCA处理条件下进行实验,感染前24 h分别加入PBS或100 μmol/L TUDCA预处理RAW264.7细胞。感染方式同上,用灭菌PBS清洗3次,加入0.1% Triton X-100裂解细胞,倍比稀释细胞裂解液后取10 μL稀释液涂布于LB平板,于37 ℃恒温培养箱, 孵育36 h后,进行菌落计数。
1.7 统计学分析各实验均进行3次独立重复,采用GraphPad Prism 5.0软件作图,采用Student’s t检验或方差分析对定量结果进行统计学差异分析。P < 0.05表示差异有统计学意义。
2 结果 2.1 TUDCA减少类鼻疽菌感染诱导的细胞凋亡如图 1所示,与未感染组相比,类鼻疽菌感染可引起RAW264.7细胞凋亡,凋亡细胞占比18%。经20 μmol/L TUDCA处理后,类鼻疽菌感染诱导的细胞凋亡与未加TUDCA药物相比差异无统计学意义,而当提升TUDCA浓度至100 μmol/L时,经处理后的RAW264.7细胞凋亡呈现明显抑制,凋亡细胞占比下降,相较未加TUDCA药物和20 μmol/L药物处理组差异具有统计学意义(P < 0.05)。进一步提升TUDCA浓度至200 μmol/L,细胞凋亡抑制率未见明显提升。以上结果表明,TUDCA浓度达100 μmol/L时可有效抑制类鼻疽菌感染诱导的细胞凋亡。
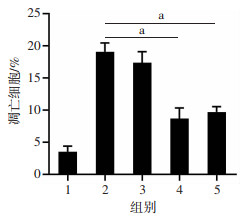
|
| 1:未感染组;2~5:类鼻疽菌感染组,TUDCA处理浓度分别为0、20、100、200 μmol/L;a: P < 0.01 图 1 TUDCA减少类鼻疽菌感染诱导的细胞凋亡 |
2.2 TUDCA通过抑制内质网应激减少类鼻疽菌感染诱导的细胞凋亡
使用另一种内质网应激抑制剂4-苯基丁酸(4-phenylbutyric acid, 4-PBA)进行处理,分别通过Annexin-V/PI双染法及MTT细胞增殖实验检测类鼻疽菌感染后细胞增殖能力及凋亡情况。如图 2所示,TUDCA或4-PBA处理均可显著降低类鼻疽菌感染诱导的细胞凋亡(P < 0.05);相反地,在TUDCA或4-PBA的作用下,类鼻疽菌感染后细胞增殖能力显著增强(P < 0.05)。该结果表明,抑制巨噬细胞内质网应激可减少类鼻疽菌感染诱导的细胞凋亡的发生,并能在一定程度上维持细胞的增殖能力。

|
|
a: P < 0.01 A:Annexin-V/PI双染法及流式细胞术检测各组细胞凋亡的变化;B:MTT细胞增殖实验检测细胞增殖能力 图 2 内质网应激抑制剂可抑制类鼻疽菌感染诱导的细胞凋亡 |
为了进一步验证TUDCA是否通过抑制内质网应激来发挥作用,采用siRNA敲降内质网应激关键蛋白CHOP。在TUDCA预处理后,通过Western blot及Annexin-V/PI双染法分别检测类鼻疽菌感染后细胞凋亡相关蛋白(Caspase-3和Caspase-12)的表达水平及细胞凋亡数量的变化。结果显示,在siC对照组或siCHOP干扰组中,类鼻疽菌感染后与未感染相比,Caspase-3表达明显增加,其中siCHOP干扰组中细胞凋亡相关蛋白的表达显著低于siC对照组;在类鼻疽菌感染条件下,siC对照组中加入TUDCA后Caspase-3和Caspase-12的表达低于PBS处理的结果,而siCHOP干扰组中,TUDCA处理对细胞凋亡相关蛋白水平的影响与PBS处理无明显差异,见图 3A~C。
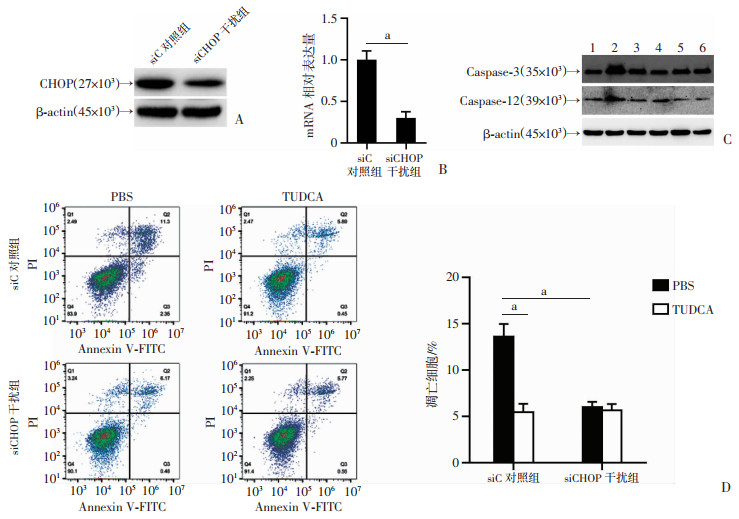
|
|
a: P < 0.01 A:Western blot检测CHOP蛋白表达;B:qRT-PCR检测CHOP mRNA表达量;C:Western blot检测Caspase-3和Caspase-12蛋白表达水平1~3:siC对照组,其中2为PBS处理加类鼻疽菌感染,3为TUDCA处理加类鼻疽菌感染;4~6:siCHOP干扰组,其中5为PBS处理加类鼻疽菌感染,6为TUDCA处理加类鼻疽菌感染;D:Annexin-V/PI双染法及流式细胞术检测细胞凋亡情况 图 3 TUDCA通过抑制宿主细胞内质网应激降低类鼻疽菌感染诱导的细胞凋亡 |
同时,流式细胞仪检测结果显示(图 3D),类鼻疽菌感染后siCHOP干扰组细胞凋亡数量显著低于siC对照组(P < 0.05);在siC对照组中,与PBS处理相比,TUDCA处理使类鼻疽菌感染诱导的细胞凋亡数量显著降低(P < 0.05),而在siCHOP干扰组中,加入TUDCA对类鼻疽菌感染诱导的凋亡数量无明显作用。以上结果提示,TUDCA通过抑制巨噬细胞内质网应激从而降低类鼻疽菌感染诱导的细胞凋亡。
2.3 TUDCA通过抑制类鼻疽菌感染导致的细胞凋亡促进巨噬细胞对类鼻疽菌的清除为了探究TUDCA抑制类鼻疽菌感染所致巨噬细胞凋亡,对类鼻疽菌胞内存活的作用,进行了类鼻疽菌胞内生存实验,发现在siC对照组中加入TUDCA处理后,宿主细胞对类鼻疽菌的清除明显增强(P < 0.05),而在siCHOP干扰组,与PBS对照相比,TUDCA对类鼻疽菌胞内增殖无明显影响(图 4)。以上结果显示,TUDCA通过抑制内质网应激,进而减少类鼻疽菌感染诱导的巨噬细胞凋亡,促进巨噬细胞对类鼻疽菌的清除。

|
| A:类鼻疽菌在LB平板上的菌落图像;B:平板菌落数统计结果 a: P < 0.01 图 4 TUDCA通过抑制内质网应激诱导的细胞凋亡从而促进类鼻疽菌的清除 |
3 讨论
类鼻疽菌作为一种胞内寄生菌,能够极快地侵入宿主多种细胞,尤其是吞噬细胞,包括巨噬细胞、单核细胞和中性粒细胞等。这些吞噬细胞不仅不能发挥吞噬和清除作用,反而被类鼻疽菌所劫持,作为“特洛伊木马”成为其逃避宿主防御系统攻击和抗菌药物杀伤的场所,为类鼻疽菌的增殖和播散提供便利,造成感染以及反复不愈[11-12]。此外,由于病原体特殊的生物学特性,其感染和免疫机制不明确,在预防和控制方面仍存在许多问题。临床治疗面临的最大困境是“顽固性耐药”。基因组分析表明,类鼻疽菌等具有特殊双染色体结构的病原微生物,遗传结构多变,对宿主环境适应性强,发生基因突变的概率高,使得类鼻疽菌在对多种临床常用抗生素存在天然耐药的同时,对目前临床一线治疗药物(复方新诺明、头孢他啶)也逐渐出现耐药,导致治疗失败和病情恶化[13],因此,迫切需要寻找解决临床治疗的新策略。
内质网应激是细胞基于内质网的结构与功能对各种胞内外的刺激产生的一系列生物学反应,促使机体更有效地适应环境,维持细胞内环境稳态[6]。内质网应激主要通过适应性反应-非折叠蛋白反应(unfolding protein response, UPR)的增强来恢复内质网蛋白处理的能力,后者反馈调节内质网应激。UPR作为内质网应激反应信号通路最重要和最保守的组成部分,包含有3种位于内质网膜上的信号感受分子,分别是IRE1、ATF6和PKR- PERK,这3种激酶通过感受内质网中的蛋白伴侣Bip的浓度水平调节胞浆或者内质网内的刺激信号,如非折叠蛋白、异种蛋白、病原菌等,进而激活通路下游的转录因子XBP1的mRNA的剪切,影响下游基因的表达,包括Bip、ERdj4和CHOP[14-15]。近年来,内质网参与病原菌致病过程的相关机制研究开始为人们关注,ERS被认为参与了先天免疫信号通路的调节和宿主对入侵微生物的防御[16]。最近的证据表明,某些细菌利用内质网环境成为利于其细胞内生存的避难所,如军团菌、布鲁氏菌、衣原体和辛卡尼亚菌。有研究报道,含有军团菌的液泡通过内吞途径与内质网膜融合,并在巨噬细胞吞噬后干扰液泡成熟以允许其细胞内复制[17-18]。SMITH等[19]发现布鲁氏菌通过效应蛋白TcpB影响UPR水平从而引起内质网重构,促进布鲁氏菌的胞内生存能力。此外,也有文献报道内质网应激通路在结核分枝杆菌持久性感染中起着重要作用,研究显示eIF2α/CHOP通路参与巨噬细胞内结核分枝杆菌的胞内存活[20]。但值得关注的是,病原菌感染诱导的内质网应激是有利于病原菌的胞内存活还是有利于宿主对病原菌感染的防御,至今尚无定论,一方面细胞内的细菌可利用宿主内质网作为复制增殖的场所,但另一方面,细菌产生的毒素,如志贺毒素、霍乱毒素[21-22],也会破坏内质网结构与功能,引起过度的内质网应激,进而诱导宿主先天免疫系统识别感染细胞、触发防御反应,以清除细菌。
内质网应激的下游反应具有高度复杂性,包括活性氧的产生、自噬的诱导、细胞凋亡的启动和先天免疫反应的激活。据报道,布鲁氏菌TcpB蛋白可诱导内质网应激,但也可与Toll样受体信号转导通路的MAL(MyD88-adapter-like)相互作用,抑制NF-κB信号通路的激活[23-24]。在强烈或持续的刺激条件下,内质网应激反应不能保护细胞,最终将导致细胞凋亡,进而影响细菌的胞内复制和增殖。已有文献报道结核分枝杆菌、幽门螺旋杆菌、布鲁氏菌和李斯特菌等感染可引起内质网应激诱导的特异性凋亡反应,但具体机制尚不清楚[16]。SEIMON等[25]在结核分枝杆菌感染后形成的富含巨噬细胞的肉芽肿组织中检测到了ERS和凋亡的发生;PILLICH等[26]发现,李斯特菌通过分泌溶细胞素LLO诱导ERS下游所有信号通路,导致内质网应激诱导的凋亡反应。这些证据提示细菌感染导致的内质网应激诱导的凋亡反应有益于感染的进行,可能的原因是诱导巨噬细胞发生凋亡反应,而不是发生坏死或焦亡,可以降低炎症的产生,进一步减少炎性细胞的浸润,更利于细菌在宿主细胞内的增殖、播散。本课题组在前期研究中发现类鼻疽菌感染后可以诱导巨噬细胞发生ERS和凋亡,但两者之间的关系还未进一步探讨;另外通过小鼠和细胞模型发现TUDCA能够促进类鼻疽菌的清除,但具体作用机制未阐明清楚。因此,本研究在此基础上进一步探讨了类鼻疽感染引起的ERS与细胞凋亡的关系,以及TUDCA促进类鼻疽菌清除的分子机制,结果表明类鼻疽菌通过激活ERS诱导细胞凋亡,而TUDCA能够抑制ERS,干扰凋亡,促进类鼻疽菌的胞内清除反应。
近年来,调节内质网应激反应的药物已用于治疗炎症性疾病和癌症[27]。在此基础上,越来越多的研究也在不断探索该类药物是否也能用于胞内菌或病毒感染的辅助治疗,如结核病、布鲁氏菌病等需要长期使用抗生素治疗的感染性疾病。与上述两种疾病类似,目前类鼻疽的临床治疗方案分为2个阶段,急性期常使用头孢他啶或美罗培南静脉滴注2周,后期需要口服复方磺胺甲噁唑长达6个月,且复发率高,治疗效果不佳。TUDCA商品名为滔罗特,在临床上主要用于治疗肝胆结石症、乙型肝炎等肝脏相关疾病[28]。本研究证实,TUDCA可通过抑制巨噬细胞内质网应激,减少细胞凋亡,促进巨噬细胞对类鼻疽菌的胞内清除。这意味着TUDCA作为一种临床常用的、安全可靠的药物,可能在类鼻疽菌感染的临床治疗中发挥潜在作用,为将来制定抗类鼻疽感染的有效治疗方案提供了重要的理论指导。
综上所述,本研究从细菌与宿主细胞互作的层面,以类鼻疽菌、内质网应激、凋亡三者之间的角度,进一步发现了类鼻疽菌通过诱导内质网应激促进宿主细胞凋亡,而TUDCA能够通过抑制内质网应激干扰凋亡的发生,从而促进类鼻疽菌的胞内清除作用。本研究旨在探讨抗类鼻疽菌感染的可能的、新的治疗方法,为将来制定类鼻疽菌感染的防治手段提供重要的理论依据。
| [1] |
WIERSINGA W J, VIRK H S, TORRES A G, et al. Melioidosis[J]. Nat Rev Dis Primers, 2018, 4(1): 1-22. |
| [2] |
BIRNIE E, VIRK H S, SAVELKOEL J, et al. Global burden of melioidosis in 2015: a systematic review and data synthesis[J]. Lancet Infect Dis, 2019, 19(8): 892-902. |
| [3] |
VIRK H S, MUKHOPADHYAY C, WIERSINGA W J. Melioidosis: a neglected cause of community-acquired pneumonia[J]. Semin Respir Crit Care Med, 2020, 41(4): 496-508. |
| [4] |
ROTZ L D, KHAN A S, LILLIBRIDGE S R, et al. Public health assessment of potential biological terrorism agents[J]. Emerg Infect Dis, 2002, 8(2): 225-230. |
| [5] |
毛旭虎, 林容, 方瑶, 等. 类鼻疽诊断与治疗专家共识[J]. 中华传染病杂志, 2022, 40(10): 577-583. MAO X H, LIN R, FANG Y, et al. Expert consensus on diagnosis and treatment of melioidosis[J]. Chin J Infect Dis, 2022, 40(10): 577-583. |
| [6] |
CHOVATIYA R, MEDZHITOV R. Stress, inflammation, and defense of homeostasis[J]. Mol Cell, 2014, 54(2): 281-288. |
| [7] |
HEUBI J E, WIECHMANN D A, CREUTZINGER V, et al. Tauroursodeoxycholic acid (TUDCA) in the prevention of total parenteral nutrition-associated liver disease[J]. J Pediatr, 2002, 141(2): 237-242. |
| [8] |
OZCAN U, YILMAZ E, OZCAN L, et al. Chemical chaperones reduce ER stress and restore glucose homeostasis in a mouse model of type 2 diabetes[J]. Science, 2006, 313(5790): 1137-1140. |
| [9] |
DE MIGUEL C, SEDAKA R, KASZTAN M, et al. Tauroursodeoxycholic acid (TUDCA) abolishes chronic high salt-induced renal injury and inflammation[J]. Acta Physiol (Oxf), 2019, 226(1): e13227. |
| [10] |
ELIA A E, LALLI S, MONSURRÒ M R, et al. Tauroursodeoxycholic acid in the treatment of patients with amyotrophic lateral sclerosis[J]. Eur J Neurol, 2016, 23(1): 45-52. |
| [11] |
GASSIEP I, ARMSTRONG M, NORTON R. Human melioidosis[J]. Clin Microbiol Rev, 2020, 33(2): e00006-e00019. |
| [12] |
ALLWOOD E M, DEVENISH R J, PRESCOTT M, et al. Strategies for intracellular survival of Burkholderia pseudomallei[J]. Front Microbio, 2011, 2: 170. |
| [13] |
WIERSINGA W J, CURRIE B J, PEACOCK S J. Melioidosis[J]. N Engl J Med, 2012, 367(11): 1035-1044. |
| [14] |
LEE A S. The ER chaperone and signaling regulator GRP78/BiP as a monitor of endoplasmic reticulum stress[J]. Methods, 2005, 35(4): 373-381. |
| [15] |
HILLARY R F, FITZGERALD U. A lifetime of stress: ATF6 in development and homeostasis[J]. J Biomed Sci, 2018, 25(1): 48. |
| [16] |
CELLI J, TSOLIS R. Bacteria, the endoplasmic reticulum and the unfolded protein response: friends or foes?[J]. Nat Rev Microbiol, 2014, 13: 71-82. |
| [17] |
KAGAN J C, ROY C R. Legionella phagosomes intercept vesicular traffic from endoplasmic reticulum exit sites[J]. Nat Cell Biol, 2002, 4(12): 945-954. |
| [18] |
ROBINSON C G, ROY C R. Attachment and fusion of endoplasmic reticulum with vacuoles containing Legionella pneumophila[J]. Cell Microbiol, 2006, 8(5): 793-805. |
| [19] |
SMITH J A, KHAN M, MAGNANI D D, et al. Brucella induces an unfolded protein response via TcpB that supports intracellular replication in macrophages[J]. PLoS Pathog, 2013, 9(12): e1003785. |
| [20] |
LIM Y J, CHOI J A, CHOI H H, et al. Endoplasmic reticulum stress pathway-mediated apoptosis in macrophages contributes to the survival of Mycobacterium tuberculosis[J]. PLoS One, 2011, 6(12): e28531. |
| [21] |
LEE S Y, LEE M S, CHERLA R P, et al. Shiga toxin 1 induces apoptosis through the endoplasmic reticulum stress response in human monocytic cells[J]. Cell Microbiol, 2008, 10(3): 770-780. |
| [22] |
CHO J, LEE A H, PLATZER B, et al. RETRACTED: the unfolded protein response element IRE1α senses bacterial proteins invading the ER to activate RIG-I and innate immune signaling[J]. Cell Host Microbe, 2013, 13(5): 558-569. |
| [23] |
SENGUPTA D, KOBLANSKY A, GAINES J, et al. Subversion of innate immune responses by Brucella through the targeted degradation of the TLR signaling adapter, MAL[J]. J Immunol, 2010, 184(2): 956-964. |
| [24] |
SNYDER G A, DEREDGE D, WALDHUBER A, et al. Crystal structures of the Toll/interleukin-1 receptor (TIR) domains from the Brucella protein TcpB and host adaptor TIRAP reveal mechanisms of molecular mimicry[J]. J Biol Chem, 2014, 289(2): 669-679. |
| [25] |
SEIMON T A, KIM M J, BLUMENTHAL A, et al. Induction of ER stress in macrophages of tuberculosis granulomas[J]. PLoS One, 2010, 5(9): e12772. |
| [26] |
PILLICH H, CHAKRABORTY T, MRAHEIL M A. Cell-autonomous responses in Listeria monocytogenes infection[J]. Future Microbiol, 2015, 10(4): 583-597. |
| [27] |
MIMURA N, FULCINTI M, GORGUN G, et al. Blockade of XBP1 splicing by inhibition of IRE1alpha is a promising therapeutic option in multiple myeloma[J]. Blood, 2012, 119(24): 5772-5781. |
| [28] |
YAN H, PENG B, LIU Y, et al. Viral entry of hepatitis B and D viruses and bile salts transportation share common molecular determinants on sodium taurocholate cotransporting polypeptide[J]. J Virol, 2014, 88(6): 3273-3284. |




