2. 400016 重庆,重庆医科大学:药物代谢研究重庆市重点实验室;
3. 610031 成都,成都市第三人民医院药学部
2. Chongqing Key Research Laboratory for Drug Metabolism, Chongqing Medical University, Chongqing, 400016;
3. Department of Pharmacy, Chengdu Third People's Hospital, Chengdu, Sichuan Province, 610031, China
乳腺癌已成为严重威胁女性健康乃至生命的最常见肿瘤之一,每年影响超过100万女性,是全球女性癌症的头号杀手,预计到2050年,全世界女性乳腺癌患者将达到320万[1]。乳腺癌是一种高异质性肿瘤,具有广泛的分子亚型,在所有乳腺癌亚型中,雌激素受体阳性(estrogen receptor positive, ER+)乳腺癌约占所有乳腺癌分型的70%[2]。内分泌治疗如他莫昔芬是治疗ER+乳腺癌的一线疗法,然而一半的患者最终会产生他莫昔芬耐药性[3-4],因此寻找新的治疗药物具有重要意义。
内质网是真核细胞膜蛋白和分泌蛋白合成和折叠的场所。酸中毒、Ca2+平衡失调、缺氧、营养匮乏等情况下,往往会引发未折叠或错误折叠蛋白在内质网聚集,引发内质网应激,从而激活未折叠蛋白反应(unfolded protein response, UPR)[5-6]。内质网应激可通过UPR启动PERK(PKR-like ER kinase)、IRE1(inositol requiring 1)和ATF6(activating transcription factor 6)3条信号通路,以抑制未折叠蛋白的生成或加速错误折叠蛋白降解来缓解内质网压力以维持细胞稳态[7-8]。但在长时间过度应激或者出现内质网功能障碍时,未折叠蛋白会持续堆积,细胞稳态失衡,从而诱导细胞凋亡。过度的内质网应激与多种疾病发生、发展有关,如肝脏疾病、肺部疾病、心血管系统疾病、糖尿病、神经系统退行性病变、慢性炎症以及肿瘤[9-10]。研究表明,诱导持续强烈的内质网应激从而激活CHOP、JNK和Caspase-12 3条促凋亡信号通路是治疗肿瘤的重要策略。其中,CHOP信号通路是内质网应激和细胞凋亡之间相互联系的重要分子。
雷公藤红素(celastrol, Cel)是一种具有显著抗肿瘤作用的生物活性化合物[11]。已有文献报道,Cel可通过影响肿瘤细胞增殖、转移、侵袭、血管生成通路来抑制胶质瘤、白血病、黑色素瘤、胰腺癌、肺癌、前列腺癌、乳腺癌和结直肠癌等多种肿瘤的发生、发展[12]。本课题组前期研究也表明Cel在体内外能通过mTOR信号通路抑制乳腺癌细胞的生长[13],但Cel能否通过诱导内质网应激介导的凋亡发挥抗ER+乳腺癌作用及其机制不清。因此本研究主要探讨Cel对ER+乳腺癌中内质网应激与凋亡信号通路的影响,以进一步揭示Cel抗ER+乳腺癌的作用机制。
1 材料与方法 1.1 材料 1.1.1 细胞人乳腺癌细胞MCF-7、T47D购于ATCC公司。
1.1.2 动物BALB/c-nu鼠购于常州卡文斯实验动物有限公司;动物许可证号:NO.202132644。
1.1.3 主要试剂雷公藤红素(货号:C107671)购于上海阿拉丁生化科技股份有限公司;DMEM培养基购于Gibco公司;胎牛血清购于美国Procell公司;MTT(货号:ST1537)购于上海碧云天生物技术有限公司;PBS、TBS均购于Biosharp公司;封闭专用脱脂奶粉购于北京普利莱基因技术有限公司;兔抗人BIP(货号:3177)、XBP1s(货号:40435)、IRE1α(货号:3294)、ATF4(货号:11815)、eIF2α(货号:5324)、BAX(货号:41162)、BCL-2(货号:4223)、PARP(货号:9532)、Cleaved PARP(货号:5625)单克隆抗体均购于美国Cell Signaling Technology公司;兔抗人p-eIF2(货号:AF3087)、p-IRE1α(货号:AF7150)、p-PERK(货号:DF7576)、ATF6(货号:DF6009)单克隆抗体均购于美国Affinity Biosciences公司;兔抗人CHOP(货号:15204-1-AP)单克隆抗体购于武汉三鹰生物技术有限公司;β-actin(SC-47778)单克隆抗体购于美国Santa Cruz Biotechnology公司;辣根过氧化物酶标记的山羊抗兔IgG(货号: ZB-2301)、辣根过氧化物酶标记的山羊抗鼠IgG(货号: ZB-2305)均购于中国中杉金桥公司;雷公藤红素(货号:HY-13067)购于美国MedChemExpress公司;Trizol(货号:9109)、逆转录试剂盒PrimeScriptTM RT reagent Kit(货号:RR047A)与实时荧光定量PCR(RT-qPCR)试剂盒TB Green® Premix EX TaqTM Ⅱ(货号:RR820A)均购于日本TaKaRa Bio公司;PERK、ATF6、IRE1α、ATF4、CHOP、BIP引物均合成于上海生工生物工程股份有限公司,引物序列见表 1。
| 基因 | 引物序列(5′→3′) |
| β-actin | 上游: CCTGGCACCCCAGCACAAT 下游: GGGCCGGACTCGTCATAC |
| PERK | 上游: ATAGCCCTCACCATTTGC 下游: GGGGACTTTCCTTCTTCTG |
| ATF6 | 上游: GTACCAGCCCCTTCAGC 下游: TCGCCTCTAACCCTAGCA |
| IRE1α | 上游: GCAGCTCCAGTTCTTCCAG 下游: GCCAGTCCATCTTCACCAC |
| ATF4 | 上游: GGCTTGGAACAGCACCTC 下游: CAGACACGCCTCGCTTC |
| CHOP | 上游: TTGACCCTGCTTCTCTGG 下游: CTGGTTCTCCCTTGGTCTT |
| BIP | 上游: TGAAACTGTGGGAGGTGTC 下游: ACGAGGAGCAGGAGGAA |
1.2 方法 1.2.1 细胞培养
人乳腺癌细胞MCF-7与T47D培养在含10%胎牛血清的DMEM培养基中,培养箱条件设置为37 ℃,5% CO2。及时观察细胞生长状态,当细胞生长融合度达70%~80%时,使用0.25%的胰蛋白酶进行消化传代,传代比例为1 ∶2。
1.2.2 MTT检测细胞活力取对数生长期的细胞,按每孔180 μL培养基(约含1×104个细胞)接种至96孔板中,待细胞贴壁过夜后,加入终浓度为1、2、4、8、16 μmol/L的Cel处理48 h后,每孔加入5 mg/mL的MTT工作液20 μL,继续培养4 h,弃上清,每孔加入150 μL二甲基亚砜,低速振荡10 min,酶标仪570 nm波长下测光密度值。每组设置3个复孔,实验重复3次。
1.2.3 细胞克隆检测细胞增殖取对数生长期的细胞,按每孔1 mL培养基(约含2×103个细胞)接种至12孔板中,待细胞贴壁过夜后,加入终浓度为1、2、4 μmol/L的Cel处理,每隔2天更换1次含相应浓度Cel的培养基,待细胞生长14 d后,弃上清,每孔加入1 mL的PBS清洗细胞2~3次,加入1 mL 4%的多聚甲醛固定细胞,1 h后弃去多聚甲醛,并使用PBS清洗2~3次,每孔加入1 mL结晶紫溶液染色1 h,弃去结晶紫溶液,使用纯水清洗12孔板2~3次,置于干燥处自然晾干。
1.2.4 RNA提取和cDNA合成采用Trizol法提取不同浓度Cel(1、2、4 μmol/L)处理后MCF-7与T47D细胞中的总RNA,并通过琼脂糖凝胶电泳检测RNA的完整性。确认RNA无降解后,使用PrimeScriptTM RT reagent Kit试剂盒将提取的RNA反转录成cDNA,得到的cDNA置于-20 ℃冰箱用于后续实验。
1.2.5 RT-qPCR反应采用SYBR Green荧光染料法进行Real-time qPCR反应。按TB Green® Premix EX TaqTM Ⅱ试剂盒使用说明书进行。扩增过程: 95 ℃ 30 s,预变性; 95 ℃ 5 s,60 ℃ 34 s,40个循环; 融解95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。以β-actin为内参,作mRNA表达水平相对定量分析,最后采用2-△△Ct法计算目的基因的相对表达量。每组设置3个复孔。
1.2.6 Western blot检测采用含磷酸酶抑制剂的RIPA裂解液裂解不同浓度Cel(1、2、4 μmol/L)处理后的MCF-7与T47D细胞,提取总蛋白,然后按4 ∶1体积比加入5× loading buffer混合煮沸10 min。采用SDS-PAGE电泳分离蛋白,将PAGE胶根据Marker位置切下目的条带与β-actin所在的条带,恒压转至0.45 μmol/L PVDF膜上,室温下用5%脱脂牛奶封闭2 h后,4 ℃过夜孵育一抗,并在室温下孵育二抗2 h,最后采用ECL化学发光显影获得结果。
1.2.7 裸鼠原位移植瘤实验裸鼠适应性喂养1周,接种前1 d在裸鼠颈部皮下埋植0.5 mg的17β雌二醇缓释片,然后将处于对数生长期的MCF-7细胞消化,离心后重悬于无双抗的培养基和基质胶中(1 ∶1),使细胞浓度为4×106个/50 μL,按每只裸鼠50 μL细胞悬液接种于第8乳房垫,建立裸鼠原位移植瘤模型。待肿瘤长至40~60 mm3时,将裸鼠分为模型对照组(Control)、Cel低剂量组(Cel-L, 0.5 mg/kg)及Cel高剂量组(Cel-H, 1 mg/kg);腹腔注射,每天给药1次,连续给药21 d。模型对照组腹腔注射等体积0.9%的生理盐水。每3天用游标卡尺测量肿瘤体积(V),并按照公式V(mm3)=(a×b2)/2(a、b分别为肿瘤的长径和短径)计算肿瘤体积并绘制肿瘤生长曲线。实验终止时,取肿瘤组织,采用Western blot检测内质网应激相关蛋白PERK、IRE1α、ATF6、Cleaved ATF6、BIP、XBP1s、ATF4、CHOP与eIF2α的表达及p-PERK、p-IRE1α、p-eIF2α的水平。
1.3 统计学分析利用Graphpad 8.0统计软件,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,实验数据以x±s表示,P<0.05表示差异具有统计学意义。
2 结果 2.1 Cel显著抑制MCF-7与T47D细胞的活力与增殖分别采用1、2、4、8、16 μmol/L 5个浓度Cel处理2株ER+乳腺癌细胞MCF-7与T47D 48 h,采用MTT法检测Cel对细胞活力的影响,结果表明,Cel呈剂量依赖性地抑制2株乳腺癌细胞的活力(P<0.05,P<0.01),且Cel抑制MCF-7与T47D细胞活力的IC50分别为3.47与3.07 μmol/L,见图 1A;此外,分别采用1、2、4 μmol/L 3个浓度Cel处理MCF-7与T47D细胞14 d,采用细胞克隆实验检测Cel对细胞增殖的影响,结果表明,Cel能明显抑制2株细胞的增殖,且具有浓度依赖性,见图 1B。
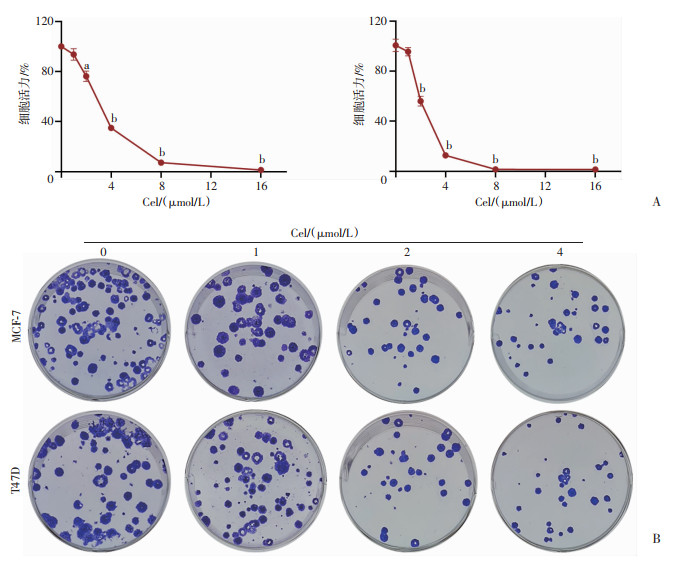
|
|
a: P<0.05,b: P<0.01,与对照组比较 A:MTT检测不同浓度Cel干预对MCF-7和T47D细胞活力的影响;B:细胞克隆检测不同浓度Cel干预对MCF-7和T47D细胞增殖能力的影响 图 1 Cel对MCF-7与T47D细胞活力与增殖的影响(x±s,n=3) |
2.2 Cel显著诱导MCF-7与T47D细胞凋亡
分别采用1、2、4 μmol/L Cel处理2株ER+乳腺癌细胞MCF-7与T47D 48 h,Western blot结果显示,与对照组相比,MCF-7与T47D细胞凋亡相关蛋白Cleaved PARP与BAX表达上调,BCL-2表达下调,且具有浓度依赖性(P<0.05),见图 2。

|
| A:Western blot检测不同浓度Cel干预对MCF-7和T47D细胞凋亡相关蛋白表达的影响;B:Cleaved PARP/PARP、BCL-2和BAX的蛋白相对表达 a: P<0.05,b: P<0.01,与对照组比较 图 2 Cel对凋亡相关蛋白表达的影响 |
2.3 Cel显著升高内质网应激相关基因的表达
分别采用1、2、4 μmol/L Cel处理2株ER+乳腺癌细胞MCF-7与T47D 48 h,RT-qPCR结果显示,与对照组相比,MCF-7与T47D细胞内质网应激相关基因IRE1α、ATF6、PERK、ATF4、CHOP、BIP水平显著升高,差异具有统计学意义(P<0.05,P<0.01),见图 3。
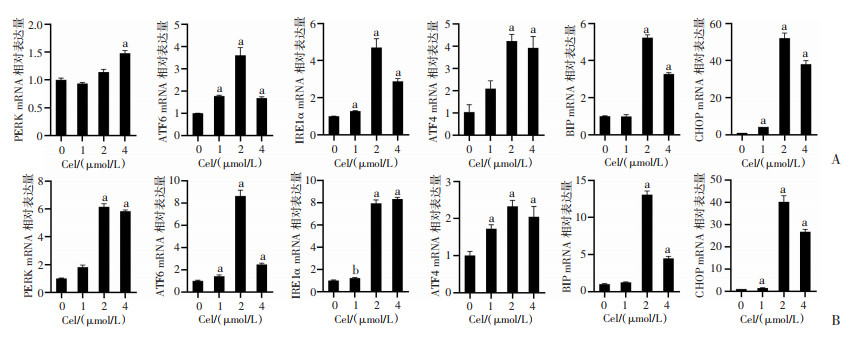
|
|
a: P<0.01,与对照组比较 A:RT-qPCR检测不同浓度Cel干预对MCF-7细胞内质网应激相关基因表达的影响;B:RT-qPCR检测不同浓度Cel干预对T47D细胞内质网应激相关基因表达的影响 图 3 Cel对内质网应激相关基因水平的影响(x±s,n=3) |
2.4 Cel显著升高内质网应激相关蛋白的表达
分别采用1、2、4 μmol/L Cel处理2株ER+乳腺癌细胞MCF-7与T47D 48 h,Western blot结果显示,与对照组相比,MCF-7与T47D细胞中内质网应激标志蛋白BIP表达升高,见图 4A;PERK通路相关蛋白p-PERK、p-eIF2α、ATF4、CHOP表达增加,见图 4B;IRE1α通路相关蛋白p-IRE1α、XBP1s表达增加,见图 4C;ATF6通路中的Cleaved ATF6水平增加,见图 4D。
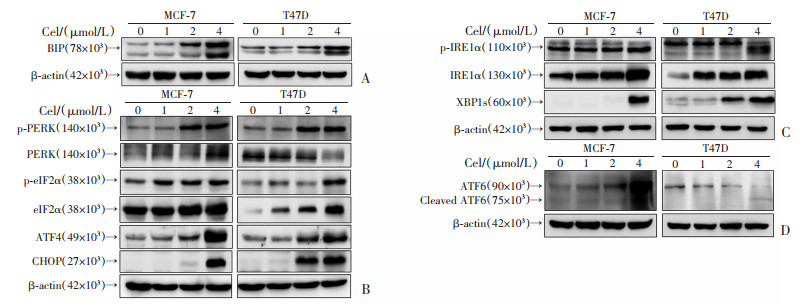
|
| A:Western blot检测不同浓度Cel干预对MCF-7和T47D细胞内质网应激标志蛋白BIP表达的影响;B:Western blot检测不同浓度Cel干预对MCF-7和T47D细胞内质网应激PERK通路相关蛋白表达的影响;C:Western blot检测不同浓度Cel干预对MCF-7和T47D细胞内质网应激IRE1α通路相关蛋白表达的影响;D:Western blot检测不同浓度Cel干预对MCF-7和T47D细胞内质网应激ATF6通路相关蛋白表达的影响 图 4 Cel对内质网应激相关蛋白表达的影响 |
2.5 Cel显著抑制MCF-7原位移植瘤的生长
裸鼠体内建立MCF-7原位移植瘤模型,连续给药21 d后,肿瘤生长曲线表明,Cel-H能够显著抑制裸鼠原位移植瘤的生长,差异有统计学意义(P<0.05),见图 5A、B;裸鼠体质量结果表明,与Control组相比,Cel-L与Cel-H对裸鼠体质量无明显影响,见图 5C。由此可见,Cel在体内可抑制乳腺癌肿瘤生长,且未见明显的毒性作用。
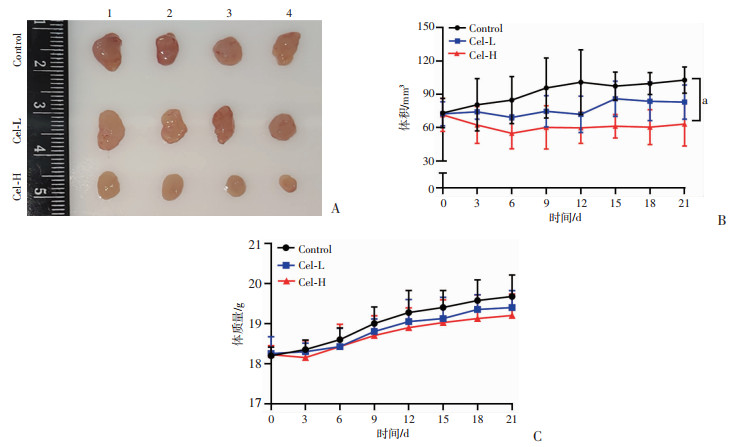
|
| A:各组MCF-7细胞裸鼠原位移植瘤;B:不同剂量Cel干预对MCF-7细胞裸鼠原位移植瘤生长的影响a: P<0.05;C:不同剂量Cel干预对裸鼠体质量的影响 图 5 Cel对MCF-7原位移植瘤生长的影响(x±s,n=4) |
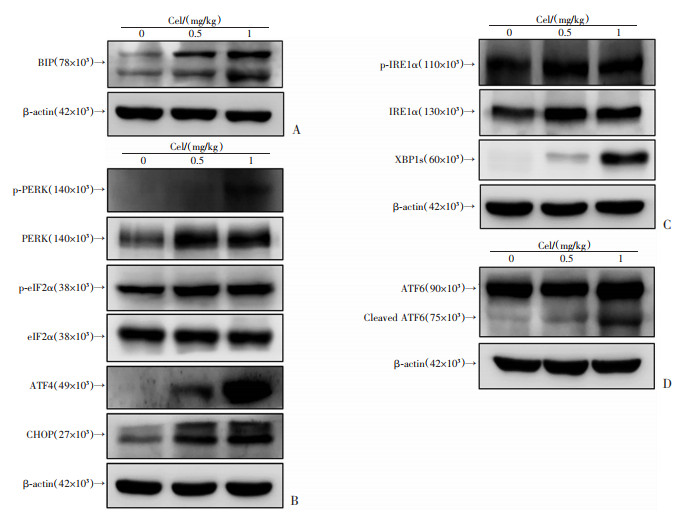
2.6 Cel显著升高MCF-7原位移植瘤内质网应激相关蛋白的表达
Western blot结果显示,与对照组相比,Cel-L与Cel-H处理组MCF-7原位移植瘤中内质网应激标志蛋白BIP表达升高,见图 6A;PERK通路相关蛋白p-PERK、p-eIF2α、ATF4、CHOP表达增加,见图 6B;IRE1α通路相关蛋白p-IRE1α与XBP1s表达增加,见图 6C;ATF6通路Cleaved ATF6水平增加,见图 6D。
|
| A:Western blot检测不同剂量Cel干预对裸鼠MCF-7细胞原位移植瘤内质网应激标志蛋白BIP表达的影响;B:Western blot检测不同剂量Cel干预对裸鼠MCF-7细胞原位移植瘤内质网应激PERK通路相关蛋白表达的影响;C:Western blot检测不同剂量Cel干预对裸鼠MCF-7细胞原位移植瘤内质网应激IRE1α通路相关蛋白表达的影响;D:Western blot检测不同剂量Cel干预对裸鼠MCF-7细胞原位移植瘤内质网应激ATF6通路相关蛋白表达的影响 图 6 Cel对MCF-7原位移植瘤内质网应激相关蛋白表达的影响 |
3 讨论
在最新的排名中,乳腺癌在全球女性恶性肿瘤中发病率排名第一,死亡率排名第五[14]。根据分子分型,乳腺癌可分为:①人类表皮生长因子受体2阳性(Her2+)乳腺癌;②雌激素受体/孕激素受体阳性(ER/PR+)乳腺癌;③三阴性乳腺癌(TNBC)[15]。其中,ER+乳腺癌约占所有乳腺癌亚型的70%。他莫昔芬耐药性仍然是ER+乳腺癌的临床问题。因此,急需寻找新一代的抗ER+乳腺癌药物,天然产物或许可以提供新的选择。
作为来自植物的活性成分,Cel具有显著的广谱抗癌活性,用于治疗多种癌症。研究报道,在肝癌、肺癌、骨髓瘤、黑色素瘤、神经胶质瘤等多种肿瘤细胞中,Cel能通过激活JNK信号传导通路,下调抗凋亡蛋白表达并抑制AKT的活性,从而诱导肿瘤细胞凋亡。Cel也能够通过下调Caspase-3蛋白表达,促进PARP蛋白裂解,诱导胃癌细胞MGC803细胞凋亡。另外,也有研究表明Cel能在肝癌细胞中诱导内质网应激反应,激活PERK与IRE1α信号通路,进而导致细胞凋亡[16]。本研究首先通过MTT与细胞克隆实验发现Cel对人乳腺癌细胞MCF-7、T47D活力与增殖具有抑制作用,同时Cel能显著升高凋亡相关蛋白Cleaved PARP与BAX表达,降低抗凋亡蛋白BCL-2表达,以上结果提示Cel能诱导ER+乳腺癌细胞凋亡发挥抗肿瘤的作用。
内质网应激是以内质网内腔中错误折叠或未折叠的蛋白质积累为特征的生理状态。这可能由多种刺激触发,包括细胞增殖率高、缺氧、营养缺乏和氧化还原稳态异常。内质网内腔中错误折叠或未折叠蛋白的存在由3种跨膜蛋白检测,即ATF6、IRE1α和PERK,这些蛋白质各自激活其自身的信号臂以诱导UPR[17-18]。研究表明,癌细胞可以通过PERK、IRE1α和ATF6 3个高度保守的信号臂来利用自然发生的内质网相关UPR,从而在不利条件下进行增殖和转移,并且诱导保护性抗肿瘤免疫[19]。但过度的内质网应激会导致细胞凋亡。有研究报道,在ER+乳腺癌细胞系MCF-7中,提高内质网应激可增加其对他莫昔芬等抗激素治疗的敏感性[20];内质网应激还能够抑制MCF-7乳腺癌细胞的迁移[21];此外,诱导内质网应激相关的IRE1-JNK-CHOP通路可显著诱导凋亡并抑制乳腺癌细胞增殖和体外克隆性生长[22]。因此,通过促进内质网应激介导的凋亡来提升抗ER+乳腺癌的效果可能是一种行之有效的策略。
PERK通路是UPR主要通路之一,在内质网应激激活后,可发生自磷酸化,然后磷酸化eIF2α,进一步激活ATF4,最终导致转录因子CHOP的上调,从而增加促凋亡蛋白Cleaved PARP与BAX的表达,抑制抗凋亡蛋白BCL-2的表达,并诱导细胞凋亡[22-25]。本研究结果表明,Cel处理后MCF-7与T47D细胞中内质网应激PERK通路相关基因PERK、ATF4、CHOP表达上调,PERK通路相关蛋白p-PERK、p-eIF2α、ATF4、CHOP表达增加。此外,有研究报道,持续的和未解决的内质网应激会导致持续的、高水平的IRE1α自磷酸化,以催化编码转录因子XBP1的mRNA非常规剪接,从而产生转录因子XBP1s,更重要的是,它激活了IRE1依赖性衰减(regulated IRE1- dependent decay,RIDD),RIDD既能通过降解编码未折叠蛋白相关的mRNA来促进细胞的存活,也能降解编码抗凋亡蛋白相关的mRNA来促进细胞的凋亡[26]。本研究证实,在2株ER+细胞中,Cel均能上调IRE1α基因的表达,并上调p-IRE1α与XBP1s蛋白的表达水平。ATF6是一种Ⅱ型跨膜蛋白,在检测到ER错误折叠的蛋白质后,ATF6穿梭到高尔基体,经历1位点和2位点蛋白酶的膜内切割,形成Cleaved ATF6,并释放p50 ATF6(N)转录因子,降低抗凋亡蛋白如Mcl-1的水平,最终促进细胞凋亡[27-28]。本研究结果也表明在2株细胞中,Cel能激活内质网应激ATF6信号通路,从而发挥抗ER+乳腺癌细胞的作用。最后,体内原位移植瘤结果也进一步证实,Cel能通过激活PERK、ATF6与IRE1α 3条信号通路抑制肿瘤生长。
综上所述,本研究发现Cel具有抑制人ER+乳腺癌MCF-7与T47D细胞增殖的作用,其机制可能与激活内质网应激信号通路从而诱导细胞凋亡有关。这为基于内质网应激信号研发抗ER+乳腺癌的药物奠定了一定的实验依据。
| [1] |
TACCONELLI E, CARRARA E, SAVOLDI A, et al. Discovery, research, and development of new antibiotics: the WHO priority list of antibiotic-resistant bacteria and tuberculosis[J]. Lancet Infect Dis, 2018, 18(3): 318-327. DOI:10.1016/S1473-3099(17)30753-3 |
| [2] |
MSHEIK Z S, NASSAR F J, CHAMANDI G, et al. MiR-126 decreases proliferation and mammosphere formation of MCF-7 and predicts prognosis of ER+ breast cancer[J]. Diagnostics (Basel), 2022, 12(3): 745. DOI:10.3390/diagnostics12030745 |
| [3] |
MICHMERHUIZEN A R, LERNER L M, PESCH A M, et al. Estrogen receptor inhibition mediates radiosensitization of ER-positive breast cancer models[J]. NPJ Breast Cancer, 2022, 8(1): 31. DOI:10.1038/s41523-022-00397-y |
| [4] |
TSOI H, YOU C P, LEUNG M H, et al. Targeting ribosome biogenesis to combat tamoxifen resistance in ER+ve breast cancer[J]. Cancers (Basel), 2022, 14(5): 1251. DOI:10.3390/cancers14051251 |
| [5] |
ZHANG Y J, HUANG S, YANG G, et al. The role of miRNAs during endoplasmic reticulum stress induced apoptosis in digestive cancer[J]. J Cancer, 2021, 12(22): 6787-6795. DOI:10.7150/jca.62352 |
| [6] |
WANG M, KAUFMAN R J. Protein misfolding in the endoplasmic reticulum as a conduit to human disease[J]. Nature, 2016, 529(7586): 326-335. DOI:10.1038/nature17041 |
| [7] |
CAO S L, TANG J Y, HUANG Y C, et al. The road of solid tumor survival: from drug-induced endoplasmic reticulum stress to drug resistance[J]. Front Mol Biosci, 2021, 8: 620514. DOI:10.3389/fmolb.2021.620514 |
| [8] |
MARROCCO V, TRAN T, ZHU S Y, et al. A small molecule UPR modulator for diabetes identified by high throughput screening[J]. Acta Pharm Sin B, 2021, 11(12): 3983-3993. DOI:10.1016/j.apsb.2021.05.018 |
| [9] |
MARCINIAK S J. Endoplasmic reticulum stress: a key player in human disease[J]. FEBS J, 2019, 286(2): 228-231. DOI:10.1111/febs.14740 |
| [10] |
WANG F Q, YAO S L, XIA H F. SIRT1 is a key regulatory target for the treatment of the endoplasmic reticulum stress-related organ damage[J]. Biomed Pharmacother, 2020, 130: 110601. DOI:10.1016/j.biopha.2020.110601 |
| [11] |
OU G X, JIANG X Y, GAO A, et al. Celastrol inhibits canine mammary tumor cells by inducing apoptosis via the caspase pathway[J]. Front Vet Sci, 2021, 8: 801407. DOI:10.3389/fvets.2021.801407 |
| [12] |
KANNAIYAN R, SHANMUGAM M K, SETHI G. Molecular targets of celastrol derived from Thunder of God Vine: potential role in the treatment of inflammatory disorders and cancer[J]. Cancer Lett, 2011, 303(1): 9-20. DOI:10.1016/j.canlet.2010.10.025 |
| [13] |
LI X L, ZHU G B, YAO X T, et al. Celastrol induces ubiquitin-dependent degradation of mTOR in breast cancer cells[J]. OncoTargets Ther, 2018, 11: 8977-8985. DOI:10.2147/OTT.S187315 |
| [14] |
GAO W L, NIU L, CHEN W L, et al. Integrative analysis of the expression levels and prognostic values for NEK family members in breast cancer[J]. Front Genet, 2022, 13: 798170. DOI:10.3389/fgene.2022.798170 |
| [15] |
ODLE T G. Precision medicine in breast cancer[J]. Radiol Technol, 2017, 88(4): 401M-421M. |
| [16] |
REN B, LIU H, GAO H, et al. Celastrol induces apoptosis in hepatocellular carcinoma cells via targeting ER-stress/UPR[J]. Oncotarget, 2017, 8(54): 93039-93050. DOI:10.18632/oncotarget.21750 |
| [17] |
LUNA-MARCO C, UBINK A, KOPSIDA M, et al. Endoplasmic reticulum stress and metabolism in hepatocellular carcinoma[J]. Am J Pathol, 2022, S0002-S9440(22): 00322-4. DOI:10.1016/j.ajpath.2022.09.012 |
| [18] |
DE LA CALLE C M, SHEE K, YANG H, et al. The endoplasmic reticulum stress response in prostate cancer[J]. Nat Rev Urol, 2022, 19(12): 708-726. DOI:10.1038/s41585-022-00649-3 |
| [19] |
SALVAGNO C, MANDULA J K, RODRIGUEZ P C, et al. Decoding endoplasmic reticulum stress signals in cancer cells and antitumor immunity[J]. Trends Cancer, 2022, 8(11): 930-943. DOI:10.1016/j.trecan.2022.06.006 |
| [20] |
JIANG W X, CHEN L, GUO X, et al. Combating multidrug resistance and metastasis of breast cancer by endoplasmic reticulum stress and cell-nucleus penetration enhanced immunochemotherapy[J]. Theranostics, 2022, 12(6): 2987-3006. DOI:10.7150/thno.71693 |
| [21] |
ZHANG Y M, LIAO S C, FAN W, et al. Tunicamycin-induced ER stress regulates chemokine CCL5 expression and secretion via STAT3 followed by decreased transmigration of MCF-7 breast cancer cells[J]. Oncol Rep, 2014, 32(6): 2769-2776. DOI:10.3892/or.2014.3479 |
| [22] |
CHOI Y K, KANG J I, HAN S, et al. L-ascorbic acid inhibits breast cancer growth by inducing IRE/JNK/CHOP-related endoplasmic reticulum stress-mediated p62/SQSTM1 accumulation in the nucleus[J]. Nutrients, 2020, 12(5): 1351. DOI:10.3390/nu12051351 |
| [23] |
MARCINIAK S J, YUN C Y, OYADOMARI S, et al. CHOP induces death by promoting protein synthesis and oxidation in the stressed endoplasmic reticulum[J]. Genes Dev, 2004, 18(24): 3066-3077. DOI:10.1101/gad.1250704 |
| [24] |
CONNOR J H, WEISER D C, LI S, et al. Growth arrest and DNA damage-inducible protein GADD34 assembles a novel signaling complex containing protein phosphatase 1 and inhibitor 1[J]. Mol Cell Biol, 2001, 21(20): 6841-6850. DOI:10.1128/MCB.21.20.6841-6850.2001 |
| [25] |
CULLINAN S B, ZHANG D, HANNINK M, et al. Nrf2 is a direct PERK substrate and effector of PERK-dependent cell survival[J]. Mol Cell Biol, 2003, 23(20): 7198-7209. DOI:10.1128/MCB.23.20.7198-7209.2003 |
| [26] |
OAKES S A. Endoplasmic reticulum stress signaling in cancer cells[J]. Am J Pathol, 2020, 190(5): 934-946. DOI:10.1016/j.ajpath.2020.01.010 |
| [27] |
YE J, RAWSON R B, KOMURO R, et al. ER stress induces cleavage of membrane-bound ATF6 by the same proteases that process SREBPs[J]. Mol Cell, 2000, 6(6): 1355-1364. DOI:10.1016/s1097-2765(00)00133-7 |
| [28] |
MORISHIMA N, NAKANISHI K, NAKANO A. Activating transcription factor-6 (ATF6) mediates apoptosis with reduction of myeloid cell leukemia sequence 1 (Mcl-1) protein via induction of WW domain binding protein 1[J]. J Biol Chem, 2011, 286(40): 35227-35235. DOI:10.1074/jbc.M111.233502 |




