主动脉带瓣人工血管置换(Bentall)手术是BENTALL和DE BONO在1968年首次描述的,用于治疗合并主动脉瓣病变的主动脉根部疾病,在完全置换升主动脉和主动脉瓣膜的同时,移植左右两侧冠状动脉,达到根治此类疾病的目的。经过众多心外科医师几十年的不懈努力和改进,Bentall手术已成为治疗累及主动脉根部疾病的经典治疗策略,并且取得了良好的治疗效果[1]。随着近年来我国心脏手术的普及,既往主动脉瓣和主动脉手术后因为主动脉根部病变需要再次手术的患者越来越多,再次手术技术难度大、手术风险高、死亡率高[2]。本文总结了我科在心脏、大血管术后因为主动脉根部病变行再次Bentall手术患者的围手术期及随访资料,探讨再次Bentall手术的安全性,现报告如下。
1 资料与方法 1.1 一般资料本研究通过陆军军医大学第二附属医院伦理委员会审查(批件号:2023-新技术第104-01)。收集2010年6月至2022年4月我科接受再次Bentall手术的患者围手术期、随访期间的病历资料,共46例,包含急诊手术2例。其中男性35例,女性11例,年龄(43.37±12.79)岁,距上一次心脏手术(4.96±6.76)年,术前体质量指数(body mass index,BMI)(21.69±3.76) kg/m2。其中合并高血压9例、合并糖尿病1例、合并COPD 3例、术前卒中病史2例、冠心病病史3例、合并心律失常21例(其中窦性心动过速2例、阵发性房性心动过速1例、心房扑动2例、心房颤动1例、完全性左束支传导阻滞3例、完全性右束支传导阻滞4例、不定型室内传导阻滞1例、一度房室传导阻滞4例、三度房室传导阻滞3例),见表 1。术前窦部直径(44.16±13.45)mm、升主动脉直径(48.89±19.59)mm、主动脉瓣反流面积(6.72±6.41)cm2。
| 临床资料 | 数据 |
| 男性 | 35(76.09) |
| 年龄/岁 | 43.37±12.79 |
| 距上次手术时间/年 | 4.96±6.76 |
| 高血压 | 9(19.57) |
| 糖尿病 | 1(2.17) |
| 慢性阻塞性肺部(COPD) | 3(6.52) |
| 卒中病史 | 2(4.35) |
| 冠心病 | 3(6.52) |
| 心律失常 | 21(45.65) |
| 窦性心动过速 | 2(4.35) |
| 阵发性房性心动过速 | 1(2.17) |
| 心房扑动 | 2(4.35) |
| 心房颤动 | 1(2.17) |
| 完全性左束支传导阻滞 | 3(6.52) |
| 完全性右束支传导阻滞 | 4(8.70) |
| 不定型室内传导阻滞 | 1(2.17) |
| 一度房室传导阻滞 | 4(8.70) |
| 三度房室传导阻滞 | 3(6.52) |
1.2 手术方式
本组患者较为年轻,为减少再次手术风险,并结合患者自身需求,46例患者均置换机械主动脉瓣。术中参考患者体表面积、瓣环、流出道直径等因素选择足够大小的人工主动脉瓣,其中选择25号瓣膜21例、23号瓣膜14例、21号瓣膜9例、22号瓣膜1例、19号瓣膜1例。根据各自病情需要同期合并行其他心脏手术情况见表 2。
| 手术方式 | 例数(%) |
| 室间隔穿孔修补术 | 1(2.17) |
| 冠状动脉旁路移植术 | 3(6.52) |
| 二尖瓣置换术 | 4(8.70) |
| 三尖瓣成形术 | 4(8.70) |
| 二尖瓣瓣周漏修补 | 1(2.17) |
| 主动脉瓣下狭窄切除术 | 1(2.17) |
| 主动脉-肺动脉瘘修补 | 1(2.17) |
| 孙氏手术 | 4(8.70) |
| IABP置入术 | 1(2.17) |
| 合计 | 19(41.30) |
1.3 手术方法
46例患者中,6例为腔内隔绝术后患者采用常规的主动脉、右心房插管建立体外循环;其余40例患者均股动脉、股静脉插管建立体外循环,胸骨正中切口进胸。
分离心脏粘连,并在上腔静脉插管,若主动脉瓣无反流、升主动脉无夹层或主动脉瓣无瓣周漏等情况,使用主动脉根部灌注心肌保护液;若有上述情况,则采用冠状动脉窦口直接灌注或冠状静脉窦口逆行灌注心肌保护液,手术过程间断给予心肌保护液灌注保护心肌。术中将最低体温维持在24~28 ℃。
彻底游离主动脉根部,剪除主动脉瓣或人工主动脉瓣,彻底清除上次手术移植物或根部脓肿(图 1A),若合并瓣环毁损的病例先行瓣环重建,闭合主动脉根部残腔。本组患者均行改良Bentall手术,冠状动脉吻合全部为“纽扣”直接吻合。
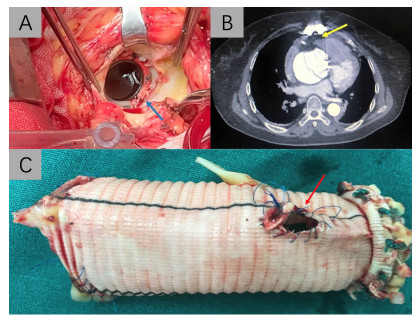
|
|
↑:示观察点 A:人工主动脉瓣置换术后感染性心内膜炎再次手术的瓣周脓肿伴瓣周漏;B:人工主动脉瓣置换术后急性主动脉A型夹层患者的右心和胸骨粘连紧密;C:再次Bentall手术患者体内取出的带瓣人工血管与冠脉吻合口撕脱 图 1 主动脉根部病变患者再次Bentall手术术前及术中术野及影像诊断资料 |
1.4 统计学分析
分析比较不同病因组生存率,主要结局事件为患者死亡。使用Excel登记数据,使用SPSS 19.0软件进行数据统计分析。计量资料用x±s表示,组间比较使用方差分析;等级资料比较使用秩和检验,Kaplan-meier生存分析比较各病因组生存率,P < 0.05表示差异有统计学意义。
2 结果 2.1 基线资料本组病例中首次手术的方式包括人工主动脉瓣置换、先心病矫治、升主动脉成形、经股动脉人工主动脉瓣置换(transcatheter aortic valve implantation,TAVI)等,具体见表 3。本组病例中再次手术的病因:瓣周漏、人工主动脉瓣感染性心内膜炎、其他原因瓣周漏等,见表 4。
| 手术方式 | 例数(%) |
| 人工主动脉瓣置换术(包含同期行二尖瓣、三尖瓣手术) | 24(52.17) |
| 先心病矫治术 | 7(15.22) |
| 瓦氏窦瘤修补术 | 2(4.35) |
| 冠状动脉漏修补术 | 1(2.17) |
| 室间隔缺损修补术 | 2(4.35) |
| 动脉导管未闭结扎术 | 2(4.35) |
| 升主动脉成形术 | 1(2.17) |
| Bentall术 | 4(8.70) |
| 主动脉瓣置换合并冠脉搭桥手术 | 2(4.35) |
| 主动脉B型夹层腔内隔绝术 | 6(13.04) |
| 二尖瓣成形术 | 1(2.17) |
| TAVI | 1(2.17) |
| 合计 | 46(100.00) |
| 再次手术病因 | 例数(%) |
| 主动脉根部动脉瘤或升主动脉瘤 | 12(26.09) |
| 瓣周漏 | 24(52.17) |
| 白塞氏病 | 12(26.09) |
| 人工主动脉瓣感染性心内膜炎 | 9(19.57) |
| 其他原因 | 3(6.52) |
| 主动脉A型夹层动脉瘤 | 10(21.74) |
| 合计 | 46(100.00) |
9例感染性心内膜炎的致病菌分别为:曲霉菌2例、高原芽孢杆菌1例、粪肠球菌1例、链球菌5例(星座链球菌1例、表皮葡萄球菌2例、缓症链球菌1例、咽峡炎链球菌1)。
2.2 围手术期临床结果本组患者体外循环时间(257.22±55.28)min,主动脉阻断时间(161.11±32.70)min,术中自动复跳40例(86.96%)、电击复跳6例(13.04%)。术后有创呼吸机辅助时长(48.88±49.03)min;无创呼吸机使用13例(28.26%)。术后早期再次开胸探查止血2例(4.35%),分别发生在术后当天和术后第12天。术后住ICU时间(5.43±4.00)d,术后住院时间(21.63±16.10)d。住院期间并发症发生情况:心跳骤停4例、急性肾功能衰竭4例、消化道出血2例、新发三度房室传导阻滞2例。术后住院死亡3例(6.52%):1例于术后当日死于低心输出量综合征、1例于术后第3天死于脑疝、1例术后第24天死于心跳骤停。
2.3 临床随访结果本组患者采用门诊随访和电话随访相结合的方式随访(5.03±3.27)年,失访5例,完整随访43例。对数秩检验分析生存率结果显示:心内膜炎组(62.3%)、白塞氏病组(70.0%)远期生存率明显低于其他原因组(80.0%),差异具有统计学意义(χ2=5.791,P=0.016,图 2)。
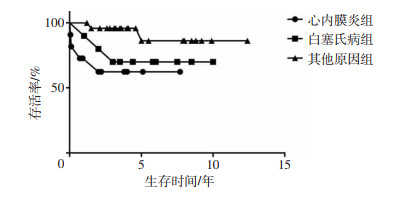
|
| 图 2 不同病因主动脉根部病变患者再次Bentall手术后生存曲线 |
3 讨论
Bentall手术是治疗主动脉瓣病变合并根部扩张的首选治疗方法,主要治疗包括与A型急性主动脉夹层和马凡综合征等涉及主动脉根部等的病变。研究表明:高龄、心功能三级以下、再次手术、急诊手术、同期二尖瓣置换、同期冠状动脉旁路移植术是该手术的独立死亡危险因素,10年生存率约为86.1%[3],可见Bentall手术是一个成熟、可靠的技术。
3.1 再次手术的插管方案有报道再次手术行Bentall手术的患者死亡率高达18%,如果出现致命性大出血的患者死亡率则高达47%[4]。本研究中,术前使用CT对心脏、主动脉和胸骨粘连的位置及严重程度进行评估(图 1B),除6例腔内隔绝术后患者外(上次手术未开胸),均常规采用股动静脉体外循环,减少心脏容量后,开胸使用胸骨摆动锯,未发生严重心脏破裂及大出血,在游离好股动脉静脉,使用5-0 Prolene线做荷包缝合,然后常规行股动静脉插管,未出现严重的出血及肢体缺血、血管狭窄等并发症,说明该方法是一种针对再次心脏手术的安全的体外循环插管方法。
3.2 对主动脉瓣膜置换手术方案选择的启示在本组患者中,第一次手术方式中主动脉瓣置换有24(52.17%)例,由此可见,当我们在临床上遇到需要手术的主动脉瓣病变患者时,应该更加关注是否合并主动脉根部病变,比如在主动脉瓣二叶畸形、马凡综合征、白塞氏病等特殊患者手术的时候,应该更加慎重选择手术方式,部分患者仅行主动脉瓣置换手术可能无法完全解决患者的病变情况,从而增加患者再次手术概率[5]。那么,对于那些主动脉根部病变处于临界水平的病例,我们在选择手术方案是否可以更加积极:直接选择Bentall手术?当然这种选择是建立在较丰富的主动脉根部手术经验之上,有荟萃分析比较了718家医院的1 276名外科医师进行主动脉根部动脉瘤手术情况,结果显示医师的年手术量、医院的病例量与患者的死亡率、并发症发生率成反比[6]。
3.3 微创介入手术给外科带来的挑战本组有1例TAVI术中形成急性主动脉夹层的患者,急诊行Bentall和主动脉全弓替换手术。近年来TAVI成为心血管科一个重要的热点方向,我们应该认识到TAVI虽是微创手术,但也是高风险手术,应该严格把握手术适应证。本组患者中有6例是B型夹层腔内隔绝手术后主动脉根部出现动脉瘤或夹层再次手术。有研究表明[7],B型夹层手术术中使用支架数量≥2枚、手术时长≥2 h患者死亡率明显升高。随着心脏瓣膜和大血管微创介入的兴起,所带来的主动脉根部并发症也对心脏外科医师提出了新的挑战。
3.4 改良Bentall手术可以避免经典Bentall手术带来的后遗症经典Bentall手术为了解决主动脉根部出血的问题,形成了以主动脉壁包裹主动脉根部并分流至右房的方法,但是同时也带来了心内分流、血栓甚至肺栓塞的风险[8]。如图 1C,该例患者第1次手术行经典Bentall手术,但是由于主动脉壁和人工血管之间距离过远,导致吻合口张力过高,最终冠状动脉吻合口撕脱,主动脉根部形成巨大假性动脉瘤而再次手术;再次手术时,为患者行改良Bentall手术(“裸Bentall”,即仅用主动脉根部少量瘤壁袖状包裹主动脉根部),取得了良好的临床效果,本组患者未出现无法控制的根部出血情况。说明采用“纽扣技术”的改良Bentall手术对于主动脉根部置换术是安全有效的[3]。
3.5 主动脉根部重建在感染性主动脉根部疾病的Bentall手术中非常重要主动脉根部的感染对心脏外科医师提出了很高的挑战,因为它们不容易根除,且常合并主动脉瓣大量反流或严重的瓣周漏,特别是移植物感染的时候,单纯药物治疗失败率为43%,而在Bentall手术后移植物感染中,30 d死亡率为46%[9]。1项对Bentall手术相关心内膜炎患者的研究表明,最常见的病原体是金黄色葡萄球菌(22%) 和链球菌(14%)。再次手术中位间隔30个月(1~221个月),住院死亡率为15%,术后并发肾衰竭(19%)、大出血(14%)、呼吸衰竭(14%)、败血症(11%)和多器官衰竭(8%),术后心内膜炎复发率为4.8%[10]。在本组手术患者中,有9例为感染性心内膜炎[其中8例患者为人工主动脉瓣置换术后(图 1A),1例为Bentall术后],术中在清除移植物后,彻底清除坏死和感染组织,消灭脓腔,在主动脉根部严重毁损时,行主动脉根部重建后再行Bentall手术,重建主动脉根部时可采用心包补片修补根部缺损,或者在缝合主动脉带瓣管道时在主动脉根部内衬心包条,必须达到消灭残腔的效果,减少术后感染的风险。但是缝合的时候一定要特别注意避开传导束,避免出现医源性三度房室传导阻滞。术后根据药敏结果输注足够疗程的抗生素,没有患者复发感染。在致病菌方面,最多的为链球菌5例(55.55%)。最终,这9例患者中有1例在住院期间死亡、1例在随访期间死亡(术后9个月死于严重心力衰竭),可见感染性疾病导致的主动脉根部再次手术死亡率明显高于其他的再次手术患者(22.22% vs 5.41%,P < 0.05)。
3.6 感染性心内膜炎和白塞氏病患者主动脉根部病变的诊断和治疗此类患者主动脉基本会面临主动脉根部脓肿、损毁的情况,在行Bentall之前需要行主动脉根部重建,增加手术难度和风险、增加术后死亡率,在本组患者中,心内膜炎组(62.3%)、白塞氏病组(70.0%)远期生存率明显低于其余病因组(80.0%),差异具有统计学意义(P<0.05)。通过经胸/经食管超声心动图(TTE/TOE),对主动脉根部脓肿,特别是对人工主动脉瓣瓣周脓肿早期诊断往往是比较困难的,使用18F-氟脱氧葡萄糖-正电子发射断层扫描(FDG-PET)可能是一个较为敏感和精确的办法,以利于早期发现和治疗该类疾病[11]。GOMES等[12]的研究为治疗提供了新的思路:使用无支架生物假体用于治疗主动脉瓣心内膜炎合并瓣周脓肿及左室流出道破坏的患者。该方法具有很高的完全清创成功率,很容易获得,并且与同源移植物修复手术这个金标准的方法一样,临床效果满意。
3.7 主动脉根部再行Bentall手术房室传导阻滞发生率较高本组患者中,术前4例一度房室传导阻滞中2例为人工主动脉瓣感染性心内膜炎患者;3例三度房室传导阻滞中2例为人工主动脉瓣感染性心内膜炎患者;术后新发2例患者新发三度房室传导阻滞中2例均为人工主动脉瓣感染性心内膜炎患者,可见人工主动脉瓣感染性心内膜炎患者术前一度房室传导阻滞、术前三度房室传导阻滞和术后新发三度房室传导阻滞比例较非感染性心内膜炎患者高(22.22% vs 5.41%,P < 0.05;22.22% vs 2.70%,P < 0.05;25% vs 0,P < 0.05)。分析原因应为主动脉瓣感染性心内膜炎造成主动脉根部脓肿,破坏心脏传导系统,而再次手术时,为了避免感染复发需要充分清除脓肿及坏死组织,甚至需要行主动脉根部重建,造成心脏传导系统的进一步破坏,导致术后新发三度房室传导阻滞。心脏手术后的传导障碍是常见的并发症,永久性起搏器依赖的发生率高达5%,Bentall手术后起搏器植入的30 d发生率为7.7%,10年永久性起搏器的发生率约为21%,永久性起搏器依赖的危险因素包括:年龄>75岁、术前心脏传导障碍、主动脉瓣狭窄、感染性心内膜炎、三尖瓣重建、脓毒症和非心脏再手术[13],永久性起搏器依赖是Bentall手术后短期和长期随访中常见的并发症,所以有必要在短期和长期随访中筛查心脏传导阻滞。跟本组研究发现的结论类似的是,很多研究表明主动脉根部脓肿的患者发生三度房室传导阻滞的概率明显高于其他人工主动脉瓣置换的患者[14]。
KASKAR等[15]对首次和再次Bentall手术患者进行对比研究,在倾向评分匹配之前,接受二次Bentall手术的患者术前情况较差,如较高的EuroSCOREⅡ评分、医院死亡率更高,但是在倾向评分匹配后,EuroSCOREⅡ评分和住院死亡率、并发症无显著差异,再次开胸手术不能被确定为术后死亡率或发病率的独立预测指标。KODA等[16]对再次Bentall手术的研究也得到类似的结论,10年第3次主动脉根部相关手术的豁免率(90.8±4.8)%,再手术后的10年精算生存率为(67.3±6.6)%。虽然在感染性心内膜炎再次手术患者中死亡率、传导阻滞发生率等偏高,但是总体来说本组再次行Bentall手术的患者还是得到了比较理想的临床结果。所以再次Bentall手术在主动脉根部病变中的应用是安全有效的,但病因为感染性心内膜炎、白塞氏病的患者生存率有待提高,使用同种移植物或无支架生物假体治疗该类患者可能是较好的选择;也有待下一步行前瞻性大宗病例临床研究进一步探索再次Bentall手术在主动脉根部病变中的应用。
| [1] |
崔金帅, 晁文晗, 高秉仁, 等. 主动脉根部疾病手术选择的研究进展[J]. 中国胸心血管外科临床杂志, 2019, 26(5): 504-508. CUI J S, CHAO W H, GAO B R, et al. Progress in surgical selection of aortic root diseases[J]. Chin J Clin Thorac Cardiovasc Surg, 2019, 26(5): 504-508. |
| [2] |
SONG L C, HE G B, IMIN E, et al. "Chimney" bentall procedure in the small aortic root after prior aortic valve operations[J]. Ann Thorac Surg, 2020, 110(3): e241-e243. |
| [3] |
VAN H D, PHAM T B, CHAU C L, et al. Modified Bentall procedure: a 15-year single-center clinical experience[J]. Asian Cardiovasc Thorac Ann, 2022, 30(7): 779-787. |
| [4] |
陆杰, 薛清, 唐杨烽, 等. 心脏术后再次行主动脉根部置换的临床分析[J]. 中国胸心血管外科临床杂志, 2021, 28(1): 99-103. LU J, XUE Q, TANG Y F, et al. Clinical analysis of redo aortic root replacement after cardiac surgery[J]. Chin J Clin Thorac Cardiovasc Surg, 2021, 28(1): 99-103. |
| [5] |
DENG J Y, ZHONG Q J. Clinical analysis of redo aortic root replacement after cardiac surgery: a retrospective study[J]. J Cardiothorac Surg, 2021, 16(1): 202. |
| [6] |
BROWN C, HAN J, SPERRY A E, et al. The impact of surgeon and hospital procedural volume on outcomes after aortic root replacement in the United States[J]. J Card Surg, 2021, 36(8): 2669-2676. |
| [7] |
李高山, 潘文旭, 高智春, 等. Stanford B型主动脉夹层患者TEVAR术后发生植入后综合征的危险因素[J]. 陆军军医大学学报, 2023, 45(20): 2149-2158. LI G S, PAN W X, GAO Z C, et al. Risk factors for TEVAR-related post-implantation syndrome in Stanford type B aortic dissection patients[J]. J Army Med Univ, 2023, 45(20): 2149-2158. |
| [8] |
范舒雅, 畅怡, 郭宏伟, 等. 主动脉根部袖状包裹技术在改良Bentall手术中应用的近期疗效[J]. 中华胸心血管外科杂志, 2021, 37(9): 550-552. FAN S Y, CHANG Y, GUO H W, et al. Short-term outcomes of cuff wrapping technique using remnant aortic wall in modified bentall procedure[J]. Chin J Thorac Cardiovasc Surg, 2021, 37(9): 550-552. |
| [9] |
HARKY A, OTHMAN A, NISTAL DE PAZ C, et al. Systematic approach to diagnosis and management of infected prosthetic grafts in the proximal aorta[J]. J Card Surg, 2021, 36(1): 145-152. |
| [10] |
SPONGA S, DI MAURO M, MALVINDI P G, et al. Surgery for Bentall endocarditis: short- and midterm outcomes from a multicentre registry[J]. Eur J Cardiothorac Surg, 2020, 58(4): 839-846. |
| [11] |
ZOGG C K, AVESTA A, BONDE P N, et al. Echocardiography fails to detect an extensive aortic root abscess in a patient with infective endocarditis: a case report[J]. Eur Heart J Case Rep, 2022, 6(2): ytac032. |
| [12] |
GOMES A, JAINANDUNSING J S, VAN ASSEN S, et al. A standardized approach to treat complex aortic valve endocarditis: a case series[J]. J Cardiothorac Surg, 2018, 13(1): 32. |
| [13] |
KLUCKNER M, ENZMANN F, GRUBER L, et al. Risk of permanent pacemaker implantation following bentall operation[J]. Semin Thorac Cardiovasc Surg, 2023, 35(4): 639-646. |
| [14] |
BRADEL L, KASHYAP K, JABBOUR F, et al. The infectious tale of aerococcal aortic endocarditis: cardiac pacing in acute aortic insufficiency with complete heart block as a bridge to aortic valve replacement[J]. Cureus, 2021, 13(9): e17921. |
| [15] |
KASKAR A, BOHRA D V, RAO K R, et al. Primary or secondary Bentall-De Bono procedure: are the outcomes worse?[J]. Asian Cardiovasc Thorac Ann, 2019, 27(4): 271-277. |
| [16] |
KODA Y, OKADA K. Clinical outcomes of aortic root reoperation[J]. Kyobu Geka, 2021, 74(10): 763-769. |




