食管胃底静脉曲张破裂出血(esophagogastric variceal bleeding,EGVB)是肝硬化门脉高压常见并发症,30%~40%的肝硬化患者全病程中会出现EGVB[1],出血所致6周病死率达到15%~20%[2],有研究表明约60%的肝硬化患者存在肝硬化性心肌病[3]。肝硬化可通过脂多糖(LPS)、内源性大麻素、β肾上腺能神经、一氧化氮(NO)、白细胞介素-1β(IL-1β)等多种机制影响心脏生理功能,导致肝硬化性心肌病[4]。通常情况下,此类患者处于代偿状态无心功能不全的表现,仅部分患者超声心动图等检查发现心脏舒张和收缩功能异常。而当机体受到外界刺激如出血、感染、外伤等出现应激反应时,较无肝硬化性心肌病的患者,更易出现心功能失代偿和心肌损伤。研究报道,消化道出血合并心肌梗死病死率达62%,远高于单纯消化道出血[5]。因此,早期识别肝硬化合并心肌损伤的患者并对其心肌损伤尽早干预治疗能极大降低其病死率。本研究旨在建立EGVB患者并发心肌损伤的预测模型,为该类患者的临床诊疗提供帮助。
1 资料与方法 1.1 研究对象本研究采用病例-对照研究设计方案。收集2021年5月至2022年7月期间武汉大学人民医院收治的235例肝硬化EGVB患者的病历资料。纳入标准:①年龄≥18岁;②肝硬化门脉高压史;③因消化道出血入院;④内镜下证实EGVB;⑤住院资料完整(基本信息、检验检查结果,医疗处理)。排除标准:基础资料及住院资料不完整;根据患者心肌肌钙蛋白I(cardiac troponin I, cTnI) 检测值将其分成心肌损伤组(cTnI≥ 0.04 ng/mL,n=46)和无心肌损伤组(cTnI<0.04 ng/mL,n=189)[6]。
1.2 研究方法根据近5年有关肝硬化EGVB伴发心肌损伤危险因素相关文献,结合EGVB和心肌损伤相关的临床特征,纳入以下观察指标:①基本信息:年龄、性别、肝硬化病因、基础疾病史(包括冠心病、高血压、糖尿病、肾病病史)、出血史、黑便、呕血、腹水、休克指数(脉搏/收缩压)。②实验室检查:cTnI、红细胞计数(RBC)、白细胞计数(WBC)、HCT、血红蛋白(Hb)、ALB、血小板计数(PLT)、ALT、AST、INR、肌酐(Cr)以及Na+、K+、Ca+、Cl+。③其他:输血史、是否紧急内镜、CP分级。采用单因素回归分析初步筛选EGVB合并心肌损伤的危险因素,再进行多因素回归分析筛选EGVB患者合并心肌损伤的独立危险因素,同时,将心肌损伤组中确诊心肌梗死的患者进行亚组分析。完成独立危险因素及联合模型的ROC曲线绘制。同时将危险因素与结局的关系用列线图形式表现,对模型的拟合优度进行分析,并且对模型进行内部验证。
1.3 统计学方法采用SPSS 26.0软件进行统计分析。符合正态分布的连续变量用x±s表示;不符合正态分布的连续变量用M(P25,P75)表示。计数资料以例数(构成比)表示。单因素分析时P<0.1的指标纳入二元Logistic回归进行多因素分析,心肌损伤与危险因素之间的关联通过优势比(OR)和95%CI量化,P<0.05且95%CI不包含1表示差异有统计学意义。各因素对心肌损伤的诊断效能通过ROC曲线及曲线下面积体现。危险因素与结局的关系用列线图形式表现,采用留一法进行内部验证。
2 结果 2.1 基线资料本研究共纳入235例患者,其中心肌损伤组46例和非心肌损伤组189例。纳入患者平均年龄62.68岁,心肌损伤组平均年龄66.62岁,非心肌损伤组平均年龄57.56岁,心肌损伤组中男性21例,女性25例,非心肌损伤组中男性138例子,女性51例。
2.2 单因素回归分析单因素回归分析发现年龄、性别、高血压、肾病、基础疾病史(包括冠心病、高血压、糖尿病、肾病病史)、呕血、HCT、白细胞升高(WBC>4×109/L)、ALT或AST上升(ALT>40 U/L、AST>40 U/L)、ALB、INR、内镜时间6 h内、CP分级在心肌损伤组与非心肌损伤组间差异有统计学意义(P<0.1,表 1)。
| 项目 | 心肌损伤组(n=46) | 非心肌损伤组(n=189) | B | P |
| 年龄/岁 | (66.62±8.75) | (57.56±11.24) | 1.09 | 0.012 |
| 性别 | 12.66 | 0.001 | ||
| 男 | 21(45.7) | 138(73.0) | ||
| 女 | 25(54.3) | 51(27.0) | ||
| 肝硬化病因 | 0.01 | 0.912 | ||
| 乙肝 | 25(54.3) | 101(53.4) | ||
| 非乙肝 | 21(45.7) | 88(46.6) | ||
| 既往病史 | ||||
| 冠心病 | 7(15.2) | 20(10.6) | 0.72 | 0.377 |
| 高血压 | 14(30.4) | 31(16.4) | 4.54 | 0.033 |
| 糖尿病 | 4(8.6) | 10(5.3) | 0.76 | 0.382 |
| 肾病 | 5(10.9) | 7(3.7) | 3.87 | 0.049 |
| 基础疾病史 | 27(55.1) | 55(29.1) | 14.26 | 0.001 |
| 出血史 | 21(45.7) | 98(51.4) | -1.32 | 0.875 |
| 临床表现 | ||||
| 黑便 | 25(59.1) | 90(47.6) | 0.67 | 0.413 |
| 呕血 | 36(78.2) | 123(65.1) | 2.93 | 0.087 |
| 腹水 | 6(13.1) | 12(6.3) | 2.34 | 0.126 |
| 休克指数(脉搏/收缩压) | 1.24(0.90,1.45) | 1.12(0.93,1.32) | 2.13 | 0.201 |
| RBC/(109/L) | 2.8(1.3,4.5) | 2.9(1.4,4.3) | 0.75 | 0.129 |
| Hb/(g/L) | 67.2(40.2,72.5) | 72.5(35.0,90.3) | 1.00 | 0.826 |
| HCT/% | 24.5(20.1,27.5) | 23.9(19.2,26.4) | 1.18 | 0.051 |
| PLT/(109/L) | 167.2(123.2,182.3) | 151.6(120.4,174.9) | 1.04 | 0.501 |
| 白细胞升高 | 9(19.6) | 20(10.6) | 2.76 | 0.100 |
| ALT或AST上升 | 11(23.9) | 21(11.1) | 5.16 | 0.023 |
| ALB/(g/L) | 22.2(19.1,24.5) | 30.2(25.1,33.5) | -0.70 | 0.001 |
| Cr/(μmol/L) | 85.2(67.9,103.4) | 80.2(59.9,99.4) | -1.08 | 0.273 |
| INR | 1.24(1.12,1.39) | 1.05(1.02,1.09) | 16.14 | 0.001 |
| Na+/(mmol/L) | 137.6 (134.2,139.9) | 139.5(137.3,140.6) | 0.97 | 0.392 |
| K+/(mmol/L) | 3.9(3.6,4.4) | 4.1(3.8,4.5) | -1.16 | 0.247 |
| Ca+/(mmol/L) | 1.9(1.7,2.1) | 2.0(1.9,2.1) | -1.58 | 0.114 |
| Cl+/(mmol/L) | 103.4(101.8,107.2) | 105.4(103.7,108.4) | -1.34 | 0.132 |
| 6 h内紧急内镜 | 17(37.0) | 123(65.1) | 12.15 | 0.001 |
| 输血 | 37(80.4) | 145(76.7) | 0.29 | 0.589 |
| CP分级(B+C) | 40(87.0) | 162(85.8) | 0.82 | 0.047 |
2.3 多因素回归分析
将上述13项变量(年龄、性别、高血压、肾病、基础疾病史、呕血、HCT、白细胞升高、ALT或AST上升、ALB、INR、内镜时间6 h内、CP分级)纳入多因素Logistic回归;考虑临床冠心病病史与患者心肌损伤的发生具有一定的关联,因此冠心病史也被纳入多因素回归分析中。通过对上述指标的多因素回归分析发现年龄、基础疾病史、ALB是EGVB患者并发心肌损伤的独立危险因素(P<0.05)。见表 2。
| 危险因素 | OR | 95%CI | P |
| INR | 2.250 | 0.020~2.704 | 0.009 |
| 性别 | 0.497 | 0.034~7.273 | 0.610 |
| 年龄 | 1.153 | 1.030~1.291 | 0.014 |
| 高血压 | 0.291 | 0.042~2.002 | 0.209 |
| 冠心病 | 0.157 | 0.018~1.358 | 0.093 |
| 肾病 | 0.154 | 0.021~1.117 | 0.064 |
| 基础疾病史 | 0.022 | 0.002~0.317 | 0.005 |
| 呕血 | 0.251 | 0.044~1.431 | 0.119 |
| 内镜处理时间 | 1.121 | 0.186~6.745 | 0.901 |
| HCT | 1.099 | 0.821~1.471 | 0.524 |
| 白细胞升高 | 0.391 | 0.004~35.785 | 0.684 |
| ALT、AST上升 | 0.017 | 0.001~0.536 | 0.071 |
| ALB | 0.449 | 0.241~0.837 | 0.012 |
| CP分级 | 0.153 | 0.005~4.385 | 0.273 |
2.4 ROC曲线及联合诊断模型
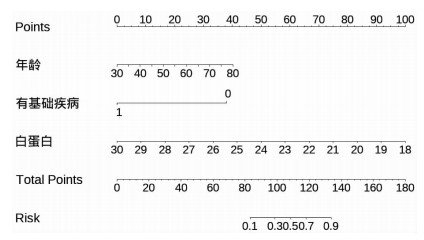
多因素分析显示年龄、基础疾病史、ALB水平是EGVB患者合并心肌损伤的独立危险因素(P<0.05),模型列线图见图 1。制作各独立因素及三者联合模型ROC曲线如图 2,各因素AUC及最佳截断值见表 3。预测模型Hosmer-Lemeshow检验:χ2=12.88,P=0.615,具有较高的拟合优度;采用留一法内部验证正确区分了86.4%的验证对象。
|
| 图 1 年龄、白蛋白、基础疾病史对肝硬化EGVB患者并发心肌损伤的预测模型列线图 |

|
| 图 2 年龄、白蛋白、基础疾病史对肝硬化EGVB患者并发心肌损伤的独立及联合模型的ROC曲线 |
| 特征 | AUC | 灵敏度 | 特异度 | 约登指数 | 最佳阈值 |
| 联合模型 | 0.82 | 0.609 | 0.942 | 0.550 | 0.299 |
| ALB | 0.71 | 0.630 | 0.725 | 0.355 | 23.628 |
| 基础疾病史 | 0.75 | 0.565 | 0.937 | 0.502 | 1.000 |
| 年龄 | 0.683 | 0.913 | 0.386 | 0.299 | 60.000 |
2.5 心肌梗死患者的亚组分析
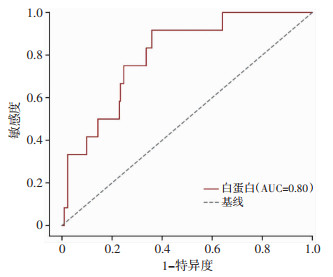
本研究235例患者中存在46例心肌损伤,其中12例患者诊断心肌梗死。将患者分为心肌梗死组(n=12)、非心肌梗死组(n=223),采用前述方法进行单因素、多因素回归分析,并绘制ROC曲线(图 3)。发现患者ALB水平是发生心肌梗死的独立危险因素,其曲线下面积AUC=0.80。
|
| 图 3 ALB预测肝硬化EGVB患者心肌梗死的ROC曲线 |
3 讨论
肝功能受损及门静脉压力升高是肝硬化失代偿期患者的主要病理生理变化,30%~40%的肝硬化患者在其全病程中会发生EGVB,约1/3肝硬化患者最终死于EGVB[7]。由于可能并发肝硬化性心肌病等,EGVB患者发生心肌损伤甚至心肌梗死的概率远高于其他消化道出血患者。研究表明合并急性心肌梗死会明显增加EGVB患者的病死率[5]。因此,建立有效的EGVB合并心肌损伤预测模型以甄别高危患者并早诊早治将有助于改善其预后。
本研究中,年龄是预测EGVB患者发生心肌损伤的独立危险因素,这可能与年龄是冠心病的危险因素相关。一项包含644 622例消化道出血患者的回顾性研究中,7 523例在3个月内发生心肌梗死,回归分析发现年龄是消化大出血患者继发心肌梗死的危险因素,同时在该研究中性别、肾脏疾病病史也是心肌梗死的危险因素,这与本研究的单因素回归分析结论相同[8]。本研究中年龄的最佳截断值为60岁,在另一项消化道出血并发心血管事件的危险因素研究中,年龄>65岁被认为是预测患者心血管事件发生的危险因素[9],与该研究不同的是本研究患者均有肝硬化这一基础疾病,提示肝硬化及肝硬化导致的肝硬化性心肌病等因素可能会提前风险年龄,但仍需要更大样本量的研究验证。
本研究对患者既往基础病史进行了独立及联合的预测分析,有研究报道高血压、肾功能不全是心肌损伤的预测指标[10]。而本研究中,有基础病史是患者并发心肌损伤的保护因素(OR<1),这与以往的研究结论不符,原因可能是本研究的患者均有肝硬化这一基础疾病,这可能会缩小这两类患者间的差距,同时本研究为回顾性研究,可能存在一定的选择偏倚。当肝硬化合并其他基础疾病时,对心血管系统的影响尚需更多的基础及临床研究证实。
本研究发现ALB水平是预测患者心肌损伤的独立危险因素。ALB占血浆蛋白50%以上,在维持血浆渗透压中发挥着重要的作用。低ALB水平常导致组织水肿、浆膜腔积液和水钠潴留,血容量的减少,会导致冠脉血供减少,造成缺血性心肌损伤。同时有研究发现ALB可以通过抑制血管紧张素转换酶增加冠脉灌注量[11]。而低白蛋白血症削弱了这一心肌保护作用。已有研究证实ALB<35 g/L与心血管事件的发生有关。低蛋白血症会增加心肌损伤的风险[12]。2020年丹麦的一项地区性前瞻性队列研究对100 520例既往无心血管疾病的白人随访8.5年,校正了体质量指数、肝功能、炎症标志物、肾功能和其他常见危险因素后,低ALB水平仍可作为独立危险因素预测缺血性心肌损伤的发生[13]。在一项2 757例关于心脏手术后心肌损伤的单中心队列研究中,发现ALB水平与患者术后心肌损伤和心肌梗死显著相关[14]。本研究关于心肌梗死患者的亚组分析也发现,ALB是患者院内并发心肌梗死的独立危险因素,这进一步佐证了ALB在EGVB患者心血管事件中的重要影响。
本研究中RBC和Hb不是心肌损伤的独立危险因素,国外的一项研究表明,在心肌损伤的患者中,患者Hb水平越低,心肌损伤的程度可能越重,预后也更差[15]。一项回顾性研究纳入1 306名贫血患者,发现Hb最低值每降低10 g/L,心肌缺血率增加10.5%[16];BELLOTTO等[17]研究表明,在消化道出血患者中,Hb≤82 g/L是发生心肌缺血的重要危险因素。但也有研究发现肝硬化患者红细胞中的Hb含量增加,红细胞的携氧能力增加,考虑到本研究的患者大部分为失代偿期肝硬化患者,其长期处于贫血状态已有部分耐受和代偿,或许可以解释本研究对RBC、Hb含量的统计结果[18]。本研究并未发现输血是该类患者心肌损伤的独立危险因素。最新的Baveno-Ⅶ指南也再次提出了EGVB患者限制性输血的建议,应将血红蛋白维持在70~80 g/L之间[19]。考虑到每位患者输血后的血红蛋白水平仍有较大差异,可以解释该结果。
本研究局限性:首先本研究是一项回顾性研究,存在一定的选择偏倚,更多结论需大样本前瞻性研究来验证。其次,本研究未按患者肌钙蛋白水平进行分层,不同的患者肌钙蛋白水平可能不同,仅根据患者肌钙蛋白有无异常做二分类,可能影响最终的统计结果。第三,本研究仅进行了模型的内部验证,无外部测试集,后续可以收集其他医院的病例进一步行外部验证。
综上所述,年龄、基础疾病史,ALB是EGVB患者院内并发心肌损伤的独立危险因素,其中ALB还是该类患者院内并发心肌梗死的独立危险因素,使用ROC曲线证明了三者的独立诊断效应以及联合诊断效应(AUC=0.82),三者联合的诊断模型具有较高的临床诊断价值,能帮助临床医师做出恰当的临床决策以期改善患者病程的进展及预后。
| [1] |
MERCHANTE N, RIVERO-JUÁREZ A, TÉLLEZ F, et al. Liver stiffness predicts variceal bleeding in HIV/HCV-coinfected patients with compensated cirrhosis[J]. AIDS, 2017, 31(4): 493-500. |
| [2] |
GARCIA-TSAO G, BOSCH J. Management of varices and variceal hemorrhage in cirrhosis[J]. N Engl J Med, 2010, 362(9): 823-832. |
| [3] |
RAZPOTNIK M, BOTA S, WIMMER P, et al. The prevalence of cirrhotic cardiomyopathy according to different diagnostic criteria[J]. Liver Int, 2021, 41(5): 1058-1069. |
| [4] |
YOON K T, LIU H Q, LEE S S. Cirrhotic cardiomyopathy[J]. Curr Gastroenterol Rep, 2020, 22(9): 45. |
| [5] |
GONZÁLEZ-GONZÁLEZ J A, MONREAL-ROBLES R, GARCÍA-COMPEAN D, et al. Nonvariceal upper gastrointestinal bleeding in elderly people: clinical outcomes and prognostic factors[J]. J Dig Dis, 2017, 18(4): 212-221. |
| [6] |
THYGESEN K, ALPERT J S, JAFFE A S, et al. Fourth universal definition of myocardial infarction (2018)[J]. Circulation, 2018, 138(20): e618-e651. |
| [7] |
TAYYEM O, BILAL M, SAMUEL R, et al. Evaluation and management of variceal bleeding[J]. Dis Mon, 2018, 64(7): 312-320. |
| [8] |
RUBINFELD G D, BERGER J S, SMILOWITZ N R, et al. Acute myocardial infarction following hospitalization for gastrointestinal bleeding: incidence, predictors, management, and outcomes[J]. Am J Med, 2022, 135(8): e263-e278. |
| [9] |
JIANG G J, GAO R K, WANG M, et al. A nomogram model for predicting type-2 myocardial infarction induced by acute upper gastrointestinal bleeding[J]. Curr Med Sci, 2022, 42(2): 317-326. |
| [10] |
HAO J J, DANG P Z, QUAN X P, et al. Risk factors, prediction model, and prognosis analysis of myocardial injury after acute upper gastrointestinal bleeding[J]. Front Cardiovasc Med, 2022, 9: 1041062. |
| [11] |
FAGYAS M, ÚRI K, SIKET I M, et al. New perspectives in the renin-angiotensin-aldosterone system (RAAS) Ⅱ: albumin suppresses angiotensin converting enzyme (ACE) activity in human[J]. PLoS One, 2014, 9(4): e87844. |
| [12] |
HARTOPO A B, GHARINI P P R, SETIANTO B Y. Low serum albumin levels and in-hospital adverse outcomes in acute coronary syndrome[J]. Int Heart J, 2010, 51(4): 221-226. |
| [13] |
RONIT A, KIRKEGAARD-KLITBO D M, DOHLMANN T L, et al. Plasma albumin and incident cardiovascular disease[J]. Arterioscler Thromb Vasc Biol, 2020, 40(2): 473-482. |
| [14] |
VAN BEEK D E C, VAN DER HORST I C C, DE GEUS A F, et al. Albumin, a marker for post-operative myocardial damage in cardiac surgery[J]. J Crit Care, 2018, 47: 55-60. |
| [15] |
KANIC V, KOMPARA G, SURAN D, et al. Untangling the relationship between hemoglobin, peak troponin level, and mortality in patients with myocardial infarction[J]. Bosn J Basic Med Sci, 2022, 22(5): 791-797. |
| [16] |
GUINN N R, COOTER M L, VILLALPANDO C, et al. Severe anemia associated with increased risk of death and myocardial ischemia in patients declining blood transfusion[J]. Transfusion, 2018, 58(10): 2290-2296. |
| [17] |
BELLOTTO F, FAGIUOLI S, PAVEI A, et al. Anemia and ischemia: Myocardial injury in patients with gastrointestinal bleeding[J]. Am J Med, 2005, 118(5): 548-551. |
| [18] |
GEETHA A, LAKSHMI PRIYA M D, JEYACHRISTY S A, et al. Level of oxidative stress in the red blood cells of patients with liver cirrhosis[J]. Indian J Med Res, 2007, 126(3): 204-210. |
| [19] |
DE FRANCHIS R, BOSCH J, GARCIA-TSAO G, et al. Baveno Ⅶ Faculty. Baveno Ⅶ-Renewing consensus in portal hypertension[J]. J Hepatol, 2022, 76(4): 959-974. |




