2. 401331 重庆,重庆城市管理职业学院康复教研室
2. Department of Rehabilitation, Chongqing City Management College, Chongqing, 401331, China
膝骨关节炎是一种以关节软骨的变性、破坏,骨质增生及滑膜炎症为特征的慢性关节病[1]。随着全球人口老龄化、饮食结构异常,膝骨关节炎发病率逐渐升高,根据中国健康与养老追踪调查数据库的研究结果显示,我国症状性膝骨关节炎的患病率为8.1%,疾病终末期需人工关节置换[2]。因此,膝骨关节炎不仅极大的损害患者的生活质量,也给我国乃至全球公共卫生事业带来沉重负担,已经成为一个亟需解决的公共医疗问题[3]。关节软骨因其无血管分布、缺乏神经支配,以及软骨细胞数量稀少且有丝分裂不活跃等特点,导致关节软骨的自我修复能力十分有限,一旦受到伤害就有可能导致关节软骨的逐步损伤与退化[4-5]。目前,有效的软骨再生与修复手段已成为临床治疗膝骨关节炎的难点与热点[6]。由于软骨细胞凋亡是膝骨关节炎的基本特征,可从抑制软骨细胞凋亡入手进行保护关节软骨的深入研究。
本课题组前期研究发现, 低强度脉冲聚焦超声(focused low-intensity pulsed ultrasound, FLIPUS)可以通过机械效应提高新西兰兔膝骨关节炎模型软骨基质蛋白的含量[7],增加AKT磷酸化水平,下调凋亡蛋白Bax表达,活化PI3K/AKT通路抗软骨细胞凋亡[8]。然而,软骨细胞是如何将FLIPUS机械应力转为化学信号,实现FLIPUS抗软骨细胞凋亡的分子机制仍不清楚。波形蛋白(Vimentin)是构成细胞骨架中间纤维的主要蛋白, 其表达水平受到机械应力调控[9-12]。Vimentin参与构成的黏着斑(focal adhesion plaque, FAP)复合物促进黏着斑激酶(focal adhesion kinase, FAK)Tyr397磷酸化,进一步激活下游AKT通路,在调控软骨细胞凋亡中起到重要作用[13-14]。因此,本研究拟用FLIPUS干预IL-1β处理的小鼠原代软骨细胞,检测Col2α1、MMP13、Bcl-2、Bax、cleaved-Caspase3、Vimentin、p-Tyr397及p-AKT表达水平,同时测定软骨细胞凋亡率,从体外细胞学层面初步探讨FLIPUS是否通过上调软骨细胞Vimentin表达并促进FAK的Tyr397磷酸化,抑制软骨细胞凋亡。
1 材料与方法 1.1 主要试剂DMEM/F12培养基和胎牛血清购自Gibco公司; 青霉素-链霉素混合液、0.25%胰蛋白酶、抗荧光淬灭剂、BCA蛋白浓度测定试剂盒和Annexin V-FITC细胞凋亡检测试剂盒购自碧云天生物技术有限公司; Ⅱ型胶原酶购自BioFroxx公司;甲苯胺蓝染液、4%多聚甲醛购自塞维尔生物科技有限公司; 山羊血清、Col2α1抗体购自博士德公司; FAK抗体购于Cell Signaling Technology公司; MMP13抗体、GAPDH抗体、Bax抗体及Bcl-2抗体均购自Proteintech公司; Vimentin、AKT、p-AKT及p-Tyr397抗体购于Abcam公司;山羊抗兔IgG H&L (Alexa FluorⓇ564)购自亚科因公司。SDS-PAGE凝胶制备试剂盒等Western blot相关试剂均购自雅酶生物有限公司。
1.2 主要仪器低强度脉冲聚焦超声(CZG200型,重庆海扶医疗科技有限公司),频率0.6 MHz,声强120 m W/cm2,重复频率300 Hz,治疗头焦平面距离28 mm,脉冲宽度200 μs,占空比20%。
1.3 小鼠膝软骨原代细胞提取与体外培养新生5 d内的SPF级C57BL/6J乳鼠从重庆医科大学实验动物中心获得,本研究通过重庆医科大学附属第二医院伦理委员会批准(2020065)。参照以前的研究[15],用75%乙醇消毒后,在超净台中用灭菌器械剪开小鼠膝关节处的皮肤,去除多余肌肉韧带组织分离膝关节。加入适量0.25%胰酶在37 ℃、5%CO2孵箱中消化10~15 min。用含1%双抗的PBS清洗后在体视学显微镜下进一步分离关节软骨,将软骨块放入干净的培养皿中,加入0.1%的Ⅱ型胶原酶浸没分离好的软骨组织于37 ℃、5%CO2的细胞培养箱中孵育过夜直至软骨块完全被消化。将培养皿中的软骨细胞悬液用移液枪吹打,经70 μm筛网过滤后转移至离心管中,1 000 r/min离心5 min。去掉上清,加入含10%胎牛血清和1%双抗的DMEM/F12培养基重悬细胞,然后接种于细胞培养皿中,放置在37 ℃、5%CO2孵箱中常规培养,待细胞生长至80%~90%时进行传代。
1.4 小鼠原代软骨细胞的鉴定 1.4.1 甲苯胺蓝染色根据前期研究结果[16],取生长状态良好的P1代软骨细胞接种于细胞爬片,培养至80%时用PBS清洗3次,4%多聚甲醛室温固定20 min。PBS清洗后加入1%甲苯胺蓝染色液浸染20 min, 双蒸水清洗多余的染液,无水乙醇中脱水,中性树胶封片置于正置显微镜下观察。
1.4.2 细胞免疫荧光染色免疫荧光染色检测Col2α1表达。按照1.4.1方法制作细胞爬片,细胞生长至70%~80%时取出爬片,4%多聚甲醛固定30 min,0.3%Triton X-100室温通透15 min,PBS清洗5 min×3次,山羊血清室温封闭1 h,轻轻甩掉封闭液。加入抗Col2α1抗体(1∶100)放湿盒内4 ℃孵育过夜。次日PBS清洗3次,加入山羊抗兔IgG H&L (Alexa FluorⓇ564)荧光二抗在室温下避光孵育1 h,PBS洗涤,吸干爬片水珠,用含DAPI的抗荧光淬灭封片剂封片,正置荧光显微镜下观察。
1.5 Vimentin免疫荧光染色按照上述1.4.2中的方法对细胞进行通透封闭等操作后,加入抗Vimentin抗体(1∶200)放湿盒内, 4 ℃孵育过夜。次日PBS洗涤后,加入山羊抗兔IgG H&L (Alexa FluorⓇ564)荧光二抗在室温下避光孵育1 h,用含DAPI的抗荧光淬灭封片剂封片,正置荧光显微镜下观察。
1.6 细胞骨关节炎模型建立将P0代原代软骨细胞按照1∶3传代,培养1~2 d后采用IL-1β在体外模拟骨关节炎样细胞损伤。参考本课题组前期研究方案[16],加入10 ng /mL的IL-1β分别处理12、24 h。在24 h时可以看到软骨细胞形态出现长梭形和不规则多边形。
1.7 细胞分组及FLIPUS干预细胞分为Control组、IL-1β组和IL-1β+FLIPUS组。将原代软骨细胞接种于6孔板或3.5 cm培养皿中培养1~2 d后用IL-1β干预24 h。施加FLIPUS处理细胞,探头上涂耦合剂,将其紧贴培养皿下方干预20 min,治疗参数同1.2。
1.8 流式细胞术检测细胞凋亡用不含EDTA的0.25%胰酶消化原代软骨细胞后离心收集,PBS洗涤3次,用Annexin V-FITC和PI室温避光孵育细胞15 min。用流式细胞仪检测各组细胞凋亡率。
1.9 Western blot检测用裂解液冰上提取细胞总蛋白,总蛋白浓度采用BCA试剂盒测定,20~40 μg的蛋白在SDS聚丙烯酰胺凝胶电泳中分离,将蛋白电转至PVDF膜中,用快速封闭液室温封闭30 min~1 h,加入相应的一抗(按抗体说明书推荐稀释比稀释)在4 ℃孵育过夜,TBST洗涤3次后加入山羊抗兔IgG (H+L)辣根过氧化物酶在室温下孵育1 h,TBST洗3次,用ECL化学发光法显影,Image J软件进行结果分析。目标蛋白的相对含量用目标蛋白灰度值与GAPDH灰度值的比值表示。
1.10 统计学方法采用GraphPad Prism 8进行统计学分析,正态分布资料用x±s表示,非正态分布资料以中位数(四分位数)[M(P25,P75)]表示,采用Kruskal-Wallis H检验。多组间比较采用单因素方差分析,并运用Tukey法多重检验进行两两比较,当P < 0.05时认为差异有统计学意义。
2 结果 2.1 原代软骨细胞鉴定及骨关节炎样体外细胞模型构建采用甲苯胺蓝染色和细胞免疫荧光对P1代软骨细胞进行双重鉴定,结果显示,所有细胞被染为蓝紫色,同时对Col2α1进行免疫荧光染色,发现大量阳性红色荧光表达(图 1A~D)。传代培养后,正常P1代软骨细胞生长至大于80%时呈现“铺路石”样外观或多角形(图 1E)。表明小鼠原代软骨细胞提取成功。进一步采用10 ng/mL IL-1β处理原代软骨细胞24 h后,细胞发生去分化,开始呈条索状或长梭形生长,细胞形态发生改变,并伴有细胞贴壁数量减少和漂浮细胞数量增加(图 1F),成功构建骨关节炎样细胞模型。
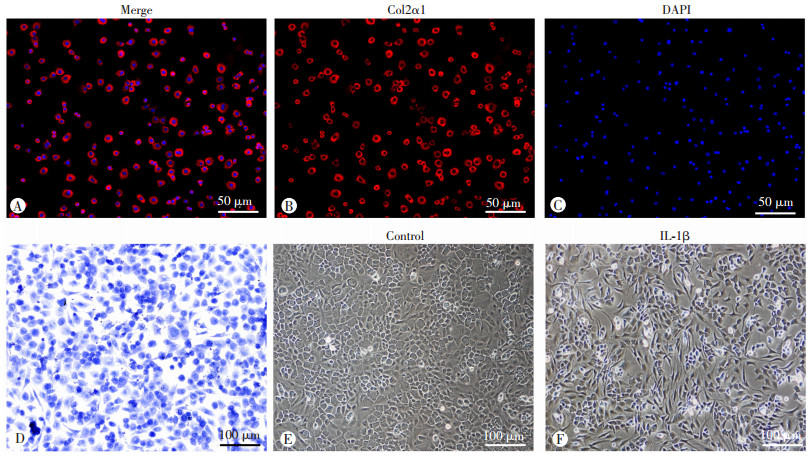
|
| A~C: 原代软骨细胞Col2α1细胞免疫荧光染色;D: 原代软骨细胞甲苯胺蓝染色;E、F: P1代正常软骨细胞及IL-1β处理24 h细胞形态 图 1 原代软骨细胞表型鉴定及IL-1β构建体外骨关节炎样模型的形态学观察 |
2.2 FLIPUS抑制IL-1β诱导的软骨细胞凋亡
流式细胞术检测细胞凋亡结果显示,与Control组相比,IL-1β组细胞凋亡率显著增加(P < 0.001);与IL-1β组相比,IL-1β+FLIPUS组的凋亡率明显减少(P < 0.001),见图 2。
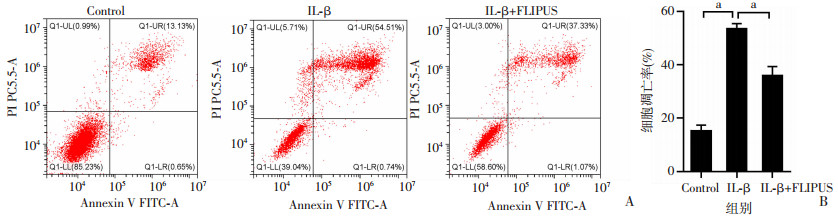
|
| A: 流式细胞术检测各组软骨细胞凋亡程度;B: 各组软骨细胞凋亡率的统计分析 a: P<0.001 图 2 FLIPUS对软骨细胞凋亡率的影响 |
2.3 IL-1β对基质蛋白、Vimentin以及凋亡相关蛋白表达的影响
Western blot结果显示,随着IL-1β处理时间的延长, Col2α1表达量逐渐降低(P < 0.001),基质金属蛋白酶13(MMP13)表达增加(P < 0.01),同时Vimentin表达降低,并在24 h时差异具有统计意义(P < 0.05,图 3A、B)。对凋亡相关蛋白进行检测发现,Bax(P < 0.01)和cleaved-Caspase3(P < 0.05)的表达随IL-1β干预时间的延长升高,而抗凋亡蛋白Bcl-2的表达明显降低(P < 0.01),见图 3C、D。
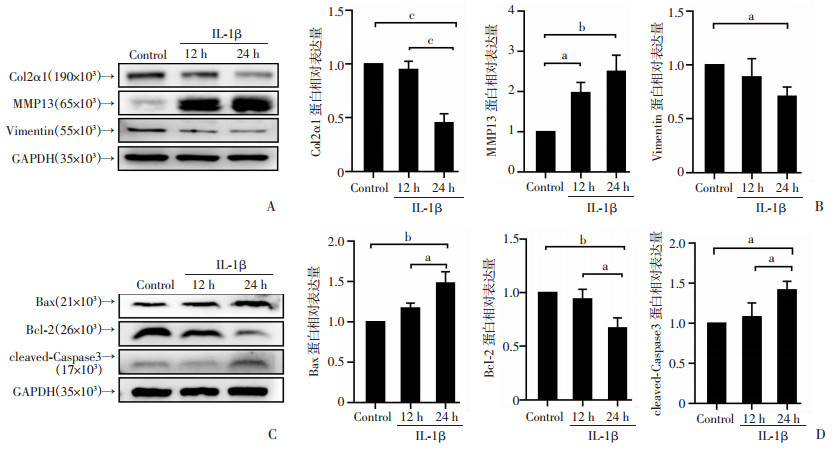
|
| A、B: Western blot检测软骨细胞Col2α1、MMP13、Vimentin蛋白表达变化及半定量分析;C、D: Western blot检测软骨细胞Bax、Bcl-2、cleaved-Caspase3蛋白表达及半定量分析 a: P<0.05,b: P<0.01,c: P<0.001 图 3 IL-1β处理不同时间后对细胞外基质相关蛋白、Vimentin及凋亡相关蛋白表达的影响 |
2.4 IL-1β对FAK和AKT磷酸化的影响
Western blot检测结果显示,与Control组相比,IL-1β处理12 h时,Tyr397磷酸化水平无统计学差异(P>0.05,图 4A)。IL-1β处理24 h后,Tyr397(P < 0.05)和AKT(P < 0.001)磷酸化水平显著下降(图 4)。
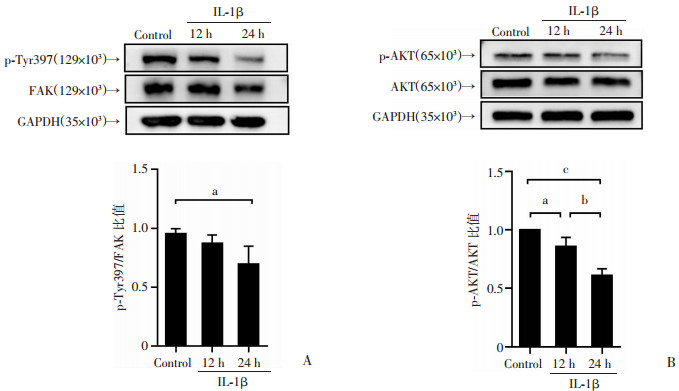
|
| A: Western blot检测不同处理时间软骨细胞FAK磷酸化程度及半定量分析;B: Western blot检测不同处理时间软骨细胞AKT磷酸化程度及半定量分析 a: P<0.05,b: P<0.01,c: P<0.001 图 4 IL-1β处理不同时间对FAK及AKT磷酸化影响 |
2.5 FLIPUS对基质蛋白、Bcl-2、Vimentin以及FAK磷酸化的影响
与IL-1β组相比,IL-1β+FLIPUS组中Col2α1(P < 0.01)和Bcl-2(P < 0.05)表达升高,MMP13的表达降低(P < 0.05,图 5A)。同时,与IL-1β组相比,IL-1β+FLIPUS组中Tyr397的磷酸化水平及Vimentin蛋白表达水平升高(P < 0.05,图 5B)。
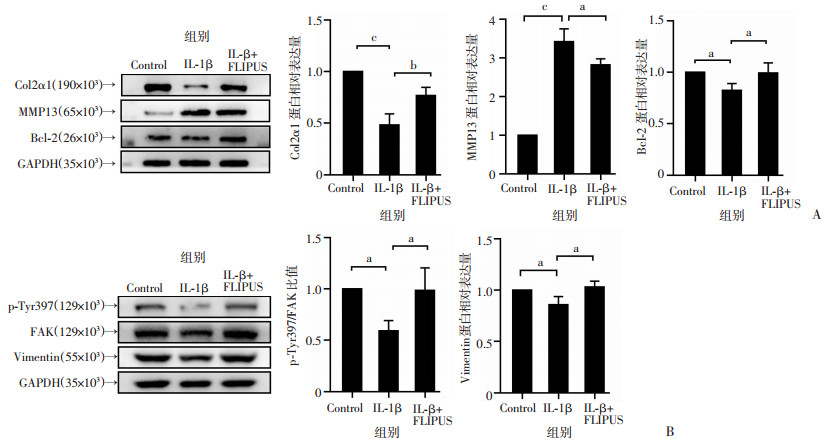
|
| A: Western blot检测FLIPUS对软骨细胞Col2α1、MMP13、Bcl-2蛋白表达的影响及半定量分析;B: Western blot检测FLIPUS对软骨细胞FAK磷酸水平及Vimentin蛋白表达的影响及半定量分析 a: P<0.05,b: P<0.01,c: P<0.001 图 5 FLIPUS对Col2α1、MMP13、Bcl-2、Vimentin蛋白表达及FAK磷酸化水平的作用 |
2.6 FLIPUS对细胞骨架蛋白Vimentin结构的影响
进一步通过免疫荧光染色,探究各组细胞中Vimentin的结构变化(图 6)。结果显示,Control组中Vimentin蛋白从核膜向外延伸,“龛笼样”结构完整。IL-1β组Vimentin的结构塌陷,向核周一侧聚集,荧光阳性表达减弱,提示Vimentin结构破坏。而IL-1β+FLIPUS组Vimentin的排列发生改变,荧光表达增强,提示Vimentin在FLIPUS干预后发生结构重塑。
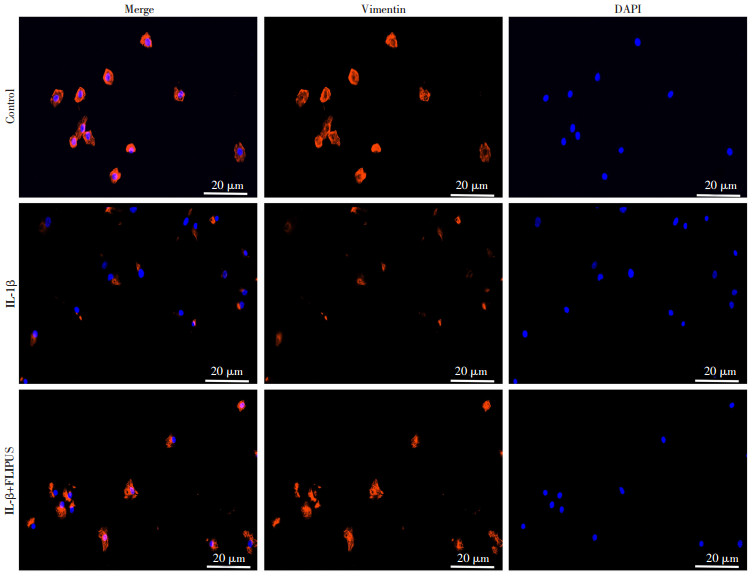
|
| 图 6 细胞免疫荧光检测FLIPUS对软骨细胞Vimentin分布的影响 |
3 讨论
膝骨关节炎是由多种因素引起关节软骨纤维化、皲裂、溃疡脱失而导致的退行性疾病,主要临床表现为受累关节疼痛、僵硬、畸形与活动功能障碍[17]。研究发现,骨关节炎患者的关节软骨中细胞骨架发生破坏,进而导致退行性关节疾病的发生[9, 18]。因此,软骨细胞骨架破坏被认为是导致关节软骨发生退行性变的重要因素之一。
细胞骨架(cytoskeleton, CSK)由微丝、中间纤维和微管组成,主要蛋白分别是肌动蛋白、波形蛋白(Vimentin)和微管蛋白,共同构成了细胞中的蛋白纤维网状体系,具有产生主动变形、抵抗被动变形和感受机械应力的能力[10, 19]。既往研究通过免疫荧光染色及共聚焦显微镜荧光检测发现,Vimentin破坏组软骨细胞凋亡水平显著上降,而肌动蛋白、微管蛋白破坏组对软骨细胞基质代谢的水平无明显影响,从而筛选出Vimentin为调控软骨细胞凋亡的关键骨架蛋白[10, 12]。进一步研究表明,Vimentin在细胞中参与构成FAP,进一步激活FAK并促进Tyr397磷酸化[14, 20-21]。本研究结果提示,经典炎症因子IL-1β下调Vimentin、Col2α1及Bcl-2蛋白表达,同时上调MMP13、Bax和cleaved-Caspase3蛋白表达,软骨细胞凋亡率显著升高。进一步通过免疫荧光证实,IL-1β组Vimentin结构塌陷并向核周一侧聚集,阳性荧光表达减弱。以上结果提示IL-1β诱导的软骨细胞凋亡可能与Vimentin蛋白低表达和结构破坏有关。LAMBRECHT等[18]在正常与骨性关节炎的蛋白质组学分析中,同样检测到中间纤维表达减少。此外,本研究还发现,IL-1β组中Tyr397和AKT磷酸化水平与Vimentin蛋白表达呈相同的下降趋势,提示Vimentin可能调控Tyr397和AKT的磷酸化水平。
超声是一种机械波,具有安全、无创、无辐射等优点,广泛应用于治疗肌肉骨骼等相关疾病[22-23]。超声与生物组织相互作用产生的生物学效应主要包括温热效应、空化效应和机械效应[24]。本研究中选用的FLIPUS采用了间歇能量输出的方式,能够尽可能地减少超声的温热效应,频率为0.6 MHz的超声产生空化效应所需的强度高达100~400 W/cm2,远远超过我们实际使用的强度(120 mW/cm2)[7]。因此本实验所采用的FLIPUS主要生物学效应为机械效应。前期研究发现,FLIPUS可通过机械效应改善关节软骨细胞代谢及生存微环境,促进软骨细胞增殖并抗软骨细胞凋亡[7, 12],但具体分子机制尚不清楚。本研究结果提示,FLIPUS上调Vimentin、Col2α1及Bcl-2蛋白表达,下调MMP13、Bax和cleaved-Caspase3蛋白表达,显著降低软骨细胞凋亡率,同时,Tyr397和AKT的磷酸化水平与Vimentin蛋白表达呈相同的上升趋势。免疫荧光显示,FLIPUS干预下Vimentin排列发生改变,荧光表达增强。以上结果提示,FLIPUS可能通过上调Vimentin蛋白表达及重塑Vimentin蛋白结构,促进Tyr397和AKT的磷酸化水平,发挥抗软骨细胞凋亡的作用。
研究显示,FAK活性在依赖于锚定的细胞生存中起关键调控作用[25]。细胞外基质破坏导致细胞粘附降低,从而抑制FAK活性,进一步诱导细胞发生失巢凋亡[26-27]。同时,研究还发现Bcl-2家族相关蛋白也广泛参与细胞失巢凋亡的调节过程[28]。本研究结果也发现,IL-1β促进软骨细胞基质中的主要成分Col2α1降解,下调FAK磷酸化水平及Bcl-2蛋白表达。因此,软骨细胞凋亡还可能与失巢凋亡相关,具体的分子机制还有待于下一步深入研究。
本研究存在以下不足之处:①本实验没有在低氧环境对软骨细胞进行3D立体培养,不能很好地模拟体内软骨细胞所处的低氧及软骨陷窝的生存环境;②本研究仅观察了FLIPUS对Vimentin及相关凋亡蛋白的影响,没有转染病毒沉默、过表达关键靶蛋白或采取特异性通路阻断剂进一步证实FLIPUS上调Vimentin抑制软骨细胞凋亡的分子机制。在下一步研究中,我们将转染病毒抑制Vimentin表达,更加深入地探讨FLIPUS抑制软骨细胞凋亡的作用机制。
综上所述,FLIPUS通过机械效应上调Vimentin蛋白表达,促进Tyr397及下游AKT磷酸化,延缓软骨基质降解并抑制软骨细胞凋亡。
| [1] |
樊子娟, 王桂杉, 李川, 等. 《中国骨关节炎诊疗指南(2021年版)》解读和评价[J]. 中国循证医学杂志, 2022, 22(6): 621-627. FAN Z J, WANG G S, LI C, et al. Interpretation and evaluation of Chinese Guideline for Diagnosis and Treatment of Osteoarthritis(2021 edition)[J]. Chin J Evid Based Med, 2022, 22(6): 621-627. |
| [2] |
中华医学会骨科学分会关节外科学组. 骨关节炎诊疗指南(2018年版)[J]. 中华骨科杂志, 2018, 38(12): 705-715. Orthopedic Branch of Chinese Medical Association Joint Surgery Group. Guidelines for diagnosis and treatment of osteoarthritis (2018 edition)[J]. Chin J Orthop, 2018, 38(12): 705-715. |
| [3] |
WATT F E. Posttraumatic osteoarthritis: what have we learned to advance osteoarthritis?[J]. Curr Opin Rheumatol, 2020, 33: 74-83. |
| [4] |
CARTER D R, BEAUPRÉ G S, WONG M, et al. The mechanobiology of articular cartilage development and degeneration[J]. Clin Orthop Relat Res, 2004, 427: S69-S77. |
| [5] |
CHEN B J, FANG L, LIN L Z, et al. Aerobic exercise combined with glucosamine hydrochloride capsules inhibited the apoptosis of chondrocytes in rabbit knee osteoarthritis by affecting TRPV5 expression[J]. Gene, 2022, 830: 146465. |
| [6] |
FERNANDES T L, GOMOLL A H, LATTERMANN C, et al. Macrophage: a potential target on cartilage regeneration[J]. Front Immunol, 2020, 11: 111. |
| [7] |
JIA L, CHEN J Y, WANG Y, et al. Focused low-intensity pulsed ultrasound affects extracellular matrix degradation via decreasing chondrocyte apoptosis and inflammatory mediators in a surgically induced osteoarthritic rabbit model[J]. Ultrasound Med Biol, 2016, 42(1): 208-219. |
| [8] |
ZUO D Y, TAN B T, JIA G W, et al. A treatment combined Prussian blue nanoparticles with low-intensity pulsed ultrasound alleviates cartilage damage in knee osteoarthritis by initiating PI3K/Akt/mTOR pathway[J]. Am J Transl Res, 2021, 13(5): 3987-4006. |
| [9] |
HODGKINSON T, KELLY D C, CURTIN C M, et al. Mechanosignalling in cartilage: an emerging target for the treatment of osteoarthritis[J]. Nat Rev Rheumatol, 2022, 18(2): 67-84. |
| [10] |
BLAIN E J, GILBERT S J, HAYES A J, et al. Disassembly of the vimentin cytoskeleton disrupts articular cartilage chondrocyte homeostasis[J]. Matrix Biol, 2006, 25(7): 398-408. |
| [11] |
LAUER J C, SELIG M, HART M L, et al. Articular chondrocyte phenotype regulation through the cytoskeleton and the signaling processes that originate from or converge on the cytoskeleton: towards a novel understanding of the intersection between actin dynamics and chondrogenic function[J]. Int J Mol Sci, 2021, 22(6): 3279. |
| [12] |
LANGELIER E, SUETTERLIN R, HOEMANN C D, et al. The chondrocyte cytoskeleton in mature articular cartilage: structure and distribution of actin, tubulin, and vimentin filaments[J]. J Histochem Cytochem, 2000, 48(10): 1307-1320. |
| [13] |
KANAZAWA H, IMOTO K, OKADA M, et al. Canstatin inhibits hypoxia-induced apoptosis through activation of integrin/focal adhesion kinase/Akt signaling pathway in H9c2 cardiomyoblasts[J]. PLoS One, 2017, 12(2): e0173051. |
| [14] |
OSTROWSKA-PODHORODECKA Z, DING I, NOROUZI M, et al. Impact of vimentin on regulation of cell signaling and matrix remodeling[J]. Front Cell Dev Biol, 2022, 10: 869069. |
| [15] |
GUAN M T, ZHU Y, LIAO B, et al. Low-intensity pulsed ultrasound inhibits VEGFA expression in chondrocytes and protects against cartilage degeneration in experimental osteoarthritis[J]. FEBS Open Bio, 2020, 10(3): 434-443. |
| [16] |
叶海霞, 虞乐华, 贾朗. 低强度脉冲聚焦超声通过上调PGAM5蛋白表达促进软骨细胞线粒体自噬[J]. 第三军医大学学报, 2021, 43(5): 403-410. YE H X, YU L H, JIA L. Focused low-intensity pulsed ultrasound promotes chondrocyte mitophagy via up-regulating PGAM5 protein[J]. J Third Mil Med Univ, 2021, 43(5): 403-410. |
| [17] |
LIU Q, NIU J, HUANG J, et al. Knee osteoarthritis and all-cause mortality: the Wuchuan osteoarthritis study[J]. Osteoarthr Cartilage, 2015, 23(7): 1154-1157. |
| [18] |
LAMBRECHT S, VERBRUGGEN G, VERDONK P C M, et al. Differential proteome analysis of normal and osteoarthritic chondrocytes reveals distortion of vimentin network in osteoarthritis[J]. Osteoarthr Cartilage, 2008, 16(2): 163-173. |
| [19] |
李春江, 卫小春. 软骨细胞骨架研究进展[J]. 生物骨科材料与临床研究, 2007, 4(2): 24-26. LI C J, WEI X C. Research progress of cartilage cytoskeleton[J]. Orthop Biomech Mater Clin Study, 2007, 4(2): 24-26. |
| [20] |
LOHBERGER B, KALTENEGGER H, WEIGL L, et al. Mechanical exposure and diacerein treatment modulates integrin-FAK-MAPKs mechanotransduction in human osteoarthritis chondrocytes[J]. Cell Signal, 2019, 56: 23-30. |
| [21] |
KIM S H, TURNBULL J, GUIMOND S. Extracellular matrix and cell signalling: the dynamic cooperation of integrin, proteoglycan and growth factor receptor[J]. J Endocrinol, 2011, 209(2): 139-151. |
| [22] |
MESSINA C, BANFI G, ORLANDI D, et al. Ultrasound-guided interventional procedures around the shoulder[J]. Br J Radiol, 2016, 89(1057): 20150372. |
| [23] |
FJELLSTAD C M, MATHIESSEN A, SLATKOWSKY-CHRISTENSEN B, et al. Associations between ultrasound-detected synovitis, pain, and function in interphalangeal and thumb base osteoarthritis: data from the nor-hand cohort[J]. Arthritis Care Res, 2020, 72(11): 1530-1535. |
| [24] |
ZHENG W T, LI H L, HU K H, et al. Chondromalacia patellae: current options and emerging cell therapies[J]. Stem Cell Res Ther, 2021, 12(1): 1-11. |
| [25] |
LIANG W W, REN K W, LIU F, et al. Periodic mechanical stress stimulates the FAK mitogenic signal in rat chondrocytes through ERK1/2 activity[J]. Cell Physiol Biochem, 2013, 32(4): 915-930. |
| [26] |
WU X H, WANG K, HUA W B, et al. Fibronectin induced ITGβ1/FAK-dependent apoptotic pathways determines the fate of degenerative NP cells[J]. J Orthop Res, 2019, 37(2): 439-448. |
| [27] |
WANG Z, BOYKO T, TRAN M C, et al. DEL1 protects against chondrocyte apoptosis through integrin binding[J]. J Surg Res, 2018, 231: 1-9. |
| [28] |
FRISCH S M, FRANCIS H. Disruption of epithelial cell-matrix interactions induces apoptosis[J]. J Cell Biol, 1994, 124(4): 619-626. |




