2. 400038 重庆,陆军军医大学(第三军医大学)军事预防医学系环境卫生学教研室
2. Department of Environmental Health, Faculty of Military Preventive Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038, China
饮酒是人体乙醇(ethanol,EtOH)暴露的一个主要来源,也是影响人体健康最常见的生活方式因素之一。目前发现乙醇是200多种疾病、损伤的危险因素,如肝硬化、癌症和心血管病等,导致许多健康问题[1]。
结直肠癌(colorectal cancer,CRC)是全球癌症相关死亡的第二大原因,预计到2035年,全球将增加250万结直肠癌新病例[2]。结直肠癌的危险因素主要包括遗传因素[2]、生活方式因素、膳食因素、医疗条件[3]等。其中,饮酒是结直肠癌一种重要的生活方式危险因素,它对结直肠癌的危害也越来越受到人们的关注[4]。酒精会增加罹患结直肠癌和乳腺癌的风险[5-6],大量流行病学研究表明,摄入酒精与癌症的发生有关[5, 7-12],且摄入所有类型的酒精饮料都会增加肿瘤发生的风险,提示乙醇可能是导致这种影响的重要化合物。血液循环中乙醇的量主要是由乙醇摄入量决定的,而其持续时间的决定因素在于乙醇脱氢酶(alcohol dehydrogenase,ADH)活性。饮酒后大部分乙醇在肠道吸收,肠道是高浓度乙醇的主要暴露部位,这一现象可能与乙醇相关的结直肠癌有关。人体摄入乙醇后,更易在结直肠癌上皮细胞中积累,因此乙醇本身可能是大多数酒精相关结直肠癌发生和转移的关键因素[13]。然而目前的研究大多聚焦于乙醛而不是乙醇本身对CRC的影响[14-15],乙醇对CRC细胞迁移能力的作用仍有待进一步研究。
人体摄入乙醇过程中,存在于细胞质和细胞核的乙酰辅酶A合成酶短链家族成员2(Acyl-CoA synthetase short chain family member 2,ACSS2)酶可催化乙酸、辅酶A和ATP生成乙酰辅酶A。ACSS2在结直肠癌、肾癌、肝癌等多种癌症中高表达,并参与肿瘤浸润、侵袭、转移等恶性进程,其异常表达常提示预后不良[16]。研究发现,ACSS2在乳腺癌和胶质母细胞瘤中表达升高,从而导致肿瘤细胞侵袭性生长和癌症患者的不良预后[17-18]。结直肠癌是一种上皮类型的恶性肿瘤,大量研究表明,上皮性肿瘤细胞在经历上皮间质转化(Epithelial-mesenchymal transformation,EMT)后可能具有更强的侵袭性。细胞发生EMT后,上皮细胞之间的连接变得更加松散,肿瘤细胞更容易侵入淋巴管和血管从而发生远处转移[19-20]。本课题组前期研究提示乙醇可通过诱导EMT促进CRC恶性进展[21],但ACSS2是否与乙醇对CRC细胞EMT效应和迁移能力存在潜在影响仍不明确。
因此,本研究使用HCT116和SW480构建不同浓度乙醇暴露的结直肠癌细胞模型,观察ACSS2在乙醇促进CRC转移过程中的作用,并结合生物信息学方法,探索调控ACSS2表达的潜在上游因子。最后结合CRC患者的临床资料,分析ACSS2与CRC患者临床指标的可能联系。
1 材料与方法 1.1 材料与试剂CRC细胞株HCT116、SW480均购于ATCC公司,DMEM培养基、PBS缓冲液、青/链霉素双抗(100×)、胎牛血清、0.25%胰酶购于Hyclone公司,无水乙醇(EtOH)购于Sigma公司,CCK-8试剂盒购于碧云天公司,Transwell细胞培养小室(8 μm)购于康宁公司,ACSS2抑制剂(ACSS2 inhibitor)购于Selleck公司,兔抗ACSS2抗体购于Abcam公司,兔抗β-actin、Vimentin、HRP标记山羊抗兔IgG抗体购于上海碧云天公司,N-cadherin,E-cadherin、C-MYC购于CST公司,兔抗CEBPB、POLR2A、SMC1A、CTCF、AR、ERG、SPI1购于武汉ABclonal公司。
1.2 细胞培养人结直肠癌细胞HCT116、SW480用含有10% FBS、1%双抗的DMEM完全培养基,于37℃、5% CO2饱和湿度的培养箱中进行培养。
1.3 细胞活力测定将结直肠癌细胞SW480、HCT116按3×103每孔接种于96孔板,培养过夜后用含不同浓度乙醇的培养基(0、22、44、88 mmol/L)分别处理细胞24、48、72 h。用CCK-8试剂盒检测其细胞活力,用酶标仪测量其450 nm处的吸光度值。然后计算乙醇对CRC细胞增殖的影响,以上实验重复3次。
1.4 细胞划痕实验用marker笔在6孔板底部间隔0.5~1 cm均匀划线,横穿过孔,每孔至少穿过5条线。每孔加入约5×105个细胞,接种原则为过夜后融合率达到100%。次日用200 μL枪头垂直于细胞平面,沿平板背面,在细胞层上进行划痕。划痕完成后,用无菌PBS洗去划线时脱落的细胞3次,使划线后留下的间隙清晰可见,然后更换新鲜的含1%胎牛血清培养基,于倒置显微镜下观察并拍照,然后将细胞放入培养箱内培养。48 h后在同一位置拍照。迁移率=(0 h划痕面积-48 h划痕面积)/0 h划痕面积×100%。对照组与实验组均设置3个平行样本。
1.5 Transwell实验将Transwell小室置于24孔板中,将处于对数生长期的细胞消化后,以预冷PBS以166×g 5 min离心清洗2次,用无血清无抗生素的培养基制备成细胞悬液,并调整细胞浓度为1×106/mL,接种于Transwell小室中,底层加入含20%胎牛血清的完全培养基作为化学引诱剂,在细胞培养箱中孵育24 h后取出Transwell小室,置于PBS中将其清洗干净后,用棉签将小室上层内面擦干。将小室浸没于4%多聚甲醛溶液中固定30 min,再用PBS充分清洗小室,最后用结晶紫溶液染色10 min后晾干,于显微镜下观察,随机选取5个高倍镜视野拍照记录,并记录细胞数量,统计分析各组差异。
1.6 在线数据库分析用在线工具基因表达谱交互式分析(Gene Expression Profiling Interactive Analysis,GEPIA)分析ACSS2基因在CRC患者中的表达情况。为了获得癌组织和正常人体组织的蛋白质免疫组化分析数据,使用了人类蛋白质图谱在线网站(The Human Protein Atlas,HPA)。HPA在线病理数据库提供了48个正常组织样本、20个典型癌症类别、47个细胞系和12个血细胞的蛋白特异性表达和定位信息。最后使用ChIP-X富集分析3(ChIP-X Enrichment Analysis 3,ChEA3)转录因子数据库对ACSS2基因上游转录因子进行富集分析。TCGA数据库中获得CRC患者ACSS2表达水平与相关临床指标参数,按中位数将其分为相对高表达组和相对低表达组。
1.7 RT-qPCR实验乙醇处理结直肠癌SW480、HCT116细胞48 h后,每瓶细胞加入1 mL Trizol裂解细胞,室温放置3 min后加入200 μL氯仿,充分混匀静置5 min后于4 ℃、10 625×g离心10 min,取上清置于新的1.5 mL EP管中,并加入等体积异丙醇充分混匀后静置30 min。相同条件离心后用75%乙醇清洗后加入DEPC水测定其浓度,按照伯乐反转录试剂盒加入对应体系后进行反转录,然后上机进行PCR实验。
1.8 Western blot检测乙醇处理结直肠癌SW480、HCT116细胞48 h后,按裂解液∶苯甲基磺酰氟(pmsf)=100 ∶1比例,每皿细胞加入200 μL含pmsf的裂解液,于冰上裂解30 min后用干净的细胞刮刮下细胞,离心后取上清进行蛋白定量。总蛋白用BCA蛋白测定试剂盒定量。测定蛋白浓度后加入总体积1/5的5×SDS-PAGE蛋白上样缓冲液后100 ℃水浴15 min。蛋白样品用SDS-PAGE分离,再转移到PVDF膜上。在4 ℃下用一抗孵育过夜,室温用二抗孵育1 h。最后使用ECL法观察蛋白条带变化。
1.9 统计学分析使用SPSS 25.0对实验数据进行统计分析,使用单因素方差分析或秩和检验分析组间差异,进一步组间两两比较,若方差齐选择LSD法,若方差不齐选择Dunnett-t法。P<0.05时认为差异具有统计学意义,使用GraphPad Prism 8.0.2绘图直方图。
2 结果 2.1 乙醇可抑制结直肠癌细胞增殖并促进其迁移不同乙醇(0、22、44、88 mmol/L)处理结直肠癌SW480、HCT116细胞后,CCK-8法检测细胞活力。结果发现,两种细胞株呈现相似的结果,即在乙醇处理24 h后,细胞活力均无明显改变。但在48、72 h时间点,与对照组相比,22、44、88 mmol/L乙醇处理后,细胞活力均受到不同程度的明显抑制。但48、72 h组的结果比较提示,以22 mmol/L乙醇处理CRC细胞48 h后即呈现显著的增殖抑制效应,但随处理时间增加,与HCT116相比,SW480抑制效应的差异并不显著,故本研究最终选择48 h作为后续研究的乙醇处理时长。进一步观察乙醇对CRC细胞迁移能力的影响,划痕实验结果表明(图 1A),与0 mmol/L相比,经乙醇处理的SW480、HCT116细胞的细胞愈合百分比明显增加;Transwell结果显示,乙醇处理后,SW480、HCT116细胞的穿孔细胞数明显增加(图 1B),提示乙醇能增强结直肠癌细胞的迁移能力,综合Transwell和划痕实验结果,乙醇促进CRC细胞迁移的能力有随剂量增加的趋势,但并无统计上的剂量依赖关系。此外,Western blot结果提示(图 1C),与0 mmol/L相比,乙醇处理48 h后,SW480和HCT116细胞的E-cadherin表达降低、N-cadherin及Vimentin蛋白表达升高。以上实验结果于实验室前期研究中已充分阐述。
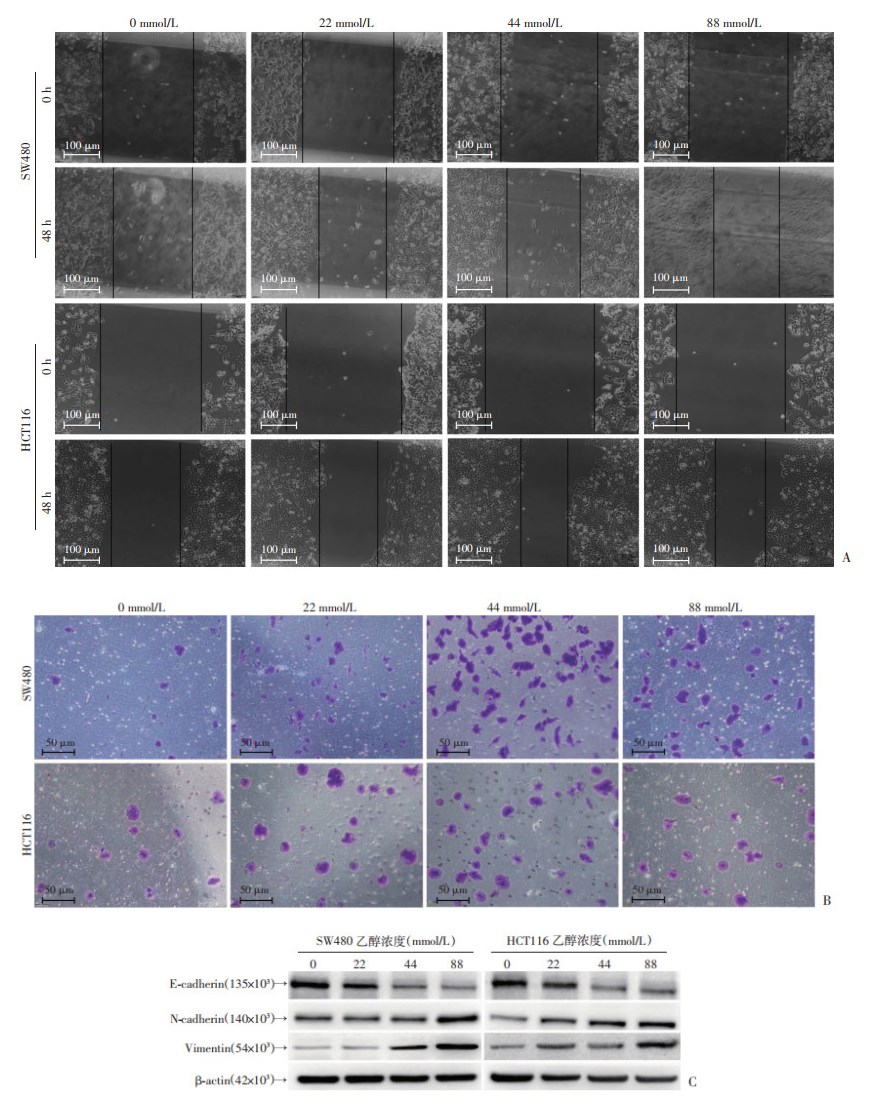
|
| A:细胞划痕生长愈合情况 B:细胞穿孔情况;C:Western blot检测EMT相关蛋白的表达 图 1 乙醇处理48 h后对结直肠癌细胞迁移能力及EMT相关蛋白的影响 |
2.2 乙醇可上调CRC细胞中ACSS2的表达
GEPIA在线工具、HPA数据库分析提示:CRC患者癌组织中ACSS2表达高于癌旁组织(图 2)。为评估乙醇对CRC细胞中ACSS2表达的影响,使用不同浓度乙醇处理CRC细胞48 h后,发现ACSS2的mRNA表达水平(图 3A)及其蛋白表达量均显著升高(图 3B、C)。
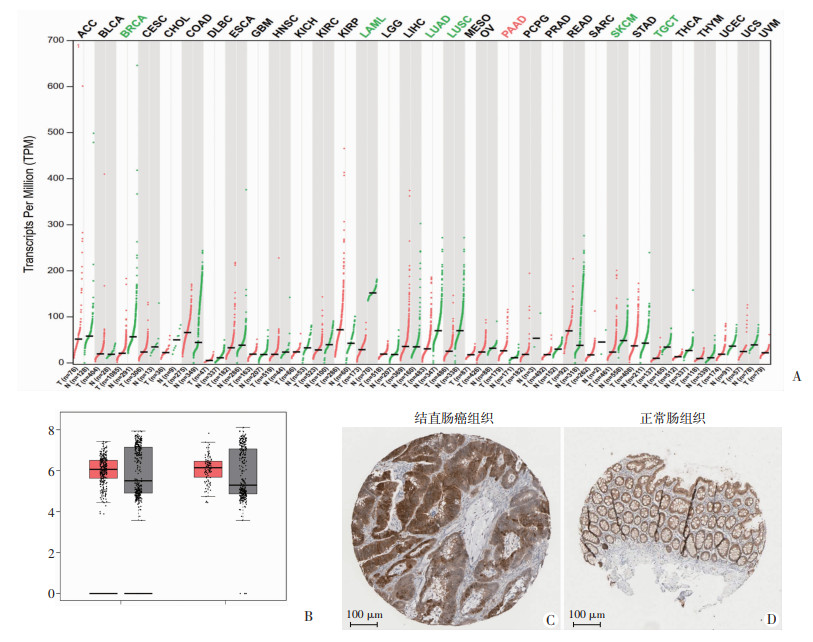
|
| A:GEPIA分析所有肿瘤样本及其配对的正常组织中ACSS2基因表达谱;B:ACSS2在结肠癌和直肠腺癌肿瘤样本及其配对的正常组织中的表达情况(箱式图从左至右分别为结直肠癌组织、正常结肠组织、直肠腺癌组织、正常直肠组织);C、D:HPA数据库对结直肠癌组织和正常肠组织的蛋白质免疫组化分析 图 2 在线数据库分析ACSS2基因在CRC中的表达情况 |
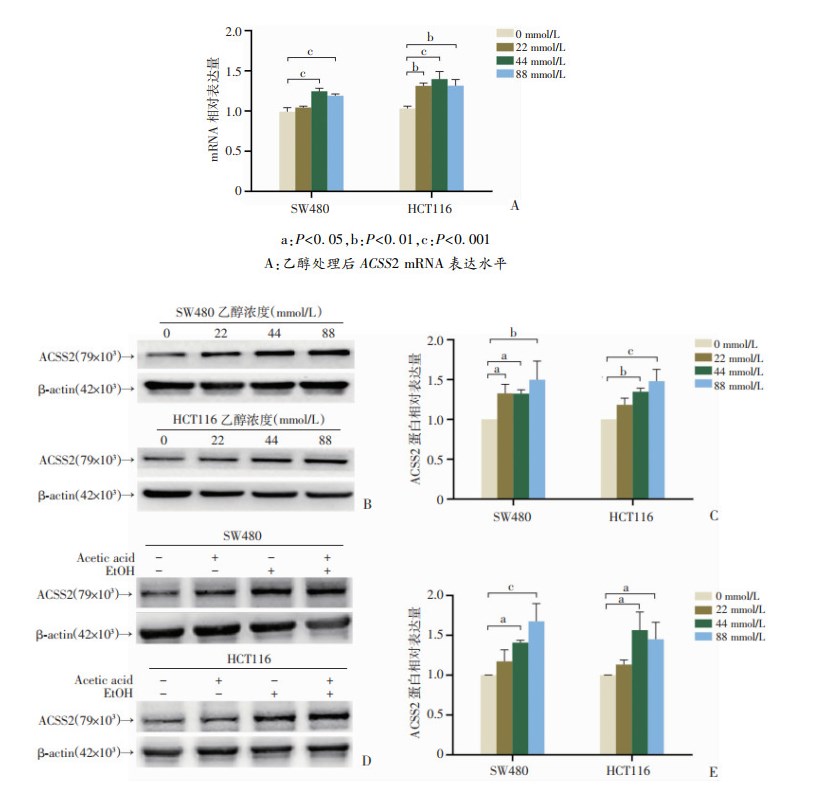
|
|
a:P<0.05,b:P<0.01,c:P<0.001 A:乙醇处理后ACSS2 mRNA表达水平a:P<0.05,b:P<0.01,c:P<0.001 B、C:乙醇处理后Western blot检测及定量结果;D、E:乙酸处理后Western blot检测及定量结果 图 3 SW480和HCT116细胞中ACSS2的表达情况(n=3,x±s) |
由于乙醇在胞内可通过乙醇脱氢酶(ADH)-乙醛脱氢酶(ALDH)途径最终代谢为乙酸,为进一步排除乙酸(Acetic acid)的影响,本研究选用ADH活性极低的细胞株SW480、HCT116以尽量减少乙醇进入胞内后代谢的影响。以100 μmol/L乙酸对细胞进行处理后的结果显示(图 3D、E),与0 mmol/L相比,单独乙酸处理组的ACSS2蛋白表达并未增加,乙酸+乙醇组的ACSS2蛋白表达则明显增加但与单独乙醇处理组相比差异无统计学意义。结果提示乙醇本身(而非乙酸)可促进CRC细胞中ACSS2的表达,ACSS2表达升高可能在乙醇促CRC细胞迁移过程中发挥重要作用。
2.3 ACSS2参与调节乙醇诱导的结直肠癌进展为评估抑制ACSS2表达是否会影响乙醇对CRC细胞迁移能力的促进,以500 nmol/L ACSS2抑制剂(ACSS2 inhibitor)处理CRC细胞,在SW480和HCT116细胞中抑制了ACSS2表达(图 4),在以88 mmol/L乙醇处理细胞48 h后行细胞功能性实验。划痕实验结果提示(图 5):单独乙醇处理时仍然显著促进SW480和HCT116的横向迁移能力,但经ACSS2抑制剂处理后,细胞划痕的愈合面积百分比明显降低。Transwell实验结果提示(图 6),乙醇处理后SW480和HCT116的穿孔细胞数目明显增加,ACSS2抑制剂处理后,结直肠癌细胞穿孔数目明显减少。表明当ACSS2被抑制后,乙醇促进CRC细胞迁移的效应也同步被抑制,提示ACSS2可能对调节乙醇诱导的CRC进展有调控作用。
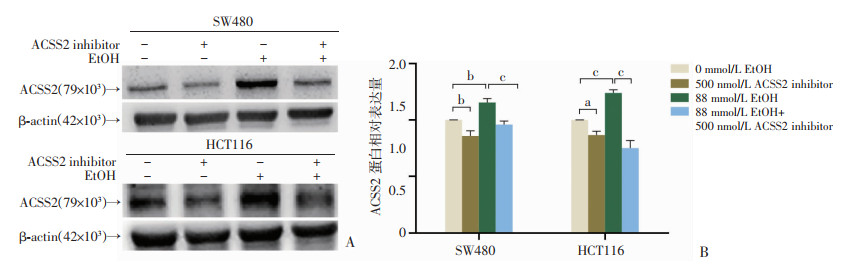
|
|
a:P<0.05,b:P<0.01,c:P<0.001 A:Western blot检测各组处理48 h后SW480、HCT116细胞ACSS2的表达;B:蛋白半定量分析 图 4 抑制ACSS2表达后结直肠癌细胞中ACSS2的表达情况(n=3,x±s) |
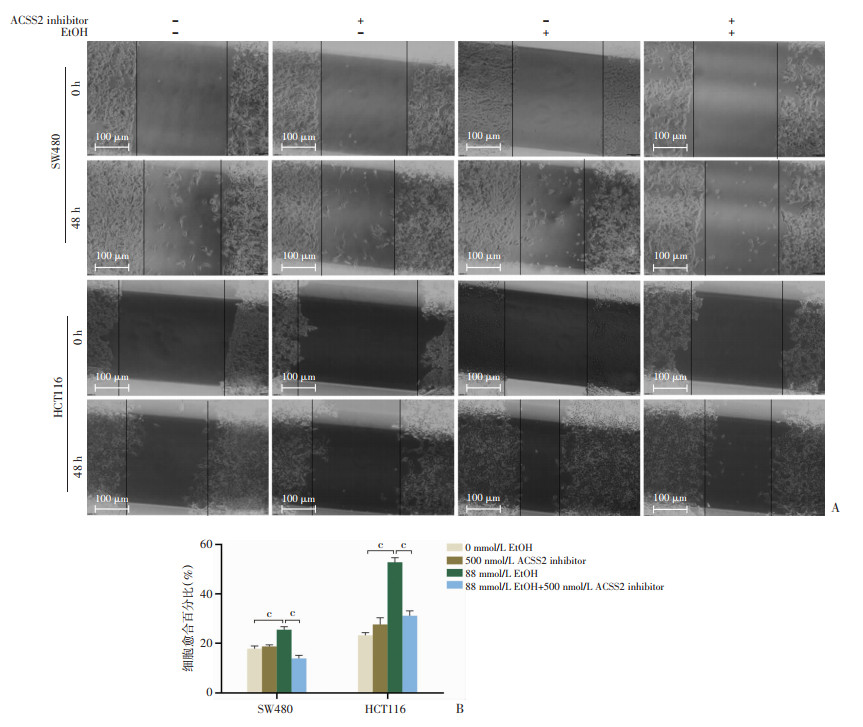
|
|
c:P<0.001 A:各组处理48 h后SW480、HCT116细胞划痕愈合情况;B:细胞愈合率比较 图 5 抑制ACSS2表达对乙醇诱导的结直肠癌细胞横向迁移的影响(n=5,x±s) |
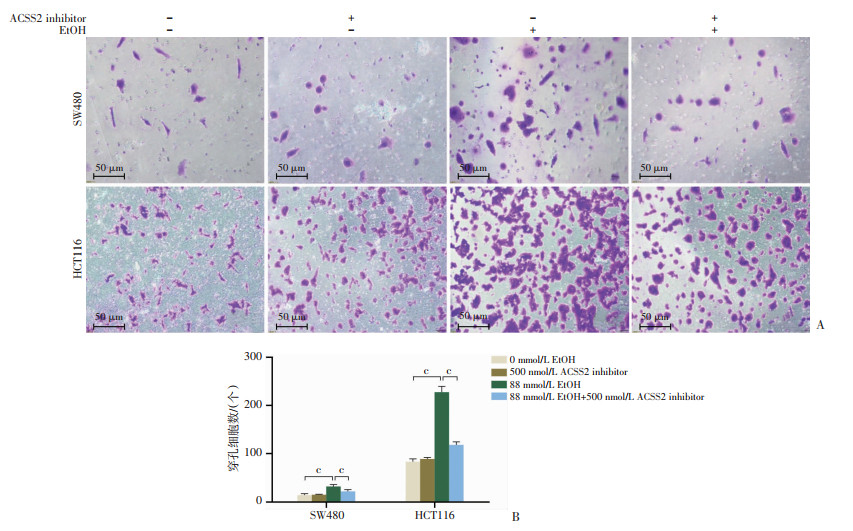
|
|
c:P<0.001 A:各组处理48 h后SW480、HCT116细胞穿孔情况;B:穿孔细胞数比较 图 6 抑制ACSS2表达对乙醇诱导的结直肠癌细胞纵向迁移能力的影响(n=5,x±s) |
2.4 抑制ACSS2表达明显减弱乙醇诱导的EMT效应
为进一步阐明ACSS2与乙醇诱导的EMT效应之间的关系,本研究用500 nmol/L的ACSS2 inhibitor处理SW480和HCT16后,再用88 mmol/L乙醇处理细胞48 h。收集细胞总蛋白行Western blot检测EMT相关蛋白的表达情况。结果显示(图 7):与0 mmol/L相比,乙醇明显增加了SW480、HCT116中的N-cadherin、Vimentin蛋白的表达,同时观察到E-cadherin蛋白的表达经乙醇处理后在两细胞株中的表达量明显降低;抑制ACSS2表达后,N-cadherin、Vimentin蛋白的表达明显降低,E-cadherin蛋白的表达明显增高。这提示抑制ACSS2表达能有效抑制结直肠癌细胞中乙醇诱导的EMT效应,在蛋白层面上进一步证明了ACSS2可能对乙醇诱导的结直肠癌迁移能力增强具有调控作用。
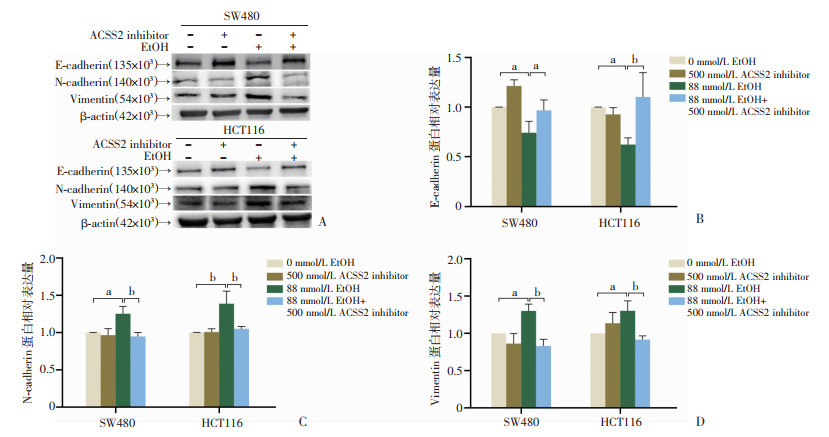
|
|
a:P<0.05,b:P<0.01 A:Western blot检测各组处理48 h后SW480、HCT116细胞相关蛋白表达;B~D:蛋白半定量分析 图 7 抑制ACSS2表达对乙醇诱导的结直肠癌细胞中EMT相关蛋白表达的影响(n=5,x±s) |
2.5 ACSS2表达调控机制的初步分析
为探索ACSS2上游调控机制,研究通过ChEA3转录因子数据库对ACSS2上游的转录因子进行富集分析发现(图 8A):POLR2A、SMC1A、CTCF、AR、ERG、C-MYC、CEBPB、SPI1等8个转录因子与ACSS2的表达变化一致,提示这些转录因子可能是调控ACSS2的潜在上游分子。Western blot验证上述8个转录因子的蛋白表达变化结果发现(图 8B):CEBPB、POLR2A、SMC1A、C-MYC、CTCF在SW480细胞中升高;CEBPB、AR、ERG、SMC1A和CTCF在HCT116细胞升高,且CEBPB、SMC1A、CTCF等3个转录因子在SW480和HCT116细胞中表达均同时显著上调。提示乙醇促进的结直肠癌细胞迁移,可能通过相关转录因子的调控使ACSS2表达增加、诱导EMT效应进而增强CRC细胞的迁移能力。
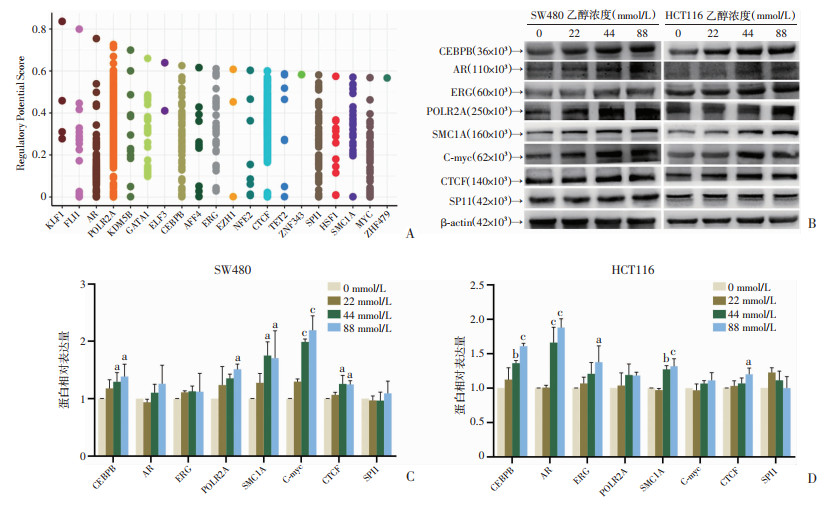
|
|
a:P<0.05,b:P<0.01,c:P<0.001,与0 mmol/L比较 A:ChEA3数据库对ACSS2上游转录因子的富集分析;B~D:Western blot检测乙醇处理48 h后SW480和HCT116细胞相关转录因子蛋白表达及半定量分析 图 8 结直肠癌细胞中ACSS2上游相关转录因子的表达(n=3,x±s) |
2.6 ACSS2表达水平与CRC患者临床特征关系的分析
为进一步评估ACSS2基因表达与结直肠癌患者临床特征的可能联系,从TCGA数据库中导出含有ACSS2表达数据的全部513例CRC患者的相关资料进行了分析(表 1)。按照中位数将患者分为ACSS2相对高表达和相对低表达2组,分析ACSS2表达与相关临床特征之间的关系。结果发现,在513例CRC患者中,与ACSS2相对低表达组相比,ACSS2相对高表达组发生血管、神经浸润及其他部位转移的比例明显较高(χ2=6.411,P=0.011),此外高表达组患者中M1:M0分期的比例也高于低表达组患者,差异处于临界水平(P=0.065)。
| 变量 | 人数及构成比a | ACSS2相对低表达(n=257) | ACSS2相对高表达(n=256) | χ2值 | P值 |
| 年龄/岁 | |||||
| <60 | 135(26.3) | 69(26.9) | 66(25.8) | 0.075 | 0.784 |
| ≥60 | 378(73.7) | 188(73.2) | 190(74.2) | ||
| 性别 | |||||
| 男 | 268(52.2) | 131(51.0) | 137(53.5) | 0.332 | 0.564 |
| 女 | 245(47.8) | 126(49.3) | 119(46.5) | ||
| 浸润及其他部位转移b | |||||
| 是 | 412(80.3) | 195(75.9) | 217(84.8) | 6.411 | 0.011 |
| 否 | 101(19.7) | 62(24.1) | 39(15.2) | ||
| M分期 | |||||
| M0 | 379(74.2) | 199(77.7) | 180(70.6) | 3.405 | 0.065 |
| M1 | 132(25.8) | 57(22.3) | 75(29.4) | ||
| N分期 | |||||
| N0 | 305(59.7) | 151(59.0) | 154(60.4) | 0.105 | 0.746 |
| >N0 | 206(40.3) | 105(41.0) | 101(39.6) | ||
| T分期 | |||||
| T1~T2 | 97(19.0) | 66(19.4) | 31(18.1) | 0.122 | 0.727 |
| T3~T4 | 414(81.0) | 274(80.1) | 140(81.9) | ||
| Stage分期 | |||||
| StageⅠ | 82(16.3) | 46(18.3) | 36(14.3) | 1.410 | 0.235 |
| Stage Ⅱ~Ⅳ | 421(83.7) | 206(81.7) | 215(85.7) | ||
| a:有2人缺少TNM分析信息;b:指出现外周神经浸润、血管浸润或其他远处部位转移的任一情况 | |||||
3 讨论 3.1 乙醇可抑制结直肠癌细胞增殖并促进其迁移
本研究主要针对乙醇处理对结直肠癌细胞生长及迁移的调控作用进行研究,并对可能的分子机制进行了探索。本研究通过体外细胞实验,使用不同浓度乙醇处理结直肠癌细胞,并且为了模拟人体摄入乙醇过程中肠道细胞所处环境中的乙醇波动性变化,每隔24 h更换一次含乙醇的完全培养基。乙醇作用后抑制结直肠癌细胞增殖但可促进其迁移。这可能是由于乙醇处理可激活P21的表达,P21主要调控细胞周期活动,使结直肠癌细胞周期阻滞在G0/G1期,从而抑制细胞增殖。此外,乙醇处理后可上调Snail、N-cadherin等间质相关蛋白的表达,进而促进结直肠癌细胞迁移[13]。流行病学研究显示,长期饮酒不仅能增加罹患癌症的风险[24-25],还可促进肿瘤转移[26-27]。多项研究已经证明,饮酒可增强结直肠癌细胞的侵袭和迁移能力。例如caco-2[28]细胞经酒精处理后出现黏附性和分化能力的降低,HT-29[29]细胞在酒精的作用下侵袭迁移能力增强。而且,在结直肠癌患者中,饮酒与肿瘤的转移密切相关,这种关联已被确定为结直肠癌患者预后不良的主要原因[30-31]。综合上述已有研究结果,本研究的实验结果提示:乙醇可能通过诱导结直肠癌细胞发生EMT促进结直肠癌的恶性进展。以上结果在其他癌症研究中也有证实,例如乙醇处理后能增强口腔鳞状细胞癌的侵袭及迁移能力[32];在异种移植模型中,乙醇可促进C57BL/6小鼠的肿瘤血管生成,并促进乳腺癌细胞的转移[33]。
3.2 乙醇可上调CRC细胞中ACSS2的表达ACSS2异常表达被证明是癌症预后不良的重要因素之一。为阐明乙醇促CRC细胞迁移的原因,本研究首先利用GEPIA在线工具和HPA数据库,确认了ACSS2在CRC癌组织中的表达量显著高于正常组织。乙醇处理后,ACSS2的表达随着乙醇作用浓度的增加而增加。同时以乙酸作为阳性对照发现可能是乙醇而非乙酸激活结直肠癌细胞中ACSS2的表达。
为进一步评估抑制ACSS2表达是否能改善乙醇诱导的结直肠癌细胞恶性进展,本研究在SW480和HCT116细胞中抑制ACSS2表达后再进行乙醇处理,结果发现抑制结直肠癌细胞中ACSS2表达能明显抑制EMT效应,同时也显著逆转了乙醇诱导的SW480和HCT116细胞的迁移。结合已有的证据,这些结果提示ACSS2可能在乙醇促CRC细胞迁移过程中发挥重要作用。在其他研究中也有类似的研究结果,有流行病学研究表明[34],酗酒人群中ACSS2基因的表达量增加。此外,SUN等[35]发现,饮酒后会过度激活Nrf2使得食管鳞癌组织中的ACSS2表达增高,从而促进癌细胞的恶性进展。于童等[22]的研究还发现,使用干扰RNA敲低结直肠癌细胞中ACSS2的表达后,结直肠癌细胞的EMT效应受到一定程度的抑制。
3.3 ACSS2表达调控机制的初步分析为进一步探索ACSS2基因表达增高的机制,本研究检索了ChEA3转录因子数据库,对ACSS2基因的上游转录因子进行富集分析,发现POLR2A、SMC1A、CTCF、AR、ERG、CEBPB、C-MYC、SPI1等转录因子的变化趋势与ACSS2具有相关性,Western blot结果提示乙醇作用于癌细胞后,转录因子SMC1A、CEBPB、CTCF在SW480和HCT116细胞中的表达水平均显著升高。这些结果提示,乙醇可能通过相关转录因子促进ACSS2表达,从而诱导CRC细胞发生EMT效应、增强CRC细胞的迁移能力。此外,本研究还对ACSS2基因表达与结直肠癌患者临床特征的关系进行了分析。通过检索在线数据库TCGA并导出含有ACSS2表达数据的全部513例CRC患者相关临床指标,按ACSS2表达量中位数将患者分为高、低表达组,比较了两组患者在临床指标上的差异,结果发现,与ACSS2相对低表达组相比,ACSS2相对高表达组发生血管、神经浸润及其他部位转移的比例明显较高(χ2=6.411,P=0.011)。此外高表达组患者中M1∶M0分期的比例也高于低表达组患者,差异处于临界水平(P=0.065)。但由于数据库资料缺乏结直肠癌患者的饮酒情况,特别是缺乏在确诊后及治疗中是否继续饮酒等信息,因此限制了在本研究中深入分析患者饮酒情况是否与相关临床特征有关以及饮酒是否与ACSS2的表达有关。但结合实验研究结果,这些发现仍提示ACSS2可能在结直肠癌进展中发挥重要作用。
综上所述,本研究首次分析了ACSS2基因在乙醇相关性结直肠癌中的作用,并结合生物信息学方法,初步探索了ACSS2表达增高的潜在机制。研究结果提示,乙醇可能通过相关转录调控因子,上调ACSS2表达,诱导结直肠癌细胞发生EMT,进而增强其迁移能力。这一结果或可为CRC患者的预防及靶点治疗提供直接的实验依据。同时,本研究也有一些重要问题尚未能深入阐明,如:乙醇诱导的ACSS2表达增高后具体是通过哪些相关信号通路促进EMT效应的发生?是否与其他因素刺激导致的ACSS2增加所致的EMT有所不同等还需要深入研究。此外,乙醇对于结直肠癌患者组织中ACSS2表达量的改变,及其对结直肠癌患者恶性进展的影响,下一步还需结合包含饮酒史等信息的结直肠癌随访人群数据,开展更为详细的人群研究加以佐证。
本研究在细胞水平上初步证明了乙醇作用于结直肠癌细胞后可激活相关转录因子调控ACSS2表达,诱导CRC细胞发生EMT进而增强其迁移能力。研究结果在一定程度上丰富了乙醇促CRC转移的分子机制,或可为CRC恶性进展的预防和干预提供新的线索。
| [1] |
Alcohol[EB/OL]. https://www.who.int/news-room/fact-sheets/detail/alcohol. 2022-05-09/2023-06-02.
|
| [2] |
DEKKER E, TANIS P J, VLEUGELS J L A, et al. Colorectal cancer[J]. Lancet, 2019, 394(10207): 1467-1480. |
| [3] |
BARDIA A, LOPRINZI C, GROTHEY A, et al. Adjuvant chemotherapy for resected stage Ⅱ and Ⅲ colon cancer: comparison of two widely used prognostic calculators[J]. Semin Oncol, 2010, 37(1): 39-46. |
| [4] |
DALERBA P, SAHOO D, PAIK S, et al. CDX2 as a prognostic biomarker in stage Ⅱ and stage Ⅲ colon cancer[J]. N Engl J Med, 2016, 374(3): 211-222. |
| [5] |
SEITZ H K, ONETA C M. Gastrointestinal alcohol dehydrogenase[J]. Nutr Rev, 1998, 56(2): 52-60. |
| [6] |
SEITZ H K, STICKEL F, HOMANN N. Pathogenetic mechanisms of upper aerodigestive tract cancer in alcoholics[J]. Int J Cancer, 2004, 108(4): 483-487. |
| [7] |
TUYNS A J. Oesophageal cancer in non-smoking drinkers and in non-drinking smokers[J]. Int J Cancer, 1983, 32(4): 443-444. |
| [8] |
BRUGERE J, GUENEL P, LECLERC A, et al. Differential effects of tobacco and alcohol in cancer of the larynx, pharynx, and mouth[J]. Cancer, 1986, 57(2): 391-395. |
| [9] |
KUNE G A, VITETTA L. Alcohol consumption and the etiology of colorectal cancer: a review of the scientific evidence from 1957 to 1991[J]. Nutr Cancer, 1992, 18(2): 97-111. |
| [10] |
BOFFETTA P, HASHIBE M. Alcohol and cancer[J]. Lancet Oncol, 2006, 7(2): 149-156. |
| [11] |
SCHEPPACH W, BINGHAM S, BOUTRON-RUAULT M C, et al. WHO consensus statement on the role of nutrition in colorectal cancer[J]. Eur J Cancer Prev, 1999, 8(1): 57-62. |
| [12] |
STICKEL F, SCHUPPAN D, HAHN E G, et al. Cocarcinogenic effects of alcohol in hepatocarcinogenesis[J]. Gut, 2002, 51(1): 132-139. |
| [13] |
ZHENG K H, YU J L, CHEN Z T, et al. Ethanol promotes alcohol-related colorectal cancer metastasis via the TGF-β/RUNX3/Snail axis by inducing TGF-β1 upregulation and RUNX3 cytoplasmic mislocalization[J]. E Bio Medicine, 2019, 50: 224-237. |
| [14] |
SEITZ H K, SIMANOWSKI U A, GARZON F T, et al. Possible role of acetaldehyde in ethanol-related rectal cocarcinogenesis in the rat[J]. Gastroenterology, 1990, 98(2): 406-413. |
| [15] |
SALASPURO M. Bacteriocolonic pathway for ethanol oxidation: characteristics and implications[J]. Ann Med, 1996, 28(3): 195-200. |
| [16] |
LI C J, CHIU Y H, CHANG C, et al. Acetyl coenzyme A synthase 2 acts as a prognostic biomarker associated with immune infiltration in cervical squamous cell carcinoma[J]. Cancers (Basel), 2021, 13(13): 3125. |
| [17] |
COMERFORD S A, HUANG Z G, DU X L, et al. Acetate dependence of tumors[J]. Cell, 2014, 159(7): 1591-1602. |
| [18] |
MASHIMO T, PICHUMANI K, VEMIREDDY V, et al. Acetate is a bioenergetic substrate for human glioblastoma and brain metastases[J]. Cell, 2014, 159(7): 1603-1614. |
| [19] |
ZHANG J, LIU D, FENG Z, et al. MicroRNA-138 modulates metastasis and EMT in breast cancer cells by targeting vimentin[J]. Biomedecine Pharmacother, 2016, 77: 135-141. |
| [20] |
LABELLE M, BEGUM S, HYNES R O. Direct signaling between platelets and cancer cells induces an epithelial-mesenchymal-like transition and promotes metastasis[J]. Cancer Cell, 2011, 20(5): 576-590. |
| [21] |
夏宜馨, 张国伟, 王灵巧, 等. 乙醇通过促进上皮间质转化增强结直肠癌细胞的侵袭转移能力[J]. 第三军医大学学报, 2020, 42(15): 1501-1510. XIA Y X, ZHANG G W, WANG L Q, et al. Ethanol promotes migration and invasion in colorectal cancer cells via epithelial-mesenchymal transition[J]. J Third Mil Med Univ, 2020, 42(15): 1501-1510. |
| [22] |
于童. ACSS2在结直肠癌中及TEAD4在溃结中的作用研究[D]. 上海: 上海交通大学. 2017. YU T. Study on the role of ACSS2 in colorectal cancer and TEAD4 in ulcerative colitis[D]. Shanghai: Shanghai Jiao Tong University, 2017. |
| [23] |
LIANG Y D, PI H F, LIAO L Z, et al. Cadmium promotes breast cancer cell proliferation, migration and invasion by inhibiting ACSS2/ATG5-mediated autophagy[J]. Environ Pollut, 2021, 273: 116504. |
| [24] |
ALDINUCCI D, GLOGHINI A, PINTO A, et al. The classical Hodgkin's lymphoma microenvironment and its role in promoting tumour growth and immune escape[J]. J Pathol, 2010, 221(3): 248-263. |
| [25] |
MANTOVANI A, ALLAVENA P, SICA A, et al. Cancer-related inflammation[J]. Nature, 2008, 454(7203): 436-444. |
| [26] |
MEADOWS S A, VEGA F, KASHISHIAN A, et al. PI3Kδ inhibitor, GS-1101 (CAL-101), attenuates pathway signaling, induces apoptosis, and overcomes signals from the microenvironment in cellular models of Hodgkin lymphoma[J]. Blood, 2012, 119(8): 1897-1900. |
| [27] |
BEN-BARUCH A. The tumor-promoting flow of cells into, within and out of the tumor site: regulation by the inflammatory axis of TNFα and chemokines[J]. Cancer Microenviron, 2012, 5(2): 151-164. |
| [28] |
KOIVISTO T, SALASPURO M. Acetaldehyde alters proliferation, differentiation and adhesion properties of human colon adenocarcinoma cell line Caco-2[J]. Carcinogenesis, 1998, 19(11): 2031-2036. |
| [29] |
赵浩东. 酒精上调CCL5表达通过激活AMPK通路诱导自噬促进结直肠癌转移[D]. 合肥: 安徽医科大学. 2018. ZHAO H D. Alcohol upregulates CCL5 expression, induces autophagy by activating AMPK pathway and promotes colorectal cancer metastasis[D]. Hefei: Anhui Medical University. 2018. |
| [30] |
MANDAL P. Molecular signature of nitric oxide on major cancer hallmarks of colorectal carcinoma[J]. Inflammopharmacol, 2018, 26(2): 331-336. |
| [31] |
MCVICKER B, TUMA D J, LAZURE K E, et al. Alcohol, carcinoembryonic antigen processing and colorectal liver metastases[J]. Adv Exp Med Biol, 2015, 815: 295-311. |
| [32] |
NGUYEN A, KIM A H, KANG M K, et al. Chronic alcohol exposure promotes cancer stemness and glycolysis in oral/oropharyngeal squamous cell carcinoma cell lines by activating NFAT signaling[J]. Int J Mol Sci, 2022, 23(17): 9779. |
| [33] |
WANG S Y, XU M, LI F F, et al. Ethanol promotes mammary tumor growth and angiogenesis: the involvement of chemoattractant factor MCP-1[J]. Breast Cancer Res Treat, 2012, 133(3): 1037-1048. |
| [34] |
RIBEIRO A F, DE LACERDA R B, CORREIA D, et al. Possible involvement of ACSS2 gene in alcoholism[J]. J Neural Transm (Vienna), 2017, 124(9): 1151-1158. |
| [35] |
SUN L, KONG Y L, CAO M Q, et al. Decreased expression of acetyl-CoA synthase 2 promotes metastasis and predicts poor prognosis in hepatocellular carcinoma[J]. Cancer Sci, 2017, 108(7): 1338-1346. |




