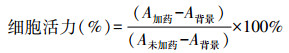2. 400038 重庆,陆军军医大学(第三军医大学)药学与检验医学系
2. Faculty of Pharmacy and Laboratory Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038, China
自2019年新型冠状病毒肺炎(corona virus disease 2019, COVID-19)暴发以来,新冠病毒(severe acute respiratory syndrome coronavirus 2, SARS-CoV-2)席卷全球给世界人民带来了巨大的灾难,同时,生物医药领域也开始了一场新冠疫苗研发竞赛。其中,mRNA疫苗凭借强大的免疫保护能力、高安全性、制备工艺简单、易于规模化生产、研发改进周期短以及可塑性强等优势,在众多候选者中脱颖而出[1-2]。新冠mRNA疫苗的成功第一次向人们展示了核酸疫苗的潜力。这一里程碑式的技术突破不仅得益于mRNA平台高效的目标蛋白翻译能力,而且更离不开mRNA递送载体——脂质纳米颗粒(lipid nanoparticle, LNP)的功劳。通过将可电离脂质、胆固醇、PEG化脂质、辅助脂质4组分包裹目标mRNA形成LNP,能保护mRNA免于在体内外复杂环境下被降解[3]。mRNA-LNP被摄取进入细胞后,通过“溶酶体逃逸”[4]将负载的mRNA释放到细胞质中并翻译为目标抗原,从而激活特异性免疫应答的发生。然而目前获批的COVID-19疫苗主要采用注射接种,无法在病毒入侵区域——呼吸道黏膜带来特异性免疫保护而降低病毒的传染能力[5]。
黏膜免疫作为机体免疫系统的重要组成部分,当抗原呈递细胞在黏膜相关淋巴组织中对淋巴细胞进行抗原展示和诱导后,B淋巴细胞进行抗体类别转换并最终产生抗原特异性sIgA,发挥中和作用降低黏液中病原体的感染能力[6-7],从而协助呼吸道黏膜屏障对病原体的防御[8]。然而,目前多以特异性血清抗体作为SARS-CoV-2疫苗评价指标,但血清中抗原特异性IgG和IgA只能反映机体应对病毒突破性感染后的获得性免疫应答水平。而外分泌型IgA因受限于受试者呼吸道黏液采样困难,并没有得到足够多的关注。但仍有研究发现,通过注射接种新冠mRNA疫苗的受试者,在其鼻拭子和唾液中未检测到抗原特异性sIgA[9-11]。而在轻症和无症状自然感染者样品中则存在高水平的抗原特异性sIgA[12-13],并且二聚体化的sIgA有高水平的病毒中和能力[6-7]。说明有效的黏膜免疫不仅能减轻COVID-19症状,也能降低病毒通过气溶胶传播的风险[14]。由此可见,开发呼吸道黏膜疫苗,为应对此类高传染性呼吸道病原体的威胁有重要意义。
有研究报道了一种核酸-多肽-泊洛沙胺自组装纳米颗粒用于治疗肺囊性纤维化[15],其组分合成多肽KG41含有3段功能化的基序:阳离子肽段用于吸附核酸;疏水肽段用于锚定疏水基团;靶向肽段提高针对肺部的递送能力[16]。此外,泊洛沙胺嵌段共聚物T704(Tetronic® 704),作为具有良好生物相容性材料泊洛沙姆的衍生物[17],其两亲性使其既能结合KG41的疏水肽段,又能增加混合物的溶解度,提高溶液稳定性[18]。本研究基于mRNA技术平台的优势,采用非复制mRNA骨架(图 1A),结合核酸-多肽-泊洛沙胺自组装递送体系[15](图 1B),制备mRNA-多肽-泊洛沙胺三元复合物(peptide polymer ternary complex, PPTC),并以多肽-mRNA二元复合物(KG41 binary complex, KG41-BC)和泊洛沙胺-mRNA二元复合物(T704 binary complex, T704-BC)作为对照,通过对KG41-BC、T704-BC和mRNA-PPTC纳米颗粒性质、体外递送能力、细胞毒性、体内呼吸道递送能力以及免疫后小鼠特异性抗体水平的考察,探讨mRNA-PPTC纳米颗粒作为新型呼吸道黏膜mRNA疫苗的潜力。
|
| A:非复制mRNA结构示意图;B:mRNA-PPTC示意图 图 1 mRNA结构及mRNA-多肽-泊洛沙胺纳米颗粒示意图 |
1 材料与方法 1.1 实验动物
6~8周龄,体质量约20 g的BALB/c雌鼠49只(购自北京维通利华公司),小鼠实验研究均得到陆军军医大学伦理委员会的批准(AMUWEC20210929),并遵循陆军军医大学和国家研究委员会关于动物实验和饲养的指导方针。
1.2 实验材料及试剂16HBE、DC2.4、RAW264.7细胞株为课题组自备。编码F-luc、EGFP、RBD蛋白的质粒由南京金斯瑞公司合成;多肽KG41由上海吉尔生化公司合成;泊洛沙胺704由德国巴斯夫公司合成;RPMI1640、DMEM、opti-MEM培养基、胎牛血清、Pen-Strep双抗、0.25%胰酶、1×PBS购自Gibco公司;BamH Ⅰ、Kpn Ⅰ、NEBufferTM r2.1、DNA上样缓冲液购自Biolabs公司;无核酶水、Lipofectamine2000购自Invitrogen公司;氯化钠、蛋白胨、酵母粉购自OXID公司;50×TAE、10×MOPs、吐温20、萤火虫荧光素酶报告基因检测试剂盒购自Beyotime公司;牛血清白蛋白、琼脂糖、核酸染料、DNA ladder、RNA上样缓冲液、RNA ladder购自ThermoScientific公司;T7高产量RNA转录试剂盒、Cap1加帽试剂盒购自APExBIO公司;TMB显色液、山羊抗小鼠IgG和IgA购自Abcam公司;异氟烷购自瑞沃德公司;D-荧光素钾盐购自PerkinElmer公司;Gel Extraction试剂盒购自Omega公司;Spin Miniprep试剂盒购自QIAGEN公司;CCK-8试剂购自MCE公司。
1.3 目标mRNA的制备 1.3.1 质粒提取无菌条件下取10 mL LB培养基加入氨苄西林至50 μg/mL,加入50 μL含目标质粒的大肠杆菌,37 ℃,220 r/min,培养12~16 h。按照试剂盒说明书提取目标质粒,并通过NanoDrop测量浓度和纯度。
1.3.2 质粒双酶切及纯化将质粒与BamH Ⅰ、Kpn Ⅰ、r2.1缓冲液混合,于PCR仪中37 ℃反应1 h。按照胶回收试剂盒说明书纯化所得线性DNA片段(转录模板),琼脂糖凝胶电泳验证DNA片段大小,并检测转录模板浓度和纯度。
1.3.3 体外转录及5’端加帽按照体外转录试剂盒说明书,将无核酶水、10×转录缓冲、模板DNA、ATP/GTP/CTP/GTP、转录酶按顺序加入PCR管中,于PCR仪中37 ℃反应3 h。完成后加入DNaseⅠ除去多余的模板DNA,氯化锂纯化。
按照加帽试剂盒说明书,将mRNA变性后按顺序加入10×加帽反应缓冲液、GTP、SAM供体分子、RNA酶抑制剂、甲基转移酶、牛痘病毒加帽酶,混匀后37 ℃反应30 min,氯化锂纯化。琼脂糖凝胶电泳验证mRNA大小,并检测mRNA终产物的纯度和浓度。
1.4 mRNA-PPTC纳米颗粒的制备及考察 1.4.1 二元及三元制剂的配制将等体积的10 mg/mL T704溶液与0.667 mg/mL KG41溶液置于2个注射器内,使用微流控装置(NanoFac A,四川铄亘科技有限公司)进行混合。将混合液与mRNA溶液以同样的方式配制为mRNA-PPTC三元制剂,4 ℃保存备用。mRNA-KG41和mRNA-T704二元制剂以同样的方法配制。
1.4.2 纳米颗粒粒径、PDI、Zeta电位以及形态的考察取适量三元与二元制剂用无核酶水稀释,于玻璃比色皿中使用马尔文粒度仪(Malvern Zetasizer)检测纳米颗粒流体动力学粒径、溶液多分散系数和粒子Zeta电位。
吸取制剂悬液滴于膜支持的铜网上,3%磷钨酸钾染色2 min,滤纸吸取多余染液,静置干燥4 h后使用透射电镜观察。
1.5 mRNA-PPTC体外递送能力的考察 1.5.1 通过化学发光考察制剂对不同细胞的转染能力将16HBE、DC2.4、RAW264.7细胞复苏,于37 ℃,5% CO2条件下培养箱中培养至60%~80%融合率,消化计数,调整细胞数量至2×104个/孔铺于96孔板中。将PBS缓冲液、400 ng裸F-luc mRNA以及各含400 ng F-luc mRNA的PPTC、KG41-BC、T704-BC、Lipofectamine® 2000制剂分别与100 μL opti-MEM混合后加入各孔中。于培养箱中培养4 h,更换opti-MEM为含双抗和FBS的RPMI1640培养基,继续培养24 h。使用F-luc报告基因检测试剂盒检测每孔化学发光信号相对强度。
1.5.2 通过荧光考察制剂在16HBE细胞中的转染能力将400 ng裸EGFP mRNA和各含400 ng EGFP mRNA的三元和二元制剂,按1.5.1中步骤转染16HBE细胞。完成后加入PBS润洗并弃去孔内液体。使用倒置荧光显微镜观察。
1.5.3 CCK-8检测制剂细胞毒性将16HBE、DC2.4、RAW264.7细胞按1×104个/孔铺于96孔板中,于培养箱中培养4 h,待细胞贴壁,按1.5.1中步骤向各孔中加入裸mRNA、Lipofectamine® 2000、二元和三元制剂。继续培养24 h后,每孔加入10 μL CCK-8试剂,于培养箱中再孵育4 h。测定每孔450 nm波长处光密度并按下述公式计算制剂对细胞活力的影响。
1.6 mRNA-PPTC体内递送能力的考察 1.6.1 不同制剂呼吸道递送能力异氟烷麻醉BALB/c雌鼠,抬起小鼠头部使呼吸道与躯干呈180°,将各含3 μg F-luc mRNA的二元和三元制剂,1×PBS和3 μg裸mRNA,向各组小鼠左右鼻孔各滴20 μL,间隔8 min。给药24 h后,腹腔注射1.1%戊巴比妥钠溶液,待完全麻醉后使用脱毛膏暴露小鼠胸口皮肤,腹腔注射D-荧光素钾盐溶液100 μL/只。5 min后将小鼠放入活体成像系统检测化学发光信号。完成后将小鼠脱颈处死,取出肝脏、脾脏和全肺,1×PBS漂洗。将脏器放入活体成像系统检测化学发光信号。使用Living Image软件计算圈选区域的光通量。
1.6.2 mRNA-PPTC不同时间点的呼吸道递送能力随机选取10只6~8周龄的BALB/c雌鼠,按1.6.1中方法将F-luc mRNA-PPTC制剂滴鼻给药,在给药后6、12、24、48、72 h时间点取小鼠肝脏、脾脏和全肺进行化学发光信号检测。
1.7 mRNA-PPTC诱导小鼠特异性抗体水平的考察 1.7.1 实验小鼠免疫计划将24只6~8周龄,体质量约20 g的BALB/c雌鼠置于同一笼中并打乱次序,随机挑选8只为一组,均分为3组。将1×PBS溶液以及各含3 μg RBD mRNA的PPTC、T704-BC制剂按照1.6.1中操作滴鼻给药。初次滴鼻免疫记为第0天,在第21天以同等剂量进行二次滴鼻加强免疫,并于初次免疫后第7、14、21、28、35、42、49天采集小鼠血液样本,于第28天脱颈处死小鼠后采集支气管肺泡灌洗液样本。
1.7.2 血清和支气管肺泡灌洗液(BALF)样品采集尾静脉采集实验小鼠血液,待完全凝血后,离心并取上层血清于-80 ℃待用。将28 d实验小鼠脱颈处死,无菌条件下,打开胸腔并剪开纵隔使胸腔与外界连通。剪开小鼠颈部皮肤和肌肉,暴露气管软骨并开口约2 mm,使用气管留置针将气管软管引入,使用冰冷的1×PBS灌洗肺叶,于-80 ℃待用。
1.7.3 ELISA将含2 mg/L RBD的包被液按100 μL/孔加入96孔板中,于4 ℃包被过夜。弃去孔内液体,每孔加入1×PBST洗板,重复3遍。将含1% BSA的1×PBST加入孔中,于4 ℃封闭过夜,洗板。使用含0.5% BSA的1×PBST按需求稀释血清和BALF样本后加入孔中,于37 ℃孵育1 h,洗板。将稀释后的山羊抗小鼠IgG、IgA分别加入血清、BALF样本孔中,于37 ℃孵育40 min,洗板。避光加入TMB显色液显色,加入终止液终止反应。使用酶标仪在450 nm波长处检测光密度。
1.8 统计学分析采用GraphPad Prism 8.0进行统计学分析,数据以x±s表示,组间比较行单因素方差分析,P < 0.05表示差异有统计学意义。
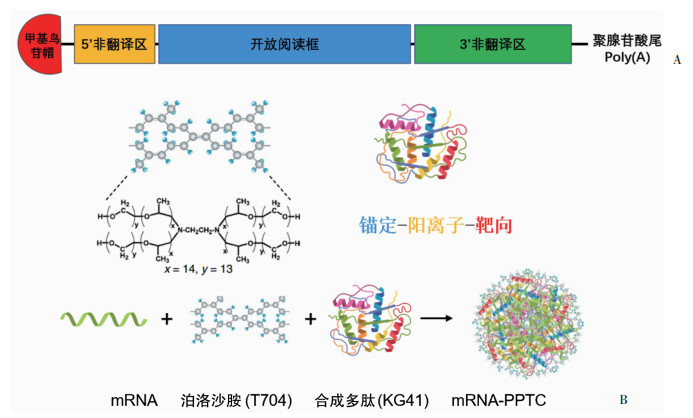
2 结果 2.1 目标mRNA制备将分别编码RBD、EGFP、F-luc蛋白的质粒和酶切反应后产物同时进行DNA凝胶电泳,结果如图 2A所示,依据DNA ladder判断,3种目标质粒及酶切后转录模板无误。将体外转录所得分别编码RBD、EGFP、F-luc蛋白的mRNA和5’端加帽后mRNA同时进行RNA凝胶电泳,结果如图 2B所示,依据RNA ladder判断,3种目标mRNA及5’端加帽后终产物制备成功,可用于后续实验。
|
| A:质粒及转录模板 1:DNA ladder;2、4、6:依次为RBD、EGFP、F-luc质粒;3、5、7:依次为RBD、EGFP、F-luc质粒双酶切后产物;B:体外转录及加帽产物 1:RNA ladder;2、4、6:依次为转录后RBD、EGFP、F-luc mRNA;3、5、7:依次为5’端加帽后RBD、EGFP、F-luc mRNA 图 2 mRNA体外转录各级产物凝胶电泳结果 |
2.2 mRNA-PPTC纳米颗粒制备结果
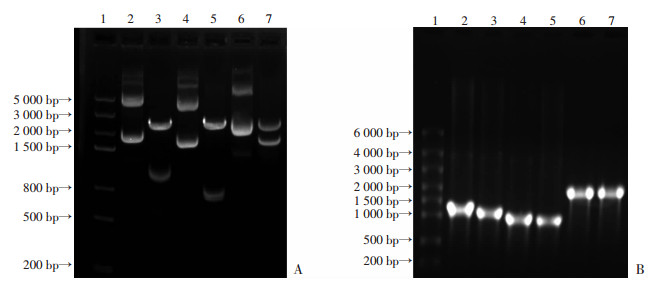
如图 3A~C所示,mRNA-PPTC三元制剂较KG41-BC和T704-BC二元对照制剂有更小的流体动力学粒径[(96.63±1.34)nm],较低的多分散系数PDI=0.210±0.003,并且Zeta电位为(+14.625±0.554)mV。提示其小粒径更易于穿过生物屏障,低PDI而悬液稳定性较好,并且在水溶液中呈弱阳离子态而细胞毒性较低。此外,通过透射电镜观察,mRNA-PPTC呈近球形的纳米颗粒,并且表面光滑,大小均一(图 3D)。以上结果表明mRNA-PPTC为粒径约100 nm的弱阳离子球形纳米颗粒,并且制剂悬液有较好的分散性。
|
| A:流体动力学粒径;B:溶液多分散系数;C:粒子Zeta电位;D:透射电镜下mRNA-PPTC形态 图 3 不同纳米颗粒理化性质考察 |
2.3 mRNA-PPTC体外递送能力
含F-luc报告基因的二元、三元制剂和各对照试剂转染16HBE、DC2.4、RAW264.7细胞系后,在16HBE细胞中PPTC组较其他二元制剂组均有更强的化学发光信号(P < 0.01,图 4A)。对于DC2.4细胞,PPTC组较KG41二元制剂组化学发光信号强度无差异,而较T704二元制剂组有统计学差异(P < 0.01,图 4B)。在RAW264.7细胞中,PPTC组较所有对照组(包括转染试剂Lipofectamine® 2000)有最强的化学发光信号(P < 0.01,图 4C)。通过CCK-8实验发现,PPTC制剂对于16HBE、DC2.4和RAW264.7细胞活力无显著影响(图 4D~F)。以上结果提示mRNA-PPTC三元制剂较KG41-mRNA或T704-mRNA二元制剂对支气管上皮细胞、树突状细胞和巨噬细胞都有更高的体外递送效率。mRNA-PPTC对3种细胞系均无显著毒性。
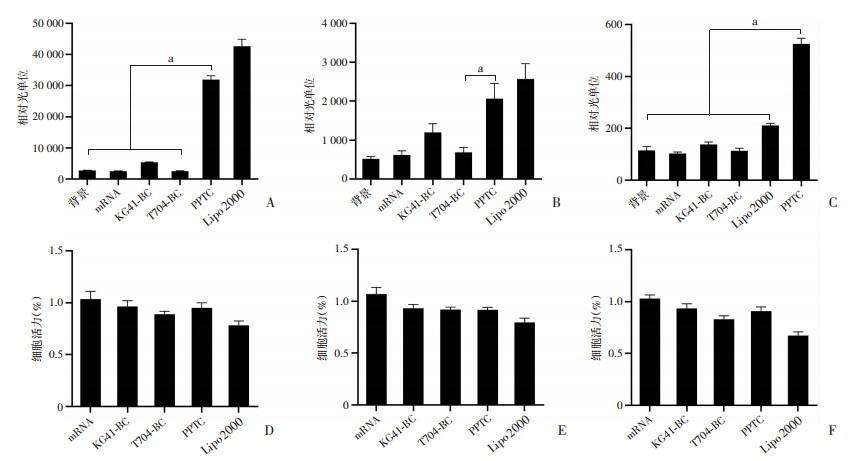
|
| A~C:不同制剂转染16HBE(A)、DC2.4(B)、RAW264.7(C)细胞后化学发光强度;D~F:不同制剂对16HBE(D)、DC2.4(E)、RAW264.7(F)细胞活力的影响 图 4 F-luc报告基因体外转染能力及制剂细胞毒性 |
如图 5所示,含EGFP报告基因的二元和三元制剂组转染16HBE细胞后,PPTC三元制剂组较KG41或T704二元制剂组有更强的绿色荧光蛋白表达。该结果再次显示mRNA-PPTC能在体外有效转染支气管上皮细胞。
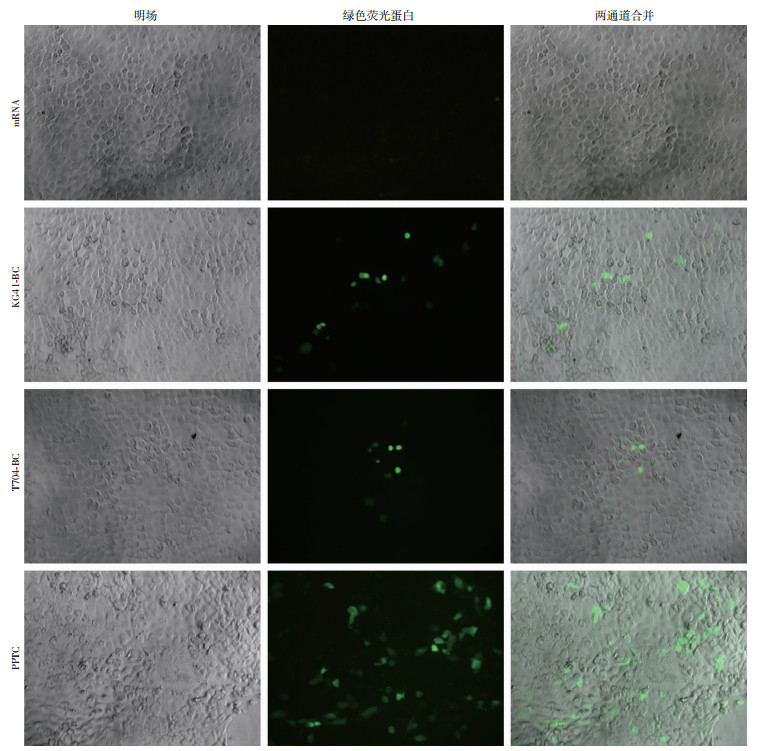
|
| 图 5 不同制剂EGFP报告基因在16HBE细胞中的表达情况 (×200) |
2.4 mRNA-PPTC体内递送能力
含F-luc报告基因的二元、三元制剂和对照试剂滴鼻给药后,在小鼠鼻部PPTC制剂组较其他组具有更强的化学发光信号(P < 0.01,图 6A、D)。小鼠肝脏和脾脏均无F-luc表达,而在肺组织中PPTC制剂组较其他组具有最强的化学发光信号(P < 0.01,图 6B、E)。如图 6C、F所示,肺组织中化学发光信号强度于mRNA-PPTC滴鼻给药后24 h达到峰值,并且mRNA能持续表达至72 h。以上结果提示mRNA-PPTC纳米颗粒通过呼吸道给药后,能在小鼠鼻部和肺组织中有效表达目标mRNA,并且不会递送至肝脏和脾脏。同时,其能在肺组织中持续翻译目的蛋白72 h。鉴于KG41-BC二元制剂体内递送能力不佳,后续动物免疫实验不再设其为实验分组。
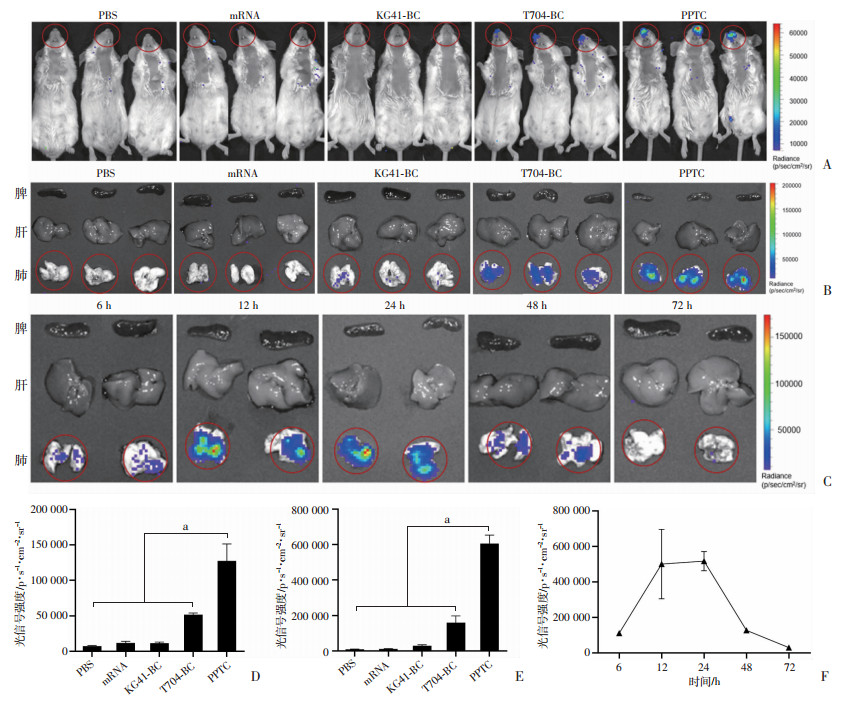
|
|
a: P < 0.01;红色圈选区域:所统计的化学发光信号 A、D:F-luc报告基因在小鼠鼻部表达情况;B、E:F-luc报告基因在小鼠肺组织表达情况;C、F:mRNA-PPTC滴鼻后不同时间点肺组织中F-luc报告基因表达情况 图 6 不同制剂体内递送能力 |
2.5 免疫后小鼠样品中特异性抗体水平
小鼠按图 7A所示免疫方案滴鼻免疫和采样后,通过检测第7、14、21、28、35、42、49天的血清样本中RBD特异性IgG光密度,发现自初次免疫后28 d(加强免疫后7 d)起,血清中特异性IgG进入平台期(图 7B)。随后对初免后第28天(加强免疫后7 d)的血清和BALF样品中特异性抗体进行考察,发现PPTC三元制剂组RBD特异性血清IgG滴度,较T704二元制剂组显著提高(P < 0.01,图 7C)。PPTC三元制剂组支气管肺泡灌洗液RBD特异性sIgA滴度显著高于T704二元制剂组(P < 0.05,图 7D)。以上结果提示滴鼻接种mRNA-PPTC纳米颗粒,能有效诱导小鼠产生高水平的抗原特异性血清IgG和支气管肺泡灌洗液sIgA。
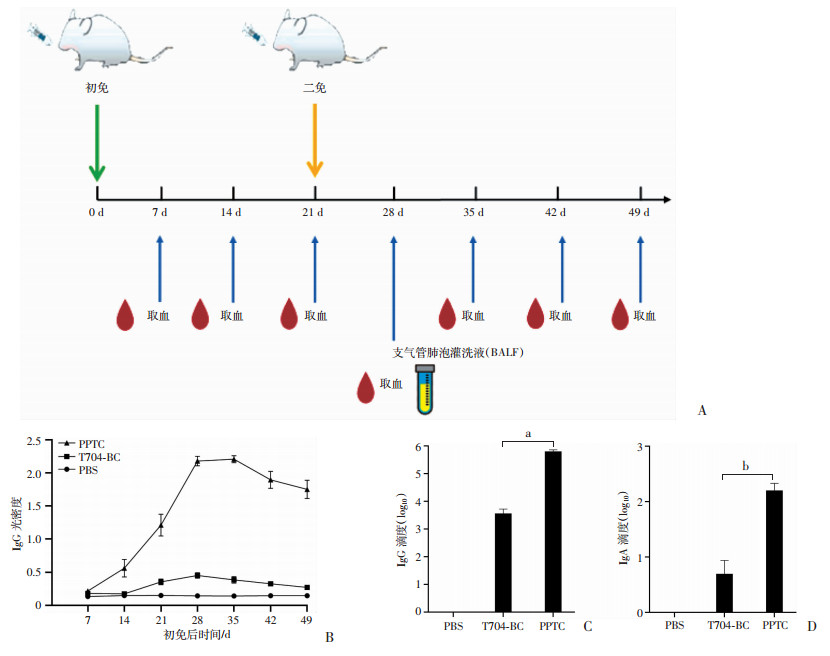
|
|
a: P < 0.01,b: P < 0.05 A:小鼠免疫及采样计划;B:时间-特异性血清IgG光密度折线图;C:初次免疫后第28天RBD特异性血清IgG滴度;D:初次免疫后第28天RBD特异性支气管肺泡灌洗液(BALF)sIgA滴度 图 7 免疫计划及特异性血清IgG和支气管肺泡灌洗液(BALF)sIgA效价考察 |
3 讨论
在新冠疫情中大放异彩的mRNA疫苗,凭借mRNA表达平台可塑性强、翻译效率可控、功能化模块设计、结构简单、成本低等优势已成为生物医药领域的新星[2]。目前除了mRNA-1273和BNT162b2所采用的非复制mRNA结构外,还有自扩增、反扩增、环状mRNA等类型也处于研究开发中[19-22],可见mRNA表达平台拥有广泛的应用前景。然而,mRNA分子极易被环境中无处不在的核酸酶降解,并且需要成功递送至目标组织脏器,才能发挥其生物学效应。而纳米颗粒载体便是保护mRNA在体内高效表达的有力助手。
SARS-CoV-2作为呼吸道感染病毒,传统的注射接种疫苗只能在其突破呼吸道黏膜屏障后,再唤起特异性免疫记忆进行应答[23]。虽然通过注射接种的疫苗能诱导机体产生强大的SARS-CoV-2抗原特异性体液和细胞免疫,并大大降低罹患重症和死亡的风险。但并不能通过增强呼吸道黏膜免疫防御(如特异性外分泌型IgA[5])来降低病毒的传染风险。同时,目前全球范围内多达11大类新冠突变株也使第一代疫苗面临保护力衰减、抗体逃逸以及需要再次加强免疫等问题[24]。故开发呼吸道黏膜mRNA疫苗,对预防各类呼吸道传染病以及处于新冠后疫情时代的我们都有重要意义。
本研究基于mRNA技术平台的优势,以及核酸-多肽-泊洛沙胺三元自组装递送体系[15, 25],设计了mRNA-PPTC呼吸道黏膜疫苗。相较于mRNA-KG41或mRNA-T704二元制剂,其粒径[(96.63±1.34) nm] 较小易于跨过生物屏障[26];呈弱阳离子态[(+14.625± 0.554) mV]而毒性较低[27-28];PDI较小(0.210±0.003)有良好的分散性[29-30]。在细胞实验中,mRNA-PPTC纳米颗粒无明显细胞毒性,在体外能高效转染人支气管上皮细胞、鼠源树突状细胞和巨噬细胞。在体内递送能力考察中,mRNA-PPTC通过滴鼻给药后,在小鼠鼻部和肺组织中显著提升了目标mRNA的表达水平,说明其具有良好的mRNA呼吸道黏膜递送能力,并且能在72 h内持续表达,有助于维持目标抗原在呼吸道黏膜的存在。而二元制剂KG41-BC或T704-BC无论对体外细胞的转染效率,还是在体内呼吸道组织表达目的mRNA的能力都不如三元制剂mRNA-PPTC,说明多肽KG41和泊洛沙胺T704是该递送体系发挥高效核酸递送能力不可或缺的组分[15]。
随后我们将编码新冠病毒RBD蛋白的mRNA装载至PPTC,获得mRNA-PPTC疫苗制剂。滴鼻免疫小鼠后诱导宿主产生了高滴度的抗原特异性血清IgG(1/640 000)和支气管肺泡灌洗液sIgA(1/160),说明其不仅能诱导体循环获得性免疫应答,也能提升呼吸道黏膜免疫水平。此外,高水平的特异性sIgA能延缓病毒“突破性感染”的速度,给予宿主免疫系统更多时间启动获得性免疫应答,从而降低COVID-19患者重症风险[31],同时也具有降低气溶胶传播风险的潜在能力,弥补了传统注射接种疫苗无法在呼吸道产生特异性免疫防御的缺陷[8, 32]。虽然mRNA-PPTC纳米颗粒被细胞摄取后的命运还有待研究,但是“质子海绵”假说[33]认为,阳离子纳米颗粒被胞吞进入内涵体后,在酸性环境中发生质子缓冲效应,溶酶体膜被破坏,装载的mRNA通过“溶酶体逃逸”被释放到细胞质中,并借助核糖体翻译目标免疫原[34],以类似病毒感染宿主细胞的方式,从而激活特异性免疫应答的发生。
综上所述,本研究通过对mRNA-PPTC纳米颗粒粒径、电位、形态、溶液分散性、细胞毒性、体外以及体内递送能力、免疫后特异性抗体诱导能力的考察,初步探索了mRNA-PPTC纳米颗粒作为黏膜mRNA疫苗的潜力。为后续考察其抗体中和能力、细胞免疫诱导能力、免疫保护率等指标做了铺垫;为进一步优化其生物相容性和制备工艺等条件,开发吸入式mRNA疫苗提供了参考。
| [1] |
HOGAN M J, PARDI N. mRNA vaccines in the COVID-19 pandemic and beyond[J]. Annu Rev Med, 2022, 73: 17-39. |
| [2] |
FANG E Y, LIU X H, LI M, et al. Advances in COVID-19 mRNA vaccine development[J]. Signal Transduct Target Ther, 2022, 7(1): 94. |
| [3] |
ROHNER E, YANG R, FOO K S, et al. Unlocking the promise of mRNA therapeutics[J]. Nat Biotechnol, 2022, 40(11): 1586-1600. |
| [4] |
WITTRUP A, AI A, LIU X, et al. Visualizing lipid-formulated siRNA release from endosomes and target gene knockdown[J]. Nat Biotechnol, 2015, 33(8): 870-876. |
| [5] |
TANG J, CAI L, XU C F, et al. Nanotechnologies in delivery of DNA and mRNA vaccines to the nasal and pulmonary mucosa[J]. Nanomaterials (Basel), 2022, 12(2): 226. |
| [6] |
SUN L, KALLOLIMATH S, PALT R, et al. Increased in vitro neutralizing activity of SARS-CoV-2 IgA1 dimers compared to monomers and IgG[J]. Proc Natl Acad Sci USA, 2021, 118(44): e2107148118. |
| [7] |
WANG Z J, LORENZI J C C, MUECKSCH F, et al. Enhanced SARS-CoV-2 neutralization by dimeric IgA[J]. Sci Transl Med, 2021, 13(577): eabf1555. |
| [8] |
HAMEED S A, PAUL S, DELLOSA G K Y, et al. Towards the future exploration of mucosal mRNA vaccines against emerging viral diseases; lessons from existing next-generation mucosal vaccine strategies[J]. NPJ Vaccines, 2022, 7(1): 71. |
| [9] |
LAMBIASE A, SACCHETTI M, MALLONE F, et al. Evaluation of the effectiveness of BNT162b2 primary vaccination and booster dose to SARS-CoV-2 in eliciting stable mucosal immunity[J]. Biomedicines, 2022, 10(10): 2430. |
| [10] |
SHEIKH-MOHAMED S, ISHO B, CHAO G Y C, et al. Systemic and mucosal IgA responses are variably induced in response to SARS-CoV-2 mRNA vaccination and are associated with protection against subsequent infection[J]. Mucosal Immunol, 2022, 15(5): 799-808. |
| [11] |
GUERRIERI M, FRANCAVILLA B, FIORELLI D, et al. Nasal and salivary mucosal humoral immune response elicited by mRNA BNT162b2 COVID-19 vaccine compared to SARS-CoV-2 natural infection[J]. Vaccines (Basel), 2021, 9(12): 1499. |
| [12] |
CHAN R W Y, CHAN K C C, LUI G C Y, et al. Mucosal antibody response to SARS-CoV-2 in paediatric and adult patients: a longitudinal study[J]. Pathogens, 2022, 11(4): 397. |
| [13] |
THOMAS A C, OLIVER E, BAUM H E, et al. Evaluation of isotype specific salivary antibody assays for detecting previous SARS-CoV-2 infection in children and adults[J]. medRxiv, 2022. |
| [14] |
FRÖBERG J, GILLARD J, PHILIPSEN R, et al. SARS-CoV-2 mucosal antibody development and persistence and their relation to viral load and COVID-19 symptoms[J]. Nat Commun, 2021, 12(1): 5621. |
| [15] |
GUAN S, MUNDER A, HEDTFELD S, et al. Self-assembled peptide-poloxamine nanoparticles enable in vitro and in vivo genome restoration for cystic fibrosis[J]. Nat Nanotechnol, 2019, 14(3): 287-297. |
| [16] |
WRITER M J, MARSHALL B, PILKINGTON-MIKSA M A, et al. Targeted gene delivery to human airway epithelial cells with synthetic vectors incorporating novel targeting peptides selected by phage display[J]. J Drug Target, 2004, 12(4): 185-193. |
| [17] |
ALVAREZ-LORENZO C, REY-RICO A, SOSNIK A, et al. Poloxamine-based nanomaterials for drug delivery[J]. Front Biosci (Elite Ed), 2010, 2(2): 424-440. |
| [18] |
REY-RICO A, CUCCHIARINI M. PEO-PPO-PEO tri-block copolymers for gene delivery applications in human regenerative medicine—an overview[J]. Int J Mol Sci, 2018, 19(3): 775. |
| [19] |
MCKAY P F, HU K, BLAKNEY A K, et al. Self-amplifying RNA SARS-CoV-2 lipid nanoparticle vaccine candidate induces high neutralizing antibody titers in mice[J]. Nat Commun, 2020, 11(1): 3523. |
| [20] |
POLLOCK K M, CHEESEMAN H M, SZUBERT A J, et al. Safety and immunogenicity of a self-amplifying RNA vaccine against COVID-19: COVAC1, a phase I, dose-ranging trial[J]. EClinicalMedicine, 2022, 44: 101262. |
| [21] |
BEISSERT T, PERKOVIC M, VOGEL A, et al. A trans-amplifying RNA vaccine strategy for induction of potent protective immunity[J]. Mol Ther, 2020, 28(1): 119-128. |
| [22] |
QU L, YI Z Y, SHEN Y, et al. Circular RNA vaccines against SARS-CoV-2 and emerging variants[J]. Cell, 2022, 185(10): 1728-1744. e16. |
| [23] |
LAVELLE E C, WARD R W. Mucosal vaccines—fortifying the frontiers[J]. Nat Rev Immunol, 2022, 22(4): 236-250. |
| [24] |
BAROUCH D H. Covid-19 vaccines-immunity, variants, boosters[J]. N Engl J Med, 2022, 387(11): 1011-1020. |
| [25] |
SUN S, LI E T, ZHAO G, et al. Respiratory mucosal vaccination of peptide-poloxamine-DNA nanoparticles provides complete protection against lethal SARS-CoV-2 challenge[J]. Biomaterials, 2023, 292: 121907. |
| [26] |
HASSETT K J, HIGGINS J, WOODS A, et al. Impact of lipid nanoparticle size on mRNA vaccine immunogenicity[J]. J Control Release, 2021, 335: 237-246. |
| [27] |
LV H T, ZHANG S B, WANG B, et al. Toxicity of cationic lipids and cationic polymers in gene delivery[J]. J Control Release, 2006, 114(1): 100-109. |
| [28] |
CLOGSTON J D, PATRI A K. Zeta potential measurement[J]. Methods Mol Biol, 2011, 697: 63-70. |
| [29] |
DANAEI M, DEHGHANKHOLD M, ATAEI S, et al. Impact of particle size and polydispersity index on the clinical applications of lipidic nanocarrier systems[J]. Pharmaceutics, 2018, 10(2): 57. |
| [30] |
SULTANA S, ALZAHRANI N, ALZAHRANI R, et al. Stability issues and approaches to stabilised nanoparticles based drug delivery system[J]. J Drug Target, 2020, 28(5): 468-486. |
| [31] |
RUSSELL M W, MESTECKY J. Mucosal immunity: the missing link in comprehending SARS-CoV-2 infection and transmission[J]. Front Immunol, 2022, 13: 957107. |
| [32] |
METTELMAN R C, ALLEN E K, THOMAS P G. Mucosal immune responses to infection and vaccination in the respiratory tract[J]. Immunity, 2022, 55(5): 749-780. |
| [33] |
BUS T, TRAEGER A, SCHUBERT U S. The great escape: how cationic polyplexes overcome the endosomal barrier[J]. J Mater Chem B, 2018, 6(43): 6904-6918. |
| [34] |
SMITH S A, SELBY L I, JOHNSTON A P R, et al. The endosomal escape of nanoparticles: toward more efficient cellular delivery[J]. Bioconjug Chem, 2019, 30(2): 263-272. |