在哺乳动物中的胚胎发育过程中,肾脏的发育一般要经历3个阶段:前肾、中肾和后肾。人胚胎第22天(小鼠胚胎第8天)生肾索的头端发育为前肾。人胚胎第24天(小鼠胚胎第9.5天)前肾导管向尾侧延伸形成上皮性的中肾导管,中肾导管及其周围的中胚层肾发生带一起形成中肾。随着时间的推移,在人胚胎第28天(小鼠胚胎第10.5天)时,中肾导管尾端向背侧形成输尿管芽,其周围环绕的中胚层间充质为后肾间充质,输尿管芽和后肾间充质组成后肾,二者相互诱导,促使后肾发育成熟[1-2]。其中,前肾和中肾属于暂时性器官,会逐步退化,只有后肾会发育成永久性的肾脏[3-4]。后肾的发育离不开细胞增殖、细胞分化以及细胞衰老等过程。细胞衰老也是胚胎发育过程中的关键过程,在胚胎发育过程中起积极作用[5-6]。细胞衰老是一个由各种压力导致的不可逆转的生长停止状态的过程[7-9]。当衰老细胞通过巨噬细胞介导的清除被去除时,它们通过消除瞬时结构而有助于形态发生。而发育中的细胞衰老主要由P21介导,并由TGFβ/SMAD和FOXO/PI3K信号通路调节。此外,胚胎衰老细胞与癌基因诱导的衰老有共同的表达特征,尤其是与衰老相关分泌表型(senescence-associated secretory phenotype,SASP)相关的细胞[10-11]。基于此,本研究通过转录组学,利用RNA-seq技术,对小鼠胚龄14.5 d(后肾发育早期)和18.5 d(后肾发育晚期)的肾脏差异表达基因进行生物信息学分析,研究胚肾发育过程中细胞衰老相关基因的变化,为后续胚肾发育的研究奠定基础。
1 材料与方法 1.1 实验动物与分组健康C57BL/6雄性小鼠15只和C57BL/6雌性小鼠30只,SPF级,8周龄左右,体质量22~25 g,均购自北京维通利华实验动物技术有限公司。雄性小鼠和雌性小鼠按1∶2合笼,每天早、晚2次检查雌性小鼠是否出现阴栓,以看到阴栓的时间计为胚龄0.5 d。本实验分为2组:胚龄14.5 d(E14.5)组和胚龄18.5 d(E18.5)组。
1.2 仪器和材料Agilent 2100 Bioanalyzer购自美国安捷伦(Agilent) 科技有限公司,Illumina NovaSeq 6000购自美国因美纳(Illumina)公司,解剖显微镜购自德国徕卡(Leica)仪器有限公司,光学显微镜购自德国徕卡(Leica)仪器有限公司,实时荧光定量PCR仪购自美国伯乐(Bio-Rad)生命医学产品公司,TRIzol购自美国(Ambion)生命技术公司,PCR逆转录试剂购自美国普洛麦格(Promega)公司,RIPA裂解液购自中国碧云天生物技术有限公司,BCA蛋白浓度测定试剂盒购自中国碧云天生物技术有限公司,蛋白免疫印迹成像仪购自美国伯乐(Bio-Rad)生命医学产品公司。
1.3 胚肾取材将怀孕14.5 d或18.5 d的母鼠麻醉后解剖,取出胎盘,剥离出胚胎,把胚胎放入装有生理盐水的培养皿中,置于解剖显微镜下,调节合适的亮度、放大倍数和焦距,使用一把直尖头镊子固定住胚胎,另一把直尖头镊子先去除胚胎上肢及头部的部分,接着去除尾部和下肢,再剥离背部的皮肤组织,去除腹腔内的肝脏、肺、心脏等器官组织后,可看到红色的腹主动脉,小心地剥离腹主动脉,一般2个后肾会与腹主动脉相连,最后剥离后肾周围的组织,得到完整的肾脏组织。
1.4 PAS染色取出肾脏组织后,10%中性福尔马林溶液固定,经过乙醇脱水、三氯甲烷透明、石蜡包埋后,用石蜡切片机进行切片,切片厚度为1.5 μm。烤片过后脱蜡复水,室温浸染高碘酸氧化,62 ℃浸染Schiff氏液,苏木精染细胞核,二甲苯透明后使用中性树脂封片。光学显微镜下观察不同年龄段的小鼠肾脏组织结构。
1.5 转录组测序使用TRIzol从每组0.3 g肾脏组织中提取总RNA后,使用Agilent 2100 bioanalyzer精确检测RNA完整性和总量。通过Oligo(dT)磁珠富集带有polyA尾的mRNA,随后在Fragmentation Buffer中用二价阳离子将得到的mRNA随机打断。以片段化的mRNA为模版,随机寡核苷酸为引物,在M-MuLV逆转录酶体系中合成cDNA第1条链,随后用RNaseH降解RNA链,并在DNA polymerase Ⅰ体系下,以dNTPs为原料合成cDNA第2条链。纯化后的双链cDNA经过末端修复、加A尾并连接测序接头,用AMPure XP beads筛选370~420 bp的cDNA,进行PCR扩增并再次使用AMPure XP beads纯化PCR产物,最终获得文库。库检合格后,把不同文库按照有效浓度及目标下机数据量的需求汇总后用Illumina NovaSeq 6000进行测序。
1.6 转录组数据分析对原始数据进行过滤,去除带接头的序列数据(reads)、无法确定碱基的reads和低质量reads(Qphred ≤20的碱基数占整个read长度的50%以上的reads),得到clean reads。从基因组网站下载参考基因组和基因模型注释文件,使用HISAT2 (v2.0.5) 将配对末端clean reads与参照基因组比对。用featureCounts(1.5.0-p3)计算映射到每个基因的读数,然后根据基因的长度计算每个基因的FPKM (fragments per kilobase of exon model per million mapped fragments,指每百万碱基对测序的转录本序列片段的每千碱基片段的预期数量),并计算映射到该基因的读数。使用皮尔逊相关系数的平方(R2) 检验实验的可靠性和样本的重复性。使用DESeq2软件(1.20.0)进行2个比较组合之间的差异表达分析。使用Benjamini和Hochberg的方法来调整所得P值(Padj)以控制错误发现率,P<0.05且|log2(fold change)|>1被设定为显著差异表达的阈值。通过clusterProfiler (3.8.1)软件实现差异表达基因的GO富集分析。使用clusterProfiler(3.8.1)软件分析KEGG通路中差异表达基因的统计富集。
1.7 实时荧光定量PCR(qRT-PCR)用TRIzol裂解法对肾脏中的RNA进行提取,再使用Promega逆转录试剂将RNA逆转录成cDNA。由上海生工生物工程技术服务有限公司合成引物,引物详见表 1。RT-qPCR反应体系:qPCR Mix 12.5 μL,上下游引物各1 μL,cDNA 2 μL,ddH2O 8.5 μL。PCR反应条件为:94 ℃ 20 s,94 ℃ 10 s,60 ℃ 20 s,40个循环,65~95 ℃。以GAPDH作为内参对照,采用2-ΔΔCt法计算每个样本的mRNA相对量。
| 基因 | 序列 |
| GAPDH(内参) | 上游5′-AGGTCGGTGTGAACGGATTTG-3′ |
| 下游5′- GGGGTCGTTGATGGCAACA-3′ | |
| Cdkn1a(P21) | 上游5′- TGATCTGCTGCTCTTTTCC-3′ |
| 下游5′-TACATTCCCTTCCAGTCCA -3′ | |
| Skp2 | 上游5′-AAACGAGTCAAGGGCAAA-3′ |
| 下游5′-AAAAGATCCCAAGGAGCAG-3′ | |
| Ccne1 | 上游5′-CCCAAGTCCTGAGCCAT-3′ |
| 下游5′-TCGGAGCCACCTTCTTC-3′ | |
| Ccnd2 | 上游5′-CCGTTCTTGGCTCTGGT-3′ |
| 下游5′-AGGCACCTGTTGAAACTGA-3′ | |
| Cdk4 | 上游5′-GGGACCTGAAGCCAGAG-3′ |
| 下游5′-CAGAGCGTAACCACCACA-3′ |
1.8 Western blot
使用RIPA裂解液提取胚肾组织中的蛋白,使用BCA蛋白浓度测定试剂盒对蛋白浓度进行量化。取30 μg的蛋白样品进行SDS-PAGE凝胶电泳分离蛋白,再转印到PVDF膜上,用5%脱脂奶粉封闭后,4 ℃孵育P21(1∶500,美国Santa Cruz)一抗溶液过夜。次日,TBST洗膜3次后,室温孵育HRP偶联二抗(1∶2 000,中国)1 h,最后使用蛋白免疫印迹成像仪(美国Bio-Rad)进行可视化分析。
1.9 统计学分析使用GraphPad Prism 6.0进行分析和绘图。数据以x±s表示,使用非配对双尾t检验进行比较,P<0.05表示差异具有统计学意义。
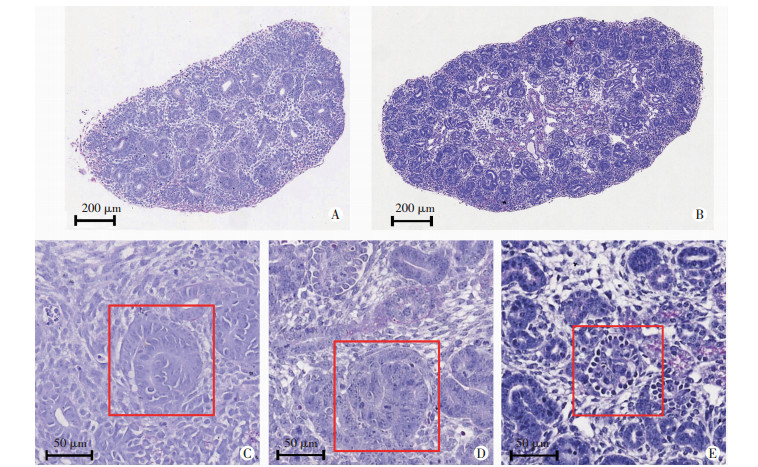
2 结果 2.1 胚肾发育过程中肾脏结构的变化对每组的肾脏组织进行PAS染色,结果显示,E18.5组的肾脏明显大于E14.5组的肾脏,且结构更复杂(图 1A、B)。E14.5组可见逗号样小体和S小体出现在输尿管芽周围(图 1C、D);E18.5组可见已有成熟的肾小管形成,同时有肾小体和早期髓质出现(图 1E)。
|
| A:E14.5组小鼠肾脏PAS染色结果;B:E18.5组小鼠肾脏PAS染色结果;C:E14.5组小鼠肾脏的结构方框示逗号小体;D:E14.5组小鼠肾脏的结构方框示S小体;E:E18.5组小鼠肾脏的结构方框示肾小体 图 1 不同组小鼠肾脏PAS染色观察 |
2.2 转录组学分析胚肾发育过程中差异表达基因变化
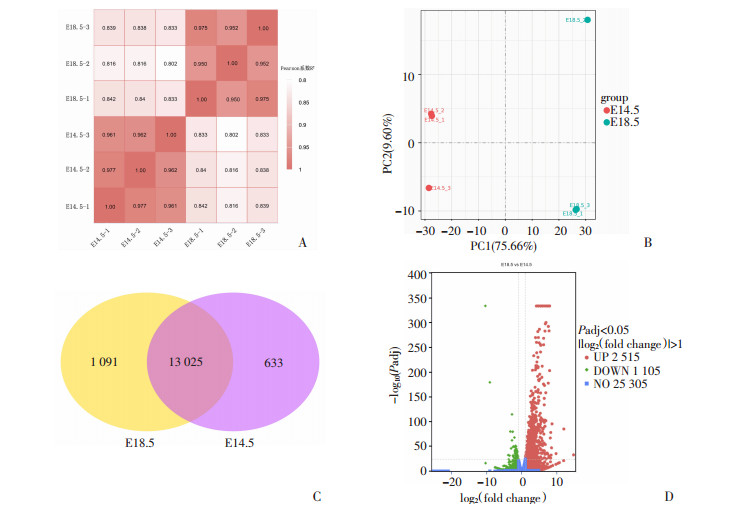
通过对转录组测序结果进行Pearson分析,结果显示各组3个重复序列之间具有较好的相似性,即Pearson系数R2>0.95(图 2A);主成分分析(PCA)结果显示,E14.5组和E18.5组的数据在PC1较集中(图 2B),表明E14.5组和E18.5组的样本组内重复性较好。韦恩图显示E18.5组和E14.5组之间共筛选到14 749个差异表达基因,其中共有的差异表达基因有13 025个(图 2C)。火山图显示,E18.5组与E14.5组相比,差异表达水平≥2倍的基因有3 620个,其中有2 515个基因表达显著上调,有1 105个基因表达显著下调(图 2D)。表达显著上调的基因有Kap、Serpina6、Ugt3a2等,表达显著下调的基因有Xist、Hba-x、Hbb-y等, 见表 2。
|
| A:样本间相关性热图;B:主成分分析;C:差异表达基因韦恩图;D:差异表达基因火山图红色代表表达显著上调的基因,绿色代表表达显著下调的基因,蓝色代表没有显著差异的基因 图 2 E18.5组vs E14.5组差异表达基因分析 |
| 基因编号 | 基因名称 | log2(fold change) | P值 |
| ENSMUSG00000032758 | Kap | 14.67 | 4.09E-35 |
| ENSMUSG00000060807 | Serpina6 | 11.90 | 6.45E-88 |
| ENSMUSG00000049152 | Ugt3a2 | 11.85 | 3.38E-23 |
| ENSMUSG00000075044 | Slc22a29 | 10.62 | 5.34E-19 |
| ENSMUSG00000061947 | Serpina10 | 10.19 | 1.59E-17 |
| ENSMUSG00000039710 | Slc7a12 | 9.695 | 1.16E-37 |
| ENSMUSG00000022598 | Psca | 9.632 | 2.07E-15 |
| ENSMUSG00000042371 | Slc5a10 | 8.733 | 5.67E-13 |
| ENSMUSG00000020051 | Pah | 8.548 | 2.26E-98 |
| ENSMUSG00000061808 | Ttr | 8.396 | 1.58E-49 |
| ENSMUSG00000086503 | Xist | -10.37 | 0 |
| ENSMUSG00000055609 | Hba-x | -10.30 | 5.36E-18 |
| ENSMUSG00000052187 | Hbb-y | -9.104 | 1.23E-182 |
| ENSMUSG00000052217 | Hbb-bh1 | -7.705 | 2.54E-09 |
| ENSMUSG00000026459 | Myog | -7.474 | 5.54E-09 |
| ENSMUSG00000062380 | Tubb3 | -7.212 | 4.71E-08 |
| ENSMUSG00000000889 | Dbh | -7.208 | 2.81E-08 |
| ENSMUSG00000051920 | Rspo2 | -6.843 | 2.90E-07 |
| ENSMUSG00000055775 | Myh8 | -6.732 | 6.51E-07 |
| ENSMUSG00000000214 | Th | -6.703 | 6.09E-07 |
2.3 差异表达基因GO富集分析
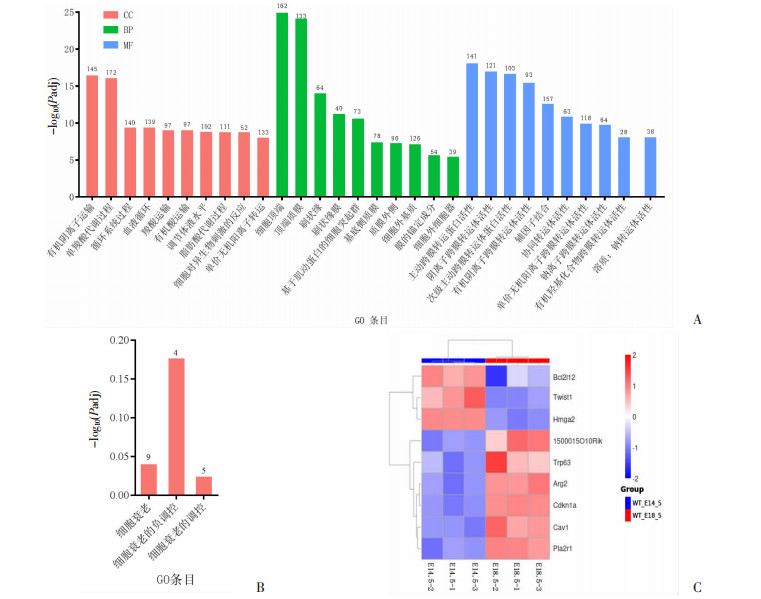
对差异表达基因进行富集分析,共富集出7 552个有显著差异的GO条目,挑选出最显著的30个GO条目用柱状图展示(图 3A),包括生物过程(biological process, BP)、细胞组分(cellular components, CC)和分子功能(molecular function, MF)。被富集到生物学过程的主要有有机阴离子运输、一元羧酸代谢过程和循环系统过程等,被富集到细胞组分的主要有细胞的顶端部分、顶端质膜和刷状缘等,被富集到分子功能的主要有主动跨膜转运蛋白活性、阴离子跨膜转运体活性和次级主动跨膜转运蛋白活性。既往研究发现细胞衰老在胚肾发育过程中具有重要作用,本研究筛选出3个与细胞衰老相关的GO条目:细胞衰老、细胞衰老的负调控和细胞衰老的调控(图 3B),其中Hmga2、Twist1和Bcl2l12这3个基因表达水平显著下调,Pla2r1、Cav1、Cdkn1a(P21)、Arg2、Trp63和1500015O10Rik这6个基因表达水平显著上调(图 3C)。
|
| A:最显著的30个GO条目富集分析柱状图上的数字代表每个GO条目里含有的基因数量;B:细胞衰老相关的GO条目富集分析柱状图上的数字代表每个GO条目里含有的基因数量;C:细胞衰老相关差异基因聚类热图 图 3 GO富集分析 |
2.4 差异表达基因KEGG富集分析
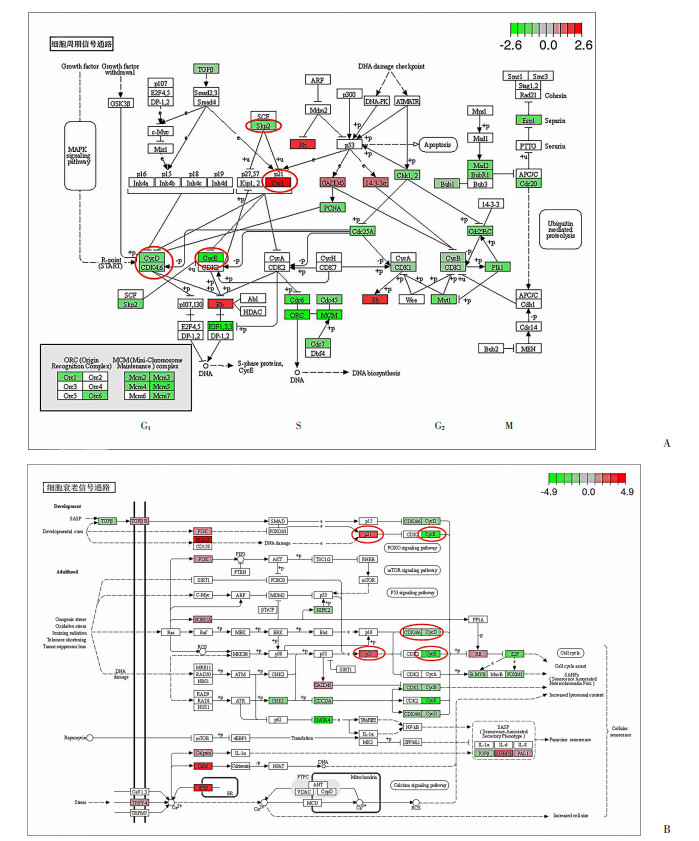
利用KEGG数据库对细胞衰老相关的信号通路进行富集分析,筛选出2条与细胞衰老相关的信号通路:细胞周期信号通路和细胞衰老信号通路(图 4)。将上述信号通路中包含的57个差异表达基因用聚类热图展示,其中Cdkn1a(P21)、Sfn、Rb1等22个基因表达显著上调,Skp2、Ccne1、Ccnd2和Cdk4等35个基因表达显著下调。
|
| A:细胞周期信号通路;B:细胞衰老信号通路 图 4 KEGG富集分析 |
2.5 qRT-PCR及Western blot验证差异表达基因
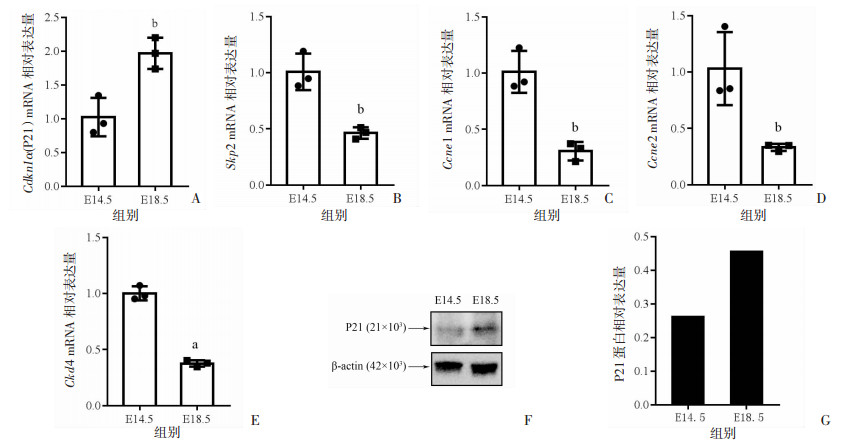
根据研究目的,对通过GO和KEGG富集分析结果筛选出的5个与衰老相关的基因——Cdkn1a(P21)、Skp2、Ccne1、Ccnd2和Cdk4,进行mRNA水平的验证,qRT-PCR结果显示,相较于E14.5组,E18.5组中Cdkn1a(P21) mRNA的相对表达升高,而Skp2、Ccne1、Ccnd2和Cdk 4mRNA相对表达降低(图 5A~E),与转录组学结果一致。后续针对调控细胞衰老最重要的靶基因Cdkn1a(P21)进行了蛋白层面的验证,Western blot结果显示,E18.5组的P21蛋白表达水平高于E14.5组(图 5F、G),与qPT-PCR结果和转录组学结果一致。
|
|
a:P<0.01,b:P<0.05,与E14.5组比较 A:Cdkn1a(P21) mRNA相对表达水平;B:Skp2 mRNA相对表达水平;C:Ccne1 mRNA相对表达水平;D:Ccnd2 mRNA相对表达水平;E:Cdk4 mRNA相对表达水平;F:Western blot检测E14.5组和E18.5组P21蛋白表达;G:P21蛋白相对表达水平 图 5 细胞衰老相关基因mRNA相对表达及P21蛋白表达水平 |
3 讨论
既往研究发现,在增龄性变化过程中,组织中会逐渐积累衰老细胞,这类细胞会持续释放炎症因子及趋化因子等衰老相关分泌表型,在老年疾病中发挥重要作用[12-13]。在病理状态下,细胞可发生应激性衰老。大量研究证明其在肾脏疾病、心血管疾病、肿瘤进展中发挥了重要作用[5, 14]。然而,细胞衰老除了上述病理损伤效应以外,还具有一定的生理保护作用,可抑制肿瘤细胞增殖、促进伤口愈合等。最近研究表明,细胞衰老在胚肾发育过程中可以抑制细胞过度增殖,参与调控组织重塑[15]。但胚肾发育过程中细胞衰老过程调控组织重塑及形态发生的具体分子机制,仍待进一步研究。基于此,本研究利用RNA-seq技术和生物信息分析筛选与胚肾发育过程中与细胞衰老相关的差异表达基因,并利用qRT-PCR及WB技术进行验证,以期探明胚肾发育过程中介导衰老细胞及其调控组织重塑的具体分子机制。
本研究通过对E14.5和E18.5胚肾的结构分析发现,胚龄14.5 d时逗号样小体和S小体出现在输尿管芽周围,胚龄18.5 d时可见已有成熟的肾小管形成,同时有肾小体和早期髓质出现。采用转录组学及生物信息学分析,发现了Cdkn1a(P21)、Skp2、Ccne1、Ccnd2和Cdk4等65个差异表达基因与细胞衰老密切相关。进一步采用qRT-PCR验证这些差异表达基因的mRNA表达水平,发现随着胚龄增加,Cdkn1a(P21) mRNA的相对表达升高,而Skp2、Ccne1、Ccnd2和Cdk4 mRNA相对表达降低。WB验证发现,调控细胞衰老最重要的靶基因P21蛋白表达水平随着胚龄的增加而升高。
Cdkn1a编码的P21蛋白,是一种细胞周期蛋白依赖性激酶(CDK)抑制剂。P21还参与调节转录、细胞凋亡、细胞分化以及细胞迁移[16],与多种细胞生命活动密切相关。它可以与多种Cyclin-CDK复合物结合后抑制其功能,进而级联调控Rb蛋白的磷酸化及E2F的释放,最终使细胞周期停滞在G1期[17]。GEORGAKILAS等[18]认为P21对细胞生命活动的调控具有两面性,一方面,P21和野生型P53共同维持基因组的完整性和稳定性,另一方面,当P53缺失或发生突变时,P21产生不稳定细胞,这些细胞可能形成癌前病变。另有研究表明P21与胚胎发育相关,中肾、内耳等在发育过程中可由P21导致衰老,在内耳的内淋巴囊、发育的四肢、闭合的神经管和顶外胚层脊的非分裂细胞均表达高水平的P21[19-20]。同时,P21在糖尿病肾病、急性肾损伤和慢性肾脏病等多种肾脏疾病中都高表达[21-22]。并且血浆和尿液中的P21也可作为AKI和肾脏衰老的潜在生物标志物[23]。本研究发现P21在E18.5时的表达较E14.5时的表达显著上调,表明P21可能在胚肾发育过程中通过上调衰老细胞表型发挥重要作用。
大量研究报道了Skp2、Ccne1、Ccnd2、Cdk4在癌症发生发展过程中的作用。Skp2在众多癌症相关信号通路中起着关键作用,它能加快细胞生长,加速细胞周期进程,促进迁移和侵袭,并抑制细胞凋亡,有助于肿瘤的发生发展[24]。Skp2失活后不会直接导致体内或者体外的细胞衰老,而是在应激后引发衰老反应[25]。近期研究表明该基因与肾脏疾病也相关。MAD2B诱导Skp2积累有助于小管上皮-间质转化和足细胞损伤,最终导致小管间质纤维化[26]。并且Skp2参与了由MAD2B介导的肾小球壁层上皮细胞的激活,导致新月体肾小球肾炎[27]。Ccne1是卵巢癌和子宫内膜癌中常见的扩增的肿瘤基因[28]。细胞周期蛋白E和CDK2复合物的致癌激活会损伤正常的DNA复制,导致复制应激和DNA损伤[29]。最近的研究表明,细胞周期蛋白E1在透明细胞肾细胞癌中高表达,可作为透明细胞肾细胞癌预后的潜在生物标志物[30]。Ccnd2是D型细胞周期蛋白家族的成员,通过多种机制参与细胞周期调节、分化和致癌转化。Ccnd2的表达是持续性癌症干细胞生长所必需的,通过维持完整的细胞周期和低水平DNA损伤积累的增殖[31]。Ccnd2在约80%的肾母细胞瘤中高表达,是肾母细胞瘤突变、将胚胎肾祖细胞锁定在未分化但增殖的状态的关键[32]。提示胚肾发育时期Ccnd2的低表达更有利于细胞分化,促进组织器官的发育。而Cdk4不仅在细胞有丝分裂中发挥重要作用,而且参与细胞衰老、凋亡和组蛋白调节等生物学过程,并在多种癌症的发生发展中被异常激活。而在一定的条件下,CDK4/6的抑制剂会导致细胞衰老[33]。也有研究表明,通过抑制CDK4/6来阻断细胞周期进展可以防止慢性肾损伤[34]。本研究结果表明,随着胚肾的发育,Skp2、Ccne1、Ccnd2和Cdk4 mRNA相对表达水平显著降低,提示胚肾发育过程中可能通过抑制细胞增殖相关基因的表达,促进细胞分化从而介导组织重塑。
综上所述,在胚肾发育过程中,细胞衰老相关基因Cdkn1a(P21)、Skp2、Ccne1、Ccnd2和Cdk4发生重要变化,Cdkn1a(P21) mRNA及蛋白相对表达水平显著升高,而Skp2、Ccne1、Ccnd2和Cdk4 mRNA相对表达水平显著降低。本研究结果提示,胚肾发育过程中,一方面可通过直接上调细胞衰老表型,另一方面可以抑制细胞生长、增殖相关基因表达,共同介导细胞衰老过程,调控组织重塑;而Cdkn1a(P21)、Skp2、Ccne1、Ccnd2和Cdk4可能是该过程中的重要分子靶点。后续将采用体内外干预研究,进一步明确上述细胞衰老相关靶基因参与调控胚肾发育中的分子机制。
| [1] |
DAVIDSON A J, LEWIS P, PRZEPIORSKI A, et al. Turning mesoderm into kidney[J]. Semin Cell Dev Biol, 2019, 91: 86-93. |
| [2] |
MCMAHON A P. Development of the mammalian kidney[J]. Curr Top Dev Biol, 2016, 117: 31-64. |
| [3] |
SCHEDL A, HASTIE N D. Cross-talk in kidney development[J]. Curr Opin Genet Dev, 2000, 10(5): 543-549. |
| [4] |
LI H, HOHENSTEIN P, KUURE S. Embryonic kidney development, stem cells and the origin of wilms tumor[J]. Genes, 2021, 12(2): 318. |
| [5] |
MICCO R D, KRIZHANOVSKY V, BAKER D, et al. Cellular senescence in ageing: from mechanisms to therapeutic opportunities[J]. Nat Rev Mol Cell Biol, 2021, 22(2): 75-95. |
| [6] |
HUANG W J, HICKSON L J, EIRIN A, et al. Cellular senescence: the good, the bad and the unknown[J]. Nat Rev Nephrol, 2022, 18(10): 611-627. |
| [7] |
REGULSKI M J. Cellular senescence: what, why, and how[J]. Wounds, 2017, 29(6): 168-174. |
| [8] |
BECK J, HORIKAWA I, HARRIS C. Cellular senescence: mechanisms, morphology, and mouse models[J]. Vet Pathol, 2020, 57(6): 747-757. |
| [9] |
RAYESS H, WANG M B, SRIVATSAN E S. Cellular senescence and tumor suppressor gene p16[J]. Int J Cancer, 2012, 130(8): 1715-1725. |
| [10] |
GAL H, MAJEWSKA J, KRIZHANOVSKY V. The intricate nature of senescence in development and cell plasticity[J]. Semin Cancer Biol, 2022, 87: 214-219. |
| [11] |
DOCHERTY M H, O'SULLIVAN E D, BONVENTRE J V, et al. Cellular senescence in the kidney[J]. J Am Soc Nephrol, 2019, 30(5): 726-736. |
| [12] |
FARR J N, KHOSLA S. Cellular senescence in bone[J]. Bone, 2019, 121: 121-133. |
| [13] |
CALCINOTTO A, KOHLI J, ZAGATO E, et al. Cellular senescence: aging, cancer, and injury[J]. Physiol Rev, 2019, 99(2): 1047-1078. |
| [14] |
HERNANDEZ-SEGURA A, NEHME J, DEMARIA M. Hallmarks of cellular senescence[J]. Trends Cell Biol, 2018, 28(6): 436-453. |
| [15] |
MUÑOZ-ESPÍN D, SERRANO M. Cellular senescence: from physiology to pathology[J]. Nat Rev Mol Cell Biol, 2014, 15(7): 482-496. |
| [16] |
KARIMIAN A, AHMADI Y, YOUSEFI B. Multiple functions of p21 in cell cycle, apoptosis and transcriptional regulation after DNA damage[J]. DNA Repair, 2016, 42: 63-71. |
| [17] |
LAI L, SHIN G Y, QIU H Y. The role of cell cycle regulators in cell survival—dual functions of cyclin-dependent kinase 20 and p21Cip1/Waf1[J]. Int J Mol Sci, 2020, 21(22): 8504. |
| [18] |
GEORGAKILAS A G, MARTIN O A, BONNER W M. p21: a two-faced genome guardian[J]. Trends Mol Med, 2017, 23(4): 310-319. |
| [19] |
MUÑOZ-ESPÍN D, CAÑAMERO M, MARAVER A, et al. Programmed cell senescence during mammalian embryonic development[J]. Cell, 2013, 155(5): 1104-1118. |
| [20] |
STORER M, MAS A, ROBERT-MORENO A, et al. Senescence is a developmental mechanism that contributes to embryonic growth and patterning[J]. Cell, 2013, 155(5): 1119-1130. |
| [21] |
AL-DABET M M, SHAHZAD K, ELWAKIEL A, et al. Reversal of the renal hyperglycemic memory in diabetic kidney disease by targeting sustained tubular p21 expression[J]. Nat Commun, 2022, 13(1): 1-17. |
| [22] |
YU J B, LEE D S, PADANILAM B, et al. Repeated administration of cisplatin transforms kidney fibroblasts through G2/M arrest and cellular senescence[J]. Cells, 2022, 11(21): 3472. |
| [23] |
JOHNSON A C, ZAGER R A. Plasma and urinary p21: potential biomarkers of AKI and renal aging[J]. Am J Physiol Ren Physiol, 2018, 315(5): F1329-F1335. |
| [24] |
ASMAMAW M D, LIU Y, ZHENG Y C, et al. Skp2 in the ubiquitin-proteasome system: a comprehensive review[J]. Med Res Rev, 2020, 40(5): 1920-1949. |
| [25] |
LIN H K, CHEN Z B, WANG G C, et al. Skp2 targeting suppresses tumorigenesis by Arf-p53-independent cellular senescence[J]. Nature, 2010, 464(7287): 374-379. |
| [26] |
TANG H, FAN D, LEI C T, et al. MAD2B promotes tubular epithelial-to-mesenchymal transition and renal tubulointerstitial fibrosis via Skp2[J]. J Mol Med, 2016, 94(11): 1297-1307. |
| [27] |
YE C, XIONG W, LEI C T, et al. MAD2B contributes to parietal epithelial cell activation and crescentic glomerulonephritis via Skp2[J]. Am J Physiol Ren Physiol, 2020, 319(4): F636-F646. |
| [28] |
XU H N, GEORGE E, KINOSE Y, et al. CCNE1 copy number is a biomarker for response to combination WEE1-ATR inhibition in ovarian and endometrial cancer models[J]. Cell Rep Med, 2021, 2(9): 100394. |
| [29] |
FAGUNDES R, TEIXEIRA L K. Cyclin E/CDK2: DNA replication, replication stress and genomic instability[J]. Front Cell Dev Biol, 2021, 9: 774845. |
| [30] |
ZHANG Q, NI Y L, WANG S J, et al. G6PD upregulates Cyclin E1 and MMP9 to promote clear cell renal cell carcinoma progression[J]. Int J Med Sci, 2022, 19(1): 47-64. |
| [31] |
PARK S Y, LEE C J, CHOI J H, et al. The JAK2/STAT3/CCND2 Axis promotes colorectal Cancer stem cell persistence and radioresistance[J]. J Exp Clin Cancer Res, 2019, 38(1): 399. |
| [32] |
XU L, DESAI K, KIM J, et al. Wilms tumor mutational subclasses converge to drive CCND2 overexpression[J]. medRxiv[Preprint]. 2023 Feb 2: 2023.01.30.23285117. DOI: 10.1101/2023.01.30.23285117.
|
| [33] |
WAGNER V, GIL J. Senescence as a therapeutically relevant response to CDK4/6 inhibitors[J]. Oncogene, 2020, 39(29): 5165-5176. |
| [34] |
OSAKI Y, MANOLOPOULOU M, IVANOVA A V, et al. Blocking cell cycle progression through CDK4/6 protects against chronic kidney disease[J]. JCI Insight, 2022, 7(12): e158754. |




