妊娠不到20周的流产被定义为自然流产,临床数据显示,多达26%的妊娠以流产告终[1]。虽然目前已明确染色体异常和内分泌紊乱等可导致妊娠早期自然流产[2-3],但仍有50%的自然流产病例缺乏明确的病因[4],因此探索自然流产发生的机制具有重要的临床意义。容受性子宫内膜和胚胎在时间和空间同步发育是妊娠关键的一步[5],而子宫内膜蜕膜化失败是流产发生的常见原因之一[6-8]。蜕膜化是囊胚着床、胎盘发育和胎儿生长以及正常足月的关键[9-10]。然而,不明原因自然流产蜕膜化受损的关键分子机制仍然难以明确。
LncRNA H19是长链非编码RNA,该印迹基因位于染色体11p15.5上[11],仅由母体等位基因表达[12-14]。目前已有研究表明LncRNA H19在胎盘中高表达,且通过调控胎盘的植入和发育参与了妊娠过程[15-17]。LncRNA H19的失调会导致多种妊娠并发症的发生[18-21]。FOXO1是FOXO叉头转录因子亚家族的成员之一,是最早发现的人类子宫内膜间质细胞对蜕膜化刺激有反应的转录因子之一[22]。研究证据表明FOXO1通过直接结合PRL和IGFBP1的启动子来调节它们的转录[23-24]。但FOXO1调控蜕膜化的上游调控机制还有待进一步研究。多项研究表明LncRNA H19上调FOXO1调控多种细胞的增殖和分化[25-26]。而子宫内膜间质细胞增殖和分化为蜕膜细胞是正常妊娠的关键步骤之一[27]。但目前关于LncRNA H19及其调控FOXO1参与蜕膜化过程的作用尚未明确。为明确LncRNA H19对蜕膜化的发生和维持的作用,本研究检测了正常妊娠和稽留流产患者子宫内膜和不同孕周蜕膜组织中LncRNA H19的表达,并通过建立体外细胞水平的蜕膜化模型,分别干扰和过表达子宫内膜间质细胞LncRNA H19的表达,探索LncRNA H19是否通过上调FOXO1来调控蜕膜化,为临床治疗不明原因自然流产提供新的思路。
1 材料与方法 1.1 实验材料 1.1.1 蜕膜组织来源选取2021年4月至2022年9月在本院妇科门诊的早孕自然流产病人(自然流产组)及非计划妊娠行人工流产的正常早孕女性,年龄18~40岁。根据《妇产科学》第9版的标准诊断正常早孕与自然流产。非妊娠子宫内膜和蜕膜组织取自重庆医科大学附属大学城医院。子宫内膜取自因子宫肌瘤切除子宫的患者。蜕膜组织标本的排除标准:①子宫畸形、甲状腺功能障碍、免疫紊乱、血栓性疾病、多囊卵巢综合征、子宫内膜异位症、严重输卵管积水、卵巢肿瘤或其他已知原因流产患者;②胚胎染色体异常者。采集的组织立即在液氮中冷冻保存以供后续的实验。本实验获得重庆医科大学附属大学城医院伦理委员会批准(LL-202152)。
1.1.2 实验试剂包括胎牛血清(中国Vivacell公司)、DMEM/F12(美国Gibco公司)、胰蛋白酶(中国碧云天公司)、青-链霉素(中国碧云天公司)和4%多聚甲醛(中国biosharp公司)、甲羟孕酮(美国sigma公司)、8-溴-环磷酸腺苷(美国Sigma公司)、反转录PCR试剂盒(日本TaKaRa公司)、TB green(日本TaKaRa公司)和PCR引物(中国擎科公司公司)。
1.2 方法 1.2.1 细胞培养人子宫内膜间质细胞株子宫内膜间质细胞(transformed human endometrial stromal cells, THESCs)购自美国标准菌库(American type culture collection,ATCC)。THESCs在含有10%胎牛血清和1%青-链霉素的DMEM/F12完全培养基中培养,培养条件为37 ℃、5%CO2的恒温培养箱。
1.2.2 RNA提取和实时荧光定量PCR检测根据试剂盒的说明书,使用TRIzol试剂分离组织和细胞的总RNA。使用反转录试剂盒在37 ℃反应15 min合成cDNA。使用SYBR Green RT-qPCR检测试剂盒检测LncRNA H19、PRL和IGFBP1水平,并以GAPDH作为内源性对照引物由擎科公司合成,见表 1。扩增程序为:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火30 s,40次循环,60 ℃延伸30 s。以相应的对照组为1,计算其他各组基因的相对表达量2-ΔΔCt值。
| 引物名称 | 引物序列(5′→3′) |
| GAPDH | 上游: GGAGTCCACTGGCGTCTTCA |
| 下游: GTCATGAGTCCTTCCACGATACC | |
| PRL | 上游: TCAGCATATTGCGATCCTGG |
| 下游: GGCTTCTTGCATACCACGTA | |
| IGFBP-1 | 上游: GAAGGAGCCCTGCCGAATAG |
| 下游: ATTCCAAGGGTAGACGCACC | |
| LncRNA H19 | 上游: CCTTCCTGAACACCTTAGGC |
| 下游: TTCATGTTGTGGGTTCTGGG | |
| FOXO1 | 上游: TTGCCCAACCAAAGCTTCCC |
| 下游: TTGCTGCCAAGTCTGACGAAA |
1.2.3 诱导细胞蜕膜化
制备诱导培养基[28]:浓度为1 μmol/L MPA和0.5 mmol/L 8-Br-cAMP加入到含有5%FBS的DMEM/F-12完全培养基中。将THESCs分为对照组和诱导组,对照组用10%FBS的DMEM/F12的完全培养基常规培养,诱导组待种板12 h后换用诱导培养基,培养条件为37 ℃、5%CO2的恒温培养箱,3 d后换液1次,培养5 d。
1.2.4 慢病毒转染THESCsLncRNA H19干扰慢病毒(LV-H19-RNAi)、LncRNA H19过表达慢病毒(LV-H19)和空白慢病毒载体(LV-GFP)由上海吉凯基因科技有限公司构建。当细胞汇合度为30%~40%时,将原始浓度为109 TU/mL慢病毒和5 μg/mL的Polybrene促转染试剂加入到培养皿中,按MOI值=10的病毒量感染THESCs,12 h后更换为含10%FBS的DMEM/F12的新鲜完全培养基继续培养。于感染72 h后置于倒置荧光显微镜下观察荧光转染率,并采用RT-qPCR检测THESCs中LncRNA H19干扰和过表达的效率。
1.2.5 诱导已干扰或过表达LncRNA H19的THESCs在THESCs感染病毒72 h后,消化、重悬细胞,将转染成功的THESCs种板于60 mm的细胞培养皿中。待种板12 h,细胞状态良好时,更换为诱导培养基诱导培养。分组为:空白对照组、LV-GFP诱导组(空白病毒+诱导)、LV-H19-RNAi诱导组(慢病毒干扰LncRNA H19+诱导)和LV-H19诱导组(慢病毒过表达LncRNA H19+诱导)。对空白对照组用10%FBS的DMEM/F12的完全培养基常规培养,LV-GFP诱导组、LV-H19-RNAi诱导组和LV-H19诱导组待种板12 h后换用诱导培养基。培养条件为37 ℃、5%CO2的恒温培养箱,3 d后换液1次,培养5 d后观察细胞形态,收集细胞用于后续操作。
1.3 统计学分析实验均独立重复3次,所得数据采用SPSS 25.0软件进行分析,计量资料数据以x±s表示。进行正态分析及方差齐性检验,两组比较采用独立样本t检验,多组比较采用单因素方差分析,检验水准α=0.05。
2 结果 2.1 不同孕周人工流产蜕膜组织LncRNA H19表达情况收集非妊娠(0周)子宫内膜和人工流产5~10周蜕膜组织各5例。采用RT-qPCR检测人工流产组中LncRNA H19的表达水平。结果显示,于早孕第7周达到一个表达高峰,非妊娠子宫内膜和第5、8、9、10周,与第7周比较差异均有统计学意义(P < 0.05),表明LncRNA H19在早孕第7周蜕膜组织表达最高(图 1A)。与非妊娠子宫比较,第6、7周差异有统计学意义(P < 0.05)。而第5、8、9、10周差异均无统计学意义(图 1B)。
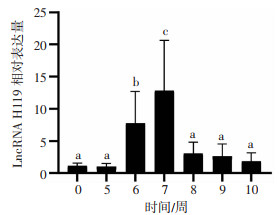
|
| a: P < 0.01,与第7周比较;b: P < 0.05,c: P < 0.01,与非妊娠子宫内膜组织比较 图 1 RT-qPCR检测不同孕周人工流产蜕膜组织LncRNA H19表达情况(n=5) |
2.2 自然流产组LncRNA H19表达较人工流产组低
收集自然流产和人工流产患者蜕膜组织,分别为20和22例,样本基本特征差异无统计学意义,见表 2。采用RT-qPCR检测自然流产组和人工流产组中LncRNA H19的表达。结果显示,早期自然流产组LncRNA H19表达较早期人工流产组降低(P < 0.01), 不同孕周自然流产组LncRNA H19表达较人工流产组降低(P < 0.05,图 2)。
| 特征 | 自然流产 (n=20) |
人工流产 (n=22) |
P |
| 母亲年龄/岁 | 30.00±5.32 | 27.75±6.11 | >0.05 |
| 孕周/周 | 9.30±1.81 | 8.68±1.49 | >0.05 |
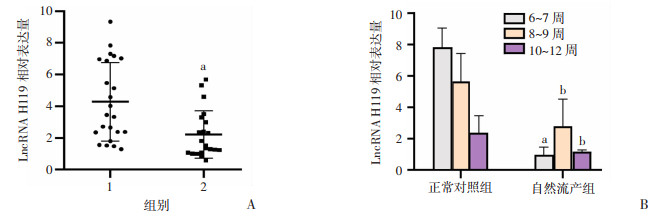
|
|
a: P < 0.05,b: P < 0.01,与人工流产组比较 A:人工流产和自然流产蜕膜组织中LncRNA H19表达;B:不同孕周人工流产和自然流产蜕膜组织中LncRNA H19表达;1:人工流产组;2:自然流产组 图 2 RT-qPCR检测人工流产和自然流产蜕膜组织LncRNA H19表达情况 |
2.3 使用诱导培养基诱导THESCs后蜕膜化标志物的表达增加,LncRNA H19和FOXO1的表达增加
诱导5 d后,诱导组细胞形态由长梭形变为短梭形和多角形(图 3A)。采用RT-qPCR检测对照组和诱导组蜕膜标志物PRL和IGFBP-1的表达情况。结果显示,与对照组比较,诱导组PRL和IGFBP-1均显著增加(P < 0.01,图 3B、C)。
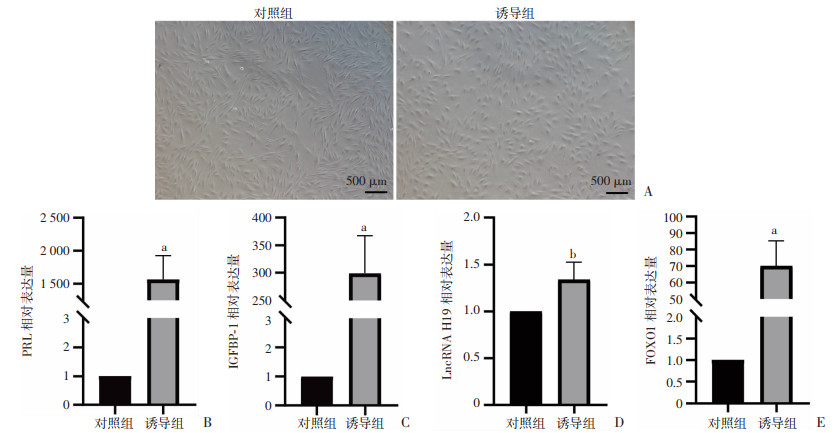
|
| A:诱导蜕膜化5 d THESCs形态;B:RT-qPCR检测PRL的相对基因表达;C:RT-qPCR检测IGFBP-1的相对基因表达;D:RT-qPCR检测LncRNA H19的相对基因表达;E:RT-qPCR检测FOXO1的相对基因表达 a: P < 0.01,b: P < 0.05,与对照组比较 图 3 RT-qPCR检测蜕膜化标志物PRL和IGFBP-1以及LncRNA H19和FOXO1的表达情况 |
采用RT-qPCR检测对照组和诱导组LncRNA H19和FOXO1的表达情况。结果显示,与对照组比较,诱导组LncRNA H19(P < 0.05)和FOXO1(P < 0.01)表达均增加(图 3D、E)。
2.4 慢病毒转染成功为了进一步验证LncRNA H19对蜕膜化的作用,分别采用慢病毒干扰和过表达LncRNA H19在子宫内膜间质细胞的表达。将LV-GFP组、LV-H19-RNAi组和LV-H19组在转染72 h后置于倒置荧光显微镜下观察(图 4A)。RT-qPCR检测对照组、LV-GFP组、LV-H19-RNAi组和LV-H19组LncRNA H19表达水平。结果显示,与LV-GFP组比较,LV-H19-RNAi组表达降低(P < 0.01,图 4B),表明LV-H19-RNAi慢病毒成功下调了LncRNA H19;与LV-GFP组比较,LV-H19组表达升高(P < 0.01,图 4B),表明LV-H19慢病毒成功过表达了LncRNA H19。
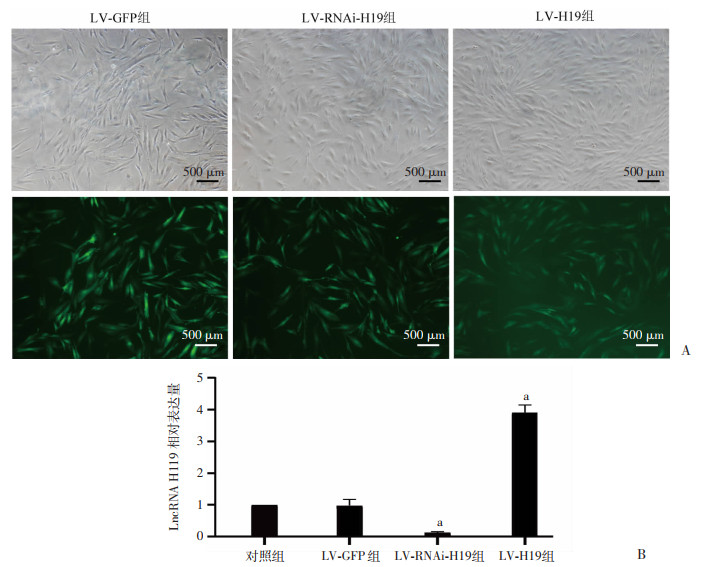
|
| A:转染72 h THESCs的白光图和荧光图;B:RT-qPCR检测LncRNA H19的相对基因表达 a: P < 0.01,与LV-GFP组比较 图 4 荧光图和RT-qPCR分别检测慢病毒转染率和LncRNA H19的表达情况 |
2.5 LncRNA H19促进THESCs增殖和蜕膜化
慢病毒转染THESCs成功后,再对THESCs进行蜕膜化诱导。如图 5A所示,LV-GFP诱导组和LV-H19诱导组细胞形态由长梭形变为短梭形和多角形,LV-RNAi-H19诱导组细胞形态则变化不明显。采用RT-qPCR检测PRL和IGFBP-1的表达。结果显示,LV-GFP诱导组IGFBP-1和PRL mRNA表达高于空白对照组(P < 0.05),表明感染LV-GFP的THESCs被成功蜕膜化。与LV-GFP诱导组比较, LV-RNAi-H19诱导组IGFBP-1和PRL mRNA表达降低(P < 0.05,图 5B),表明下调THESCs的LncRNA H19后诱导蜕膜化会被阻碍。而LV-H19诱导组与LV-GFP诱导组比较,IGFBP-1和PRL mRNA表达升高(P < 0.05,图 5B)。
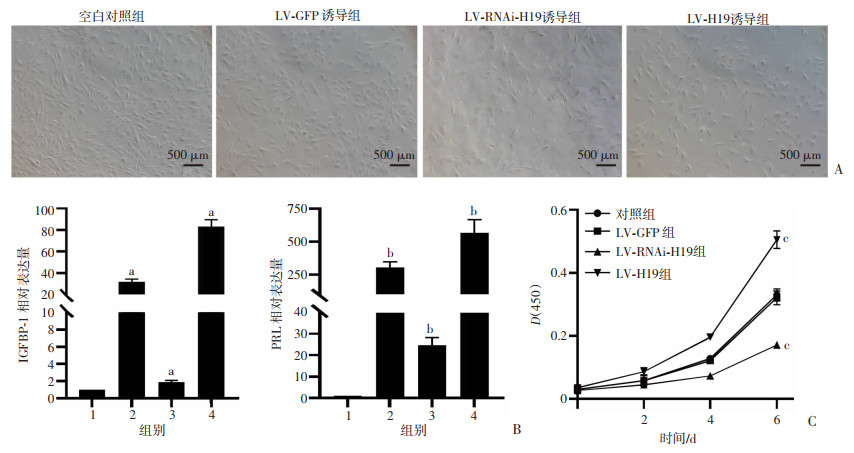
|
|
1:空白对照组;2:LV-GFP诱导组;3:LV-RNAi-H19诱导组;4:LV-H19诱导组;a: P < 0.01,b: P < 0.05,与空白对照组比较; c: P < 0.01,与LV-GFP组比较 A:慢病毒转染后诱导蜕膜化5 d各组THESCs形态;B:RT-qPCR检测蜕膜化标志物PRL和IGFBP-1的相对基因表达; C: CCK-8检测THESCs的增殖能力, 图 5 CCK-8和RT-qPCR分别检测转染慢病毒后的THESCS增殖性和蜕膜化指标的表达情况 |
慢病毒转染THESCs成功后,采用CCK-8检测对照组、LV-GFP组、LV-H19-RNAi组和LV-H19组THESCs的增殖情况。结果表明,与LV-GFP组比较,LV-H19-RNAi组的THESCs增殖被抑制(P < 0.01),LV-H19组的THESCs增殖被促进(图 5C,P < 0.01)。
2.6 干扰LncRNA H19的THESCs蜕膜化后FOXO1的表达降低使用慢病毒分别干扰和过表达LncRNA H19后,诱导THESCs蜕膜化,采用RT-qPCR检测空白对照组、LV-GFP诱导组、LV-RNAi-H19诱导组和LV-H19诱导组FOXO1的表达。结果显示,与空白对照组比较,LV-GFP诱导组FOXO1表达升高(P < 0.01),LV-RNAi-H19诱导组FOXO1表达低于LV-GFP诱导组(P < 0.01),空白对照组与LV-RNAi-H19诱导组的差异无统计学意义(图 6)。
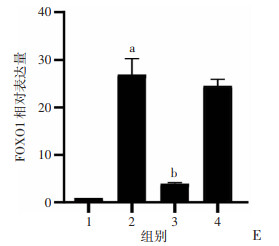
|
| 1:空白对照组;2:LV-GFP诱导组;3:LV-RNAi-H19诱导组;4:LV-H19诱导组; a: P < 0.01,与空白对照组比较;b: P < 0.01,与LV-GFP诱导组比较 图 6 RT-qPCR检测LncRNA H19影响蜕膜化后FOXO1的表达 |
3 讨论
胚胎着床过程中,伴随着胚胎粘附到母体子宫内膜,子宫内膜间质细胞逐渐增殖并分化为蜕膜细胞,这一过程称之为子宫内膜蜕膜化[4, 6]。“着床窗口”是妊娠最早的关键阶段之一[29],是胚胎能够附着在子宫壁内膜上的唯一时间,而“打开”植入窗口的必要条件是子宫内膜的蜕膜化[30]。子宫内膜蜕膜化异常,导致胚胎植入失败,从而导致不孕或流产。体外受精-胚胎移植(in vitro fertilization/external fertilization,IVF-ET)是不孕不育主要的解决方法之一[1-2],目前IVF-ET的成功率仅为40%,其成功率不高的主要原因之一是胚胎无法正常着床[3-5, 7-8]。因此进一步研究子宫内膜间质细胞增殖和分化为蜕膜细胞对于阐明胚胎着床和妊娠调节的可能机制有着重要的意义。
3.1 LncRNA H19在人工流产和自然流产中的表达情况本研究发现,自然流产蜕膜组织中LncRNA H19的表达低于人工流产蜕膜组织,LncRNA H19在非妊娠子宫内膜和人工流产5~10周蜕膜组织中于第7周表达明显增高,推断LncRNA H19可能通过调控蜕膜化的发生和维持参与正常妊娠的过程。与非妊娠子宫内膜比较,LncRNA H19的表达在第6、7周差异有统计学意义。而第5、8、9、10周均差异无统计学意义。小鼠的子宫内膜蜕膜化的发生依赖于胚胎着床的物理信号传导,而人的子宫内膜在分泌中-晚期即开始蜕膜样变。子宫内膜间质细胞增殖分化为分泌性蜕膜细胞的过程叫做蜕膜化,是子宫内膜转变为容受性子宫内膜的关键步骤,表明LncRNA H19可能在子宫内膜增殖期即开始参与调控子宫内膜间质细胞增殖,后逐渐分化为蜕膜细胞。
3.2 LncRNA H19促进子宫内膜间质细胞蜕膜化细胞增殖和分化涉及多个水平的调控。其调节细胞分裂周期的开始和进展必须严格控制,以确保组织稳态。目前已知LncRNA可以参与多个水平的基因调控,包括染色质重塑和转录、选择性剪接、核亚区室组织和细胞间通讯[31-33]等过程。多项研究表明LncRNA H19通过这些多样调控方式参与了多种生理和病理过程[34-37],但目前LncRNA H19参与多种增殖和分化方向的调控研究集中在肿瘤方面[38-40],LncRNA H19在蜕膜化的研究还未明确。
体外诱导人子宫内膜间质细胞蜕膜化,结果显示,LncRNA H19在诱导蜕膜化组表达高于对照组,表明其参与了蜕膜化过程。为了进一步明确其功能,本研究分别干扰和过表达LncRNA H19在THESCs中的表达后进行蜕膜化诱导,结果显示,THESCs中LncRNA H19被下调时,无法诱导THESCs蜕膜化,而THESCs中LncRNA H19被上调时,促进THESCs蜕膜化。表明LncRNA H19参与了THESCs蜕膜化的调控。CCK-8检测LncRNA H19对THESCs的增殖的影响,结果表明LncRNA H19促进THESCs的增殖。LncRNA H19可以通过多种方式参与细胞增殖[40],包括促进细胞周期进程,作为海绵作用结合miRNA等,推测当上游分子调控LncRNA H19过表达时,促进了子宫内膜间质细胞的增殖和分化进程。本研究通过干扰和过表达LncRNA H19正反向均验证了LncRNA H19可以调控THESCs的增殖和分化为蜕膜细胞。
3.3 LncRNA H19参与蜕膜化与FOXO1表达存在相关性为明确LncRNA H19如何调控蜕膜化过程,研究发现,诱导蜕膜化组,LncRNA H19升高,同时FOXO1表达也升高,蜕膜化标志物PRL和IGFBP-1也增高,表达趋势一致。多项研究已经明确叉头盒因子1(FOXO1)是蜕膜化过程中重要的转录因子之一[41-42],它可以通过调节蜕膜化标志因子PRL和IGFBP-1基因的转录参与蜕膜化[43-45]。为进一步明确LncRNA H19是否通过影响FOXO1参与蜕膜化过程,本研究下调了THESCs的LncRNA H19表达后使其蜕膜化。结果显示,与LV-GFP诱导组比较,LV-RNAi-H19诱导组蜕膜化标志物PRL和IGFBP-1均下降,且FOXO1表达也明显降低;LV-RNAi-H19诱导组与空白组比较,FOXO1、PRL和IGFBP-1差异无统计学意义。干扰LncRNA H19的表达后不能诱导出蜕膜化,可能是通过影响FOXO1的转录来实现影响蜕膜化标志物PRL和IGFBP-1的转录,从而阻碍蜕膜化发生。而过表达诱导组FOXO1的表达与空白病毒诱导组没有明显差异的原因还有待分析研究。已有研究表明LncRNAs改变目标mRNA的稳定性、降解和翻译状态。例如,TINCR将RNA结合蛋白staufen1与促表皮分化mRNA结合,从而促进其转录后的稳定和积累[46]。推测LncRNA H19可能通过调节RNA结合蛋白来增加FOXO1 mRNA的稳定性或抑制其降解,因此过表达LncRNA H19后,FOXO1 mRNA的表达变化不明显。后续可通过免疫共沉淀检测LncRNA H19结合位点,干扰或过表达FOXO1进行拯救实验来进一步验证,继续研究LncRNA H19如何调控FOXO1来促进蜕膜化的具体机制才能更好地解释这一结果。
综上所述,本研究主要通过检测人工流产和自然流产蜕膜组织的LncRNA H19的表达差异,通过干扰和过表达THESCs的LncRNA H19探索其调控子宫内膜间质细胞增殖和蜕膜化的作用,结果提示LncRNA H19是调控子宫内膜间质细胞蜕膜化的关键,为诊断和治疗不明原因自然流产提供了新思路。
| [1] |
ROUSE C E, ECKERT L O, BABARINSA I, et al. Spontaneous abortion and ectopic pregnancy: case definition & guidelines for data collection, analysis, and presentation of maternal immunization safety data[J]. Vaccine, 2017, 35(48 Pt A): 6563-6574. |
| [2] |
BROWN S. Miscarriage and its associations[J]. Semin Reprod Med, 2008, 26(5): 391-400. |
| [3] |
CHAN YY, JAYAPRAKASAN K, TAN A, et al. Reproductive outcomes in women with congenital uterine anomalies: a systematic review[J]. Ultrasound Obstet Gynecol, 2011, 38(4): 371-382. |
| [4] |
JEVE Y, DAVIES W. Evidence-based management of recurrent miscarriages[J]. J Hum Reprod Sci, 2014, 7(3): 159. |
| [5] |
ASHARY N, TIWARI A, MODI D. Embryoimplantation: war in times of love[J]. Endocrinology, 2018, 159(2): 1188-1198. |
| [6] |
ZHOU M J, XU H H, ZHANG D, et al. Decreased PIBF1/IL6/p-STAT3 during the mid-secretory phase inhibits human endometrial stromal cell proliferation and decidualization[J]. J Adv Res, 2021, 30: 15-25. |
| [7] |
KELLEHER A M, SETLEM R, DANTZER F, et al. Deficiency of PARP-1 and PARP-2 in the mouse uterus results in decidualization failure and pregnancy loss[J]. Proc Natl Acad Sci USA, 2021, 118(40): e2109252118. |
| [8] |
ZHOU X W, CAO Y, ZHOU M J, et al. Decreased CD44v3 expression impairs endometrial stromal cell proliferation and decidualization in women with recurrent implantation failure[J]. Reprod Biol Endocrinol, 2022, 20(1): 170. |
| [9] |
LIU H, HUANG X B, MOR G, et al. Epigenetic modifications working in the decidualization and endometrial receptivity[J]. Cell Mol Life Sci, 2020, 77(11): 2091-2101. |
| [10] |
NG S W, NORWITZ G A, PAVLICEV M, et al. Endometrial decidualization: the primary driver of pregnancy health[J]. Int J Mol Sci, 2020, 21(11): 4092. |
| [11] |
GHAFOURI-FARD S, ESMAEILI M, TAHERI M. H19lncRNA: roles in tumorigenesis[J]. Biomed Pharmacother, 2020, 123: 109774. |
| [12] |
AMIT K, MALABIKA D. H19 inhibition increases HDAC6 and regulates IRS1 levels and insulin signaling in the skeletal muscle during diabetes[J]. Mol Med Camb Mass, 2022, 28(1): 81. |
| [13] |
XIE W, SHU T, PENG H S, et al. LncRNA H19 inhibits oxidative stress injury of cochlear hair cells by regulating miR-653-5p/SIRT1 axis[J]. Acta Biochim Biophys Sin (Shanghai), 2022, 54(3): 332-339. |
| [14] |
YAO Y L, WANG Y L, WANG F P, et al. BMP15 modulates the H19/miR-26b/SMAD1 axis influences yak granulosa cell proliferation, autophagy, and apoptosis[J]. Reprod Sci, 2023, 30(4): 1266-1280. |
| [15] |
BARBERET J, BINQUET C, GUILLEMAN M, et al. Does underlying infertility in natural conception modify the epigenetic control of imprinted genes and transposable elements in newborns?[J]. Reprod Biomed Online, 2022, 44(4): 706-715. |
| [16] |
APICELLA C, RUANO C S M, MÉHATS C, et al. The role of epigenetics in placental development and the etiology of preeclampsia[J]. Int J Mol Sci, 2019, 20(11): 2837. |
| [17] |
OGOYAMA M, TAKAHASHI H, SUZUKI H, et al. Non-coding RNAs and prediction of preeclampsia in the first trimester of pregnancy[J]. Cells, 2022, 11(15): 2428. |
| [18] |
HU L, ZENG H, LIU N H. Expression of H19 long non-coding RNA and ZEB1 in the trophoblast of women with spontaneous abortion[J]. J Central South Univ Med Sci, 2018, 43(2): 179-183. |
| [19] |
HE D M, ZENG H, CHEN J F, et al. H19 regulates trophoblastic spheroid adhesion by competitively binding to let-7[J]. Reproduction, 2019, 157(5): 423-430. |
| [20] |
TSUNODA Y, KUDO M, WADA R, et al. Expression level of long noncoding RNA H19 of normotensive placentas in late pregnancy relates to the fetal growth restriction[J]. J Obstet Gynaecol Res, 2020, 46(7): 1025-1034. |
| [21] |
AYKROYD B R L, TUNSTER S J, SFERRUZZI-PERRI A N. Loss of imprinting of the Igf2-H19 ICR1 enhances placental endocrine capacity via sex-specific alterations in signalling pathways in the mouse[J]. Development, 2022, 149(1): dev199811. |
| [22] |
HUANG PX, et al. SOX4 facilitates PGR protein stability and FOXO1 expression conducive for human endometrial decidualization[J]. eLife, 2022, 11: 72073. |
| [23] |
ADIGUZEL D, CELIK-OZENCI C. FoxO1 is a cell-specific core transcription factor for endometrial remodeling and homeostasis during menstrual cycle and earlypregnancy[J]. Hum Reprod Update, 2021, 27(3): 570-583. |
| [24] |
CHENG J H, LIANG J, LI Y Z, et al. Shp2 in uterine stromal cells critically regulates on time embryo implantation and stromal decidualization by multiple pathways during early pregnancy[J]. PLoS Genet, 2022, 18(1): e1010018. |
| [25] |
WEI X M, SU Y M, LI Q Y, et al. Analysis of crucial genes, pathways and construction of the molecular regulatory networks in vascular smooth muscle cell calcification[J]. Exp Ther Med, 2021, 21(6): 589. |
| [26] |
XU X C, JI S Y, LI W L, et al. LncRNA H19 promotes the differentiation of bovine skeletal muscle satellite cells by suppressing Sirt1/FoxO1[J]. Cell Mol Biol Lett, 2017, 22: 10. |
| [27] |
ZHOU Q, YAN G J, DING L J, et al. EHD1 impairs decidualization by regulating the Wnt4/β-catenin signaling pathway in recurrent implantation failure[J]. EBioMedicine, 2019, 50: 343-354. |
| [28] |
HUANG J Y, YU P H, LI Y C, et al. NLRP7 contributes to in vitro decidualization of endometrial stromal cells[J]. Reprod Biol Endocrinol, 2017, 15(1): 66. |
| [29] |
OCHOA-BERNAL M A, FAZLEABAS A T. Physiologic events of embryo implantation and decidualization in human and non-human primates[J]. Int J Mol Sci, 2020, 21(6): 1973. |
| [30] |
ZHAO H T, HU S G, QI J, et al. Increased expression of HOXA11-AS attenuates endometrial decidualization in recurrent implantation failure patients[J]. Mol Ther, 2022, 30(4): 1706-1720. |
| [31] |
BUSSCHER D, BOON R, JUNI R. The multifaceted actions of the lncRNA H19 in cardiovascular biology and diseases[J]. Clin Sci, 2022, 136(15): 1157-1178. |
| [32] |
ANGRAND P O, VENNIN C, BOURHIS X L, et al. The role of long non-coding RNAs in genome formatting and expression[J]. Front Genet, 2015, 6: 165. |
| [33] |
STATELLO L, GUO C J, CHEN LL, et al. Gene regulation by long non-coding RNAs and its biological functions[J]. Nat Rev Mol Cell Biol, 2021, 22(2): 96-118. |
| [34] |
MENG L F, ZHANG Y F, HE X E, et al. LncRNA H19 modulates neuropathic pain through miR-141/GLI2 axis in chronic constriction injury (CCI) rats[J]. Transpl Immunol, 2022, 71: 101526. |
| [35] |
BI Y, WANG Y, SUN X L. Correction: recent advances of LncRNA H19 in diabetes[J]. Horm Metab Res, 2022, 54(4): e2. |
| [36] |
HAO X, WEI H. LncRNA H19 alleviates sepsis-induced acute lung injury by regulating the miR-107/TGFBR3 axis[J]. Bmc Pulmonary Medicine, 2022, 22(1). |
| [37] |
XIE W, SHU T, PENG H S, et al. LncRNA H19 inhibits oxidative stress injury of cochlear hair cells by regulating miR-653-5p/SIRT1 axis[J]. Acta Biochim Biophys Sin (Shanghai), 2022, 54(3): 332-339. |
| [38] |
LI Y J, ZHANG Y H, HU Q S, et al. Functional significance of gain-of-function H19 lncRNA in skeletal muscle differentiation and anti-obesity effects[J]. Genome Med, 2021, 13(1): 137. |
| [39] |
XIAO T, ZOU Z L, XUE J C, et al. LncRNA H19-mediated M2 polarization of macrophages promotes myofibroblast differentiation in pulmonary fibrosis induced by arsenic exposure[J]. Environ Pollut, 2021, 268(Pt A): 115810. |
| [40] |
SUN L Q, LI J T, YAN W Y, et al. H19 promotes aerobic glycolysis, proliferation, and immune escape of gastric cancer cells through the microRNA-519d-3p/lactate dehydrogenase A axis[J]. Cancer Sci, 2021, 112(6): 2245-2259. |
| [41] |
ZHANG M, CAI X Y, LIU J Y, et al. A novel lncRNAlncSAMD11-1: 1 interacts with PIP4K2A to promote endometrial decidualization by stabilizing FoxO1 nuclear localization[J]. Int J Biochem Cell Biol, 2022, 151: 106280. |
| [42] |
NI T X, ZHANG Q, LI Y, et al. CircSTK40 contributes to recurrent implantation failure via modulating the HSP90/AKT/FOXO1 axis[J]. Mol Ther Nucleic Acids, 2021, 26: 208-221. |
| [43] |
ADIGUZEL D, CELIK-OZENCI C. FoxO1 is a cell-specific core transcription factor for endometrial remodeling and homeostasis during menstrual cycle and early pregnancy[J]. Hum Reprod Update, 2021, 27(3): 570-583. |
| [44] |
ADIGUZEL D, SAHIN P, KUSCU N, et al. Spatiotemporal expression and regulation of FoxO1 in mouse uterus during peri-implantation period[J]. PLoS One, 2019, 14(5): e0216814. |
| [45] |
YU S L, LEE S I, PARK H W, et al. SIRT1 suppresses in vitro decidualization of human endometrial stromal cells through the downregulation of forkhead box O1 expression[J]. Reprod Biol, 2022, 22(3): 100672. |
| [46] |
KRETZ M, SIPRASHVILI Z, CHU C, et al. Control of somatic tissue differentiation by the long non-coding RNA TINCR[J]. Nature, 2013, 493(7431): 231-235. |




