2. 418000 湖南 怀化,湖南医药学院侗医药研究湖南省重点实验室;
3. 400042 重庆,陆军特色医学中心战伤感染与特需药品研究室,创伤、烧伤与复合伤国家重点实验室
2. Hunan Provincial Key Laboratory of Dong Medicine Research, Hunan University of Medicine, Huaihua, Hunan Province, 418000;
3. State Key Laboratory of Trauma, Burns and Combined Injury, Department of Wound Infection and Drug, Army Medical Center of PLA, Chongqing, 400042, China
炎症是指机体受到某些刺激如感染、外伤等损伤因子的刺激所发生的一种以防御反应为主的基本病理过程,局部症状表现为红、肿、热、痛或功能障碍[1]。炎症发生时会诱导机体产生一系列免疫反应,同时诱导免疫细胞发生变化,从而在损伤部位引起细胞增殖和组织修复。在持续的炎症刺激或抑炎机制失效的情况下,炎症可能转变为慢性疾病[2-3]。有研究表明,炎症在糖尿病、神经退行性疾病、癌症、炎症性肠病和心血管疾病等慢性疾病的发生中起着关键作用,严重的炎症甚至可能发展成脓毒症,从而引起多器官功能障碍,最终导致死亡[4-5]。
目前临床上最有效的抗炎药物仍然是以激素类药物为主,但这类药物引起的不良反应较多且重,为了改善这一状况,越来越多的研究者把目光放在了具有抗炎活性的药用植物上,并成功研制出了多种植物抗炎药物,如口炎清颗粒、青藤碱、白芍总苷及莲花清瘟颗粒等[6-8]。“马镫艾”(Madeng’ai,MDA)是一种传统的侗族植物药,经湖南省侗族医药研究重点实验室鉴定为Potentilla freyniana Bornm(P. freyniana)原变种,它的根部在民间常被用于清热解毒,治疗癌症及外出血等[9-10]。已有研究[11]表明MDA水提物对人类正常致病菌及多耐药细菌如铜绿假单胞菌、金黄色葡萄球菌和鲍曼不动杆菌都具有很好的抑菌效果,并且可以促进伤口的愈合,而有关其抗炎成分及具体机制仍待证明和进一步研究,因此本文在质谱分析技术的基础上联合网络药理学和体外实验初步探讨了MDA发挥抗炎功效的潜在活性物质及相关机制,从而为后续的深入研究和药物开发提供思路和参考。
1 材料与方法 1.1 主要试剂本研究所用试剂有:RNA提取试剂TRIzol、RT-PCR试剂盒购自TaKaRa公司;胰蛋白酶、细胞培养液RPMI-1640、胎牛血清(FBS)、青-链霉素(PS)和胰蛋白酶购自Gibco公司;JNK、p-JNK、p65、p-p65、p38、p-p38、β-actin、ERK、p-ERK一抗及酶标二抗购自美国Danvers公司;CCK-8检测试剂盒、BCA试剂盒、总蛋白提取试剂盒购自上海碧云天生物技术限公司;LPS购自美国Sigma公司。
1.2 主要仪器本研究所用仪器有:Agilent 1290 UPLC超高效液相色谱仪(安捷伦科技有限公司);Agilent Q-TOF 6545 LC/MS高分辨串联质谱(安捷伦科技有限公司);CO2细胞培养箱(美国ThermoFisher Scientific公司);Bio-Rad PCR仪CFX96(美国BIO公司);化学发光检测系统(Bio-Rad,Hercules,CA,USA)。
1.3 MDA水提物的制备在4.5 kg MDA干燥根中加入17倍体积的水,每次浸泡1 h,共2次,并将2次得到的水提取物混合后在70℃下浓缩成糊状,然后依次分批冻干,待样品干燥后制成粉末,4 ℃冷藏保存备用。
1.4 UPLC-Q-TOF-MS鉴定取样品约0.1 g,精密称量后置于15 mL离心管中,加入20%甲醇5 mL,超声处理(功率300 W,频率40 kHz)30 min,摇匀,12 000 r/min离心5 min,取上清液待测。色谱柱:Waters CORTECS UPLC T3 (2.1×100 mm,1.6 μm);柱温:30;流速:0.3 mL/min;进样量:2 μL;检测波长:190~400 nm。流动相:A相为乙腈,B相为0.1%甲酸水溶液。质谱检测模式为ESI-Negative/Positive ion mode,具体参数见表 1。
| MS参数 | 参数值 | MS/MS参数 | 参数值 |
| 质量范围 | 50~1 700 | 二级质量范围 | 50~1 700 |
| 干燥气温度/(L/min) | 325 | 碰撞能量(eV) | ±40 |
| 干燥气流速/(L/min) | 8 | ||
| 雾化气压力/psi | 45 | ||
| 鞘气温度/℃ | 325 | ||
| 鞘气流速/(L/min) | 8 | ||
| 毛细管电压/V | 4 000 | ||
| 喷嘴电压/V | 1 000 | ||
| 裂解电压/V | 175 | ||
| 锥孔电压/V | 60 | ||
| 基准质量 |  pos 121.0508&922.0097 pos 121.0508&922.0097  neg 197.8073&1033.9881 neg 197.8073&1033.9881 |
1.5 MDA水提物抗炎成分的网络药理学分析 1.5.1 药物成分及靶点筛选
根据质谱鉴定的结果,在Pubchem数据库(https://pubchem.ncbi.nlm.nih.gov/)中筛选出对应化合物的结构,并将其一一导入Swiss Target Prediction数据库(www.swisstargetpre-diction.ch/)或TCMSP数据库(https://www.tcmsp-e.com/tcmsp.php),将预测得分大于0的靶点作为药物靶点,通过Uniprot数据库(https://www.uniprot.org/)对靶点名称进行标准化统一,最终剔除重复的靶点。在Omim、Disgenet和Genecards数据库中分别输入“anti-inflammatory”和“inflammation”两个关键词进行搜索,得到相应的疾病靶标。
1.5.2 “药物-成分-疾病-靶点”网络图的构建与分析将分析得到的药物-疾病共同靶点和相关的活性成分导入Cytoscape3.9.1软件,绘制“药物-成分-疾病-靶点”网络图。使用Network Analyzer对该网络图进行拓扑分析,用Degree值表示该成分与作用靶点的关联个数,Degree值越大说明该成分越重要。
1.5.3 蛋白质-蛋白质相互作用(protein-protein interaction networks,PPI)的构建与分析将上述药物-疾病共同靶点输入到String数据库(https://string-db.org/)进行检索,设置蛋白种类为“Homo sapiens”,相互作用阈值≥0.4,从而构建蛋白相互作用的PPI网络。为了更直观地反映靶点的相关性,也可将数据导入Cytoscape软件绘制蛋白相互作用网络图。其中,节点的大小、颜色深浅随节点Degree值的大小变化,最外圈为degree>50的靶点。通过Network Analyzer进行拓扑分析,可获得核心靶点。
1.5.4 交集靶点的GO分析和KEGG通路分析使用David数据库(https://david.ncifcrf.gov/)对共同靶点进行基因本体论(gene ontology,GO)分析与京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)富集分析,以P < 0.05为筛选标准,使用R语言对富集结果进行可视化,分别绘制条形图和气泡图。
1.6 细胞实验 1.6.1 细胞培养将冻存在陆军特色医学中心外研所实验室的小鼠巨噬细胞系RAW264.7复苏后,在含有100 U/mL青霉素、100 mg/mL链霉素和10%FBS的RPMI1640培养基中37 ℃,5% CO2进行细胞培养。待细胞传代培养至最佳状态再行细胞实验。
1.6.2 CCK-8实验用胰酶消化培养皿中的RAW264.7细胞,300×g离心5 min, 将细胞沉淀用培养基重悬后进行计数,并以5×104/孔的密度重新接种到96孔板中,分别加入200 μL稀释好的不同浓度的MDA溶液,浓度依次为:0.001、0.01、0.1、1.0、10、50、100、1 000和10 000 μg/mL。37 ℃、5% CO2培养24 h后每孔加入10 μL CCK-8试剂,4 h后测定450 nm处的吸光值[D(450)]。
1.6.3 RT-qPCR检测将RAW264.7细胞以2×106/孔接种在6孔板上,分4组:正常对照组、LPS组、MDA处理组及阳性药物(20 μg/mL地塞米松,Dexamethasone, DEX)对照组。37 ℃、5% CO2培养4 h,再用PBS清洗细胞2遍,每孔加1 mL TRIzol试剂提取总RNA,反转录将RNA合成互补DNA,并使用SYBR Premix在BioRad CFX96上通过RT-qPCR检测靶因子的mRNA水平,用β-actin作为内参基因。实验用到的引物序列见表 2。
| 基因 | 正义 | 反义 |
| CCL2 | TTAAAAACCTGGATCGGAACCAA | GCATTAGCTTCAGATTTACGGGT |
| IL-1β | GCAACTGTTCCTGAACTCAACT | ATCTTTTGGGGTCCGTCAACT |
| IL-6 | ACCACGGCCTTCCCTACTTC | CTCATTTCCACGATTTCCCAG |
| TNF-α | GAGTCCGGGCAGGTCTACTTT | CAGGTCACTGTCCCAGCATCT |
| β-actin | AGCCATGTACGTAGCCATCC | CTCTCAGCTGTGGTGGTGAA |
1.6.4 Western blot
将RAW264.7细胞以2×106/孔接种在6孔板上,共分为8组:正常对照组,MDA组,LPS 30、60、120 min组和LPS+MDA 30、60、120 min组。将处理好的各组细胞用WI裂解液充分裂解提取总蛋白,BCA定量后上样电泳。使用10%的SDS-PAGE凝胶作为分离胶,先70 V分离30 min,再120 V分离60 min,最后用快速转膜仪将分离后的蛋白转移到PVDF膜上,再用TBST配制5%的脱脂奶粉,封闭膜1 h,以减少非特异性结合,接下来孵育一抗(p-p65、p65、p-p38、p-38、p-ERK、ERK、p-JNK和JNK 1 ∶1 000稀释),4 ℃下过夜。次日用TBST洗膜后再孵育相应的二抗,60 min后再用TBST洗膜3次以上,最后加显影液,使用增强化学发光仪读取反应条带。
1.7 统计学分析采用GraphPad Prism 9.0软件进行数据统计分析,所有计量数据均以x±s表示,组间差异采用单因素方差分析,P < 0.05为差异具有统计学意义。
2 结果 2.1 MDA水提物的UPLC-Q-TOF-MS检测通过UPLC-Q-TOF-MS法共鉴定出29种化合物,鉴定质谱图见图 1,鉴定结果见表 3。
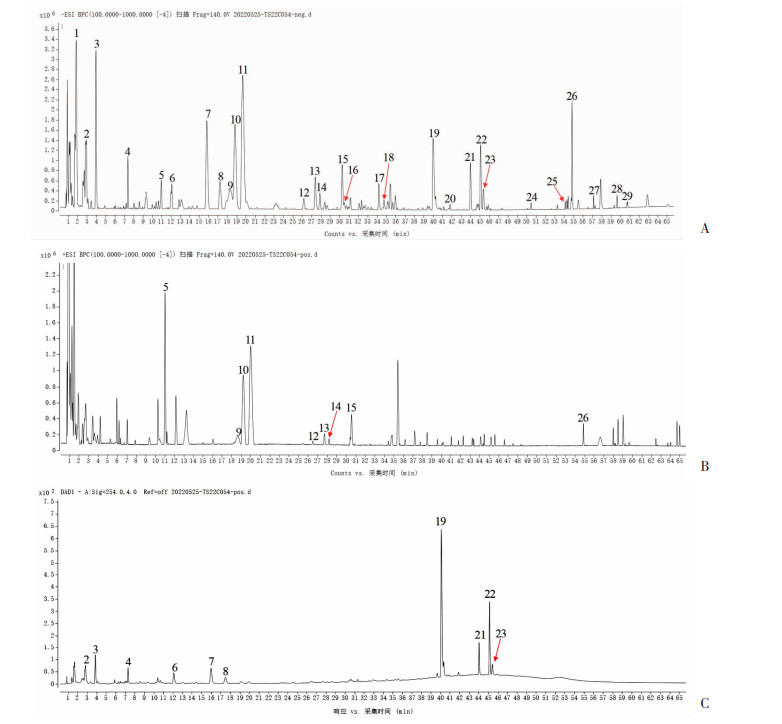
|
| A:负离子模式;B:正离子模式;C:紫外色谱图 ↙: 示质谱检测化合物的基峰位置 图 1 MDA水提物的UPLC-Q-TOF-MS基峰离子流图 |
| 序号 | tR/min | m/z值 | 分子式 | 鉴定结果 | MS/MS |
| 1 | 1.84 | 191.020 3 | C6H8O7 | 柠檬酸 | 111.008 7;87.008 2;85.028 8;67.018 3;57.034 1 |
| 2 | 2.90 | 481.063 1 | C20H18O14 | … | 300.999 0;275.020 4;257.008 6;229.015 3 |
| 3 | 3.94 | 169.014 5 | C7H6O5 | 没食子酸 | 169.013 8;125.023 9 |
| 4 | 7.33 | 153.019 2 | C7H6O4 | 原儿茶酸 | 108.019 6;91.016 4;65.001 5;53.037 5 |
| 5 | 10.93 | 451.124 4 | C21H24O11 | 儿茶素-7-O-葡萄糖苷 | 361.090 7;331.081 4 |
| 6 | 12.06 | 345.083 1 | C14H18O10 | 没食子酸-6-O-甲基-β-D-葡萄糖 | 124.015 3;123.009 0;107.013 2;59.014 0 |
| 7 | 15.80 | 633.074 6 | C27H22O18 | 柯里拉京 | 463.052 2;300.999 9;275.020 3;257.007 3 |
| 8 | 17.22 | 801.080 7 | C34H26O23 | … | 757.082 8;633.071 7;614.045 2;300.988 5 |
| 9 | 18.30 | 577.136 0 | C30H26O12 | 原花青素B1 | 451.102 3;425.086 9;407.077 0;289.070 9;125.024 2 |
| 10 | 18.81 | 577.136 5 | C30H26O12 | 原花青素B2 | 451.102 4;425.086 3;407.077 3;289.071 6 |
| 11 | 19.64 | 289.072 3 | C15H14O6 | 儿茶素 | 245.080 4;203.070 5;187.037 8;151.039 2;125.024 0; |
| 12 | 26.17 | 291.014 9 | C13H8O8 | 短叶苏木酚酸 | 247.024 4;219.029 2;191.034 0 |
| 13 | 27.38 | 865.200 3 | C45H38O18 | 原花青素C1 | 407.076 0;289.072 1;287.055 5;161.024 1;125.023 5 |
| 14 | 27.88 | 577.135 5 | C30H26O12 | 原花青素B3 | 451.102 4;425.088 1;407.076 1;289.070 9;125.023 2 |
| 15 | 30.27 | 289.072 2 | C15H14O6 | 表儿茶素 | 245.083 4;221.081 2;203.071 1;151.039 7;137.024 7;125.024 4 |
| 16 | 30.47 | 449.108 8 | C21H22O11 | 圣草酚-7-O-葡萄糖苷 | 287.055 7;269.044 5;259.059 8;125.022 9 |
| 17 | 34.17 | 729.146 1 | C37H30O16 | 原花青素B2 3-O-没食子酸酯 | 577.134 9;559.125 6;425.088 0;407.076 7;287.055 5;269.045 8 |
| 18 | 34.71 | 577.135 2 | C30H26O12 | 原花青素B4 | 451.102 4;425.088 1;407.076 1;289.070 9;125.023 2 |
| 19 | 39.97 | 300.999 6 | C14H6O8 | 鞣花酸 | 283.996 2;226.997 6;173.024 6;145.028 6;129.033 7 |
| 20 | 41.79 | 447.056 7 | C20H16O12 | … | 315.014 5;299.991 1 |
| 21 | 43.96 | 447.058 0 | C20H16O12 | … | 315.013 5;299.990 7;270.986 9 |
| 22 | 45.04 | 461.072 9 | C21H18O12 | 3-O-甲基鞣花酸-4′-O-鼠李糖苷 | 315.015 4;299.989 9 |
| 23 | 45.34 | 315.015 3 | C15H8O8 | 3-O-甲基鞣花酸 | 299.990 7;270.988 6;216.005 4;200.011 1;160.016 6 |
| 24 | 50.44 | 549.161 1 | C26H30O13 | 芹糖甘草苷 | 429.112 8;255.065 6 |
| 25 | 54.09 | 679.370 1 | C36H56O12 | … | 617.366 8;517.315 8;473.326 2;439.283 7 |
| 26 | 54.88 | 695.402 3 | C36H58O10 | 野蔷薇苷 | 649.394 8;487.343 4 |
| 27 | 57.10 | 693.386 3 | C36H56O10 | … | 485.326 9;467.314 9 |
| 28 | 59.63 | 485.327 4 | C30H46O5 | … | 485.329 2;467.317 5;373.287 3 |
| 29 | 60.58 | 487.342 6 | C30H48O5 | 委陵菜酸 | 487.343 6;469.331 2 |
2.2 MDA水提物抗炎活性成分的靶点
将质谱鉴定得到的29种化合物在Pubchem数据库中进行筛选,最终获取到21个活性成分的结构;将成分信息导入Swiss数据库进行靶点筛选,最后采用Uniprot数据库对靶点名称进行规范统一,去除重复靶点后共筛选到285个药物靶点;通过Omim、Disgenet和Genecards数据库共筛选到861个抗炎靶点,二者取交集后获得104个药物-疾病的共同潜在靶点,使用R4.2.1软件绘制韦恩图(图 2)。
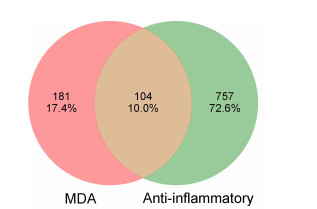
|
| 图 2 MDA水提物活性成分靶点与炎症相关靶点韦恩图 |
2.3 构建“药物-成分-靶点-疾病”网络图,筛选核心成分
将104个共同靶点和相关活性成分导入Cytoscape软件中,绘制“药物-成分-靶点-疾病”网络图(如图 3)。Network Analyzer拓扑分析的结果显示排名前五的核心成分分别是:委陵菜酸(Tormentic acid)、鞣花酸(Ellagic acid)、原花青素C1(Procyanidin C1)、儿茶素(Epicatechin)、原花青素B1(Procyanidin B1),这表明MDA可能通过多成分的协同作用发挥抗炎功能。
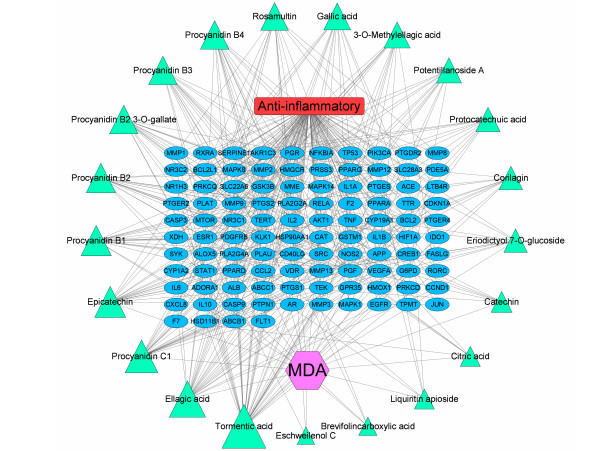
|
| 图 3 MDA水提物“药物-成分-疾病-靶点”网络图 |
2.4 PPI网络的构建与核心靶点分析
将上述104个药物-疾病共同靶点输入到String数据库中进行检索,设置蛋白种类为“Homo sapiens”,相互作用阈值≥0.4,得到PPI网络(图 4A)。通过Cytoscape软件绘制蛋白相互作用网络图(图 4B)。其中节点的大小、颜色深浅按节点Degree值大小变化,最外圈为degree>50的靶点。最后通过Network Analyzer进行拓扑分析,选取degree值大于平均分的基因作为核心靶点,采用R 4.2.1将degree排名前20的靶点绘制条形图(图 4C)。
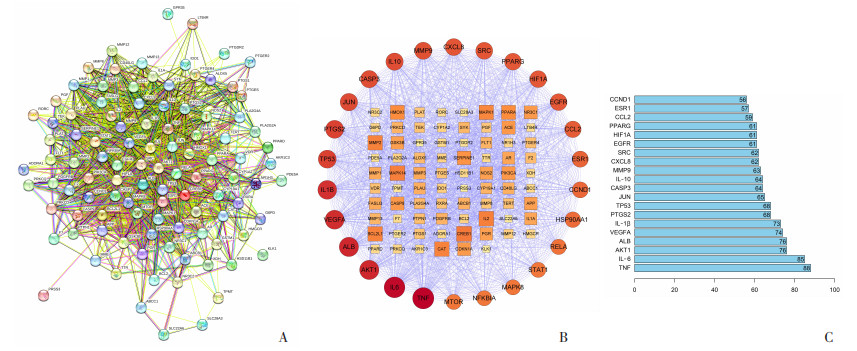
|
| A:PPI网络图;B:潜在核心靶点网络图;C:潜在核心靶点条形图 图 4 MDA水提物抗炎网络图 |
2.5 GO功能分析与KEGG通路分析
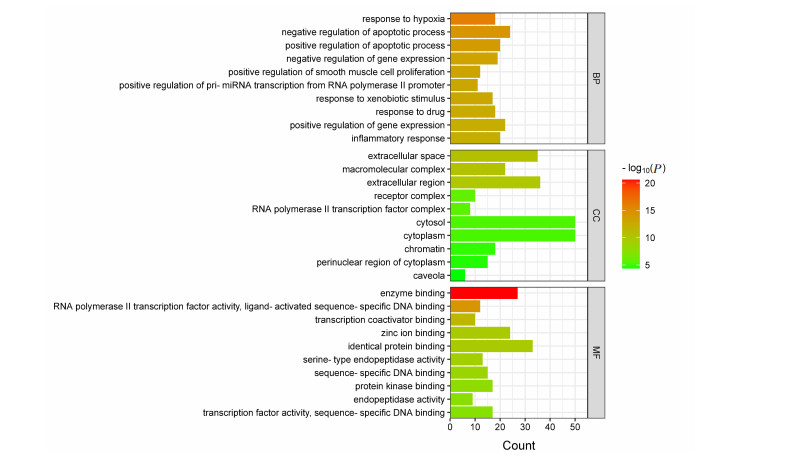
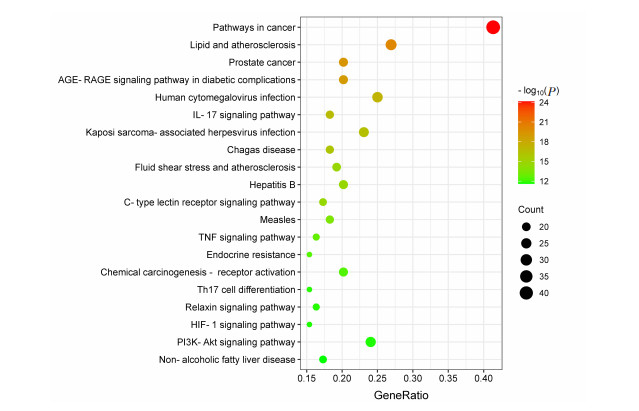
将上述104个共同靶点经David数据库做GO富集分析,得到生物过程(biological process,BP)条目600条,主要与炎症反应通路、细胞凋亡的调控、基因表达的正向调控等信号通路有关;细胞组成(cellular component,CC)条目52条,主要涉及质膜、细胞外间隙、胞外区等;分子功能(molecular function,MF)条目109条,主要涉及蛋白结合、蛋白激酶结合、内肽酶结合等,选取每部分P值排名前10的条目绘制条形图(图 5)。同理,经David数据库KEGG富集分析后共得到160条KEGG通路,以富集到该通路的核心靶点个数和-Log10(P) 来衡量KEGG富集程度,选取P值排名前20的通路绘制KEGG富集的气泡图(图 6),GO功能分析与KEGG通路分析的结果表明MDA水提物组分可通过多途径、多靶点发挥抗炎作用。
|
| 图 5 MDA水提物潜在抗炎靶点的GO功能富集分析 |
|
| 图 6 MDA水提物潜在抗炎作用靶点的KEGG通路富集分析 |
2.6 MDA水提物对RAW264.7细胞炎症因子及通路蛋白的影响
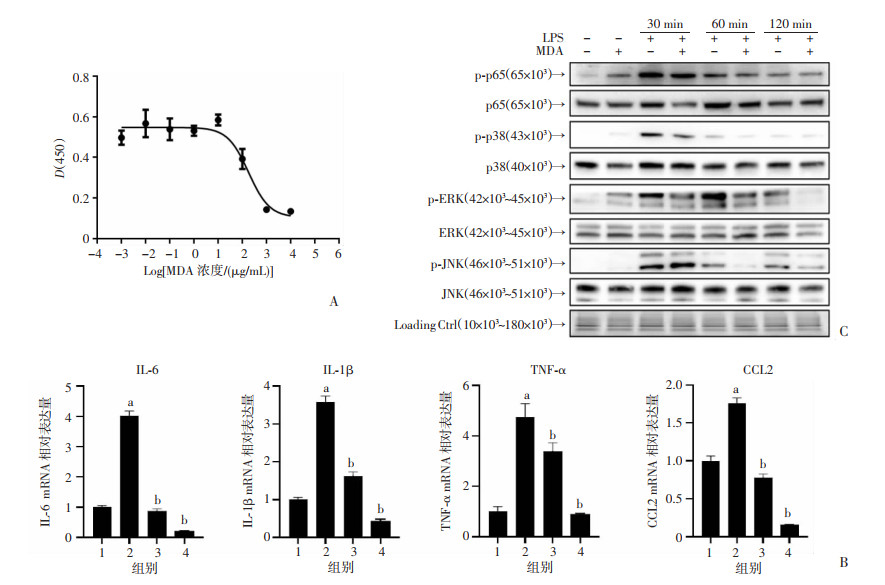
CCK-8的实验结果表明MDA浓度在100 μg/mL及以上时对细胞具有毒性(图 7A),本研究最终选择50 μg/mL作为MDA对细胞的安全剂量。参照网络药理分析的结果初步选择4种炎症因子进行细胞实验:与正常对照组相比,LPS组TNF-α、IL-6、IL-1β及CCL2的mRNA水平显著升高(P < 0.05)。与模型组相比,MDA组TNF-α、IL-6、IL-1β及CCL2的mRNA水平显著降低(P < 0.05,图 7B)。结合网药结果选择实验室最常用的几种通路蛋白初步验证该药物是否可通过多条途径抑制炎症反应:与正常对照组相比,LPS组p65、p38、JNK及ERK的磷酸化水平显著上调(P < 0.05);与LPS组相比,MDA药物处理组p38、JNK及ERK的磷酸化水是显著下调的(P < 0.05,图 7C),而p65的磷酸化水平未见显著改变。上述结果表明MDA水提物的抗炎功能可能与MAPK信号通路相关且具有多条途径。
|
|
1:正常对照组;2:LPS组;3:LPS+MDA组;4:LPS+DEX组 A:CCK-8实验检测细胞活性;B:细胞炎症因子的mRNA相对表达量 a: P < 0.05, 与正常对照组比较;b: P < 0.05, 与LPS组比较;C:炎症相关通路蛋白的磷酸化水平变化 图 7 MDA水提物对RAW264.7细胞炎症因子及通路蛋白的影响(n=3,x±s) |
3 讨论
炎症是机体抵御损伤和感染的第一道防线,可以激活先天和适应性免疫以应对挑战,对机体起着一定的保护作用[11]。炎症反应时机体会产生一系列的炎性细胞及炎症因子,当这些因素失控时可能会引起机体损伤甚至死亡。有研究表明,某些炎症或趋化因子的失调在许多疾病如脓毒症、阿尔兹海默症、帕金森综合征、癌症等的发生和发展过程中起着关键作用。越来越多的研究表明,植物中不仅含有丰富的抗炎活性成分且毒副作用较小,已成为开发新型抗炎药物的热点方向。近期,我们实验室首次证实了另一种侗药“Jiao Mei Gu”水提物可以通过抑制NF-κB活性从而减轻LPS介导的小鼠炎症反应[12]以及通过抑制M1巨噬细胞的极化从而减弱酵母多糖A诱导的炎症,并且通过质谱法定量分析了该植物所含有的化学成分及含量[13]。本文的研究对象“马镫艾”(MDA)也是一种传统的侗族药物,经湖南省侗族医药研究重点实验室鉴定为Potentilla freyniana Bornm(P. freyniana)原变种,其根部在民间常被用于清热解毒,治疗癌症及外出血等[9-10]。已经有报导表明,MDA水提物能有效抑制普通细菌及几种临床常见多重耐药菌的生长,具有很好的抗感染的作用,同时还能促进伤口的愈合[11]。感染与炎症既有本质区别也有密切联系[14],因此本文旨在采用UPLC-Q-TOF-MS技术联合网络药理学以及体外实验的方法初步探讨MDA水提物抑制炎症的潜在药效物质及机制,并为后续研究提供思路和参考。
通过高效液相色谱串联质谱技术在MDA水提物中一共检测到29种化合物,经过Pubchem数据库筛选后获取到21个成分的结构;将这21个成分信息导入Swiss数据库进行筛选得到285个药物靶点,再通过Omim、Disgenet和Genecards数据库筛选得到861个抗炎靶点,二者取交集后共获得104个药物-疾病的共同潜在靶点。采用Cytoscape 3.9.1构建“药物-成分-疾病-靶点”网络再进行拓扑分析,筛选出具有抗炎活性的核心成分,其中排名前五的分别是:委陵菜酸(Tormentic acid)、鞣花酸(Ellagic acid)、原花青素C1(Procyanidin C1)、儿茶素(Epicatechin)、原花青素B1(Procyanidin B1)。目前对于委陵菜酸报导较多的是它对肝脏和血管内皮的保护作用以及对妇科癌症的抗癌作用[15-17],而有关炎症方面还未见广泛的报道;鞣花酸属于天然多酚化合物,具备抗炎、抑菌、抗病毒等多种药理活性,国内外已有较多关于其抗炎功能与机制的报导[18-19];原花青素和儿茶素都属于天然的抗氧化剂,有研究表明:原花青素Bl可抑制LPS诱导的小鼠巨噬细胞炎症[20];儿茶素可通过AMPK/SIRT1信号通路抑制促炎性因子和炎性酶的表达,同时促进抗炎性因子的表达发挥显著的抗炎作用[21-22];而关于原花青素C1的抗炎作用和机制有待进一步研究。综上,侗药MDA充分具备抗炎药物的成药潜力。
从PPI网络可视化分析的结果来看,TNF-α、IL-1β、IL-6、ALB、AKT1等可能是MDA发挥抗炎作用的核心靶点。参照上述结果,用小鼠巨噬细胞RAW264.7作为工具细胞,采用LPS诱导细胞建立炎症模型,挑选其中几种常见的炎症因子进行体外验证。IL-1β是IL-1家族中的重要成员,具有较强的促炎活性,可诱导多种促炎介质的产生,如IL-6[23];而IL-6是一种继发性炎症介质,被激活后可反过来作用于肝脏产生急性期蛋白,如全C反应蛋白(CRP)、纤维蛋白原和纤溶酶原激活物抑制剂等[24];与IL-1β相似,TNF-α是一种多效性促炎细胞因子,属于TNF配体超家族,在调节多种发育和免疫过程中发挥着不同的作用,包括炎症、分化、脂质代谢和凋亡[25-28];CCL2是一种重要的监测炎症和免疫的因子,参与了许多炎性疾病的发病机制,是常见的治疗靶点之一。由体外实验结果可见,与正常对照组相比,模型组TNF-α、IL-6、IL-1β及CCL2的mRNA水平显著升高(P < 0.05);而与模型组相比,MDA组TNF-α、IL-6、IL-1β及CCL2的mRNA水平是显著降低的(P < 0.05)。因此,MDA可能通过以上四个核心靶点发挥抗炎作用,与网络药理分析的结果一致,接下来我们将继续验证其余筛选出的核心靶点,争取找出更多相关的有效靶点。通过对筛选出的104个抗炎相关靶点进行GO和KEGG通路分析发现MDA的生物过程主要涉及炎症反应通路、细胞凋亡的调控、基因表达的正向和负向调控等;其抗炎活性主要涉及癌症通路、脂质与动脉粥样硬化、TNF信号通路、PI3K-Akt信号通路、NF-κB信号通路、MAPK信号通路等。基于网络药理分析的结果,我们采用Western blot的方法初步检测了MDA对几种最常见的炎症通路蛋白的调控情况,结果显示:与正常对照组相比,模型组p65、p38、JNK及ERK的磷酸化水平显著上调(P < 0.05);而与模型组相比,MDA组p38、JNK及ERK的磷酸化水平从30 min开始显著下调(P < 0.05),而p65的磷酸化水平未见明显变化,由此推测MDA发挥抗炎作用的机制很可能与MAPK信号通路密切相关且具有多条抗炎路径,其具体的分子机制及其他可能的信号通路是接下来的研究重点。
综上所述,本研究通过UPLC-Q-TOF-MS技术联合网络药理学以及体外实验的方法预测了侗药“马镫艾”水提物发挥抗炎功效的潜在药效物质及相关机制通路,为后续的深入研究提供了重要的思路和参考。
| [1] |
HE F, ANTONUCCI L, KARIN M. NRF2 as a regulator of cell metabolism and inflammation in cancer[J]. Carcinogenesis, 2020, 41(4): 405-416. |
| [2] |
YEUNG Y T, AZIZ F, GUERRERO-CASTILLA A, et al. Signaling pathways in inflammation and anti-inflammatory therapies[J]. Curr Pharm Des, 2018, 24(14): 1449-1484. |
| [3] |
SOEHNLEIN O, LIBBY P. Targeting inflammation in atherosclerosis—from experimental insights to the clinic[J]. Nat Rev Drug Discov, 2021, 20(8): 589-610. |
| [4] |
WÖLFLE U, HOFFMANN J, HAARHAUS B, et al. Anti-inflammatory and vasoconstrictive properties of Potentilla erecta—A traditional medicinal plant from the Northern hemisphere[J]. J Ethnopharmacol, 2017, 204: 86-94. |
| [5] |
CAPLAN A, FETT N, ROSENBACH M, et al. Prevention and management of glucocorticoid-induced side effects: a comprehensive review: gastrointestinal and endocrinologic side effects[J]. J Am Acad Dermatol, 2017, 76(1): 11-16. |
| [6] |
ZHANG R R, MENG N N, LIU C, et al. PDB-1 from Potentilla discolor Bunge induces apoptosis and autophagy by downregulating the PI3K/Akt/mTOR signaling pathway in A549 cells[J]. Biomedecine Pharmacother, 2020, 129: 110378. |
| [7] |
LIU W W, ZHANG Y J, ZHU W N, et al. Sinomenine inhibits the progression of rheumatoid arthritis by regulating the secretion of inflammatory cytokines and monocyte/macrophage subsets[J]. Front Immunol, 2018, 9: 2228. |
| [8] |
DHAIBAN S, AL-ANI M, ELEMAM N M, et al. Targeting chemokines and chemokine receptors in multiple sclerosis and experimental autoimmune encephalomyelitis[J]. J Inflamm Res, 2020, 13: 619-633. |
| [9] |
WU J, ZHANG Z Q, ZHOU X D, et al. New terpenoids from Potentilla freyniana Bornm. and their cytotoxic activities[J]. Molecules, 2022, 27(12): 3665. |
| [10] |
CAI W, LI K L, QIN S H, et al. Rapid identification and systematic mechanism of flavonoids from Potentilla freyniana Bornm. based on UHPLC-Q-exactive orbitrap mass spectrometry and network pharmacology[J]. Int J Anal Chem, 2021, 2021: 6619959. |
| [11] |
TANG Z R, ZHAO Y N, ZHANG Z Q, et al. Study of the antimicrobial activity of the Chinese Dong ethnic minority medicine, madeng'ai[J]. Evid Based Complement Alternat Med, 2022, 2022: 3678240. |
| [12] |
LI W, LUO L, ZHU J Y, et al. Water extract of Cayratia albifolia C.L.Li root relieves zymosan A-induced inflammation by restraining M1 macrophage polarization[J]. Phytomedicine, 2022, 96: 153901. |
| [13] |
LUO L, ZHANG W, ZHANG Z Q, et al. The water extract of "Jiao Mei Gu" attenuates the lipopolysaccharide-induced inflammatory response via inhibiting NF-κB activity in mice[J]. J Ethnopharmacol, 2020, 259: 112882. |
| [14] |
DONG Y Z, ZHAO Q L, WANG Y G, et al. Network pharmacology-based investigation of potential targets of astragalus membranaceous-angelica sinensis compound acting on diabetic nephropathy[J]. Sci Rep, 2021, 11(1): 19496. |
| [15] |
LI X, WEI S Z, NIU S Q, et al. Network pharmacology prediction and molecular docking-based strategy to explore the potential mechanism of Huanglian Jiedu Decoction against sepsis[J]. Comput Biol Med, 2022, 144: 105389. |
| [16] |
WANG Z Y, WANG X, ZHANG D Y, et al. Traditional Chinese medicine network pharmacology: development in new era under guidance of network pharmacology evaluation method guidance[J]. China J Chin Materia Medica, 2022, 47(1): 7-17. |
| [17] |
TAO J Y, YAN S L, ZHOU C Y, et al. Total flavonoids from Potentilla kleiniana Wight et Arn inhibits biofilm formation and virulence factors production in methicillin-resistant Staphylococcus aureus (MRSA)[J]. J Ethnopharmacol, 2021, 279: 114383. |
| [18] |
D'ELIA R V, HARRISON K, OYSTON P C, et al. Targeting the cytokine storm for therapeutic benefit[J]. Clin Vaccine Immunol, 2013, 20(3): 319-327. |
| [19] |
MUNJAL A, KHANDIA R. Atherosclerosis: orchestrating cells and biomolecules involved in its activation and inhibition[M]//Advances in protein chemistry and structural biology. Amsterdam: Elsevier, 2020: 85-122. DOI: 10.1016/bs.apcsb.2019.11.002.
|
| [20] |
BEIZAVI Z, ZOHOURI M, ASADIPOUR M, et al. IL-27, a pleiotropic cytokine for fine-tuning the immune response in cancer[J]. Int Rev Immunol, 2021, 40(5): 319-329. |
| [21] |
SARAIVA M, VIEIRA P, O'GARRA A. Biology and therapeutic potential of interleukin-10[J]. J Exp Med, 2020, 217(1). |
| [22] |
LIANG W G, TRIANDAFILLOU C G, HUANG T Y, et al. Structural basis for oligomerization and glycosaminoglycan binding of CCL5 and CCL3[J]. Proc Natl Acad Sci USA, 2016, 113(18): 5000-5005. |
| [23] |
HUA X L, GE S D, ZHANG M, et al. Pathogenic roles of CXCL10 in experimental autoimmune prostatitis by modulating macrophage chemotaxis and cytokine secretion[J]. Front Immunol, 2021, 12: 706027. |
| [24] |
DENG T Y, SHEN P, LI A M, et al. CCDC65 as a new potential tumor suppressor induced by metformin inhibits activation of AKT1 via ubiquitination of ENO1 in gastric cancer[J]. Theranostics, 2021, 11(16): 8112-8128. |
| [25] |
IGLESIAS D E, CREMONINI E, FRAGA C G, et al. Ellagic acid protects Caco-2 cell monolayers against inflammation-induced permeabilization[J]. Free Radic Biol Med, 2020, 152: 776-786. |
| [26] |
LIN X, WEI Y Y, LI Y, et al. Tormentic acid ameliorates hepatic fibrosis in vivo by inhibiting glycerophospholipids metabolism and PI3K/Akt/mTOR and NF-κB pathways: based on transcriptomics and metabolomics[J]. Front. Pharmacol, 2022, 13: 801982. |
| [27] |
SHEINENZON A, SHEHADEH M, MICHELIS R, et al. Serum albumin levels and inflammation[J]. Int J Biol Macromol, 2021, 184: 857-862. |
| [28] |
ZHENG K N, LV B J, WU L L, et al. Protecting effect of emodin in experimental autoimmune encephalomyelitis mice by inhibiting microglia activation and inflammation via Myd88/PI3K/Akt/NF-κB signalling pathway[J]. Bioengineered, 2022, 13(4): 9322-9344. |




