2. 400038 重庆,陆军军医大学(第三军医大学)极端环境医学教育部重点实验室;
3. 400038 重庆,陆军军医大学(第三军医大学)高原军事医学系高原生理学与病理学教研室
2. Key Laboratory of Extreme Environmental Medicine of Ministry of Education, Army Medical University (Third Military Medical University), Chongqing, 400038, China;
3. Department of High Altitude Physiology and Pathology, College of High Altitude Military Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038, China
低氧性肺动脉高压(hypoxic pulmonary hypertension,HPH)是以肺动脉的压力异常升高为特征的一种临床疾病,低氧是其主要病因[1]。长期低氧可导致肺血管重塑,是HPH的主要病理特征,其中包括肺动脉内皮细胞功能障碍、内膜增厚伴内皮间质化,平滑肌细胞过度增殖和凋亡抵抗,细胞外基质增多和血管周围炎症反应等[2]。PASMCs的过度增殖是引起肺血管重塑的重要机制[3]。HPH的发病机制复杂且尚不完全明确,是多种因素、多个环节共同作用的结果[4-6]。
大量研究发现,机体内铁稳态的失衡与肺动脉高压密切相关[7-10]。铁元素参与许多重要的生命过程,包括氧气运输、DNA合成、线粒体电子转移、能量代谢等。细胞内可利用的游离铁减少,细胞的正常功能将受到抑制[11]。而细胞内的Fe2+具有氧化还原活性,易发生芬顿反应(fenton reaction),产生大量活性氧(reactive oxygen species,ROS),游离铁过多易导致细胞内蛋白质、脂质等的过氧化,最终导致细胞死亡[12]。因此,细胞内的铁稳态需受到精确调控。但低氧时,PASMCs的铁稳态是否失衡,其变化机制是什么,是否参与低氧诱导的细胞增殖,尚不明确。
为此,本研究将观察低氧处理的原代小鼠PASMCs中铁稳态变化;构建HPH模型小鼠,干扰PASMCs的铁稳态,检测右心功能变化,右心室收缩压等血流动力学指标,以及肺血管重塑变化等;检测低氧处理后PAMSCs铁稳态调节分子的变化,并进一步探究其变化的机制。揭示铁稳态在肺动脉重塑和HPH发生发展中的作用及具体机制,为防治HPH提供新的思路。
1 材料与方法 1.1 细胞培养与分组 1.1.1 细胞培养原代小鼠PASMCs购自武汉普诺赛生命科技有限公司。DMEM/F-12培养基购自美国Thermo Fisher公司。DMSO购自江苏碧云天生物技术有限公司。FAC和雷帕霉素购自美国MedChem-Express公司。细胞培养在含有10%胎牛血清和1%抗生素的DMEM/F12培养基中。实验在原代细胞的第三代和第六代之间进行。
1.1.2 实验分组细胞分组为常氧组(C)、常氧柠檬酸铁铵组(C+FAC)、常氧雷帕霉素组(C+R)、低氧组(H)、低氧柠檬酸铁铵组(H+FAC)、低氧雷帕霉素组(H+R)。C组、C+FAC组和C+R组置于常氧(21%O2)环境中培养48 h,H组、H+FAC组和H+R组置于低氧(1%O2)环境中培养48 h。C+FAC组和H+FAC组使用FAC(40 μmol/L) 处理,C+R组和H+R组使用雷帕霉素(10 nmol/L)处理。RT-qRCR和Western blot实验样本量为n=3, 其余细胞实验样本量为n=6。
1.2 实验动物与分组 1.2.1 动物分组与饲养24只C57/BL6N小鼠(雄性,6周龄,体质量18~22 g)购自北京维通利华实验动物技术有限公司。普通饲料(铁含量约为50 mg/kg)和高铁饲料(铁含量约为500 mg/kg) 均购自深圳睿迪生物科技有限公司。24只C57/BL6N小鼠采取随机数字表法分成4组:常氧组(C-4W)、常氧高铁饮食组(C+HID-4W)、低氧组(H-4W)和低氧高铁饮食组(H+HID-4W)(n=6)。C-4W组和H-4W组给予普通饲料,C+HID-4W组和H+HID-4W组给予高铁饲料(按饮食量计算,补铁量相当于每天100 mg/kg)。H-4W组和H+HID-4W组饲养于低氧环境(空气压力约为375 mmHg,相当于海拔5 000 m)中4周,复制小鼠HPH模型,环境温度20~25 ℃,相对湿度为50%~70%,动物可自由获得水和食物。
1.2.2 实验内容小鼠通过吸入异氟烷(1%~3%)进行麻醉。麻醉深度通过疼痛和角膜反射的消失评估。心脏超声法测量右心功能,导管法测量右心室收缩压等血流动力学参数,分离右心室并称量计算右心室肥厚指数。小鼠实施安乐死,有关动物的操作流程严格遵守陆军军医大学实验动物福利和伦理相关规定,并尽可能减少实验动物的痛苦,降低小鼠使用量。
1.3 Western blot检测RIPA裂解液、Western blot快速封闭液、PMSF、BCA蛋白浓度测定试剂盒、辣根过氧化物酶标记山羊抗兔IgG购自江苏碧云天生物技术有限公司。封闭蛋白干粉、PBS、TBS购自博士德公司。FTH抗体、TFR抗体购自英国Abcam公司,FPN抗体、IRP1抗体、IRP2抗体购自美国Proteintech公司,β-actin抗体购自武汉爱博泰克生物科技有限公司。使用适量蛋白裂解液RIPA提取细胞总蛋白,BCA法检测蛋白浓度。蛋白上样量为40 μg,进行SDS-PAGE凝胶电泳,电泳后恒压(100 Ⅴ,65 min)转膜,快速封闭液常温封闭15 min。IRP1(1 ∶1 000),IRP2(1 ∶1 000),FTH(1 ∶1 000),TFR(1 ∶1 000),FPN(1 ∶1 000),β-actin(1 ∶50 000)一抗4 ℃摇床孵育过夜,TBST洗膜3次,10 min/次,二抗(1 ∶2 000)常温孵育1 h,TBST洗膜3次,10 min/次。ECL法显影,Image lab分析结果。
1.4 RT-qPCR检测RNA提取试剂盒购自美国OMEGA公司,PrimeScript RT和SYBRTM Green PCR Master Mix试剂盒购自日本TaKaRa公司。使用总RNA提取试剂盒提取RNA,测定mRNA浓度与纯度。用PrimeScript RT试剂盒进行反转录得到cDNA。然后,使用SYBRTM Green PCR Master Mix进行RT-qPCR。β-actin作为内参,使用2-△△Ct法计算基因的相对表达量。小鼠FPN上游引物5′-GGCACTTTGCAGTGTCTGTG-3′,下游引物5′-GTGACGTCTGGGCCACTTTA-3′;TFR上游引物5′-CACTGAGTGGTTGGAGGGAT-3′,下游引物5′-AGA-TTTTCCATCAACTGGATGCT-3′;FTH上游引物5′-GG-AGCATGCCGAGAAACTGA-3′,下游引物5′-GTCATCACGGTCTGGTTTCTTT-3′;β-actin上游引物5′-CACTGTCGAGTCGCGTCC-3′,下游引物5′-TCATCCATGGCGAACTGGTG-3′,引物购自美国Invitrogen公司。
1.5 CCK-8检测CCK-8试剂购自美国MedChemExpress公司。将细胞接种到96孔板,细胞密度为5×103/孔,每孔培养基100 μL。用FAC或雷帕霉素处理细胞,低氧或常氧培养48 h后,每孔加入CCK-8和PBS混合液100 μL(1 ∶9),孵育2 h。酶标仪450 nm波长测量光密度,没有细胞的孔作为空白对照。细胞增殖指数由光密度值比值表示。
1.6 EdU检测EdU-594细胞增殖检测试剂盒购自江苏碧云天生物科技有限公司。在激光共聚焦皿中培养适当数量的细胞。细胞培养过夜并且恢复到正常状态后,用FAC或雷帕霉素处理细胞,低氧或常氧培养48 h。EdU标记细胞2 h,固定、通透细胞,加入Click反应液室温避光孵育30 min,Hoechst 33342室温避光孵育10 min进行细胞核染色。荧光显微镜下观察,计算随机视野中EdU阳性细胞的数量,及EdU阳性细胞与Hoechst染色细胞的比例。
1.7 PASMCs分离和游离铁检测分离小鼠的肺组织,找到右肺动脉。通过去除外膜和内膜获得中间层的平滑肌。将其剪下,用胶原酶消化,过滤成细胞悬液,离心,并重新悬浮在FerroOrange染色液中。将细胞悬浮液转移到96孔板中,并染色30 min。使用微孔板多功能分析仪测量总荧光强度。吸出FerroOrange染色液,用PBS清洗,离心,并将细胞重新悬浮在CCK-8染色液中。然后将细胞悬液转移到96孔板中,孵育120 min。使用酶标仪检测光密度值。游离铁(%)以常氧组为对照,计算各组相对荧光强度比值表示。校正荧光强度=荧光强度÷光密度值。
1.8 HE染色小鼠断颈处死后,取右肺组织中叶,4%甲醛固定,常规石蜡包埋,制作石蜡切片(4 μm)。HE染色,光学显微镜下观察,用Image J软件分析肺动脉厚度,并做统计学分析。HE染色实验样本量为n=3。
1.9 统计学分析使用GraphPad Prism 8.0进行统计学分析。计量资料以
为明确低氧环境中PASMCs内游离铁含量变化,将PASMCs置于低氧工作站中,培养48 h,复制低氧诱导的细胞增殖模型。CCK-8法检测细胞增殖活性,FerroOrange法检测游离铁含量,结果显示:与C组相比,H组PASMCs的增殖水平显著增加(P < 0.01,图 1A),细胞内游离铁含量显著减少(P < 0.01,图 1B)。细胞感知游离铁含量主要是通过IRPs。当细胞内游离铁减少时,IRPs表达增多,来增加细胞内游离铁,维持铁稳态。Western blot结果显示:与C组相比,低氧后IRP1和IRP2表达量增加(P < 0.05,图 1C、D)。以上结果提示低氧诱导PASMCs游离铁减少。
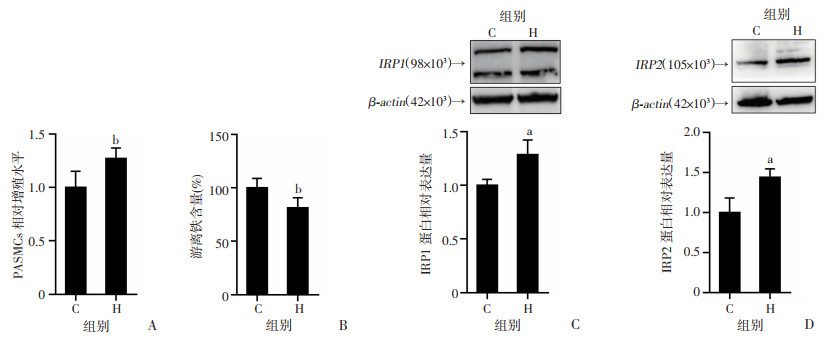
|
|
a:P < 0.05,b:P < 0.01,与C组比较 A:CCK-8法检测PASMCs相对增殖水平(n=6, |
2.2 高铁饮食改善小鼠HPH
为验证缺铁是否在HPH的形成中起关键作用,将小鼠暴露于5 000 m海拔,给予高铁饮食饲养4周,结果显示:与C-4W组比较,H-4W组小鼠的PASMCs内游离铁含量显著降低(P < 0.01,图 2A),右心室收缩压显著升高(P < 0.01,图 2B),右心室肥厚指数显著增加(P < 0.01,图 2C),肺动脉壁厚度显著增加(P < 0.01,图 2D、E),三尖瓣环收缩期位移(P < 0.05,图 2F)和三尖瓣环收缩期速度显著减弱(P < 0.01,图 2G);与H-4W组比较,H+HID-4W组小鼠的PASMCs内游离铁含量显著增加(P < 0.01,图 2A),右心室收缩压显著降低(图 2B,P < 0.05),右心室肥厚指数显著减少(P < 0.01,图 2C),肺动脉壁厚度显著减少(P < 0.01,图 2D、E),三尖瓣环收缩期位移(图 2F,P < 0.01)和三尖瓣环收缩期速度显著增加(P < 0.01,图 2G)。以上结果表明高铁饮食可逆转低氧诱导的PASMCs内游离铁减少,降低慢性低氧小鼠的右心室压力,抑制肺血管重塑和改善心功能。
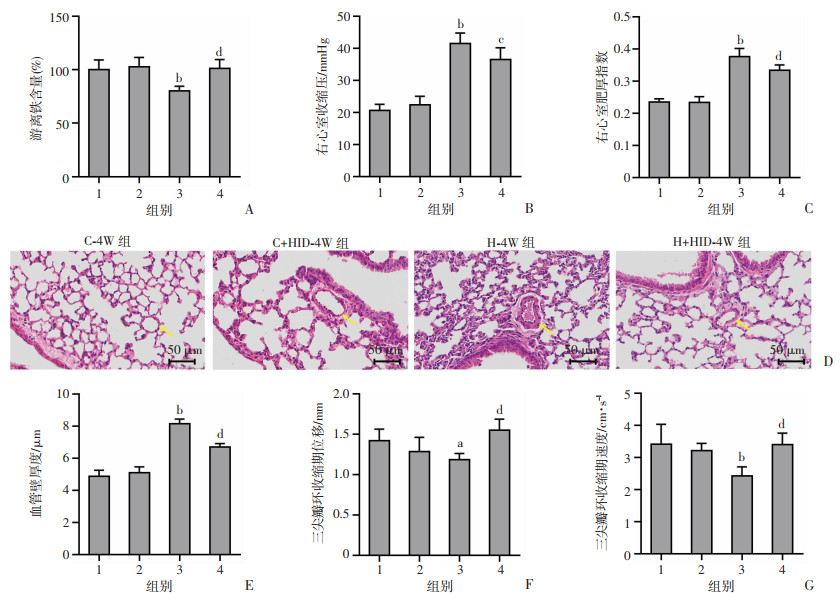
|
|
1: C-4W组; 2: C+HID-4W组; 3: H-4W组; H+HID-4W组; a:P < 0.05,b:P < 0.01,与C-4W组比较;c:P < 0.05,d:P < 0.01,与H-4W组比较 A:FerroOrange法检测分离的小鼠PASMCs游离铁含量(n=6, |
2.3 补铁抑制低氧诱导的PASMCs增殖
在观察到高铁饮食可以改善HPH后,进一步实验明确铁稳态变化是否调节低氧诱导的PASMCs增殖。用FAC处理PASMCs,低氧培养48 h后,检测细胞增殖水平变化。结果显示:与H组相比,H+FAC组PASMCs内游离铁含量显著增加(P < 0.01,图 3A),细胞相对增殖水平显著降低(P < 0.01,图 3B),EdU阳性细胞率显著降低(P < 0.05,图 3C、D)。以上结果提示,补铁抑制低氧诱导的PASMCs增殖。
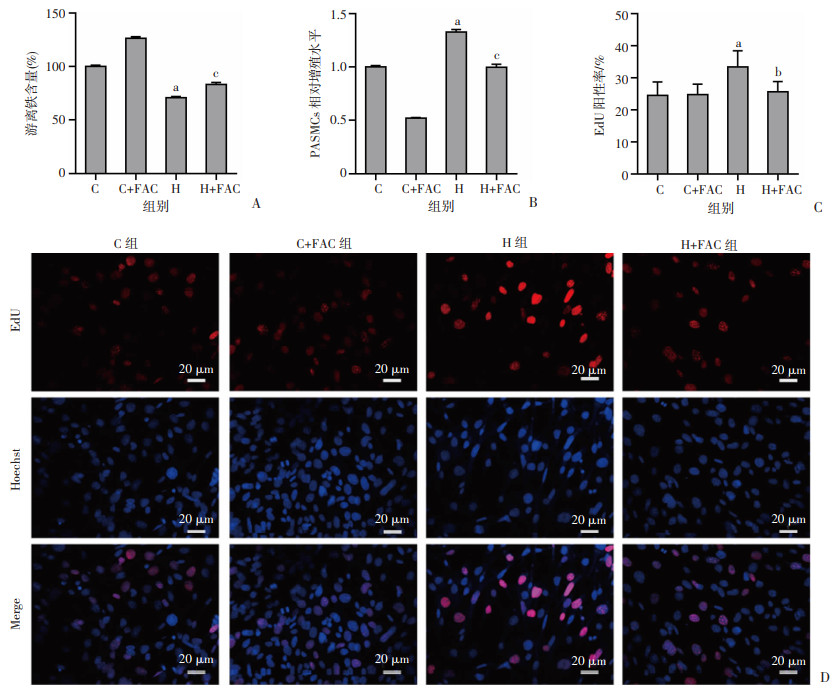
|
|
a:P < 0.01,与C组比较;b:P < 0.05,c:P < 0.01,与H组比较 A:FerroOrange法检测PASMCs游离铁含量;B:CCK-8法检测PASMCs相对增殖水平;C:统计分析PASMCs细胞EdU染色阳性率;D:PASMCs细胞EdU染色 图 3 FAC对PASMCs增殖水平的影响(n=6, |
2.4 低氧抑制铁蛋白自噬
为了进一步探究PASMCs缺铁的原因,检测铁稳态调控途径的关键分子,即FPN、TFR和FTH。结果显示,与C组相比,H组PASMCs内TFR的mRNA水平显著增加(P < 0.05,图 4B),FPN(P < 0.01,图 4A)和FTH的mRNA水平显著降低(P < 0.05,图 4C),符合细胞缺铁反应变化。与C组相比,H组FPN的蛋白水平变化没有显著差异(图 4D),TFR的蛋白水平(P < 0.05,图 4E)和FTH的蛋白水平显著增加(P < 0.01,图 4F)。结果提示,低氧后细胞内铁蛋白的增加,是通过抑制铁蛋白自噬这一降解利用途径,而非通过上调其基因转录。
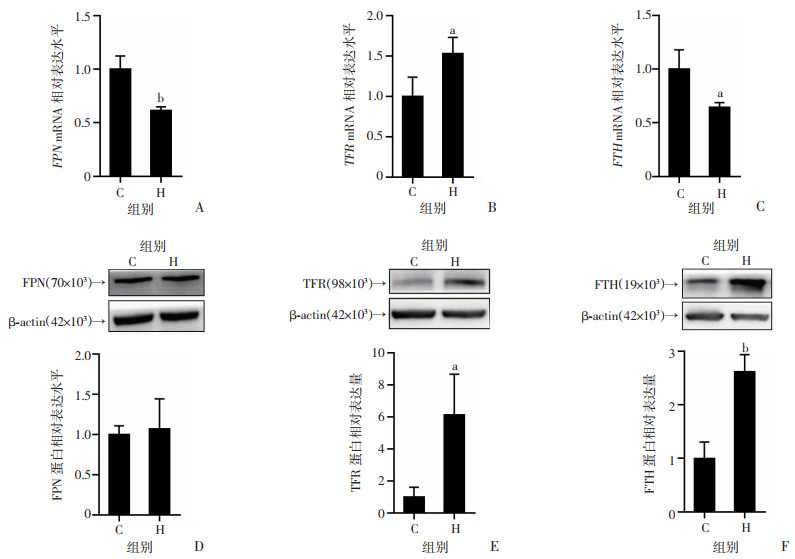
|
|
a:P < 0.05,b:P < 0.01,与常氧组比较 A:PCR检测FPN的mRNA相对表达水平;B:PCR检测TFR的mRNA相对表达水平;C:PCR检测FTH的mRNA相对表达水平;D:Western blot检测FPN蛋白的相对表达量;E:Western blot检测TFR蛋白的相对表达量;F:Western blot检测FTH蛋白的相对表达量 图 4 低氧对PASMCs内FPN、TFR和FTH表达的影响(n=3, |
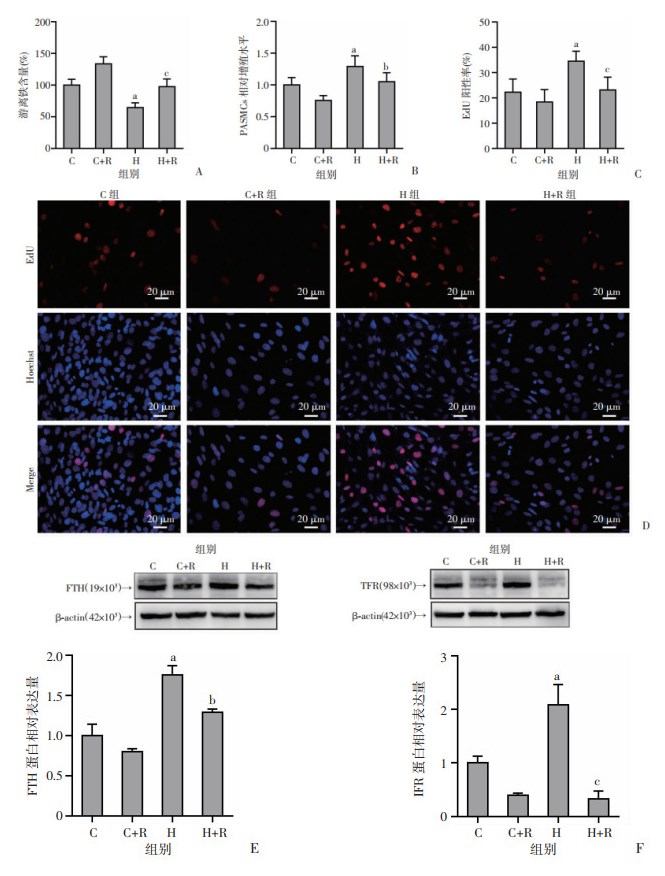
2.5 雷帕霉素抑制低氧诱导的PASMCs增殖
使用自噬激活剂雷帕霉素促进铁蛋白自噬,来观察低氧后细胞的铁缺乏是否能被其改变。雷帕霉素处理PASMCs,低氧培养48 h,FerroOrange法检测细胞内游离铁含量,CCK-8法和EdU法检测细胞增殖水平变化。结果显示:与H组相比,H+R组PASMCs内游离铁含量显著增加(P < 0.01,图 5A),相对增殖水平降低(P < 0.05,图 5B),EdU阳性细胞率显著降低(P < 0.01,图 5C、D)。以上结果提示,雷帕霉素抑制低氧诱导的PASMCs增殖。进一步检测雷帕霉素对PASMCs中铁稳态蛋白的影响,结果显示:与H组相比,H+R组PASMCs内FTH的蛋白水平(P < 0.05,图 5E)和TFR的蛋白水平都显著降低(P < 0.01,图 5F)。以上结果进一步说明,铁蛋白自噬功能的改善有助于增加低氧后的细胞内游离铁含量,抑制低氧诱导的细胞增殖。
|
|
a:P < 0.01,与C组比较;b:P < 0.05,c:P < 0.01,与H组比较 A:FerroOrange法检测PASMCs游离铁含量(n=6, |
3 讨论
在常氧条件下,肺动脉铁稳态受到精确调控,从而维持血管功能稳定[2-3]。本研究发现,在慢性低氧时PASMCs内游离铁减少,补铁可抑制低氧诱导的PASMCs增殖,以及高铁饮食可改善HPH,结果提示铁稳态改变参与低氧诱导的PASMCs增殖和肺动脉重塑。同时,慢性低氧后PASMCs内铁储存蛋白FTH蓄积,使用自噬激活剂雷帕霉素可增加细胞内游离铁含量和抑制低氧诱导的PASMCs增殖,结果提示低氧通过抑制铁蛋白自噬,介导PASMCs的游离铁减少,从而促进细胞增殖。
铁稳态在肺动脉重塑中起着重要作用。大多数特发性肺动脉高压患者存在明显的铁缺乏,表现为循环可溶性TFR水平升高,血清铁、铁蛋白和转铁蛋白饱和度水平降低,红细胞分布宽度增加,并且与疾病严重程度和不良临床预后相关[10]。喂食4周缺铁饮食的大鼠发生肺动脉重塑,形成肺动脉高压,其血管表现为显著的肌肉化、内侧肥大和血管周围炎性细胞浸润。缺铁可以促进PASMCs增殖,其机制与线粒体功能抑制和和葡萄糖摄取增加有关[13]。然而也有不同的报道,提示铁累积能够促进平滑肌细胞增殖和肺血管重塑。脂质运载蛋白2(lipocalin,Lcn2)是一种铁摄取蛋白,可通过增加细胞内铁,促进PASMCs内质网应激和细胞增殖,使用铁螯合剂可抑制Lcn2在PASMCs中的作用[14]。铁螯合剂去铁胺可抑制慢性低氧大鼠的肺血管重构和肺动脉高压,其作用机制与减少蛋白质羰基化有关[15]。在长期慢性低氧形成的肺动脉高压中,PASMCs是否存在缺铁或铁累积目前尚无定论。本研究通过分离HPH小鼠的PASMCs,使用FerroOrange染色检测游离铁含量。结果显示HPH小鼠PASMCs的平均荧光强度较正常小鼠明显减少,证实其游离铁含量显著减少。同时给予高铁饲料喂养小鼠,通过口服补铁使慢性低氧小鼠PASMCs内游离铁含量增加,肺动脉压力降低,肺血管重塑抑制。本研究的结果显示:HPH小鼠体内PASMCs存在缺铁,为靶向铁稳态可以缓解HPH的概念提供了明确的证据。
细胞内铁稳态主要由铁摄入、铁输出和铁存储与释放调节。TFR是细胞铁摄入的主要途径[16-17]。FPN是细胞铁输出的唯一途径,通过平滑肌特异性敲入抗铁调素同种型FPN C326Y,可导致平滑肌细胞内缺铁,进而导致肺动脉高压[12]。铁蛋白是细胞内铁存储蛋白,代表细胞的整体铁含量水平,其由FTH和铁蛋白轻链(ferritin light chain,FTL)组成[18]。为明确低氧后PASMCs的铁稳态变化,本研究对这三条调节途径的关键蛋白进行了检测。结果发现低氧后,FPN的蛋白水平变化不显著,TFR和FTH的蛋白水平显著增加,说明细胞处于一个铁累积表型,即细胞内总的铁含量增加。细胞内的铁离子可能受困于铁蛋白中,不能直接被细胞利用,导致细胞可利用铁减少,细胞感应缺铁,从而引起高表达TFR的铁摄入增强状态。因此,本研究发现PASMCs处于游离铁减少的功能性缺铁状态。
铁蛋白自噬是一种选择性自噬,是细胞内储存铁蛋白转变为可直接利用的铁离子的唯一途径[19]。在观察到PASMCs的FTH蛋白含量增多时,本研究也观察到FTH的mRNA水平降低。提示FTH的增多并不是因为基因转录上调,而可能是其降解利用途径受损。然而,缺乏直接证据证实铁蛋白自噬与肺动脉高压之间的相关性,也很少有研究集中于平滑肌增殖。铁蛋白自噬是否影响慢性低氧诱导的肺动脉重塑仍然是一个关键问题。通过使用雷帕霉素激活铁蛋白自噬,本研究发现雷帕霉素可显著增加PASMCs内的游离铁含量,显著抑制低氧诱导的细胞增殖及TFR、FTH增加,结果提示铁蛋白自噬是低氧条件下PASMCs内铁稳态调节的关键步骤。铁蛋白自噬分为2个主要阶段:①铁蛋白与货物载体NCOA4结合,然后由NCOA4运送至自噬体;②自噬体进入溶酶体,铁蛋白被降解[20-21]。NCOA4是铁蛋白自噬的关键因子。研究发现,低氧可降低NCOA4从而抑制铁蛋白自噬,减少细胞内游离铁含量[22-23]。溶酶体是分解蛋白质、核酸、多糖等生物大分子的细胞器[24]。溶酶体酸度、溶酶体膜完整性和溶酶体水解酶活性等都会影响溶酶体的降解功能。溶酶体酸化是正常细胞的一个关键特征。研究发现溶酶体酸化的抑制会引发细胞缺铁,从而导致线粒体功能受损[25-26]。目前,低氧抑制PASMCs铁蛋白自噬的机制还有待阐明。
缺铁后导致PASMCs增殖的可能机制是激活了线粒体自噬。研究发现,细胞内铁耗竭可诱导线粒体功能障碍和线粒体自噬增加[27-29]。低氧可以上调线粒体自噬,诱导PASMCs增殖,抑制细胞凋亡[30-31]。缺铁也可触发Cxcl10、Isg15、Ifit1、Ifit3和Ifi44等炎症因子表达[32]。血管炎症与HPH高度相关[33-34]。上述研究提示,线粒体自噬或炎症可能是铁稳态变化影响平滑肌细胞过度增殖的机制。
总之,本研究显示HPH小鼠PASMCs处于功能性缺铁状态,而铁蛋白自噬受损是导致其功能性缺铁的关键原因。这一发现表明,铁蛋白自噬有望成为HPH干预的潜在靶点。
| [1] |
NATHAN S D, BARBERA J A, GAINE S P, et al. Pulmonary hypertension in chronic lung disease and hypoxia[J]. Eur Respir J, 2019, 53(1): 1801914. |
| [2] |
THOMPSON A A R, LAWRIE A. Targeting vascular remodeling to treat pulmonary arterial hypertension[J]. Trends Mol Med, 2017, 23(1): 31-45. |
| [3] |
NAEIJE R, RICHTER M J, RUBIN L J. The physiological basis of pulmonary arterial hypertension[J]. Eur Respir J, 2022, 59(6): 2102334. |
| [4] |
GORELOVA A, BERMAN M, AL GHOULEH I. Endothelial- to-mesenchymal transition in pulmonary arterial hypertension[J]. Antioxid Redox Signal, 2021, 34(12): 891-914. |
| [5] |
CHEN D W, GAO W X, WANG S X, et al. Critical effects of epigenetic regulation in pulmonary arterial hypertension[J]. Cell Mol Life Sci, 2017, 74(20): 3789-3808. |
| [6] |
ROWAN S C, KEANE M P, GAINE S, et al. Hypoxic pulmonary hypertension in chronic lung diseases: novel vasoconstrictor pathways[J]. Lancet Respir Med, 2016, 4(3): 225-236. |
| [7] |
VON HAEHLING S, JANKOWSKA E A, VAN VELDHUISEN D J, et al. Iron deficiency and cardiovascular disease[J]. Nat Rev Cardiol, 2015, 12(11): 659-669. |
| [8] |
RHODES C J, HOWARD L S, BUSBRIDGE M, et al. Iron deficiency and raised hepcidin in idiopathic pulmonary arterial hypertension: clinical prevalence, outcomes, and mechanistic insights[J]. J Am Coll Cardiol, 2011, 58(3): 300-309. |
| [9] |
OLSSON K M, FUGE J, BROD T, et al. Oral iron supplementation with ferric maltol in patients with pulmonary hypertension[J]. Eur Respir J, 2020, 56(5): 2000616. |
| [10] |
LAKHAL-LITTLETON S, CROSBY A, FRISE M C, et al. Intracellular iron deficiency in pulmonary arterial smooth muscle cells induces pulmonary arterial hypertension in mice[J]. Proc Natl Acad Sci U S A, 2019, 116(26): 13122-13130. |
| [11] |
SILVESTRI L, PETTINATO M, FURIOSI V, et al. Managing the dual nature of iron to preserve health[J]. Int J Mol Sci, 2023, 24(4): 3995. |
| [12] |
YAN H F, ZOU T, TUO Q Z, et al. Ferroptosis: mechanisms and links with diseases[J]. Signal Transduct Target Ther, 2021, 6(1): 49. |
| [13] |
COTRONEO E, ASHEK A, WANG L, et al. Iron homeostasis and pulmonary hypertension: iron deficiency leads to pulmonary vascular remodeling in the rat[J]. Circ Res, 2015, 116(10): 1680-1690. |
| [14] |
WANG G L, LIU S H, WANG L, et al. Lipocalin-2 promotes endoplasmic reticulum stress and proliferation by augmenting intracellular iron in human pulmonary arterial smooth muscle cells[J]. Int J Biol Sci, 2017, 13(2): 135-144. |
| [15] |
WONG C M, PRESTON I R, HILL N S, et al. Iron chelation inhibits the development of pulmonary vascular remodeling[J]. Free Radic Biol Med, 2012, 53(9): 1738-1747. |
| [16] |
WANG C Y, BABITT J L. Liver iron sensing andbody iron homeostasis[J]. Blood, 2019, 133(1): 18-29. |
| [17] |
SANGKHAE V, NEMETH E. Regulation of the iron homeostatic hormone hepcidin[J]. Adv Nutr, 2017, 8(1): 126-136. |
| [18] |
WARD D M, CLOONAN S M. Mitochondrial iron in human health and disease[J]. Annu Rev Physiol, 2019, 81: 453-482. |
| [19] |
TORTI S V, TORTI F M. Iron and cancer: more ore to be mined[J]. Nat Rev Cancer, 2013, 13(5): 342-355. |
| [20] |
LV H H, SHANG P. The significance, trafficking and determination of labile iron in cytosol, mitochondria and lysosomes[J]. Metallomics, 2018, 10(7): 899-916. |
| [21] |
AJOOLABADY A, ASLKHODAPASANDHOKMABAD H, LIBBY P, et al. Ferritinophagy and ferroptosis in the manage- ment of metabolic diseases[J]. Trends Endocrinol Metab, 2021, 32(7): 444-462. |
| [22] |
SANTANA-CODINA N, MANCIAS J D. Therole of NCOA4-mediated ferritinophagy in health and disease[J]. Pharmaceuticals (Basel), 2018, 11(4): 114. |
| [23] |
FUHRMANN D C, MONDORF A, BEIFUB J, et al. Hypoxia inhibits ferritinophagy, increases mitochondrial ferritin, and protects from ferroptosis[J]. Redox Biol, 2020, 36: 101670. |
| [24] |
NI S, YUAN Y, QIAN Z, et al. Hypoxia inhibits RANKL-induced ferritinophagy and protects osteoclasts from ferro-ptosis[J]. Free Radic Biol Med, 2021, 169: 271-282. |
| [25] |
RIZZOLLO F, MORE S, VANGHELUWE P, et al. The lysosome as a master regulator of iron metabolism[J]. Trends Biochem Sci, 2021, 46(12): 960-975. |
| [26] |
MASALDAN S, CLATWORTHY S A S, GAMELL C, et al. Iron accumulation in senescent cells is coupled with impaired ferritinophagy and inhibition of ferroptosis[J]. Redox Biol, 2018, 14: 100-115. |
| [27] |
WEBER R A, YEN F S, NICHOLSON S P V, et al. Maintaining iron homeostasis is the key role of lysosomal acidity for cell proliferation[J]. Mol Cell, 2020, 77(3): 645-655.e7. |
| [28] |
ALLEN G F G, TOTH R, JAMES J, et al. Loss of iron triggers PINK1/parkin-independent mitophagy[J]. EMBO Rep, 2013, 14(12): 1127-1135. |
| [29] |
SCHIAVI A, MAGLIONI S, PALIKARAS K, et al. Iron-starvation-induced mitophagy mediates lifespan extension upon mitochondrial stress in C. elegans[J]. Curr Biol, 2015, 25(14): 1810-1822. |
| [30] |
NAGI M, TANABE K, NAKAYAMA H, et al. Iron-depletion promotes mitophagy to maintain mitochondrial integrity in pathogenic yeast Candida glabrata[J]. Autophagy, 2016, 12(8): 1259-1271. |
| [31] |
LIU R X, XU C L, ZHANG W L, et al. FUNDC1-mediated mitophagy and HIF1α activation drives pulmonary hypertension during hypoxia[J]. Cell Death Dis, 2022, 13(7): 634. |
| [32] |
LINQING L, YUHAN Q, ERFEI L, et al. Hypoxia-induced PINK1/Parkin-mediated mitophagy promotes pulmonary vascular remodeling[J]. Biochem Biophys Res Commun, 2021, 534: 568-575. |
| [33] |
YAMBIRE K F, ROSTOSKY C, WATANABE T, et al. Impaired lysosomal acidification triggers iron deficiency and inflammation in vivo[J]. Elife, 2019, 8: e51031. |
| [34] |
WANG S X, WANG Y, LIU C, et al. EPAS1 (endothelial PAS domain protein 1) orchestrates transactivation of endothelial ICAM1 (intercellular adhesion molecule 1) by small nucleolar RNA host gene 5 (SNHG5) to promote hypoxic pulmonary hypertension[J]. Hypertension, 2021, 78(4): 1080-1091. |




