作为高发病率的退行性疾病,椎间盘退变是导致腰痛的主要原因[1]。目前在临床上,可以通过药物或手术的方式减轻椎间盘退变导致的疼痛,但难以恢复椎间盘的功能,因此阐明椎间盘退变的发生机制对疾病的治疗具有重要意义。椎间盘由位于中心的髓核、上下软骨终板以及包绕髓核的纤维环构成。髓核细胞分泌的细胞外基质是维持椎间盘生理功能的重要因素[2]。当各种原因(如炎症、创伤、衰老等)导致有活力的髓核细胞减少时,髓核细胞分泌的细胞外基质减少,从而促进椎间盘退变的发生[3]。
椎间盘是人体最大的乏血管器官,在生理条件下,髓核组织长期处于缺氧环境[4-5]。在常氧条件下缺氧诱导因子-1α(HIF-1α)被蛋白酶体分解,而在缺氧条件下HIF-1α可以积聚并作为转录因子诱导一系列的蛋白表达,维持细胞在缺氧条件下的生理功能[6]。随着椎间盘退变的发展,血管会侵入内部纤维环和髓核并破坏缺氧环境,从而促进椎间盘退变的发展[7-8]。近年来,越来越多的研究表明HIF-1α在椎间盘退变中发挥着重要作用[9]。
锌指蛋白A20由DIXIT等[10]于1990年发现。A20可有效抑制NF-κB通路的活性,从而减少炎症的过度激活[11-13]。本课题组前期研究发现,A20可通过抗炎作用延缓椎间盘退变的发展[14-17]。已有研究表明在其他组织与细胞中,缺氧可以通过HIF-1α依赖途径调节A20的表达从而调控疾病的发展进程[18]。但是在关于椎间盘退变的相关研究中,尚缺乏相关的报道。本研究旨在探索椎间盘中缺氧与A20蛋白表达之间的关系以及A20蛋白对于髓核细胞在缺氧条件下的具体影响,结合椎间盘的特殊解剖结构,进一步阐明椎间盘退变发生发展的机制。
1 材料与方法 1.1 标本的获取所收集的人髓核组织来自重庆医科大学附属第一医院骨科于2022年3月1日至7月1日接受手术治疗椎间盘突出症的患者。本实验标本来自于10位捐赠者,年龄31~65岁,其中男性7例,女性3例,Pfirrmann等级为Ⅲ~Ⅵ级。用于器官培养的10只SPF级SD大鼠购自重庆医科大学动物中心,年龄(6±1)周,体质量170~220 g。上述实验皆通过重庆医科大学伦理委员会批准(2021-632)。
1.2 药物,腺病毒处理以及分组体外培养的椎间盘组织缺氧处理为将椎间盘放入缺氧细胞培养箱(1% O2)培养7 d; DMOG处理为在培养基中加入1 mol/L DMOG;体外培养的人髓核细胞缺氧处理为将细胞放入缺氧细胞培养箱24 h,以模拟椎间盘在体内的缺氧环境。根据处理因素将大鼠椎间盘(n=40)随机分为常氧组、DMOG组、缺氧组和缺氧+DMOG组。
病毒转染方法如下:根据处理因素将人的髓核细胞n=12分为缺氧+空载腺病毒组、缺氧+A20干扰腺病毒组、常氧+空载腺病毒组、常氧+A20干扰腺病毒组(A20干扰腺病毒以及阴性对照腺病毒购自汉恒生物科技有限公司)。髓核细胞培养至第3代且融合度大于80%时,按照分组将1 μL/mL的空载腺病毒或1 μL/mL的A20干扰腺病毒加入完全培养基,8 h后换液,继续培养16 h后使用荧光显微镜观察细胞估算转染效率。为避免影响JC-1和流式细胞术检测效果,在确定转染条件后使用无荧光蛋白序列的腺病毒转染髓核细胞进行后续实验,并使用蛋白免疫印迹实验(Western blot)检测基因干扰效率。
1.3 椎间盘的体外培养以及髓核细胞的体外培养椎间盘的体外器官培养参照文献[19-20]的方法并加以改进。在无菌条件下取得大鼠的椎间盘并使用含10%青-链霉素的PBS冲洗。在细胞培养箱中,在含1%青-链霉素,20 mmol/L柠檬酸钠,10%胎牛血清的DMEM/F12培养基中培养,每2天换液1次。
在取得术中切除的髓核标本后,使用PBS清洗并切割为体积约1 mm3的小块。以1∶2的体积加入胰酶在37 ℃消化30 min后,随后使用Ⅱ型胶原酶消化4 h。以200目细胞筛过滤后,1 500 r/min收集细胞。将细胞悬浮于含有20%胎牛血清和1%青-链霉素的DMEN/F12培养基中,并在细胞培养箱中培养。显微镜下观察细胞融合度达到80%后传代,使用第4代细胞进行实验。
1.4 Western blot实验分离体外培养椎间盘的髓核组织后,加入液氮研磨组织后使用裂解液处理。对数生长期的髓核细胞在处理后,加入裂解液处理。将上述组织或细胞于4 ℃,15 000 r/min离心后取上清,使用BCA检测蛋白浓度并平衡各组蛋白浓度。总蛋白于恒压120 V电泳分离后于恒流250 mA进行电转。使用10%脱脂奶粉封闭2 h后,使用TBST洗涤3次。一抗(1∶1 000)在4 ℃条件孵育12 h后,使用TBST洗涤3次,二抗(1∶3 000)在室温孵育1 h,使用TBST洗涤3次,加入ECL显影剂进行显影。使用Image J软件进行分析条带光密度值。本实验所使用一抗:A20(美国,CST)、HIF-1α(美国,CST)、P-p65(美国,CST)、Aggrecan(英国,Abcam)、Collagen Ⅱ(美国,CST)、TNF-α(美国,CST)。二抗:羊抗兔(中图,正能),兔抗鼠(中国,正能)。
1.5 组织切片染色标本用4%多聚甲醛固定,脱水处理后石蜡包埋,并制成染色用切片。切片脱蜡至水,使用HE染色,封片后于显微镜下拍照观察HE染色结果。石蜡切片脱蜡至水,苏木精复染,使用固绿和番红染料染色后封片,在显微镜下观察并拍照番红固绿染色结果。
1.6 EdU检测EdU检测试剂盒购自碧云天生物技术公司。根据分组处理完毕髓核细胞后,在检测前1 d将髓核细胞传代至6孔板中,分别在缺氧和常氧条件下培养,控制细胞浓度,使检测当天细胞融合度为50%左右。将EdU加入6孔板内并继续培养3 h。随后按照试剂盒说明书操作,使用DAPI将细胞核染色。使用荧光显微镜拍照观察,并统计阳性细胞率。
1.7 线粒体膜电位检测JC-1试剂盒购自碧云天生物技术公司。根据分组处理髓核细胞后,按照分组分别置于缺氧或常氧条件下继续培养1 d后进行检测。将JC-1工作液按照说明书配置后,加入细胞培养皿,继续培养30 min,随后加入等量的完全培养基,于荧光显微镜下观察并拍照,并使用Image J分析荧光强度。
1.8 流式细胞仪检测将髓核细胞如前述方法处理后,使用无EDTA的胰酶消化,并使用PBS洗涤3次。使用Annexin V APC和DAPI染料对细胞进行染色,使用流式细胞仪进行检测,并统计分析细胞凋亡比例。
1.9 统计学分析采用GraphPad Prism 8.0软件进行分析,计量资料数据以x±s表示。对数据进行方差齐性检验后,两组比较采用student’s t检验。P < 0.05被视为差异有统计学意义。
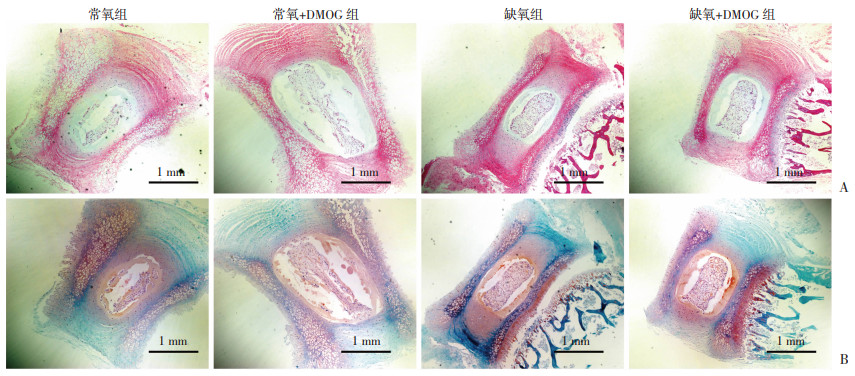
2 结果 2.1 不同氧气浓度下体外培养的大鼠椎间盘退变情况在体外培养7 d的常氧组大鼠椎间盘大体标本如图 1所示。观察发现:常氧组的大鼠椎间盘髓核体积明显减小,此现象在常氧+DMOG组中减弱,在缺氧组以及缺氧+DMOG组中未见(图 2)。Western blot检测结果显示, 与常氧组比较,缺氧组的HIF-1α和A20蛋白表达量显著上升(P < 0.05,图 3)。提示缺氧可能通过诱导A20蛋白的表达,对椎间盘退变的进程发挥重要作用。此外,Western blot结果显示,与常氧组比较,常氧+DMOG组的HIF-1α和A20的表达量也显著升高(P < 0.05,图 3),说明HIF-1α可能参与缺氧对A20蛋白的诱导和对椎间盘退变的影响。
|
| 图 1 常氧组大鼠椎间盘的大体观察 |
|
| A:大鼠椎间盘组织切片HE染色;B:大鼠椎间盘组织切片番红固绿染色 图 2 体外培养的大鼠椎间盘的形态学观察 |

|
| A:Western blot检测各组髓核组织相关蛋白表达;B、C:HIF-1α和A20蛋白相对表达量 1:常氧组;2:常氧+DMOG组;3:缺氧组;4:缺氧+DMOG组;a:P < 0.05,与常氧组比较 图 3 Western blot检测不同条件下体外器官培养的椎间盘髓核HIF-1α和A20的蛋白表达 |
2.2 干扰A20促进髓核细胞炎症
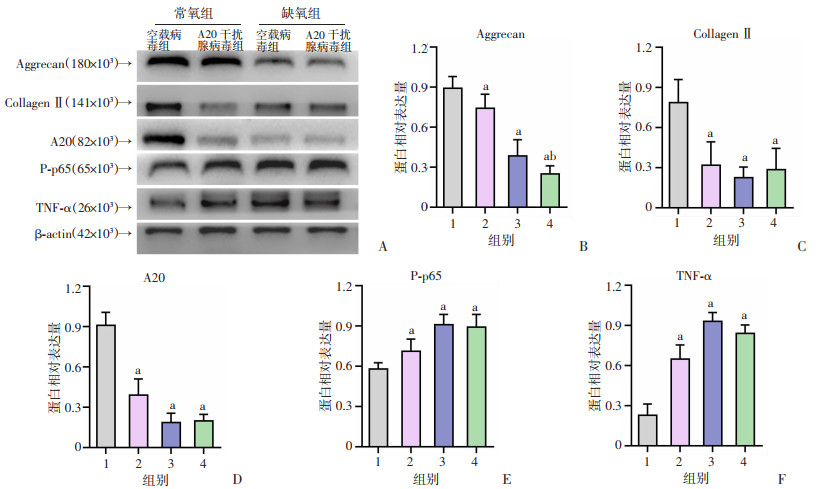
为进一步研究在缺氧条件下A20的蛋白表达对髓核细胞的作用,在体外培养人髓核细胞并且使用腺病毒转染髓核细胞,以此干扰A20蛋白的表达。Western blot检测结果显示,与缺氧+空载病毒组比较,缺氧+A20干扰腺病毒组的A20蛋白表达量降低(P < 0.05,图 4A、D);但与常氧组比较,常氧组+A20干扰腺病毒组的A20蛋白表达差异无统计学意义,可能是因为在常氧条件下,在缺少外界炎症刺激时,A20蛋白表达水平较低。与缺氧+空载病毒组比较,缺氧+A20干扰腺病毒组的Collage Ⅱ与Aggrecan的蛋白表达量下降(P < 0.05,图 4A~C),TNF-α和P-p65的蛋白量表达上升(P < 0.05,图 4A、E、F)。以上结果表明,在缺氧条件下A20蛋白可以抑制髓核细胞的炎症并促进细胞外基质的分泌。
|
| A:Western blot检测各组髓核细胞相关蛋白表达;B~F:蛋白相对表达量 1:缺氧+空载腺病毒组;2:缺氧+A20干扰腺病毒组;3:常氧+空载腺病毒组;4:常氧+A20干扰腺病毒组;a:P < 0.05,与缺氧+空载腺病毒组比较;b:P < 0.05,与缺氧+A20干扰腺病毒组比较 图 4 Western blot检测各组髓核细胞A20以及退变相关蛋白表达量 |
2.3 A20缺失可以增加缺氧条件下的细胞凋亡以及减少髓核细胞增殖
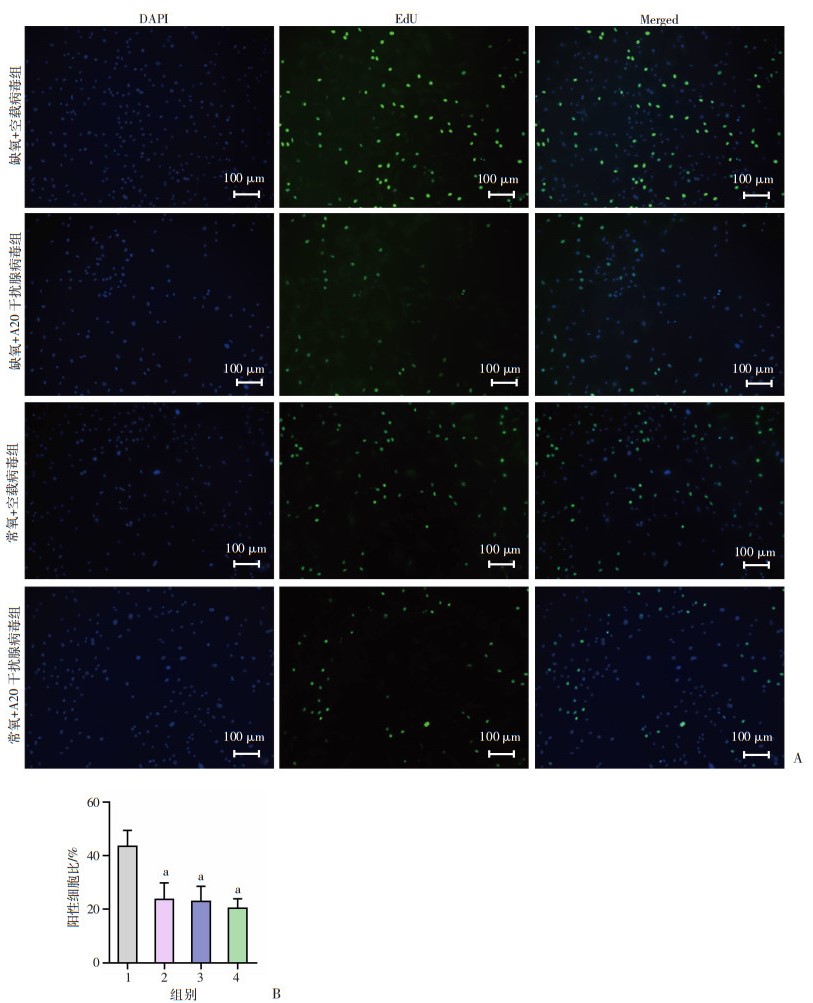
EdU检测结果显示,相较于常氧+空载病毒组,缺氧+空载病毒组的髓核细胞增殖上调(P < 0.05);与缺氧+空载病毒组比较,缺氧+A20干扰腺病毒组的髓核细胞增殖显著降低(P < 0.05,图 5)。为进一步探究A20在缺氧条件下保护髓核细胞退变的机制,使用JC-1检测不同处理组的髓核细胞线粒体膜电位情况。当膜电位较高时,JC-1聚集在线粒体的基质中生成复合物,发出红色荧光。当细胞处于凋亡早期,线粒体膜电位降低时,JC-1以单体的形式存在,发出绿色荧光。与缺氧+空载病毒组比较,缺氧+A20干扰腺病毒组的髓核细胞线粒体膜电位下降(P < 0.05,图 6), 提示该组处于凋亡早期的髓核细胞比例增加。使用流式细胞仪检测髓核细胞凋亡情况,结果表明,缺氧条件下A20的缺失可以导致髓核细胞凋亡增加(P < 0.05, 图 7)。上述结果表明,在缺氧条件下,干扰A20的表达可以导致髓核细胞增殖下调而凋亡增加,这些因素最终将导致髓核细胞数目减少,从而引起椎间盘退变。
|
| A:EdU检测不同处理组髓核细胞增殖;B:阳性细胞比例统计分析 1:缺氧+空载病毒组;2:缺氧+A20干扰腺病毒组;3:常氧+空载病毒组;4:常氧+A20干扰腺病毒组;a:P < 0.05,与缺氧+空载病毒组比较 图 5 A20缺失对不同条件下髓核细胞增殖的影响 |

|
| A: JC-1检测不同处理组髓核细胞线粒体膜电位;B:荧光强度比值统计分析 1:缺氧+空载病毒组;2:缺氧+A20干扰腺病毒组;3:常氧+空载腺病毒组;4:常氧+A20干扰腺病毒组;a:P < 0.05,与缺氧+空载病毒组比较 图 6 A20缺失对不同氧气条件下髓核细胞线粒体膜电位的影响 |

|
| A: 流式细胞仪检测不同处理组髓核细胞凋亡情况;B:髓核细胞凋亡比率 1:缺氧+空载病毒组;2:缺氧+A20干扰腺病毒组;3:常氧+空载病毒组;4:常氧+A20干扰腺病毒组;a:P < 0.05,与缺氧+空载病毒组比较 图 7 A20缺失对不同氧气条件下髓核细胞凋亡的影响 |
3 讨论
众多研究表明,缺氧可以通过HIF-1α依赖的途径调控A20的蛋白表达,从而改变疾病的进程[21-22]。但目前缺乏研究报道缺氧在椎间盘中对A20蛋白是否有调控作用。因此,本研究通过椎间盘体外器官培养等方式构建椎间盘的缺氧模型, 并检测不同氧气浓度下髓核组织A20蛋白表达水平。结果显示,在髓核组织中缺氧可以诱导A20蛋白表达升高并减轻椎间盘退变,表明A20蛋白可能在椎间盘退变的进程中起重要的作用。由于椎间盘的特殊结构,体外器官培养的方法已经被应用到椎间盘退变病理生理的研究中[19-20]。本研究将该方法应用于缺氧和椎间盘的研究中,结果显示氧气浓度可以显著地影响离体椎间盘的退变进程。DOMG作为脯氨酸羟化酶(prolyl hydroxylase, PHDs)的抑制剂,能够稳定HIF-1α的表达。CHEN等[23]曾使用DMOG处理离体椎间盘来模拟缺氧环境,本研究对比DMOG和缺氧2种模拟椎间盘缺氧环境的方法,发现二者都可以有效地诱导HIF-1α的表达。本研究结果表明,该模型对氧气浓度和椎间盘的研究有广阔的应用前景,并且在未来的椎间盘体外培养实验中,需要考虑氧气浓度对椎间盘的影响。髓核细胞可以通过分泌细胞外基质维持椎间盘的完整性,细胞外基质的进行性减少是椎间盘退变的重要特点[24]。既往研究报道了缺氧可以增加细胞外基质的合成,从而延缓椎间盘退变[25]。本研究结果表明,干扰A20的蛋白表达会减弱缺氧对细胞外基质上调作用,说明A20可能参与了对髓核细胞在缺氧环境中细胞外基质代谢平衡的调控。
过度的炎症和细胞凋亡是促进椎间盘退变的重要原因。本研究结果发现,缺氧可以通过诱导A20的表达,减少髓核细胞的凋亡和炎症。如前所述,随着椎间盘退变的进展,血管侵入内部纤维环和髓核,导致缺氧环境的破坏,从而进一步促进椎间盘退变的发展[7-8]。结合本研究结果分析,锌指蛋白A20在不同浓度氧气条件下的表达差异,可能是缺氧环境改变后,椎间盘退变进展的机制之一。
正常髓核组织内的细胞密度极低,约为3 000个/mm3,并且会随着椎间盘退变的进程进一步减少[26]。调节髓核细胞增殖是延缓椎间盘退变的重要途径,GORTH等[27]报道了缺氧可以上调髓核细胞的增殖,从而促进髓核组织的自身修复作用。本研究发现缺氧可以通过诱导A20蛋白的表达上调髓核细胞的增殖。该结果提示锌指蛋白A20有望成为调节髓核细胞增殖的有效治疗靶点。
本研究表明,在体外研究中,缺氧处理可以通过诱导A20蛋白表达抑制髓核细胞炎症和凋亡、增加髓核细胞增殖和细胞外基质的分泌。因此,A20蛋白具有作为椎间盘退变治疗靶点的潜在应用前景。
此外,本研究尚缺乏体内实验验证A20蛋白对椎间盘退变的保护作用。接下来将以本研究结果为基础,继续探索缺氧诱导A20保护椎间盘退变的机制,并将在动物层面进一步探索锌指蛋白A20对椎间盘退变发生和发展的作用。
| [1] |
GBD DALYS and HALE Collaborators. Global, regional, and national disability-adjusted life-years (DALYs) for 333 diseases and injuries and healthy life expectancy (HALE) for 195 countries and territories, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016[J]. Lancet, 2017, 390(10100): 1260-1344. |
| [2] |
CHEN F, LIU H, WANG X, et al. Melatonin activates autophagy via the NF-κB signaling pathway to prevent extracellular matrix degeneration in intervertebral disc[J]. Osteoarthritis Cartilage, 2020, 28(8): 1121-1132. |
| [3] |
WANG S J, LI J, TIAN J W, et al. High amplitude and low frequency cyclic mechanical strain promotes degeneration of human nucleus pulposus cells via the NF-κB p65 pathway[J]. J Cell Physiol, 2018, 233(9): 7206-7216. |
| [4] |
RÄTSEP T, MINAJEVA A, ASSER T. Relationship between neovascularization and degenerative changes in herniated lumbar intervertebral discs[J]. Eur Spine J, 2013, 22(11): 2474-2480. |
| [5] |
LAMA P, LE MAITRE C L, HARDING I J, et al. Nerves and blood vessels in degenerated intervertebral discs are confined to physically disrupted tissue[J]. J Anat, 2018, 233(1): 86-97. |
| [6] |
JIANG B H, ZHENG J Z, LEUNG S W, et al. Transactivation and inhibitory domains of hypoxia-inducible factor 1alpha. Modulation of transcriptional activity by oxygen tension[J]. J Biol Chem, 1997, 272(31): 19253-19260. |
| [7] |
NERLICH A G, SCHAAF R, WÄLCHLI B, et al. Temporo-spatial distribution of blood vessels in human lumbar intervertebral discs[J]. Eur Spine J, 2007, 16(4): 547-555. |
| [8] |
FENG C C, ZHANG Y, YANG M H, et al. Transcriptome and alternative splicing analysis of nucleus pulposus cells in response to high oxygen tension: involvement of high oxygen tension in the pathogenesis of intervertebral disc degeneration[J]. Int J Mol Med, 2018, 41(6): 3422-3432. |
| [9] |
SILAGI E S, SCHIPANI E, SHAPIRO I M, et al. The role of HIF proteins in maintaining the metabolic health of the intervertebral disc[J]. Nat Rev Rheumatol, 2021, 17(7): 426-439. |
| [10] |
DIXIT V M, GREEN S, SARMA V, et al. Tumor necrosis factor-alpha induction of novel gene products in human endothelial cells including a macrophage-specific chemotaxin[J]. J Biol Chem, 1990, 265(5): 2973-2978. |
| [11] |
WERTZ I E, O'ROURKE K M, ZHOU H L, et al. De-ubiquitination and ubiquitin ligase domains of A20 downregulate NF-kappaB signalling[J]. Nature, 2004, 430(7000): 694-699. |
| [12] |
SHEMBADE N, MA A, HARHAJ E W. Inhibition of NF-κB signaling by A20 through disruption of ubiquitin enzyme complexes[J]. Science, 2010, 327(5969): 1135-1139. |
| [13] |
CHEN M X, DING Z Y, ZHANG F Y, et al. A20 attenuates hypoxia-induced pulmonary arterial hypertension by inhibiting NF-κB activation and pulmonary artery smooth muscle cell proliferation[J]. Exp Cell Res, 2020, 390(2): 111982. |
| [14] |
YI W W, WEN Y F, TAN F Q, et al. Impact of NF-κB pathway on the apoptosis-inflammation-autophagy crosstalk in human degenerative nucleus pulposus cells[J]. Aging (Albany NY), 2019, 11(17): 7294-7306. |
| [15] |
蓝海洋, 杨智杰, 夏辉强, 等. 锌指蛋白A20对内毒素刺激时人椎间盘髓核细胞炎症及退变的影响[J]. 第三军医大学学报, 2019, 41(6): 543-548. LAN H Y, YANG Z J, XIA H Q, et al. Effects of zinc finger protein A20 over-expression on inflammatory response and degeneration of human intervertebral disc nucleus pulposus cells stimulated with lipopolysaccharide[J]. J Third Mil Med Univ, 2019, 41(6): 543-548. |
| [16] |
CHEN J, MA Y F, YANG Z J, et al. TNFAIP3 ameliorates the degeneration of inflammatory human nucleus pulposus cells by inhibiting mTOR signaling and promoting autophagy[J]. Aging (Albany NY), 2020, 12(23): 24242-24254. |
| [17] |
ZHANG Y, YI W W, XIA H Q, et al. A20 regulates inflammation through autophagy mediated by NF-κB pathway in human nucleus pulposus cells and ameliorates disc degeneration invivo[J]. Biochem Biophys Res Commun, 2021, 549: 179-186. |
| [18] |
YAN K, WU C Y, YE Y, et al. A20 inhibits osteoclastogenesis via TRAF6-dependent autophagy in human periodontal ligament cells under hypoxia[J]. Cell Prolif, 2020, 53(3): e12778. |
| [19] |
LI Z, GEHLEN Y, HEIZMANN F, et al. Preclinical ex-vivo testing of anti-inflammatory drugs in a bovine intervertebral degenerative disc model[J]. Front Bioeng Biotechnol, 2020, 8: 583. |
| [20] |
NOVAIS E J, TRAN V A, MIAO J Y, et al. Comparison of inbred mouse strains shows diverse phenotypic outcomes of intervertebral disc aging[J]. Aging Cell, 2020, 19(5): e13148. |
| [21] |
LIU D, ZHANG P, ZHOU J J, et al. TNFAIP3 interacting protein 3 overexpression suppresses nonalcoholic steatohepatitis by blocking TAK1 activation[J]. Cell Metab, 2020, 31(4): 726-740. |
| [22] |
LI Z L, LV L L, TANG T T, et al. HIF-1α inducing exosomal microRNA-23a expression mediates the cross-talk between tubular epithelial cells and macrophages in tubulointerstitial inflammation[J]. Kidney Int, 2019, 95(2): 388-404. |
| [23] |
CHEN S, FANG X Q, WANG Q, et al. PHD/HIF-1 upregulates CA12 to protect against degenerative disc disease: a human sample, in vitro and ex vivo study[J]. Lab Investig, 2016, 96(5): 561-569. |
| [24] |
MORRIS H, GONÇALVES C F, DUDEK M, et al. Tissue physiology revolving around the clock: circadian rhythms as exemplified by the intervertebral disc[J]. Ann Rheum Dis, 2021, 80(7): 828-839. |
| [25] |
LIU Z C, LI C W, MENG X C, et al. Hypoxia-inducible factor-lα mediates aggrecan and collagen Π expression via NOTCH1 signaling in nucleus pulposus cells during intervertebral disc degeneration[J]. Biochem Biophys Res Commun, 2017, 488(3): 554-561. |
| [26] |
FONTANA G, SEE E, PANDIT A. Current trends in biologics delivery to restore intervertebral disc anabolism[J]. Adv Drug Deliv Rev, 2015, 84: 146-158. |
| [27] |
GORTH D J, LOTHSTEIN K E, CHIARO J A, et al. Hypoxic regulation of functional extracellular matrix elaboration by nucleus pulposus cells in long-term agarose culture[J]. J Orthop Res, 2015, 33(5): 747-754. |




