胆汁淤积是一种肝胆系统疾病,由多种因素引起,包括胆汁产生、分泌和排泄障碍等。使用3, 5-二乙氧羰基-1, 4-二氢-2, 4, 6-三甲吡啶(3, 5-diethoxycarbonyl-1, 4-dihydro-2, 4, 6-collidine, DDC)喂养小鼠,是构建胆汁淤积小鼠模型的经典方法之一。DDC给药可刺激卟啉分泌,导致小胆管内形成堵塞。其病理表现具有胆管周围纤维组织增生、典型呈同心圆性洋葱皮样纤维化以及汇管区炎症等特征[1]。肝纤维化是指由各种致病因子所致肝内结缔组织异常增生的病理生理过程[2]。在肝脏修复愈合的过程中都有纤维化的发生,如果损伤因素长期存在,肝纤维化就会进展成为不可逆的病理过程——肝硬化。细胞外基质(extracellular matrix, ECM)主要来源于肝星状细胞(hepatic stellate cell, HSC)[3]。当炎症、机械刺激或其他有害因素长期存在时,会导致肝星状细胞的过度活化,最终导致肝纤维化的形成。值得注意的是,胆汁淤积与肝纤维化关系密切。胆汁淤积可导致肝纤维化,而病变胆管周围的纤维化扩展至其他胆管以及汇管区周围肝窦系统时,又可进一步加重胆汁淤积[4]。转化生长因子-β(transforming growth factor-β, TGF-β)的高表达是纤维化过程中的典型特征之一[5]。TGF-β可以通过PI3K激活Akt[6],而PI3K/Akt信号通路可以通过基因表达调控,在细胞的存活、分化、生长、运动和凋亡等多种生理和病理过程中起到重要作用[7]。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)是PI3K/Akt信号通路的下游靶点。有报道指出,mTOR抑制剂可抑制TGF-β诱导的HSC活化中纤维化相关标志蛋白的表达[8]。
青蒿琥酯(artesunate, ART)是菊科植物黄花蒿提取的倍半萜内酯青蒿素的衍生物,可用于各类疟疾治疗,尤其适用于抗氯喹和哌喹的恶性疟和凶险型脑型疟疾患者的救治,具有抗疟活性高、毒副作用小等特点[9]。除了具有抗疟活性外,青蒿琥酯还具有抗癌、抗病毒和抗炎等作用[10]。有研究发现,青蒿琥酯可通过铁死亡相关途径减轻纤维化[11]。青蒿琥酯治疗纤维化的研究仍旧较少,关于其对胆汁淤积性肝纤维化的作用和分子机制更是鲜有报道。如前所述,PI3K/Akt/mTOR信号通路与肝纤维化的发展过程密切相关,结合青蒿琥酯在某些临床环境中具有的抗纤维化特性,本研究通过体内实验,探究青蒿琥酯能否减轻DDC诱导的胆汁淤积性肝纤维化;同时进一步在细胞实验中探索青蒿琥酯减轻肝纤维化的机制,探讨青蒿琥酯是否通过调控PI3K/Akt/mTOR信号通路,从而发挥其抗纤维化的作用。
1 材料与方法 1.1 材料与试剂青蒿琥酯购自上海源叶生物科技有限公司。TGF-β1购自美国ABclonal公司。
1.2 动物实验实验方案由陆军军医大学实验动物福利伦理委员会批准(AMUWEC20226168)。本研究动物实验在医学动物研究中心的指导方针下进行。选取24只8周龄雄性C57BL/6J小鼠,体质量为20 ~ 23 g,购自陆军军医大学实验动物中心。小鼠按随机数字表法分为3组,然后造模。分为对照组(n=6)、0.1% DDC组(n=9)和0.1% DDC+ART组(n=9)。对照组以常规饲料喂养,其他组以含0.1% DDC的饲料喂养。0.1% DDC+ART组小鼠按30.0 mg/kg体质量肌肉注射青蒿琥酯生理盐水溶液,其余2组肌肉注射等量生理盐水。每天1次,连续2周。造模结束前1天禁食1晚,第2天进行小鼠取样,留取肝组织冻存于液氮罐或固定于多聚甲醛中。收集血清并保存于-80 ℃备用。血清生化检测由陆军军医大学第一附属医院检验科进行。
1.3 LX2细胞的培养及处理LX2细胞购自上海中乔新舟生物科技有限公司,培养在10% FBS-DMEM高糖培养基中。将TGF-β1溶于无菌蒸馏水,青蒿琥酯、PI3K抑制剂LY294002(美国Selleck公司)、mTOR抑制剂雷帕霉素(美国Selleck公司)溶于二甲基亚砜(dimethyl sulfoxide, DMSO)。使用TGF-β1(10 ng/mL)、青蒿琥酯(20 μg/mL)、PI3K抑制剂(500 nmol/L)或mTOR抑制剂(100 nmol/L)处理LX2细胞,对照组加入等体积的DMSO。在37 ℃,5% CO2的培养箱中进行培养。
1.4 肝组织内胆汁酸含量测定从液氮罐中取出小鼠肝脏组织,加入75%的酒精研磨。混悬液在旋转混合器中旋转1夜,然后在65 ℃的水中水浴2.5 h。离心后取上清,送陆军军医大学第一附属医院检验科检测肝组织内胆汁酸含量。
1.5 组织病理学染色肝组织切片常规脱蜡后,用HE染色试剂盒(北京索莱宝公司)和天狼星红染色试剂盒(安徽雷根生物公司)染色,用中性树胶封片。在显微镜下观察染色结果,并根据Scheuer系统进行组织病理学评分。
1.6 实时荧光定量PCR使用TRIzol试剂(美国Invitrogen公司)提取肝脏总RNA,然后使用反转录试剂盒(日本TaKaRa公司)将提取的RNA反转录为cDNA。使用探针(美国ABI公司)或引物(北京擎科生物公司)检测相关基因表达水平。结果用18 s归一化。引物序列如下:18 s,上游:5′-GGGAGCCTGAGAAACGGC-3′, 下游:5′-GGGT-CGGGAGTGGGTAATTT-3′。
1.7 肝组织内羟脯氨酸(hydroxyproline, HYP)含量测定称取约0.05 g肝脏样品,按比例加入500 μL的提取液,将组织尽量研磨碎以便消化。后续按照HYP含量检测试剂盒(北京索莱宝公司)的说明书进行,检测肝脏组织内HYP含量。
1.8 Westen blot检测使用含有磷酸酶抑制剂和蛋白酶抑制剂(美国Roche公司)的RIPA裂解液提取LX2细胞总蛋白,采用SDS-PAGE技术分离蛋白。数据采用Image J软件进行分析。孵育一抗及其浓度: p-PI3K(1 ∶1 000, 美国Cell Signaling公司)、PI3K(1 ∶1 000, 美国Cell Signaling公司)、p-AKT(1 ∶1 000, 美国Cell Signaling公司)、AKT(1 ∶1 000, 美国Cell Signaling公司)、p-mTOR(1 ∶1 000, 美国Cell Signaling公司)、mTOR (1 ∶1 000, 美国Cell Signaling公司)、GAPDH(1 ∶5 000, 美国Proteintech公司)。
1.9 免疫荧光染色胰酶消化细胞后重悬细胞于完全培养基中,在孔板每个准备放爬片的位置滴少量培养基,然后放玻片,将相应的细胞混匀后铺到孔板,等待细胞贴壁面积约80%时,即可进行免疫荧光染色。孵育一抗及其浓度: α-SMA(1 ∶400, 英国Abcam公司)。
1.10 统计学分析所有数据采用SPSS 22.0软件进行统计分析。结果以x±s表示。多组之间使用单因素方差分析进行比较。P < 0.05表示差异有统计学意义。
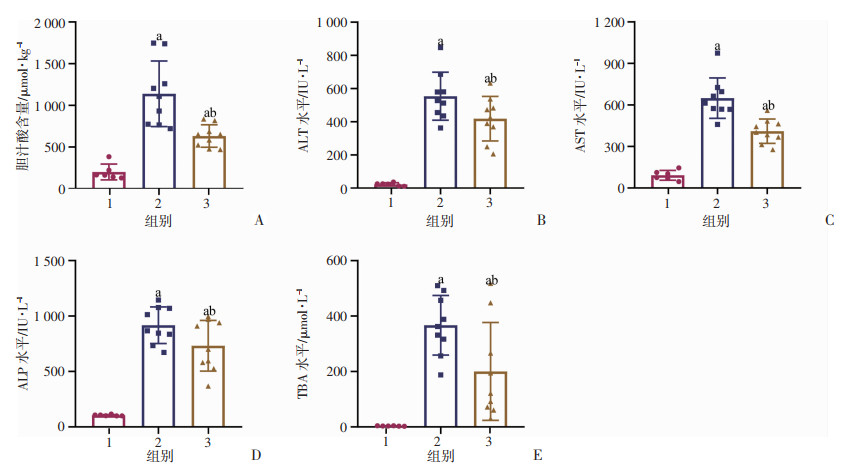
2 结果 2.1 青蒿琥酯减轻DDC诱导的胆汁淤积性肝损伤为研究青蒿琥酯对胆汁淤积性肝损伤的作用,构建0.1% DDC喂养的小鼠模型,并用青蒿琥酯进行治疗(图 1)。结果显示,与对照组比较,0.1% DDC组肝脏组织内胆汁酸含量升高,而0.1% DDC+ART组则显著降低(P < 0.05,图 2A)。血清学结果显示,青蒿琥酯明显降低0.1% DDC喂养小鼠血清中ALT、AST、ALP和TBA水平(P < 0.05,图 2B~E)。以上结果表明,青蒿琥酯处理能够减少胆汁淤积小鼠肝组织内胆汁酸含量,降低小鼠血清肝损伤相关指标水平,减轻DDC诱导的胆汁淤积性肝损伤。
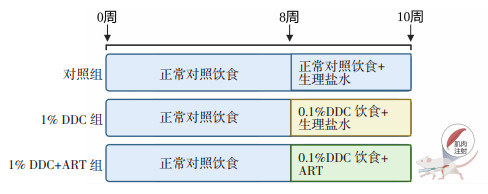
|
| 图 1 0.1% DDC小鼠模型造模方法及时间 |
|
| A:各组小鼠肝脏组织内胆汁酸含量;B~E:各组小鼠血清生化指标ALT、AST、ALP和TBA水平a:P < 0.05,与对照组比较;b:P < 0.05,与0.1% DDC组比较;1:对照组;2:0.1% DDC组;3:0.1% DDC+ART组 图 2 青蒿琥酯对0.1% DDC喂养小鼠肝脏内胆汁酸含量及肝损伤相关指标水平的影响 |
2.2 青蒿琥酯改善DDC诱导的胆汁淤积性肝纤维化
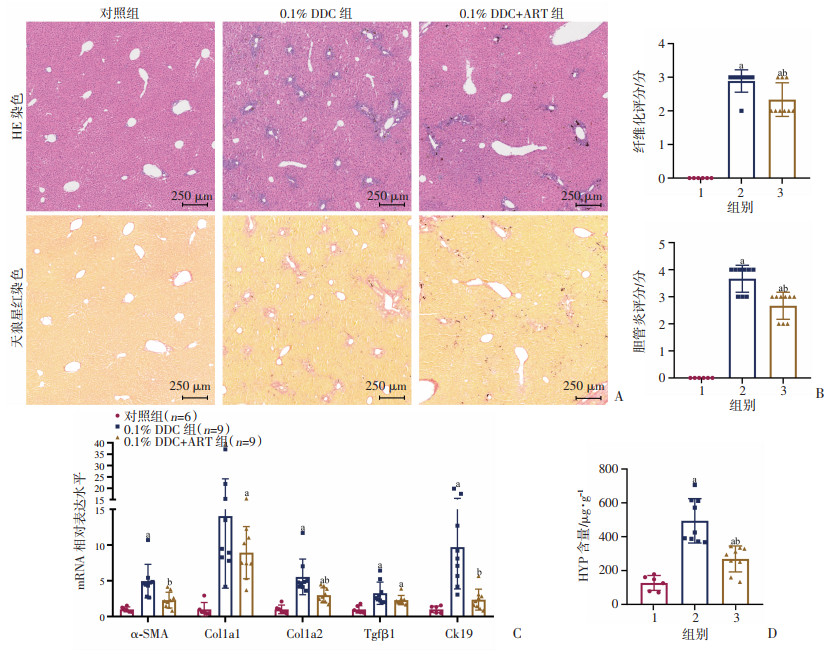
在0.1% DDC喂养的小鼠模型中通过组织病理学染色及其评分,评估青蒿琥酯处理前后小鼠肝纤维化和胆管炎的变化。HE染色和天狼星红染色结果显示,与0.1% DDC组比较,0.1% DDC+ART组的纤维化和胆管炎得到明显改善(P < 0.05,图 3A、B)。利用RT-qPCR检测青蒿琥酯对胆汁淤积状态下纤维化相关指标水平的影响。结果显示,与对照组比较,0.1% DDC组α-SMA、Col1a1、Col1a2和Tgfβ1均显著升高(P < 0.05)。而在0.1% DDC+ART组,与0.1% DDC组比较,这些纤维化关键指标则明显下降。此外,与对照组比较,0.1% DDC组胆管损伤的指标Ck19的mRNA表达水平增加(P < 0.05),而0.1% DDC+ART组Ck19的mRNA表达水平则明显下降(P < 0.05,图 3C)。肝脏组织内HYP含量测定结果显示,与0.1% DDC组比较,0.1% DDC+ART组肝脏HYP含量明显下降(P < 0.05,图 3D)。
|
| A:各组小鼠HE染色和天狼星红染色代表性图片;B:各组小鼠肝组织纤维化和胆管炎评分;C:各组小鼠α-SMA、Col1a1、Col1a2、Tgfβ1和Ck19的mRNA相对表达水平;D:各组小鼠肝脏组织内HYP含量a:P < 0.05,与对照组比较;b:P < 0.05,与0.1% DDC组比较;1:对照组;2:0.1% DDC组;3:0.1% DDC+ART组 图 3 青蒿琥酯对0.1% DDC喂养小鼠组织病理学表现及纤维化相关指标表达水平的影响 |
2.3 青蒿琥酯抑制TGF-β激活PI3K/Akt/mTOR信号通路
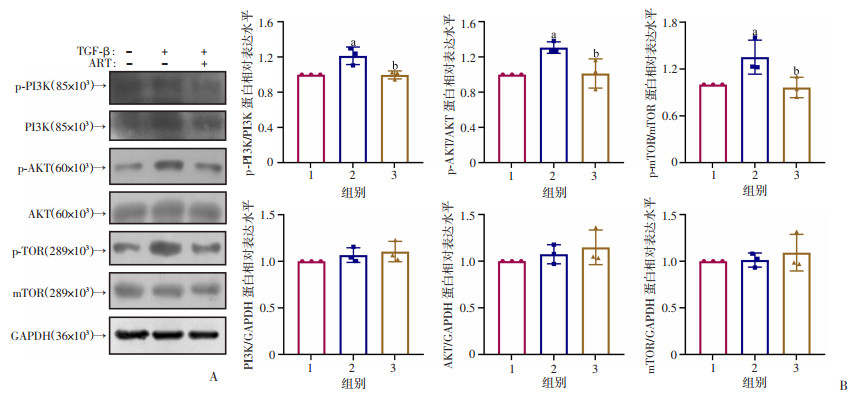
上述研究发现,经过青蒿琥酯处理后,纤维化相关指标均明显改善。尤其是肝星状细胞活化标志物α-SMA显著下降,这提示青蒿琥酯可能抑制了肝星状细胞向肌成纤维细胞样细胞的转化。为此,本研究组在细胞层面进一步探讨青蒿琥酯调控HSC生物学表型的信号机制。由于PI3K/Akt/mTOR信号通路在蛋白质合成途径发挥重要作用,且PI3K/Akt/mTOR信号通路与肝纤维化的发展过程密切相关,因此对PI3K/Akt/mTOR信号通路相关指标的表达进行检测。Western blot检测结果显示,与DMSO组比较,TGF-β组LX2细胞p-PI3K、p-AKT和p-mTOR的蛋白表达量明显增加(P < 0.05),而与TGF-β组比较,TGF-β+ART组p-PI3K、p-AKT和p-mTOR的蛋白表达水平则显著降低(P < 0.05,图 4)。
|
| A:青蒿琥酯处理后,Western blot检测各组LX2细胞p-PI3K、PI3K、p-AKT、AKT、p-mTOR和mTOR蛋白表达;B:青蒿琥酯处理后,各组LX2细胞p-PI3K、PI3K、p-AKT、AKT、p-mTOR和mTOR蛋白相对表达量a:P < 0.05,与DMSO组比较;b:P < 0.05,与TGF-β组比较;1:DMSO组;2:TGF-β组;3:TGF-β+ART组 图 4 青蒿琥酯对TGF-β激活的PI3K/Akt/mTOR信号通路的影响(n=3) |
2.4 青蒿琥酯通过抑制PI3K/Akt/mTOR信号通路抑制TGF-β诱导的肝星状细胞活化
采用青蒿琥酯、PI3K抑制剂LY294002、mTOR抑制剂雷帕霉素联合处理LX2细胞,进一步验证青蒿琥酯通过PI3K/Akt/mTOR信号通路抑制TGF-β诱导的肝星状细胞活化。结果发现,加入PI3K抑制剂、mTOR抑制剂和青蒿琥酯均能抑制TGF-β诱导的LX2细胞活化,降低纤维化关键指标α-SMA的表达(P < 0.05)。青蒿琥酯联合PI3K抑制剂和mTOR抑制剂处理后,这种抑制作用被增强(P < 0.05,图 5、6)。以上结果提示,青蒿琥酯可以通过PI3K/Akt/mTOR信号通路抑制DDC诱导的胆汁淤积小鼠体内HSC的激活,从而发挥抗纤维化作用。
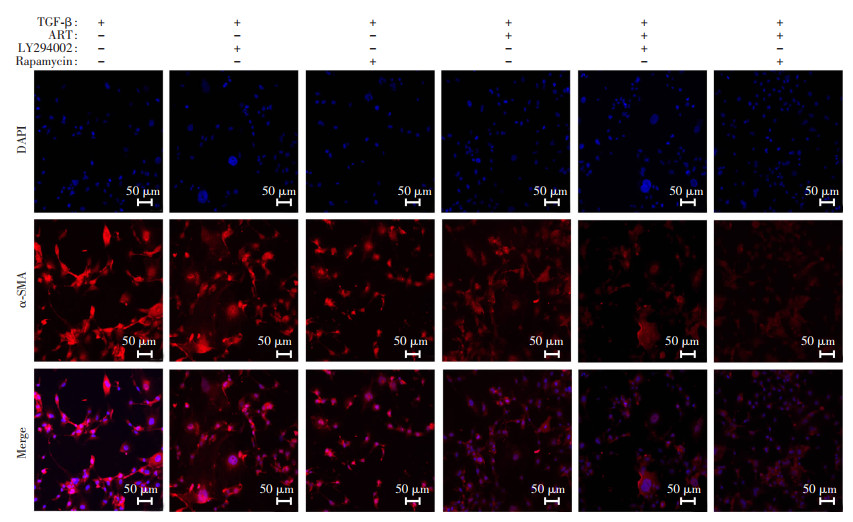
|
| 图 5 PI3K/Akt/mTOR通路抑制剂增强青蒿琥酯对TGF-β诱导的HSC活化的抑制作用 |
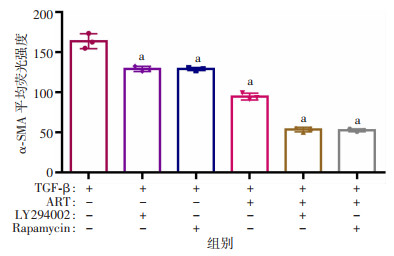
|
| a:P < 0.05,与TGF-β单独刺激组比较 图 6 PI3K/Akt/mTOR通路抑制剂增强青蒿琥酯对TGF-β诱导的HSC活化的抑制作用的免疫荧光染色统计分析(n=3) |
3 讨论 3.1 青蒿琥酯能够改善DDC诱导的胆汁淤积性肝纤维化
肝纤维化是机体对慢性肝损伤的一种修复反应,但过度的纤维化会导致肝脏结构的重塑,加剧肝功能损伤,最终发展为肝硬化。研究表明,胆汁淤积与肝纤维化的发生发展密切相关[12]。随着疾病的进展,纤维化范围扩大,影响到损伤和非损伤胆管以及汇管区周围肝窦系统,导致明显的胆汁淤积,胆汁淤积造成进行性肝细胞损伤,进一步扩大纤维化范围。肝星状细胞的持续激活被认为是肝纤维化发生发展过程中的关键环节[13],正常情况下肝星状细胞处于静止状态,当肝脏受到炎症或机械刺激等损伤时,肝星状细胞迅速激活并分化为肌成纤维细胞样细胞。活化后的肝星状细胞快速增殖,并分泌大量胶原蛋白和纤维连接蛋白,从而形成细胞外基质促进肝脏的修复,重建肝内结构。因此,抑制肝星状细胞的活化是改善肝纤维化的重要途径。本研究发现,在0.1% DDC喂养小鼠的肝脏组织内,胆汁酸含量明显增加;血清中肝损伤关键指标ALT、AST和ALP等水平显著升高;组织病理学结果显示,0.1% DDC喂养小鼠肝纤维化和胆管炎表现加重;纤维化主要指标α-SMA、Col1a1、Col1a2和Tgfβ1 mRNA相对表达水平均明显升高;胶原组织代谢及纤维化程度的重要指标HYP也显著增加,而青蒿琥酯给药可以减轻以上指标变化。
3.2 青蒿琥酯对多种疾病导致的器官纤维化有明显的治疗作用本研究所用药物青蒿琥酯是青蒿素的衍生物。青蒿素存在于中草药黄花蒿的花叶中,是一种含量非常低的萜类化合物[14]。青蒿琥酯具有多种药理作用,适用于脑型疟及各种危重疟疾的抢救[15]。除具有抗疟疾活性外,青蒿琥酯还具有抗癌、抗病毒、抗炎和改善纤维化等作用。由于青蒿琥酯具有毒副作用小、安全性能高等特点,近年来其抗纤维化的作用得到广泛关注。已证实青蒿琥酯对多种疾病导致的器官纤维化有明显治疗作用,如青蒿琥酯通过抑制Notch信号通路改善肺纤维化[16];青蒿琥酯通过调控肝星状细胞,发挥抗血吸虫病诱导的肝纤维化的作用[17];青蒿琥酯通过调节大鼠骨形成蛋白和子宫致敏相关基因的表达来减轻单侧输尿管梗阻诱导的肾纤维化[18]。本研究探讨了青蒿琥酯对DDC诱导的胆汁淤积性肝纤维化的作用,并进一步在肝星状细胞中探讨了其相关的分子机制。
3.3 青蒿琥酯通过调控PI3K/Akt/mTOR信号通路发挥其抗纤维化的作用0.1% DDC喂养的小鼠模型是一种常见的胆汁淤积性肝病造模方法,胆管周围纤维组织增生是其经典特征之一[19]。结合青蒿琥酯在某些临床环境中的抗纤维化作用,分析青蒿琥酯对胆汁淤积性肝纤维化具有治疗作用。结果表明,青蒿琥酯能够明显改善DDC诱导的胆汁淤积性肝纤维化,降低各项肝损伤和肝纤维化指标,减轻DDC饮食小鼠的肝脏组织病理形态学改变。较多的研究表明TGF-β为主要的促纤维化因子。TGF-β信号在早期胚胎发育与组织器官形成、免疫监督、组织修复与成体稳态平衡中发挥重要作用。TGF-β信号转导异常可能导致多种疾病的发生,比如胚胎发育异常、肿瘤、组织纤维化、心血管疾病和免疫性疾病等[20]。mTOR是一种保守的丝氨酸/苏氨酸蛋白激酶,可以调节细胞的多种功能包括蛋白质的翻译、营养转运和自噬等。PI3K/Akt/mTOR信号通路在肝脏细胞外基质产生和降解过程中起到重要作用[21]。此外,PI3K/Akt/mTOR信号通路还可以通过调节HSC的活化以及调节肝窦毛细血管化等作用参与肝纤维化的形成[22]。人肝星状细胞LX2细胞是取HSC细胞转染SV40大T抗原而建立的永生化细胞系,其保留了HSC信号传导和纤维化形成等关键特性[23]。LX2细胞作为模拟体外肝纤维化的经典模型,常被用于纤维化相关分子机制的探究[24-26]。本研究中,使用LX2细胞探究青蒿琥酯对胆汁淤积性肝纤维化保护作用的机制,发现LX2细胞经TGF-β处理后,p-PI3K、p-AKT和p-mTOR的蛋白表达量明显增加,PI3K/Akt/mTOR信号通路显著激活;而青蒿琥酯给药后,PI3K、p-AKT和p-mTOR的蛋白表达水平降低,PI3K/Akt/mTOR信号通路受到抑制。为进一步确认青蒿琥酯通过PI3K/Akt/mTOR信号通路抑制TGF-β诱导的肝星状细胞活化,用青蒿琥酯联合PI3K抑制剂LY294002、mTOR抑制剂雷帕霉素处理LX2细胞。结果显示,青蒿琥酯联合PI3K抑制剂和mTOR抑制剂处理细胞后,青蒿琥酯对HSC激活标志物α-SMA表达的抑制作用被增强。以上研究表明,青蒿琥酯可以通过PI3K/Akt/mTOR信号通路抑制DDC诱导的胆汁淤积小鼠体内HSC的激活,从而发挥抗纤维化的作用。
尽管青蒿琥酯对胆汁淤积性肝纤维化有明显的改善作用,但本研究也存在一定的局限性:仅构建了一种胆汁淤积小鼠模型,尚未利用其他胆汁淤积小鼠模型验证青蒿琥酯对胆汁淤积性肝纤维化的作用,且细胞层面的研究尚不深入。此外,炎症和纤维化的形成密切相关,青蒿琥酯对胆汁淤积状态下炎症的作用仍待进一步探究。
综上所述,本研究表明青蒿琥酯能够明显改善DDC诱导的胆汁淤积性肝纤维化,它可通过调控PI3K/Akt/mTOR信号通路抑制HSC的活化,从而发挥其抗纤维化的作用。为青蒿琥酯成为胆汁淤积性肝病的潜在药物提供了理论依据。
| [1] |
FICKERT P, POLLHEIMER M J, BEUERS U, et al. Characterization of animal models for primary sclerosing cholangitis (PSC)[J]. J Hepatol, 2014, 60(6): 1290-1303. |
| [2] |
WANG C, MA C, FU K, et al. Phillygenin attenuates carbon tetrachloride-induced liver fibrosis via modulating inflammation and gut microbiota[J]. Front Pharmacol, 2021, 12: 756924. |
| [3] |
秦雨萌, 陈胜华. 肝纤维化进程中细胞外基质对肝星状细胞的作用及机制研究进展[J]. 实用肝脏病杂志, 2017, 20(3): 381-384. QIN Y M, CHEN S H. Influence of extracellular matrix on hepatic stellate cells during liver fibrosis process[J]. J Pract Hepatol, 2017, 20(3): 381-384. |
| [4] |
GHONEM N S, ASSIS D N, BOYER J L. Fibrates and cholestasis[J]. Hepatology, 2015, 62(2): 635-643. |
| [5] |
FRANGOGIANNIS N. Transforming growth factor-β in tissue fibrosis[J]. J Exp Med, 2020, 217(3): e20190103. |
| [6] |
HAMIDI A, SONG J, THAKUR N, et al. TGF-β promotes PI3K-AKT signaling and prostate cancer cell migration through the TRAF6-mediated ubiquitylation of p85α[J]. Sci Signal, 2017, 10(486): eaal4186[pii]. |
| [7] |
JAFARI M, GHADAMI E, DADKHAH T, et al. PI3k/AKT signaling pathway: erythropoiesis and beyond[J]. J Cell Physiol, 2019, 234(3): 2373-2385. |
| [8] |
SHIGEMATSU T, TAJIMA S, FU R, et al. The mTOR inhibitor everolimus attenuates tacrolimus-induced renal interstitial fibrosis in rats[J]. Life Sci, 2022, 288: 120150. |
| [9] |
陈海亮, 刘毅, 邹中元, 等. 青蒿琥酯与奎宁治疗疟疾的疗效比较[J]. 江西医药, 2014, 49(1): 57-59. CHEN H L, LIU Y, ZOU Z Y, et al. Comparison between artesunate and quinine in the treatment of malaria[J]. Jiangxi Med J, 2014, 49(1): 57-59. |
| [10] |
蒋沅岐, 董玉洁, 周福军, 等. 青蒿素及其衍生物的研究进展[J]. 中草药, 2022, 53(2): 599-608. JIANG Y Q, DONG Y J, ZHOU F J, et al. Research progress on artemisinin and its derivatives[J]. Chin Tradit Herb Drugs, 2022, 53(2): 599-608. |
| [11] |
KONG Z Y, LIU R, CHENG Y. Artesunate alleviates liver fibrosis by regulating ferroptosis signaling pathway[J]. Biomed Pharmacother, 2019, 109: 2043-2053. |
| [12] |
郭辉, 肖刚, 孟昕珂, 等. 基于TGF-β1/Smads信号通路研究胆通颗粒对胆汁淤积性肝纤维化的影响[J]. 现代中西医结合杂志, 2020, 29(18): 1944-1947, 2024. GUO H, XIAO G, MENG X K, et al. Study on the effect of Dantong Granule on cholestatic liver fibrosis based on TGF-β1/Smads signal pathway[J]. Mod J Integr Tradit Chin West Med, 2020, 29(18): 1944-1947, 2024. |
| [13] |
HIGASHI T, FRIEDMAN S L, HOSHIDA Y. Hepatic stellate cells as key target in liver fibrosis[J]. Adv Drug Deliv Rev, 2017, 121: S0169-S409X(17)30063-7[pii]. |
| [14] |
YANG X L, ZHENG Y D, LIU L, et al. Progress on the study of the anticancer effects of artesunate[J]. Oncol Lett, 2021, 22(5): 750. |
| [15] |
SINCLAIR D, DONEGAN S, ISBA R, et al. Artesunate versus quinine for treating severe malaria[J]. Cochrane Database Syst Rev, 2012, 2012(6): CD005967. |
| [16] |
LIU Y J, HUANG G J, MO B W, et al. Artesunate ameliorates lung fibrosis via inhibiting the Notch signaling pathway[J]. Exp Ther Med, 2017, 14(1): 561-566. |
| [17] |
SHUANG, SHEN. Artesunate alleviates schistosomiasis-induced liver fibrosis by downregulation of mitochondrial complex Ⅰ subunit NDUFB8 and complex Ⅲ subunit UQCRC2 in hepatic stellate cells[J]. Acta Trop, 2021, 214: 105781. |
| [18] |
CAO J, WANG W, LI Y, et al. Artesunate attenuates unilateral ureteral obstruction-induced renal fibrosis by regulating the expressions of bone morphogenetic protein-7 and uterine sensitization-associated gene-1 in rats[J]. Int Urol Nephrol, 2016, 48(4): 619-629. |
| [19] |
张波, 谈仁秀, 黄芝月, 等. MMI-0100对DDC诱导的胆汁淤积性肝损伤的治疗作用研究[J]. 中国现代应用药学, 2022, 39(13): 1692-1697. ZHANG B, TAN R X, HUANG Z Y, et al. Study on therapeutic effect of MMI-0100 against DDC-induced cholestatic liver injury[J]. Chin J Mod Appl Pharm, 2022, 39(13): 1692-1697. |
| [20] |
李欣泽, 王彦君, 李杨, 等. 转化生长因子-β信号通路在疾病发生发展中作用的研究状况[J]. 中国临床药理学杂志, 2022, 38(16): 1958-1962. LI X Z, WANG Y J, LI Y, et al. Study on the role of transforming growth factor-β/Smads signaling pathway in the occurrence and development of diseases[J]. Chin J Clin Pharmacol, 2022, 38(16): 1958-1962. |
| [21] |
LEI Y, WANG Q L, SHEN L, et al. MicroRNA-101 suppresses liver fibrosis by down-regulating PI3K/Akt/mTOR signaling pathway[J]. Clin Res Hepatol Gastroenterol, 2019, 43(5): 575-584. |
| [22] |
JI D, ZHAO Q, QIN Y W, et al. Germacrone improves liver fibrosis by regulating the PI3K/AKT/mTOR signalling pathway[J]. Cell Biol Int, 2021, 45(9): 1866-1875. |
| [23] |
XU L, HUI A Y, ALBANIS E, et al. Human hepatic stellate cell lines, LX-1 and LX-2: new tools for analysis of hepatic fibrosis[J]. Gut, 2005, 54(1): 142-151. |
| [24] |
MEJIAS M, GALLEGO J, NARANJO-SUAREZ S, et al. CPEB4 increases expression of PFKFB3 to induce glycolysis and activate mouse and human hepatic stellate cells, promoting liver fibrosis[J]. Gastroenterology, 2020, 159(1): 273-288. |
| [25] |
LUO X J, LI H G, MA L Q, et al. Expression of STING is increased in liver tissues from patients with NAFLD and promotes macrophage-mediated hepatic inflammation and fibrosis in mice[J]. Gastroenterology, 2018, 155(6): 1971-1984.e4. |
| [26] |
GAUL S, LESZCZYNSKA A, ALEGRE F, et al. Hepatocyte pyroptosis and release of inflammasome particles induce stellate cell activation and liver fibrosis[J]. J Hepatol, 2021, 74(1): 156-167. |




