宫腔粘连(intrauterine adhesions, IUA)因子宫内膜损伤导致不孕不育,宫腔镜下宫腔粘连分离术(transcervical resection of adhesion, TCRA)是治疗IUA的首选与标准术式[1]。目前已有多个研究证实TCRA术后进行羊膜移植可以有效预防术后再粘连[2-5],羊膜含有人羊膜间充质干细胞(human amniotic mesenchymal stem cells, hAMSCs)、羊膜上皮细胞等成分,其中hAMSCs具有间充质干细胞(mesenchymal stem cells, MSCs)多向分化和免疫调节的共性,本课题组前期通过动物实验证实hAMSCs宫腔内移植可有效修复IUA大鼠模型受损的子宫内膜,并发现hAMSCs具有上皮化的潜能[6-8],加之目前已有多个研究分别证实不同来源的MSCs在IUA治疗中发挥重要作用[9-12],故推测hAMSCs上皮化是TCRA术后羊膜移植治疗IUA的关键。
核因子-κB(NF-κB)是一种广泛存在于真核生物体内的多功能核转录因子,对控制细胞生长、分化、凋亡等通路的基因调节发挥着重要作用[13-14],已有研究发现NF-κB信号通路能影响骨髓MSCs的成骨分化[15]。另有研究表明IUA患者和IUA动物模型中NF-κB表达升高,说明NF-κB在IUA发病机理中发挥一定作用[16-17]。本课题组前期通过动物实验证实了NF-κB信号通路在大鼠IUA模型的子宫内膜中被激活,而将hAMSCs移植至IUA大鼠宫腔后NF-κB通路被抑制[7],实验结果显示NF-κB信号通路在hAMSCs促进子宫内膜修复过程中发挥一定作用,但其作用机制尚不明确。根据前期研究结果,本研究推测NF-κB信号通路可能通过调控hAMSCs的生物学功能而在其上皮化过程中发挥作用。为进一步明确NF-κB信号通路在hAMSCs修复受损子宫内膜中的作用机制,本研究拟通过抑制、过表达和沉默NF-κB信号通路中的关键分子,进一步探索NF-κB信号通路在hAMSCs上皮化中的作用,为临床治疗IUA提供新的理论思路。
1 材料与方法 1.1 实验材料 1.1.1 羊膜来源羊膜取自2021年12月-2022年6月于重庆医科大学附属大学城医院产科足月剖宫产产妇的胎盘组织,产妇年龄在25~35岁之间,无其他基础疾病,本实验获得重庆医科大学附属大学城医院伦理委员会批准(LL-202153)。
1.1.2 实验试剂一抗(兔抗)IκBα、p-p65(美国Affinity公司),一抗(兔抗)p65、Vimentin、E-cadherin(美国CST公司),一抗(兔抗)CK-7(英国Abcam公司),Cy3标记山羊抗兔IgG(H+L)(中国碧云天公司),生长因子TGF-β1、EGF、PDGF-BB(美国Peprotech公司),胎牛血清(德国PAN ES公司),DMEM/F12(美国Gibco公司),胰蛋白酶(中国碧云天公司),β-雌二醇(中国索莱宝公司),Ⅰ型胶原酶(德国BioFroxx公司),双抗(中国白鲨公司),BAY11-7082(中国碧云天公司),4%多聚甲醛(中国白鲨公司),Triton X-100(中国索莱宝公司),5%牛血清白蛋白(中国博士公司),抗荧光淬灭剂(中国美仑公司),DAPI(中国博士德公司);反转录PCR试剂盒、TB green(日本TaKaRa公司),Ad-GFP、Ad-IκBα(中国德诺和公司),LV-GFP、LV-RELA-RNAi(中国吉凯公司)。
1.2 方法 1.2.1 hAMSCs提取、培养hAMSCs提取、培养方法沿用课题组前期hAMSCs提取、培养方法[2-4],于含10%胎牛血清的DMEM/F12培养基中培养,每2~3天换液1次,待细胞融合度达90%时传代,取第3代细胞备用。
1.2.2 体外诱导hAMSCs上皮化制备诱导培养基[18]:在含血清浓度为10%的DMEM/F12培养基中添加细胞因子(10 ng/mL TGF-β1 +10 ng/mL EGF+10 ng/mL PDGF-BB)和1 μmol/L β-雌二醇。将第3代hAMSCs消化、离心后用含10%胎牛血清的DMEM/F12培养基重悬,以60%初始细胞密度种到6 cm皿中,将hAMSCs分为对照组和诱导组,对照组使用含血清浓度为10%的DMEM/F12培养,诱导组经6~8 h细胞贴壁后换用诱导培养基,放置于37 ℃、5%CO2培养箱培养,隔天换液1次,培养5 d。
1.2.3 干扰hAMSCs中的NF-κB通路将第3代hAMSCs消化、离心后用含10%胎牛血清的DMEM/F12培养基重悬,将hAMSCs分为6组,即诱导组、抑制剂组、Ad-GFP组、Ad-IκBα组、LV-GFP组和LV-RELA-RNAi组,以60%初始细胞密度种到6 cm皿中,经6~8 h细胞贴壁后换用诱导培养基培养,并按分组加入抑制剂、腺病毒和慢病毒。抑制剂组:加入10 nmol/L BAY11-7082;Ad-GFP组:按MOI值=10加入浓度为109 TU/mL的Ad-GFP腺病毒;Ad-IκBα组:按MOI值=10加入浓度为109TU/mL的Ad-IκBα,过表达NF-κB的抑制蛋白IκBα,抑制NF-κB信号通路的激活,进一步抑制NF-κB信号转导;LV-GFP:按MOI值=40加入浓度为5×108TU/mL的LV-GFP;LV-RELA-RNAi组:按MOI值=15加入浓度为109TU/mL的LV-RELA-RNAi,沉默p65的蛋白表达,抑制NF-κB信号通路的激活,进一步抑制NF-κB信号转导。在加入病毒的同时加入Polybrene(5 μg/mL)以提高感染效率,37 ℃培养12 h后用新鲜培养基替换含有病毒的培养基,培养24 h后于倒置荧光显微镜下观察腺病毒组的荧光转染率,培养60 h后于倒置荧光显微镜下观察慢病毒组的荧光转染率。
1.2.4 免疫荧光检测将第3代hAMSCs以2.5×105个/孔的细胞数种到置有10 mm爬片的24孔板中,按1.2.2和1.2.3中所述分组和方法处理各组细胞,细胞处理5 d后,先用PBS洗3次,4%多聚甲醛固定20 min,PBS洗3次,用0.3%Triton X-100、37 ℃孵育10 min破细胞膜,PBS洗3次,5%BSA于37 ℃封闭30 min。分别加入一抗(IκBα、p65、p-p65、CK-7、E-cadherin、Vimentin),4 ℃孵育过夜,PBS洗3次,加入二抗37 ℃避光孵育1 h,PBS洗3次,加DAPI孵育5 min,PBS洗3次后,加抗荧光淬灭剂,用荧光显微镜进行拍照,观察目的蛋白的表达情况。
1.2.5 实时荧光定量PCR检测将第3代hAMSCs以60%初始细胞密度种到6 cm皿中,按1.2.2和1.2.3中所述分组和方法培养各组细胞,5 d后结束细胞培养。按照RNA提取试剂说明书提取各组细胞总RNA,按照反转录试剂盒说明书进行反转录。每管共包含20 μL的体系,在95 ℃(30 s)下进行扩增,然后在95 ℃(5 s)和60 ℃(30 s)下进行40个循环,最终在65 ℃下延伸。以Ct值确定靶基因的表达量,以GADPH为内参,检测mRNA水平,每个基因设置3个复孔。用2-△△Ct法计算各组基因相对表达量,以相应的对照组值为1,计算其他各组的相对值。引物由擎科公司合成(表 1),在NCBI基因数据库中比对无误。
| 引物名称 | 产物长度/bp | 引物序列(5′→3′) |
| GAPDH | 240 | 上游:GGAGTCCACTGGCGTCTTCA |
| 下游:GTCATGAGTCCTTCCACGATACC | ||
| IκBα | 186 | 上游:GAAGTGATCCGCCAGGTGAA |
| 下游:CTCACAGGCAAGGTGTAGGG | ||
| p65 | 70 | 上游:AGGCTATCAGTCAGCGCATC |
| 下游:TCCCCACGCTGCTCTTCTAT | ||
| CK-7 | 108 | 上游:TGTGGATGCTGCCTACATGA |
| 下游:AGCTCTGTCAACTCCGTCTC | ||
| CK-19 | 225 | 上游:TGAGCAGGTCCGAGGTTACT |
| 下游:GCCGCTGGTACTCCTGATTC | ||
| E-cadherin | 153 | 上游:TGCCTGAGAACGAGGCTAAC |
| 下游:TGCCATCGTTGTTCACTGGA | ||
| Vimentin | 162 | 上游:AAACTTAGGGGCGCTCTTGT |
| 下游:GAGGGCTCCTAGCGGTTTAG | ||
| cyclin D1 | 223 | 上游:CCTCGGTGTCCTACTTCAAATGT |
| 下游:TTCATCTTAGAGGCCACGAACAT |
1.2.6 统计学分析
实验均独立重复3次,采用SPSS 25.0软件进行分析。计量资料数据以x±s表示。首先进行正态分析及方差齐性检验,两组比较采用独立样本t检验,多组比较采用单因素方差分析。检验水准α=0.05。
2 结果 2.1 hAMSCs的形态学观察hAMSCs在体外培养,通过传代纯化hAMSCs,显微镜下观察可见第3代hAMSCs贴壁生长,形态呈长梭形(图 1)。
|
| A:hAMSCs在40倍下的细胞形态;B:hAMSCs在100倍下的细胞形态 图 1 第3代hAMSCs细胞形态观察 |
2.2 使用条件培养基诱导hAMSCs后上皮标志物表达上调,间质标志物表达下调
RT-qPCR结果显示:与对照组比较,诱导组中CK-7、CK-19和E-cadherin mRNA表达升高(P < 0.01,图 2A),Vimentin mRNA表达降低(P < 0.01,图 2B)。免疫荧光检测结果显示:与对照组比较,诱导组中CK-7和E-cadherin蛋白表达升高,Vimentin蛋白表达降低,差异有统计学意义(P < 0.05,图 2C)。RT-qPCR和免疫荧光的结果均表明诱导组诱导hAMSCs上皮化成功。
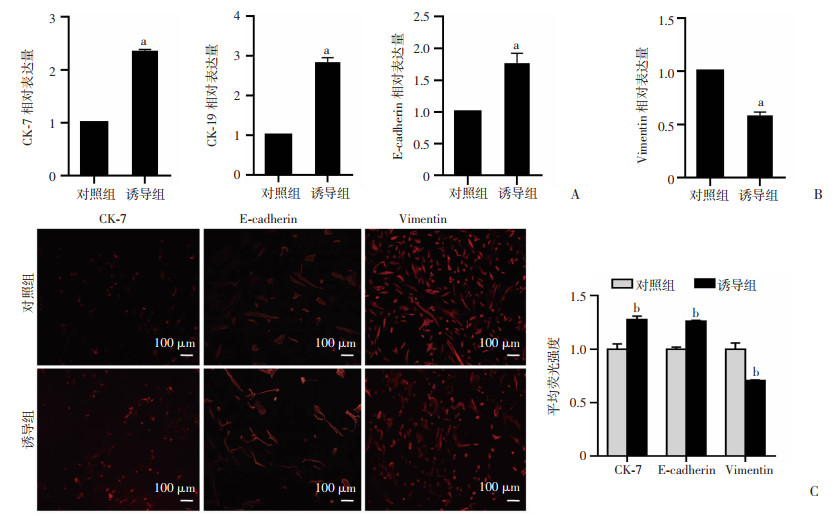
|
|
a: P < 0.01,b: P < 0.05,与对照组比较 A:RT-qPCR检测CK-7、CK-19、E-Cadherin的相对基因表达;B:RT-qPCR检测Vimentin的相对基因表达;C:免疫荧光检测CK-7、E-Cadherin、Vimentin的蛋白表达 图 2 RT-qPCR、免疫荧光检测对照组、诱导组hAMSCs上皮化情况 |
2.3 诱导hAMSCs上皮化后IκBα、p65、cyclin D1表达下调
RT-qPCR结果显示:与对照组比较,诱导组中IκBα、p65、cyclin D1 mRNA表达降低(P < 0.001,图 3A)。免疫荧光检测结果显示:与对照组比较,诱导组中IκBα、p65、p-p65蛋白表达降低,差异有统计学意义(P < 0.05,图 3B)。RT-qPCR和免疫荧光的结果表明诱导上皮化的hAMSCs中,NF-κB信号通路的表达受到抑制。
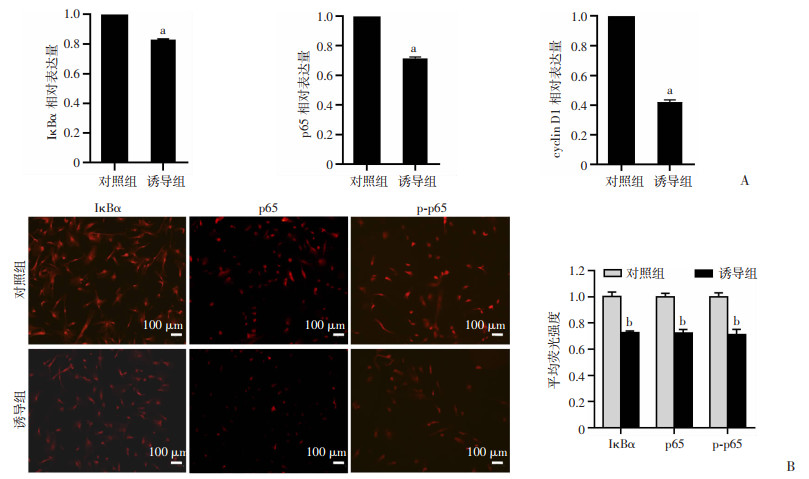
|
|
a: P < 0.001,b: P < 0.05,与对照组比较 A:RT-qPCR检测IκBα、p65、cyclin D1的相对基因表达;B:免疫荧光检测IκBα、p65、p-p65的蛋白表达 图 3 RT-qPCR、免疫荧光检测对照组和诱导组NF-κB信号通路表达情况 |
2.4 腺病毒、慢病毒转染hAMSCs
观察荧光显示:hAMSCs腺病毒组在转染后24 h、慢病毒组在转染后60 h的转染率均达80%以上(图 4A、B)。RT-qPCR结果显示:与Ad-GFP组比较,Ad-IκBα组IκBα mRNA表达显著增加(P < 0.001,图 4C),与LV-GFP组比较,LV-RELA-RNAi组p65 mRNA表达显著降低(P < 0.001,图 4D)。RT-qPCR结果表明Ad-IκBα腺病毒成功过表达IκBα,LV-RELA-RNAi慢病毒成功沉默p65。
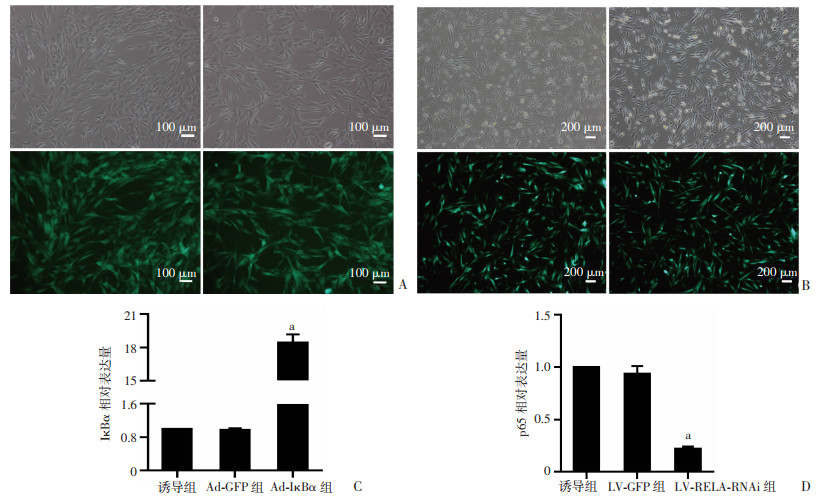
|
| A:腺病毒Ad-GFP和Ad-IκBα分别转染24 h hAMSCs荧光图;B:慢病毒LV-GFP和LV-RELA-RNAi转染60 h hAMSCs荧光图;C:RT-qPCR检测Ad-IκBα腺病毒转染效果 a: P < 0.001,与诱导组和Ad-GFP组比较;D:RT-qPCR检测LV-RELA-RNAi慢病毒转染效果; a: P < 0.001,与诱导组和LV-GFP组比较 图 4 腺病毒、慢病毒对hAMSCs的转染效率 |
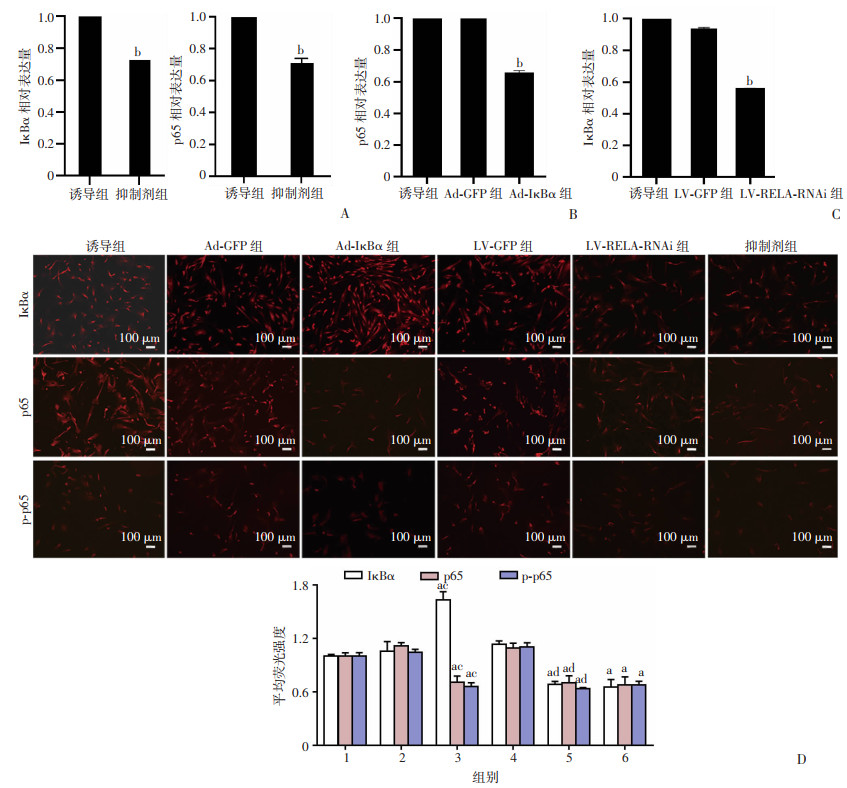
2.5 抑制剂BAY11-7082、Ad-IκBα腺病毒LV-RELA-RNAi慢病毒对hAMSCs中的NF-κB信号通路有抑制作用
RT-qPCR结果显,抑制剂组IκBα、p65 mRNA表达均较诱导组降低(P < 0.001,图 5A),Ad-IκBα组p65 mRNA表达较诱导组降低(P < 0.001,图 5B),LV-RELA-RNAi组IκBα mRNA表达较诱导组降低(P < 0.001,图 5C),表明抑制剂、Ad-IκBα腺病毒和LV-RELA-RNAi慢病毒均对hAMSCs中的NF-κB信号通路有抑制作用;免疫荧光检测结果显示:与Ad-GFP组比较,Ad-IκBα组IκBα蛋白表达增加(P < 0.05),证实了Ad-IκBα腺病毒成功过表达IκBα;与LV-GFP组比较,LV-RELA-RNAi组p65蛋白表达降低(P < 0.05),证实了LV-RELA-RNAi慢病毒成功沉默p65;与诱导组比较,抑制剂组中IκBα、p65、p-p65蛋白表达降低(P < 0.05);与诱导组比较,Ad-IκBα组中p65、p-p65蛋白表达降低(P < 0.05);与诱导组比较,LV-RELA-RNAi组中IκBα、p-p65的蛋白表达降低(P < 0.05)。见图 5D。
|
|
a: P < 0.05, b: P < 0.001,与诱导组比较;c: P < 0.05,与Ad-GFP组比较;d: P < 0.05, 与LV-GFP组比较 A:RT-qPCR检测抑制剂对通路的干预作用;B:RT-qPCR检测Ad-IκBα对通路的干预作用;C:RT-qPCR检测LV-RELA-RNAi对通路的干预作用;D:免疫荧光检测3种方式对通路的干预作用 1: 诱导组;2: Ad-GFP组;3: Ad-IκBα组;4: LV-GFP组;5: LV-RELA-RNAi组;6: 抑制剂组 图 5 RT-qPCR检测干预手段处理通路的效果 |
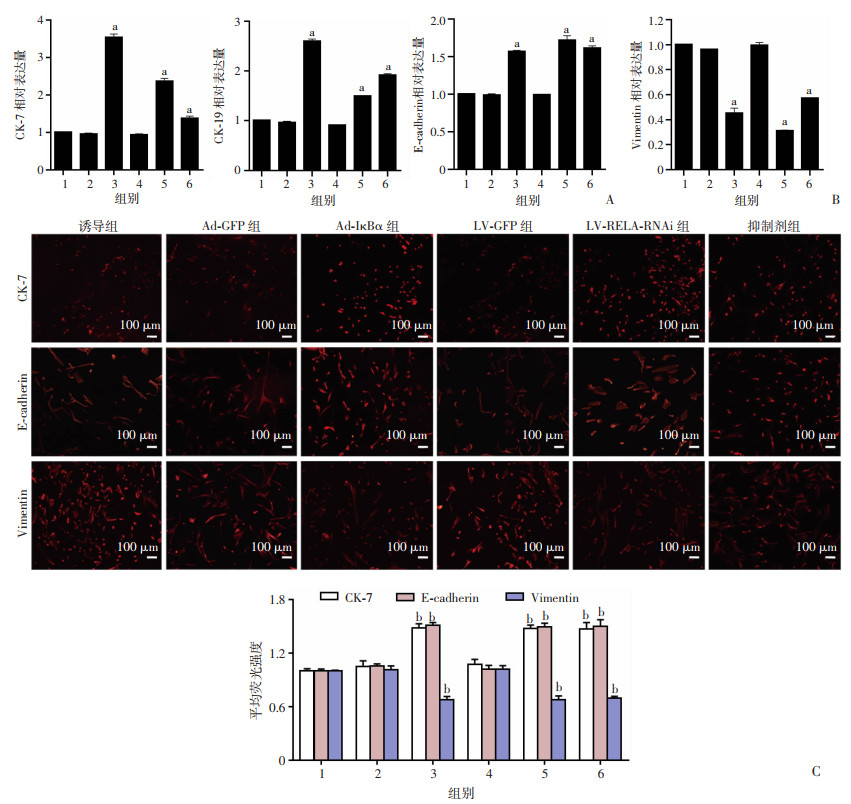
2.6 抑制NF-κB信号通路促进hAMSCs上皮化
RT-qPCR结果显示:与诱导组比较,抑制剂组、Ad-IκBα组、LV-RELA-RNAi组hAMSCs中CK-7、CK-19和E-cadherin mRNA表达上调(P < 0.01),Vimentin mRNA表达下调(P < 0.01,图 6B)。免疫荧光法检测结果显示:与诱导组比较,抑制剂组、Ad-IκBα组、LV-RELA-RNAi组hAMSCs中CK-7和E-cadherin蛋白表达上调(P < 0.05),Vimentin蛋白表达下调(P < 0.05,图 6C)。RT-qPCR和免疫荧光的结果均表明抑制NF-κB通路能促进hAMSCs上皮化。
|
| 1: 诱导组;2: Ad-GFP组;3: Ad-IκBα组;4: LV-GFP组;5: LV-RELA-RNAi组;6: 抑制剂组;a: P < 0.01,b: P < 0.05,与诱导组比较A:RT-qPCR检测CK-7、CK-19、E-cadherin的相对基因表达;B:RT-qPCR检测Vimentin的相对基因表达;C:免疫荧光检测CK-7、E-cadherin、Vimentin的蛋白表达 图 6 RT-qPCR、免疫荧光检测干预通路后hAMSCs上皮化趋势改变情况 |
3 讨论
IUA是由于子宫内膜基底层受损导致宫腔或宫颈纤维化,严重危害女性生殖健康,而重度宫腔粘连TCRA术后再粘连的复发率可达20%~62.5%[19-22]。本研究前期发现IUA患者术后行新鲜羊膜移植可有效预防术后再粘连[2-4],羊膜来源于胎盘并由滋养细胞分化而成,具有抗炎、抗纤维化、免疫原性低、非致瘤性等生物学特性。其主要成分是hAMSCs、羊膜上皮细胞等。研究表明hAMSCs具有自我更新和多向分化潜能,比骨髓来源的MSCs具有更强的扩增能力[5],因此hAMSCs被认为是再生医学领域最有前途的干细胞之一[15, 23]。目前已有研究[15, 24-27]将hAMSCs应用于卵巢早衰、多发性硬化症、急性创伤性脊髓损伤、骨关节炎及皮肤创面修复的治疗。本团队前期通过动物实验证实了向IUA大鼠宫腔内移植hAMSCs可有效治疗大鼠IUA[6-8],揭示了hAMSCs修复子宫内膜可能是通过上皮化实现的,但其作用机制尚未阐明[28]。
NF-κB是一种广泛存在于真核生物体内的多功能核转录因子,在细胞的炎症反应、免疫应答等过程中发挥重要作用,控制细胞生长、分化及凋亡等[13-14]。在未受刺激的细胞中,NF-κB的抑制蛋白IκBα与NF-κB的p65亚基结合并覆盖NF-κB的核定位信号,使NF-κB以p50/p65-IκBα三聚体的形式存在于细胞质中。在受到适当刺激后,IKK三聚体被激活后磷酸化IκBα,触发IκBα的泛素化和蛋白酶体降解,NF-κB二聚体入核并调控NF-κB靶基因的激活[13]。研究发现IUA患者和动物模型中NF-κB信号通路的表达均升高[16-17],本研究前期证实了大鼠IUA的子宫内膜中NF-κB信号通路表达上调,发现向IUA的大鼠宫腔内移植hAMSCs后NF-κB的表达下降[7],表明NF-κB信号通路在IUA的形成过程中发挥一定作用。多项研究表明,抑制NF-κB信号通路可以增强MSCs成骨和成软骨分化能力[15, 29],表明NF-κB信号通路能调控MSCs的分化。由此我们推测NF-κB信号通路能调控hAMSCs的生物学功能,在hAMSCs上皮化促进子宫内膜修复的过程中起重要作用。因此,本研究旨在探讨下调NF-κB信号通路后对hAMSCs上皮化的影响。
3.1 hAMSCs上皮化过程中NF-κB信号通路受到抑制本研究利用诱导培养基(TGF-β1、EGF、PDGF-BB、雌二醇)诱导hAMSCs上皮化,并检测对照组和诱导组中上皮标记物和间充质标记物mRNA和蛋白的表达情况。角蛋白是一类主要在上皮细胞表达的骨架蛋白,在维持上皮细胞的完整性上具有重要作用[30],有研究表明CK-19存在于子宫内膜组织中[31],尤其是在腺上皮细胞的细胞膜和细胞质中,且有多个研究[6, 32-33]使用CK-7或CK-19来观察IUA动物模型受损子宫内膜上皮修复的情况。E-cadherin是一种钙粘蛋白(cadherin),主要存在于上皮细胞中,在维持细胞上皮表型中起重要作用[34]。Vimentin是一种主要在间质细胞中表达的结构蛋白[35]。因此,本研究选择上皮标记物CK-7、CK-19、E-cadherin和间质标志物Vimentin作为观察hAMSCs上皮化的指标。结果显示诱导组中上皮CK-7、CK-19、E-cadherin的mRNA和蛋白表达水平均较对照组上调,而Vimentin的mRNA和蛋白表达水平均较对照组下调,验证了使用诱导培养基可以成功诱导hAMSCs上皮化。
Cyclin D1是NF-κB的靶基因,在细胞周期早期表达,参与DNA的合成,NF-κB可直接或间接激活cyclin D1的转录来促进G/S期进程,且其在细胞周期中与NF-κB联系最密切[36]。被激活的的NF-κB入核直接与cyclin D1启动子中的特定序列结合,上调cyclin D1的表达[37]。通过检测对照组和诱导组中cyclin D1的表达,结果显示诱导组较对照组中cyclin D1 mRNA表达水平下调。且发现NF-κB信号通路的关键因子p65和p-p65的表达下调,因此推测诱导上皮化的过程中通过下调p65的表达进而抑制NF-κB信号通路。值得注意的是IκBα的表达也有所下调,推测可能原因有:①NF-κB激活并入核后,可诱导IκBα重新合成,促进NF-κB的出核,形成一个负反馈调节机制,防止NF-κB信号通路过度激活。但由于在诱导上皮化的过程中NF-κB信号通路受到抑制,该负反馈机制受抑制,IκBα重新合成减少;②由于p65受到抑制,所以p50/p65-IκBα三聚体的形成减少,IκBα从三聚体中解离并发生磷酸化降解,导致IκBα表达下调。
3.2 下调NF-κB信号通路可促进hAMSCs上皮化本实验通过使用抑制剂BAY11-7082抑制NF-κB、腺病毒过表达IκBα和慢病毒沉默p65 3种方式干预NF-κB信号通路,进一步探索NF-κB信号通路在hAMSCs上皮化过程中的作用。研究结果显示,BAY11-7082、Ad-IκBα腺病毒、LV-RELA-RNAi慢病毒均能对NF-κB信号通路起抑制作用。BAY11-7082是一种较为常用的NF-κB抑制剂,能通过抑制IKKβ的降解而阻断IκBα的磷酸化,使IκBα持续与NF-κB结合,防止NF-κB进行核转位[38-39]。研究结果显示,抑制剂组、Ad-IκBα组、LV-RELA-RNAi组上皮标志物较诱导组显著上调,间充质标志物显著下调,表明抑制NF-κB信号通路可进一步促进hAMSCs上皮化。
综上所述,本研究主要通过抑制NF-κB信号通路探索其在hAMSCs上皮化过程中的作用,结果提示抑制NF-κB信号通路可促进hAMSCs上皮化,为提高hAMSCs治疗IUA的疗效提供了新思路。但本研究缺乏体内研究证据,拟进一步通过动物实验探究NF-κB信号通路在IUA模型中内膜修复的具体机制。
| [1] |
KHAN Z, GOLDBERG J M. Hysteroscopic management of Asherman's syndrome[J]. J Minim Invasive Gynecol, 2018, 25(2): 218-228. |
| [2] |
LI C J, CAI A Q, SUN C C, et al. The study on the safety and efficacy of amnion graft for preventing the recurrence of moderate to severe intrauterine adhesions[J]. Genes Dis, 2020, 7(2): 266-271. |
| [3] |
吴本媛, 王佳. 重度宫腔粘连电切术后羊膜移植羊膜放置方式临床研究[J]. 现代医药卫生, 2018, 34(20): 3128-3131. WU B Y, WANG J. Clinical study on the placement of amniotic membrane transplantation after severe uterine adhesion electrotomy[J]. J Mod Med Health, 2018, 34(20): 3128-3131. |
| [4] |
蔡艾杞, 吴本媛, 王佳. 新鲜羊膜移植对中、重度宫腔粘连月经模式的影响[J]. 重庆医科大学学报, 2017, 42(4): 424-428. CAI A Q, WU B Y, WANG J. Effect of fresh amniotic membrane transplantation on menstrual pattern of moderate and severe intrauterine adhesions[J]. J Chongqing Med Univ, 2017, 42(4): 424-428. |
| [5] |
张冉, 段华. 羊膜移植在预防宫腔粘连中的应用[J]. 中华妇产科杂志, 2012, 47(6): 470-472. ZHANG R, DUAN H. Application of amniotic membrane transplantation in preventing intrauterine adhesions[J]. Chin J Obstet Gynecol, 2012, 47(6): 470-472. |
| [6] |
HUANG J Y, ZHANG W W, YU J, et al. Human amniotic mesenchymal stem cells combined with PPCNg facilitate injured endometrial regeneration[J]. Stem Cell Res Ther, 2022, 13(1): 17. |
| [7] |
勾亚婷, 张文文, 李长江, 等. NF-κB信号通路在人羊膜间充质干细胞治疗宫腔粘连中的作用[J]. 第三军医大学学报, 2020, 42(11): 1101-1108. GOU Y T, ZHANG W W, LI C J, et al. Role of NF-κB signaling pathway in treatment of intrauterine adhesions by human amniotic mesenchymal stem cells[J]. J Third Mil Med Univ, 2020, 42(11): 1101-1108. |
| [8] |
陈芯培, 张文文, 毛艳华, 等. PPCNg介导人羊膜间充质干细胞治疗大鼠宫腔粘连的研究[J]. 重庆医科大学学报, 2019, 44(8): 1016-1023. CHEN X P, ZHANG W W, MAO Y H, et al. A study of PPCNg-mediated effect of human amniotic mesenchymal stem cells in the treatment of intrauterine adhesion in rats[J]. J Chongqing Med Univ, 2019, 44(8): 1016-1023. |
| [9] |
SINGH N, MOHANTY S, SETH T, et al. Autologous stem cell transplantation in refractory Asherman's syndrome: a novel cell based therapy[J]. J Hum Reprod Sci, 2014, 7(2): 93-98. |
| [10] |
KILIC S, YUKSEL B, PINARLI F, et al. Effect of stem cell application on Asherman syndrome, an experimental rat model[J]. J Assist Reprod Genet, 2014, 31(8): 975-982. |
| [11] |
TAN J C, LI P P, WANG Q S, et al. Autologous menstrual blood-derived stromal cells transplantation for severe Asherman's syndrome[J]. Hum Reprod, 2016, 31(12): 2723-2729. |
| [12] |
CAO Y, SUN H X, ZHU H, et al. Allogeneic cell therapy using umbilical cord MSCs on collagen scaffolds for patients with recurrent uterine adhesion: a phase Ⅰ clinical trial[J]. Stem Cell Res Ther, 2018, 9(1): 192. |
| [13] |
WILLIAMS L M, GILMORE T D. Looking Down on NF-kappa B[J]. Mol Cell Biol, 2020, 40(15). |
| [14] |
SUN S C, LEY S C. New insights into NF-kappaB regulation andfunction[J]. Trends Immunol, 2008, 29(10): 469-478. |
| [15] |
LI J Y, REN K K, ZHANG W J, et al. Human amniotic mesenchymal stem cells and their paracrine factors promote wound healing by inhibiting heat stress-induced skin cell apoptosis and enhancing their proliferation through activating PI3K/AKT signaling pathway[J]. Stem Cell Res Ther, 2019, 10(1): 247. |
| [16] |
WANG X Z, MA N N, SUN Q N, et al. Elevated NF-κB signaling in Asherman syndrome patients and animal models[J]. Oncotarget, 2017, 8(9): 15399-15406. |
| [17] |
马娜娜, 王祥珍. 核转录因子κb在宫腔粘连大鼠模型中的表达[J]. 中国计划生育和妇产科, 2014, 6(2): 61-64, 68. MA N N, WANG X Z. The expression of nuclear transcription factorκb in rat model of intrauterine adhesions[J]. Chin J Fam Plan Gynecotokology, 2014, 6(2): 61-64, 68. |
| [18] |
ZHANG W B, CHENG M J, HUANG Y T, et al. A study in vitro on differentiation of bone marrow mesenchymal stem cells into endometrial epithelial cells in mice[J]. Eur J Obstet Gynecol Reprod Biol, 2012, 160(2): 185-190. |
| [19] |
YU D, WONG Y M, CHEONG Y, et al. Asherman syndrome—one century later[J]. Fertil Steril, 2008, 89(4): 759-779. |
| [20] |
CAPMAS P, MIHALACHE A, DUMINIL L, et al. Intrauterine adhesions: what is the pregnancy rate after hysteroscopic management?[J]. J Gynecol Obstet Hum Reprod, 2020, 49(7): 101797. |
| [21] |
ZHOU Q Y, SHI X Y, SARAVELOS S, et al. Auto-cross-linked hyaluronic acid gel for prevention of intrauterine adhesions after hysteroscopic adhesiolysis: a randomized controlled trial[J]. J Minim Invasive Gynecol, 2021, 28(2): 307-313. |
| [22] |
HUANG X W, LIN M M, ZHAO H Q, et al. A prospective randomized controlled trial comparing two different treatments of intrauterine adhesions[J]. Reprod Biomed Online, 2020, 40(6): 835-841. |
| [23] |
IN'T ANKER P S, SCHERJON S A, KLEIJBURG-VAN DER KEUR C, et al. Isolation of mesenchymal stem cells of fetal or maternal origin from human placenta[J]. Stem Cells, 2004, 22(7): 1338-1345. |
| [24] |
LING L, FENG X S, WEI T Q, et al. Human amnion-derived mesenchymal stem cell (hAD-MSC) transplantation improves ovarian function in rats with premature ovarian insufficiency (POI) at least partly through a paracrine mechanism[J]. Stem Cell Res Ther, 2019, 10(1): 46. |
| [25] |
ABBASI-KANGEVARI M, GHAMARI S H, SAFAEINEJAD F, et al. Potential therapeutic features of human amniotic mesenchymal stem cells in multiple sclerosis: immunomodulation, inflammation suppression, angiogenesis promotion, oxidative stress inhibition, neurogenesis induction, MMPs regulation, and remyelination stimulation[J]. Front Immunol, 2019, 10: 238. |
| [26] |
ZHOU H L, FANG H, LUO H T, et al. Intravenous administration of human amniotic mesenchymal stem cells improves outcomes in rats with acute traumatic spinal cord injury[J]. Neuroreport, 2020, 31(10): 730-736. |
| [27] |
TOPOLUK N, STECKBECK K, SIATKOWSKI S, et al. Amniotic mesenchymal stem cells mitigate osteoarthritis progression in a synovial macrophage-mediated in vitro explant coculture model[J]. J Tissue Eng Regen Med, 2018, 12(4): 1097-1110. |
| [28] |
YU J, ZHANG W W, HUANG J Y, et al. Management of intrauterine adhesions using human amniotic mesenchymal stromal cells to promote endometrial regeneration and repair through Notch signalling[J]. J Cell Mol Med, 2021, 25(23): 11002-11015. |
| [29] |
YU S X, LI P, LI B J, et al. RelA promotes proliferation but inhibits osteogenic and chondrogenic differentiation of mesenchymal stem cells[J]. FEBS Lett, 2020, 594(9): 1368-1378. |
| [30] |
KUBURICH N A, DEN HOLLANDER P, PIETZ J T, et al. Vimentin and cytokeratin: good alone, bad together[J]. Semin Cancer Biol, 2022, 86(Pt 3): 816-826. |
| [31] |
CHEN D Y, QIAO H, WANG Y T, et al. Adenomyosis-derived extracellular vesicles endow endometrial epithelial cells with an invasive phenotype through epithelial-mesenchymal transition[J]. Genes Dis, 2020, 7(4): 636-648. |
| [32] |
YAO Y, CHEN R, WANG G W, et al. Exosomes derived from mesenchymal stem cells reverse EMT via TGF-β1/Smad pathway and promote repair of damaged endometrium[J]. Stem Cell Res Ther, 2019, 10(1): 1-17. |
| [33] |
ZHENG J H, ZHANG J K, KONG D S, et al. Quantification of the CM-Dil-labeled human umbilical cord mesenchymal stem cells migrated to the dual injured uterus in SD rat[J]. Stem Cell Res Ther, 2020, 11(1): 280. |
| [34] |
MENDONSA A M, NA T Y, GUMBINER B M. E-cadherin in contact inhibition and cancer[J]. Oncogene, 2018, 37(35): 4769-4780. |
| [35] |
RAMOS I, STAMATAKIS K, OESTE C L, et al. Vimentin as a multifaceted player and potential therapeutic target in viral infections[J]. Int J Mol Sci, 2020, 21(13): 4675. |
| [36] |
JOYCE D, ALBANESE C, STEER J, et al. NF-kappaB and cell-cycle regulation: the cyclin connection[J]. Cytokine Growth Factor Rev, 2001, 12(1): 73-90. |
| [37] |
GU P, ZHANG M H, ZHU J, et al. Suppression of CDCA3 inhibits prostate cancer progression via NF-κB/cyclin D1 signaling inactivation and p21 accumulation[J]. Oncol Rep, 2022, 47(2): 42. |
| [38] |
YAN Y, QIAN H Y, CAO Y, et al. Nuclear factor-κB inhibitor Bay11-7082 inhibits gastric cancer cell proliferation by inhibiting Gli1 expression[J]. Oncol Lett, 2021, 21(4): 301. |
| [39] |
LANG Y, CHU F N, LIU L L, et al. Potential role of BAY11-7082, a NF-κB blocker inhibiting experimental autoimmune encephalomyelitis in C57BL/6J mice via declining NLRP3 inflammasomes[J]. Clin Exp Immunol, 2022, 207(3): 378-386. |




