铝是一种广泛存在于自然界的具有神经毒性的金属,其暴露途径和方式多样,如食品、饮用水、药品、疫苗等[1-2]。氢氧化铝[Al(OH)3]是一种常用的疫苗佐剂,是新生期铝暴露的主要途径之一[3-4]。研究指出,进入人体内的铝具有生物持久性并且可以透过血脑屏障沉积在脑内[5]。在人群流行病学调查发现, 职业铝暴露可以损害人体的定向力、反应时间、记忆力、注意力等认知功能[6-7]。在动物铝暴露模型中均发现摄入过量铝会造成海马结构损伤[8],进而使小鼠学习记忆功能受损导致认知功能障碍[9-10]。研究表明铝和多种神经系统疾病有关,包括帕金森病、阿尔茨海默病、透析性脑病和自闭症,但其确切的致病机制仍待探究[11]。
近年来,有文献指出自闭症患病率上升与疫苗接种率提升有关[12],新生儿接种疫苗含铝佐剂的安全剂量应当被重新评估[13]。新生期是神经系统生长发育的重要阶段,在该阶段遭受铝暴露,是否会对人体的正常生长产生影响,特别是对认知功能产生影响是重要的课题。据此,本研究采用新生C57BL/6雄性小鼠建立新生期Al(OH)3暴露模型,通过一系列行为学实验检测成年后小鼠的运功功能、焦虑样行为、社交行为、重复刻板样行为、短期记忆和空间学习记忆等,利用形态学方法检测P14小鼠海马结构变化,以明确新生期Al(OH)3暴露是否会对海马发育产生不利影响,进而损害小鼠成年后的社交行为和认知功能,为重新评估当前儿童Al(OH)3临床剂量提供了动物实验依据。
1 材料与方法 1.1 材料商品级Al(OH)3材料由中科院高能物理研究所制备提供。本实验使用的荧光一抗如下:Sox2抗体、NeuN抗体和S100β抗体(英国Abcam公司);GFAP抗体(美国Dako公司);PCNA抗体和Iba1抗体(美国Millipore公司);所有荧光二抗和Trition-X-100购自美国Invitrogen公司。
1.2 实验动物及分组选取购于陆军军医大学实验动物中心的7~8周龄C57BL/6雄鼠10只,雌鼠20只,体质量为(24.52±1.25)g,将该批小鼠进行配种繁育得到新生小鼠。所有实验动物均饲养于12 h光/暗昼夜节律、温度恒定在18~22 ℃的陆军军医大学实验动物中心标准清洁SPF级动物房,小鼠可自由取食和饮水。为避免雌性激素对实验结果产生影响,本研究均采用雄性小鼠。按照随机数字表法进行分组,每窝最多选取2只小鼠,体质量2~3 g, 共分为2组(每组8只):正常对照组(C57+Sal)和新生期Al(OH)3处理组[C57+Al(OH)3]参考SHETH等[14]的研究报道,根据儿童免疫规划疫苗中铝佐剂添加量及疫苗接种时间,对应换算为小鼠出生后每千克体质量铝佐剂接种剂量及时间,C57+Al(OH)3均以肌肉注射方式在小鼠出生第3、5、7、10、12天分别以290、75、100、110、50 μg/kg体质量的剂量进行处理,C57+Sal组以相同形式注射等体积的生理盐水[14]。所有实验程序按照陆军军医大学实验动物福利伦理委员会的动物伦理和动物福利要求进行(AMUWEC20230277)。
1.3 行为学检测所有行为学实验于小鼠12周龄时进行检测。
1.3.1 旷场实验旷场实验在由尺寸为40 cm×40 cm×40 cm不透明的树脂玻璃组成的装置中进行,用以检测小鼠的一般运动能力。实验开始时,先将箱体底面均分为16个小格,位于箱体中心的4个小格定义为旷场中央区域,其余小格定义为旷场周围区域,将小鼠从中央区域放入,使用Ethovision 11.0软件追踪记录小鼠在30 min旷场实验中的活动情况,测试结束后分析小鼠的运动轨迹、运动总距离以及在箱体中间所处总时间。为去除小鼠气味的影响,每次测试结束后用75%酒精清洁旷场箱体,在酒精挥发完全后进行下一次试验。
1.3.2 高架十字迷宫高架十字迷宫装置由两个尺寸为32 cm×6 cm的开臂和两个闭臂及尺寸为6 cm×6 cm的中央区域组成。实验开始,将小鼠由中央区域放入高价十字迷宫中,注意小鼠头部需朝向任一开臂,利用Ethovision 11.0软件记录小鼠在迷宫内自由探索10 min的活动数据,按照以下公式分析小鼠在开臂时间的百分比:开臂时间百分比=进入开臂时间/(进入开臂时间+进入闭臂时间)×100%。
1.3.3 明暗箱实验明暗箱由尺寸为27 cm×27 cm×30 cm明箱和尺寸为18 cm×27 cm×30 cm的暗箱组成,两个箱体之间有尺寸为7.5 cm×30 cm的小门可供小鼠自由穿梭。实验开始,把小鼠放入明箱中远离小门的一端后于5 s之内打开小门,记录小鼠在箱内10 min的自由探索活动数据,利用Ethovision 11.0软件分析小鼠在明箱内时间。
1.3.4 理毛实验将每只小鼠单独放置干净透明的标准鼠笼中,将摄像机放在距离鼠笼20 cm位置,记录小鼠在笼中20 min的活动视频。其中将活动前10 min定义为小鼠适应阶段,后10 min定义为理毛统计时间,由对本次实验设计未知的经验丰富的实验员统计每只小鼠梳理身体各部位(包括头部,身体以及尾巴)的总时间。
1.3.5 埋珠实验埋珠实验在尺寸为27 cm×16.5 cm×12.5 cm的标准鼠笼中进行。每只鼠笼内中均匀铺入约2 cm深的山杨木屑,20颗直径为15 mm的黑色玻璃弹珠以4×5的网格形状轻放在木屑表面并保持表面平整后,将小鼠轻放入笼中开始测试,30 min后拍照埋珠情况并统计受试小鼠掩埋的玻璃珠数量(以埋掉玻璃珠体积的3/4为标准)。
1.3.6 三箱社交实验三箱社交实验装置由尺寸为60 cm× 40 cm×22 cm透明聚碳酸酯制成的矩形箱体组成,箱体间的分隔墙内设置有可供小鼠自由穿行活动小门。实验测试分为两个阶段:适应阶段(第一阶段)和社交阶段(第二阶段)。在适应阶段测试时,将受试小鼠轻放于中间箱体,允许小鼠在3个箱体间自由活动10 min。在社交阶段测试时,在左右对称的两侧箱体鼠笼中分别放入陌生C57BL/6雄鼠和陌生物体后,把受试小鼠从中间箱体放入并可在3个箱体中自由活动10 min。用Ethovision 11.0软件记录并分析每个阶段小鼠在每个箱体中停留的时间和小鼠嗅探的时间,并按以下公式计算箱体偏好系数和嗅探偏好指数:箱体偏好系数=(陌生小鼠箱体侧时间-陌生物体侧箱体时间)/(陌生小鼠侧箱体时间+物体箱体时间);嗅探偏好系数=(嗅探陌生小鼠时间-嗅探陌生物体嗅探时间)/(嗅探陌生小鼠时间+嗅探陌生物体时间)。
1.3.7 新物体识别实验在实验前1 d, 将小鼠放置于不透明的树脂玻璃装置中适应30 min。实验分为两个阶段:第一阶段为习得阶段,第二阶段为测试阶段。在第一阶段中,把两个几乎相同的物体(旧物体O)分别放置在箱子一侧两个避光角落, 允许小鼠在箱体内自由探索10 min。第一阶段结束后间隔2 h进行第二阶段测试。第二阶段测试中,先将其中一个旧物体O更换为与旧物体O相似但形状、颜色和纹理均不同的新物体N放置于相同的避光角落,将小鼠放入箱内自由探索活动10 min。用Ethovision 11.0软件分析记录小鼠10 min内探索旧物体(TO)和新物体(TN)的活动数据,并按照以下公式计算识别指数(discrimination index,DI):DI=TN/(TN+TO)×100%。
1.3.8 Y迷宫实验Y迷宫是一个由三条臂(A、B、C臂)组成的Y型不透明树脂装置(40 cm×9 cm×6 cm),实验开始时,将小鼠放入箱体中心自由探索8 min。当小鼠的4个爪子全部在一条臂中时视作该小鼠完全进入此臂,当小鼠未重复进入三条臂被定义为一次正确的自发交替行为(spontaneous alternation,SAP)。用Ethovision 11.0软件记录SAP次数及进入各臂的总次数,按照以下公式计算SAP行为的得分(SAB):SAB=SAP次数/(穿臂总次数-2)。
1.3.9 筑巢实验在测试当天,将每只受试小鼠单独置于一个标准鼠笼中,放入少量的木屑和一块质量为2.5 g的压制棉垫,保证小鼠自由进食和饮水。在24 h后拍照笼内筑巢情况,并记录已撕碎和未撕碎的棉垫重量,并按照以下评分标准评估受试小鼠的巢穴质量:>90%棉垫未撕碎评为1分;50%~90%棉垫未撕碎评为2分;10%~50%棉垫未撕碎且没有可识别的巢穴评为3分;<10%棉垫未撕碎且巢穴平坦评为4分;<10%棉垫未撕碎且巢穴完好评为5分。
1.3.10 Morris水迷宫实验实验开始前1 d,对受试小鼠进行适应性训练,以确保每只小鼠的运动能力和视觉能力正常。在学习期的隐藏平台试验中,受试小鼠每天以随机象限入水,在第1~5天的同一时段重复此试验,记录小鼠轨迹以及找到平台所用时间。在第6天空间探索实验中,将平台撤除,各组受试小鼠从平台对侧象限入水,测试时间为60 s,利用Ethovision 11.0软件记录并分析收集小鼠的运动轨迹、各象限停留时间、穿越平台的次数、游泳速度和游泳距离等参数。
1.4 免疫荧光染色Al(OH)3注射结束后, 将P14小鼠经心脏灌注多聚甲醛(paraformaldehyde,PFA)后取出脑组织。把小鼠脑组织置于4%PFA中固定24 h后利用不同浓度酒精梯度脱水后进行石蜡包埋,包埋后用石蜡切片机沿冠状面切取5 μm包含海马结构的脑组织切片贴于粘附性载玻片上,并放入切片盒常温保存备用。进行免疫荧光染色时,选取位置适当的脑组织切片,依次使用二甲苯和不同浓度的酒精将切片脱蜡水化后进行微波抗原修复,修复完成后,用0.3% TritonX-100进行破膜,之后分别加入不同一抗: 兔来源NeuN抗体(1 ∶500),鼠来源GFAP抗体(1 ∶500),兔来源Sox2抗体(1 ∶500),鼠来源Iba1抗体(1 ∶500),鼠来源PCNA抗体(1 ∶500),兔来源S100β(1 ∶500), 于37 ℃温箱孵育2 h后放于室温过夜,总时间不超过16 h,用0.1 mol/L PBS清洗3次,每次10 min。清洗干净切片后加入对应的二抗:分别为Alexa FluorTM 488-Goat anti-Mouse IgG和Cy3-Donkey Anti-Rabbit IgG,Cy3-Donkey Anti-Mouse IgG使用比例为1 ∶500,在37 ℃孵育2 h后,DAPI复染1 min,用0.1 mol/L PBS清洗3次,每次10 min,之后用抗荧光淬灭封片剂封片。2组内各选取3只小鼠,每只小鼠选取海马位置相似的3张大脑切片用于免疫荧光半定量分析统计。
1.5 统计学分析所有实验数据用SPSS 26.0软件进行统计分析,计量数据以x±s显示,采用重复测量双因素方差分析Morris水迷宫前5 d训练潜伏期数据,采用配对样本t检验分析三箱社交小鼠在陌生鼠所在箱体和物体所在箱体的时间比较(未涉及中间箱体时间比较),其余实验数据采用独立样本t检验用于2组比较,以P < 0.05为差异具有统计学意义。
2 结果 2.1 新生期Al(OH)3暴露不影响成年后小鼠的运动能力及焦虑样行为旷场实验可反映小鼠的运动能力和焦虑样行为,在30 min总测试的时间中,与对照组比较,Al(OH)3处理组小鼠的运动轨迹较为一致,分段运动距离、总运动距离以及总中心时间也较为一致,差异无统计学差异(图 1A~D)。高架十字迷宫可反映小鼠的焦虑样行为,在开臂时间越多则焦虑水平越低,在10 min总测试时间中,2组小鼠在开臂时间占比差异均无统计学意义(图 1 E)。明暗箱实验结果显示,在10 min总测试时间中,与对照组比较,Al(OH)3处理组小鼠在暗箱时间占比上呈现下降趋势,但2组小鼠的暗箱时间占比差异无统计学意义(图 1F)。这部分实验结果提示新生期Al(OH)3处理不会影响小鼠成年后的运动能力,同时成年后小鼠也不会出现焦虑样行为。
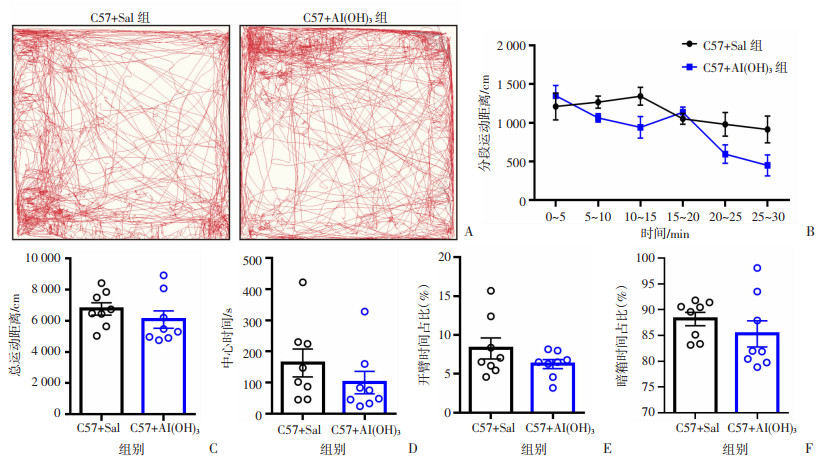
|
| A:旷场代表性轨迹图;B:旷场实验小鼠分段运动距离;C:旷场实验小鼠总运动距离;D:旷场实验小鼠在中心区域总时间;E: 高架十字迷宫开臂时间占比;F:明暗箱实验暗箱时间占比 图 1 Al(OH)3对小鼠运动能力和焦虑样行为的影响(n=8) |
2.2 新生期Al(OH)3暴露导致成年后小鼠社交行为异常并出现重复刻板行为
三箱社交实验用于检测小鼠的社交行为,在三箱社交第二阶段中,正常对照小鼠在陌生小鼠侧的箱体时间显著多于物体侧的箱体时间(P < 0.05,图 2A、B),而Al(OH)3处理组小鼠在陌生小鼠侧的箱体时间和在物体侧的箱体时间差异无统计学意义(图 2A、B);箱体偏好系数和嗅探偏好系数分析结果表明,与对照组相比,Al(OH)3处理组小鼠更偏好于陌生物体,且差异具有统计学意义(P < 0.05, P < 0.01,图 2 C、D)。理毛实验和埋珠实验可用于检测小鼠的重复刻板样行为,理毛实验结果显示,在10 min测试时间中,Al(OH)3处理组小鼠的理毛总时间显著高于对照组小鼠(P < 0.05,图 2E);埋珠实验结果显示,2组小鼠埋珠数量差异无统计学意义(图 2F)。这提示Al(OH)3处理组小鼠在成年后存在社交行为异常以及重复刻板样行为。
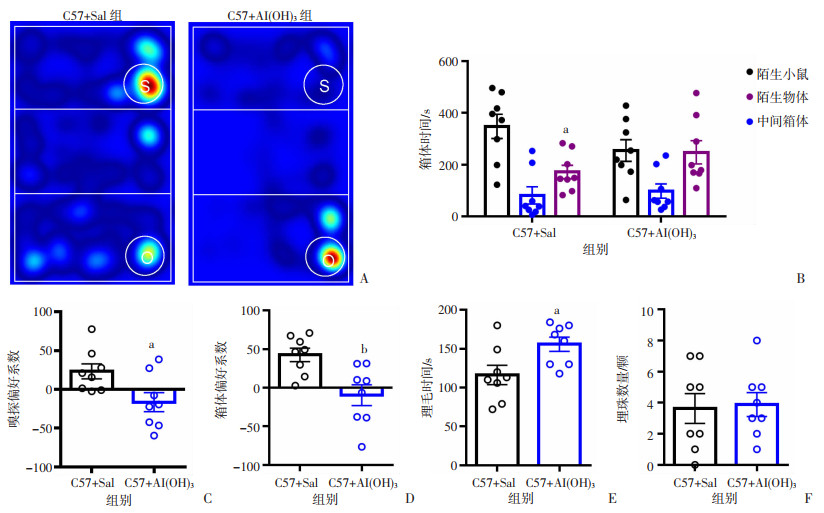
|
| A:三箱社交实验第二阶段代表性热图;B:三箱社交实验小鼠箱体时间分布;C: 嗅探偏好系数;D: 箱体偏好系数;E:理毛时间;F:埋珠数量a: P < 0.05, b: P < 0.01, 与C57+Sal组比较 图 2 Al(OH)3对小鼠社交行为和重复刻板样行为的影响(n=8) |
2.3 新生期Al(OH)3暴露导致成年后小鼠短期记忆缺陷及筑巢行为异常
新物体识别实验用于新生期Al(OH)3暴露对成年后小鼠短时学习记忆的影响(图 3A)。新物体识别实验结果显示,Al(OH)3处理组小鼠的新物体的识别指数与对照组相比明显降低(P < 0.05, 图 3B)。Y迷宫实验用于检测小鼠的短期记忆能力,实验结果显示Al(OH)3处理组小鼠的自发交替行为比率低于对照组小鼠,且差异具有统计学意义(P < 0.05, 图 3C)。筑巢实验可以评估小鼠的认知能力,按照小鼠筑巢1~5分评分标准对小鼠筑的巢进行评分,实验结果显示Al(OH)3处理组小鼠筑巢得分显著低于对照组小鼠(P < 0.05, 图 3D)。这部分实验结果提示新生期Al(OH)3暴露会导致成年后小鼠出现短期记忆缺陷及认知障碍。
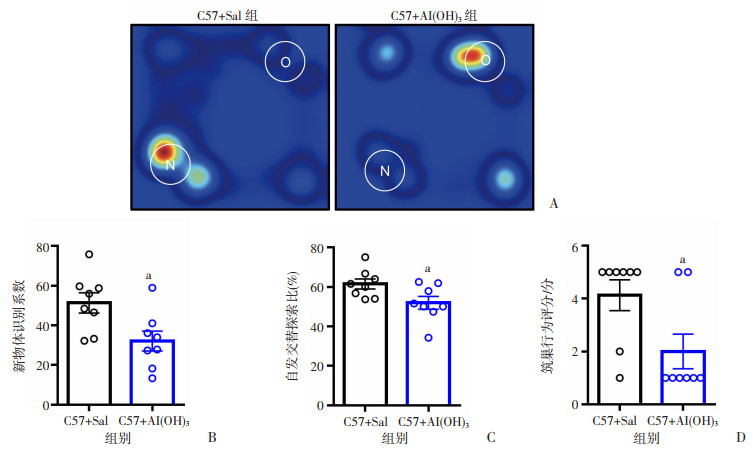
|
| A:新物体识别10 min内受试小鼠所处位置和持续时间的代表性热图N代表新物体;O代表旧物体;B:新物体识别系数;C:Y迷宫自发交替探索行为占比;D: 筑巢行为评分a: P < 0.05, 与对照组比较 图 3 Al(OH)3对小鼠短期记忆和筑巢行为的影响(n=8) |
2.4 新生期Al(OH)3暴露导致成年后小鼠空间记忆能力异常
经典的Morris水迷宫试验可以反应小鼠空间学习记忆能力(图 4A)。水迷宫实验结果显示,在前5 d的学习测试中,2组小鼠的逃离潜伏期差异无统计学意义(图 4B)。进一步分析结果显示随着训练天数逐步增加,2组小鼠的训练潜伏期逐渐缩短。此外,与对照组小鼠比较,Al(OH)3处理组小鼠的平均游泳速度和总游泳距离基本一致,无显著性变化,这表明2组小鼠的运动水平基本一致(图 4C、D)。在第6天的空间记忆测试结果中:与对照组小鼠比较,Al(OH)3组小鼠在目标象限的停留时间明显减少(P < 0.05, 图 4E),Al(OH)3组小鼠穿越平台次数也比对照组小鼠少,具有边缘显著效应(P=0.100 5,图 4 F)。这表明新生期Al(OH)3处理成年后小鼠的运动能力正常,但是空间记忆能力出现了异常。
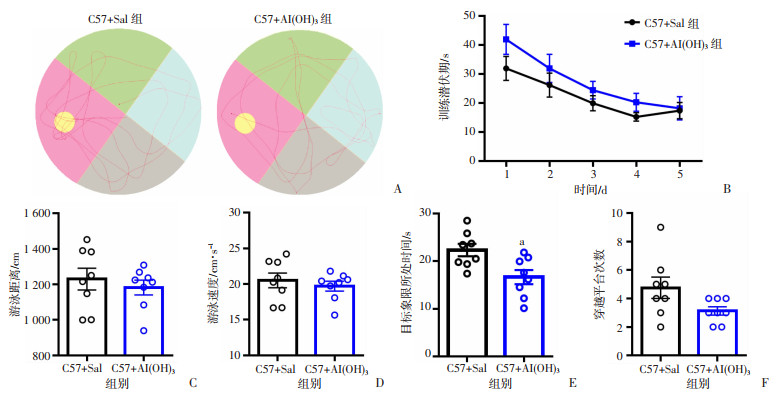
|
| A:Morris水迷宫代表性轨迹图;B: 游泳速度比较;C:游泳距离比较;D:前5 d训练潜伏期比较;E:第6天撤除平台小鼠在目标象限所处时间;F:第6天撤除平台后小鼠穿越平台次数a: P < 0.05, 与对照组比较 图 4 Al(OH)3对小鼠空间学习记忆的影响(n=8) |
2.5 新生期Al(OH)3暴露减少P14小鼠海马齿状回颗粒下区神经干细胞数量
转录因子Sox2是维持胚胎干细胞自我更新和多潜能性的必要因子,可用于标记神经干细胞和神经前体细胞;Sox2和GFAP双标记可用于检测生后小鼠海马齿回中的神经干细胞。与正常对照组比较,Al(OH)3处理组P14小鼠的海马齿回颗粒下区Sox2阳性的神经干细胞数显著减少(P < 0.05,图 5A、B);同样,Al(OH)3处理组小鼠海马齿状颗粒下区Sox2和GFAP共同标记的神经干细胞数也显著减少(P < 0.05,图 5A,C)。PCNA可用于反应细胞增殖情况,与对照组比较,Al(OH)3处理组P14小鼠海马中PCNA阳性细胞数呈现下降趋势(图 5A、D)。结果提示新生期Al(OH)3暴露显著减少了P14小鼠海马Sox2阳性细胞数量以及Sox2和GFAP共同标记的神经干细胞数量,同时增殖细胞也呈现下降趋势。
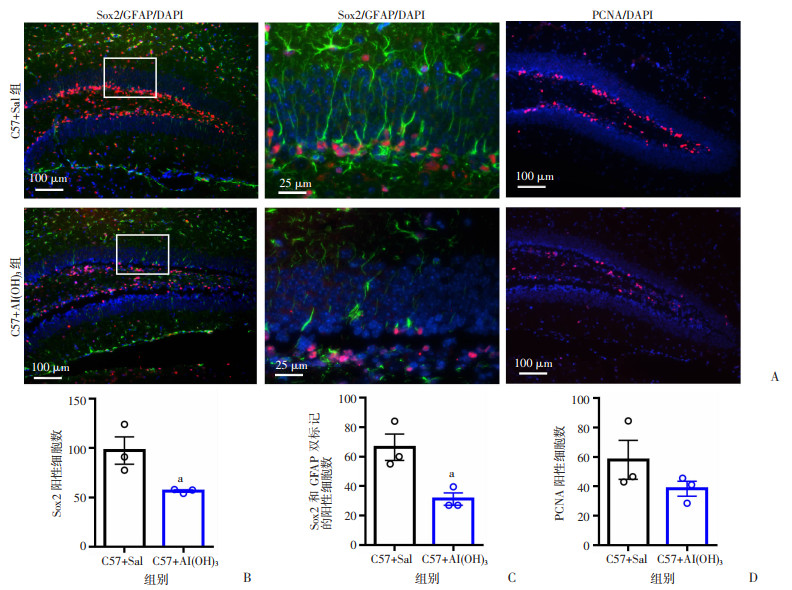
|
| A: 免疫荧光染色图Sox2(红色)/GFAP(绿色)/DAPI(蓝色); PCNA(红色)/DAPI(蓝色);B: 2组小鼠海马齿回颗粒下区Sox2阳性细胞数;C:2组小鼠海马齿状回颗粒下区Sox2和GFAP双标记的阳性细胞数;D: 2组小鼠海马PCNA阳性细胞数;a: P < 0.05, 与对照组比较 图 5 Al(OH)3对P14小鼠神经干细胞及增殖细胞的影响 |
2.6 新生期Al(OH)3暴露促进P14小鼠成熟星形胶质细胞分化
为探究新生期Al(OH)3暴露对P14小鼠海马神经干细胞分化的影响,利用NeuN标记成熟的神经元细胞,S100β标记成熟星形胶质细胞,Iba1标记小胶质细胞,通过免疫荧光半定量分析发现,与对照组比较,Al(OH)3处理组P14小鼠海马中NeuN标记的颗粒细胞层明显变薄(P < 0.01,图 6A、B), S100β标记海马齿状回区域的成熟星形胶质细胞显著增多(P < 0.05, 图 6A、C),Iba1标记海马齿状回区域的小胶质细胞变化不大(图 6A、D)。这提示新生期Al(OH)3暴露会导致P14小鼠海马齿回颗粒层变薄,促进成熟星形胶质细胞的分化。
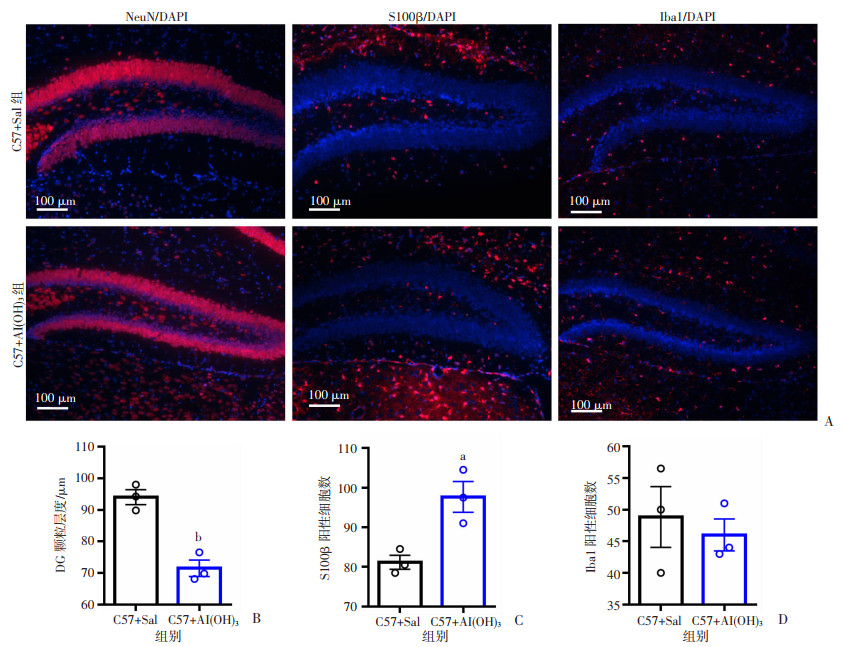
|
| A: 免疫荧光染色图NeuN(红色)/DAPI(蓝色);S100β(红色)/DAPI(蓝色);Iba1(红色)/DAPI(蓝色);B: 2组小鼠海马齿状回颗粒层厚度;C:2组海马S100β阳性细胞数;D: 2组海马Iba1阳性细胞数a: P < 0.05, b: P < 0.01, 与对照组比较 图 6 Al(OH)3暴露对小鼠海马结构中神经细胞分化的影响 |
3 讨论
铝是地壳中含量最丰富的元素之一,长期暴露会对神经系统造成一定损伤。铝可通过多种形式及途径进入人体,如药品,食品,化妆品,饮用水,疫苗等。Al(OH)3是常用的一种疫苗佐剂,也是新生期铝暴露的主要途径之一,新生儿出生后至6岁会接种多种含Al(OH)3佐剂的疫苗,如乙肝疫苗、百白破疫苗等,近年来有研究怀疑自闭症发生率上升与疫苗佐剂有关[13]。多项研究表明铝暴露和神经系统疾病有关,包括帕金森病[15]、阿尔茨海默病[16]、透析性脑病[17]和自闭症[18]等,在人群流行病学[19]和动物铝中毒模型[20]中均发现摄入过量铝会造成认知功能障碍。在动物模型中发现新生期含铝佐剂暴露导致绵羊出现社交行为和认知异常[21],小鼠在三箱社交实验中也表现出社交新奇性缺陷[14, 22]。本研究使用C57BL/6模型小鼠,建立新生期Al(OH)3暴露的小鼠模型,探究生后早期Al(OH)3暴露是否会对成年后小鼠的社交及认知功能产生影响。实验结果显示,在旷场实验中,总中心时间和总的运动距离与对照组相比无差异,说明早期Al(OH)3暴露不会影响小鼠成年后的运动能力。在高架十字迷宫和明暗箱实验中,Al(OH)3组小鼠也未出现焦虑样行为。但在三箱社交第二阶段实验中Al(OH)3组小鼠表现出对物体而非陌生小鼠的偏向,在理毛实验中,其理毛时间明显高于对照组,这说明新生期Al(OH)3暴露会影响成年后小鼠的社交行为并出现重复刻板样行为。
据已有文献报道,孕期铝暴露可导致子代小鼠生后1个月内表现出发育迟缓且学习记忆能力受损[23-25],慢性口服铝暴露会导致小鼠空间学习记忆明显下降[26]。为评估成年后小鼠的短期记忆功能,本研究进行了新物体识别实验,结果发现Al(OH)3组小鼠的新物体识别系数明显下降,识别新旧物体出现障碍,表明小鼠的短期记忆功能受损。Y迷宫实验用以检测工作记忆,发现Al(OH)3组小鼠在Y迷宫实验中自发交替探索系数明显降低,表明发育早期Al(OH)3暴露损伤小鼠的工作记忆。同时,本研究采用水迷宫空间探索实验以评估小鼠的空间记忆能力,发现撤除平台后Al(OH)3组小鼠到达水迷宫平台的时间与正常对照小鼠相比明显延长,穿梭平台次数亦有减少的趋势,提示新生期Al(OH)3暴露损伤了小鼠的空间记忆能力。
海马是大脑中参与社交行为与学习记忆的重要脑区,研究表明,海马结构异常与认知功能障碍和学习记忆能力下降有关[27]。同时,海马是铝暴露后受影响最为严重的脑区,经亚慢性铝暴露后会减少小鼠海马区的神经干细胞和增殖细胞[26],在大鼠慢性氯化铝暴露28 d后发现海马DG区反应性星形胶质细胞增加[28], 体外实验中也发现铝暴露会减少神经球中神经干细胞数量并影响干细胞的定向分化[29]。在新生期Al(OH)3暴露后,本研究发现与对照组比较,Al(OH)3组P14小鼠海马齿状回颗粒层厚度变薄,表明齿回颗粒细胞的产生受到明显抑制。Sox2+/GFAP+用以标记海马齿回内的神经干细胞,Al(OH)3处理组减少P14小鼠海马齿状回Sox2+/GFAP+双标记细胞,并观察到S100β标记的成熟星形胶质细胞数量增加,表明新生期Al(OH)3暴露减少齿回干细胞的数量并促进其向星形胶质细胞分化,是Al(OH)3减少齿回颗粒神经元数量的重要因素。被Al(OH)3阻滞的海马齿回发育模式,可能影响成年后小鼠学习记忆功能,造成其发生认知功能障碍和异常社交行为。
综上所述,本研究通过构建新生期Al(OH)3暴露小鼠模型,利用行为学检测发现成年后Al(OH)3暴露小鼠出现社交行为异常和重复刻板样行为倾向以及短期记忆和空间记忆受损为特征的认知障碍,利用免疫荧光检测发现P14小鼠海马结构发育缺陷,推测这是引起小鼠成年后社交和认知障碍的可能机制,这为临床上Al(OH)3安全用量的评估提供了基础数据参考,但其致病具体机制仍有待进一步深入研究。
| [1] |
ALASFAR R H, ISAIFAN R J. Aluminum environmental pollution: the silent killer[J]. Environ Sci Pollut Res, 2021, 28(33): 44587-44597. |
| [2] |
NIU Q. Overview of the relationship between aluminum exposure and health of human being[J]. Adv Exp Med Biol, 2018, 1091: 1-31. |
| [3] |
SHAW C A. Aluminum as a CNS and immune system toxin across the life span[J]. Adv Exp Med Biol, 2018, 1091: 53-83. |
| [4] |
SHAW C A, TOMLJENOVIC L. Aluminum in the central nervous system (CNS): toxicity in humans and animals, vaccine adjuvants, and autoimmunity[J]. Immunol Res, 2013, 56(2): 304-316. |
| [5] |
GHERARDI R K, EIDI H, CRÉPEAUX G, et al. Biopersistence and brain translocation of aluminum adjuvants of vaccines[J]. Front Neurol, 2015, 6: 4. |
| [6] |
SONG F F, YANG X J, YIN J Z, et al. Characteristics and subtypes of mild cognitive impairment caused by occupational aluminum exposure[J]. J Environ Occup Med, 2014, 31(4): 258-261. |
| [7] |
XU S M, ZHANG Y W, JU X F, et al. Effects of occupational aluminum exposure on workers' cognitive function: based on factor analysis[J]. J Environ Occup Med, 2020, 37(1): 30-35. |
| [8] |
NAM S M, YOO D Y, KWON H J, et al. Effects of long-term exposure to aluminum in the hippocampus in the type 2 diabetes model rats[J]. Toxicol Res (Camb), 2019, 8(2): 206-215. |
| [9] |
MEHRBEHESHTI N, ESMAILI Z, AHMADI M, et al. A dose response effect of oral aluminum nanoparticle on novel object recognition memory, hippocampal caspase-3 and MAPKs signaling in mice[J]. Behav Brain Res, 2022, 417: 113615. |
| [10] |
LIU W, LIU J X, GAO J, et al. Effects of subchronic aluminum exposure on learning, memory, and neurotrophic factors in rats[J]. Neurotox Res, 2022, 40(6): 2046-2060. |
| [11] |
MOLD M, LINHART C, GÓMEZ-RAMÍREZ J, et al. Aluminum and amyloid-β in familial alzheimer's disease[J]. J Alzheimer's Dis, 2020, 73(4): 1627-1635. |
| [12] |
TOMLJENOVIC L, SHAW C A. Do aluminum vaccine adjuvants contribute to the rising prevalence of autism?[J]. J Inorg Biochem, 2011, 105(11): 1489-1499. |
| [13] |
PRINCIPI N, ESPOSITO S. Aluminum in vaccines: does it create a safety problem?[J]. Vaccine, 2018, 36(39): 5825-5831. |
| [14] |
SHETH S K S, LI Y L, SHAW C A. Is exposure to aluminium adjuvants associated with social impairments in mice? A pilot study[J]. J Inorg Biochem, 2018, 181: 96-103. |
| [15] |
SALKOV V N, KHUDOERKOV R M. The role of aluminum and lead in the development of Alzheimer's and Parkinson's diseases[J]. Arkh Patol, 2021, 83(3): 56. |
| [16] |
COLOMINA M T, PERIS-SAMPEDRO F. Aluminum and Alzheimer's Disease[J]. Adv Neurobiol, 2017, 18: 183-197. |
| [17] |
BONDY S C. Prolonged exposure to low levels of aluminum leads to changes associated with brain aging and neurodegeneration[J]. Toxicology, 2014, 315: 1-7. |
| [18] |
ANGRAND L, MASSON J D, RUBIO-CASILLAS A, et al. Inflammation and autophagy: a convergent point between autism spectrum disorder (ASD)-related genetic and environmental factors: focus on aluminum adjuvants[J]. Toxics, 2022, 10(9): 518. |
| [19] |
LU X T, LIANG R F, JIA Z J, et al. Cognitive disorders and tau-protein expression among retired aluminum smelting workers[J]. J Occup Environ Med, 2014, 56(2): 155-160. |
| [20] |
BITTENCOURT L O, DAMASCENO-SILVA R D, ARAGÃO W A B, et al. Global proteomic profile of aluminum-induced hippocampal impairments in rats: are low doses of aluminum really safe?[J]. Int J Mol Sci, 2022, 23(20): 12523. |
| [21] |
ASÍN J, PASCUAL-ALONSO M, PINCZOWSKI P, et al. Cognition and behavior in sheep repetitively inoculated with aluminum adjuvant-containing vaccines or aluminum adjuvant only[J]. J Inorg Biochem, 2020, 203: 110934. |
| [22] |
FARHAT S M, MAHBOOB A, IQBAL G, et al. Aluminum-induced cholinergic deficits in different brain parts and its implications on sociability and cognitive functions in mouse[J]. Biol Trace Elem Res, 2017, 177(1): 115-121. |
| [23] |
INOHANA M, EGUCHI A, NAKAMURA M, et al. Developmental exposure to aluminum chloride irreversibly affects postnatal hippocampal neurogenesis involving multiple functions in mice[J]. Toxicol Sci, 2018, 164(1): 264-277. |
| [24] |
ABU-TAWEEL G M, AJAREM J S, AHMAD M. Neurobehavioral toxic effects of perinatal oral exposure to aluminum on the developmental motor reflexes, learning, memory and brain neurotransmitters of mice offspring[J]. Pharmacol Biochem Behav, 2012, 101(1): 49-56. |
| [25] |
GE Q D, ZHANG H, XIE C, et al. Effect of continuous aluminum exposure from maternal pregnancy and lactation period to offspring adulthood on spatial learning and memory, and miR-132 expression in hippocampus of offspring rats[J]. J Environ Occup Med, 2018, 35(8): 761-766. |
| [26] |
MEHPARA FARHAT S, MAHBOOB A, AHMED T. Oral exposure to aluminum leads to reduced nicotinic acetylcholine receptor gene expression, severe neurodegeneration and impaired hippocampus dependent learning in mice[J]. Drug Chem Toxicol, 2021, 44(3): 310-318. |
| [27] |
LI Y, SHEN M J, STOCKTON M E, et al. Hippocampal deficits in neurodevelopmental disorders[J]. Neurobiol Learn Mem, 2019, 165: 106945. |
| [28] |
SHIMIZU S, MAEDA N, TAKAHASHI Y, et al. Oral exposure to aluminum chloride for 28 days suppresses neural stem cell proliferation and increases mature granule cells in adult hippocampal neurogenesis of young-adult rats[J]. J Appl Toxicol, 2022, 42(8): 1337-1353. |
| [29] |
REICHERT K P, SCHETINGER M R C, PILLAT M M, et al. Aluminum affects neural phenotype determination of embryonic neural progenitor cells[J]. Arch Toxicol, 2019, 93(9): 2515-2524. |




