嗜铬细胞瘤/副神经节瘤(pheochromocytoma/paraganglioma, PCC/PGL)是一类少见的神经内分泌肿瘤,发病率为(2~8)/100万[1-2]。嗜铬细胞瘤(PCC)起源于肾上腺髓质的嗜铬细胞,而副神经节瘤(PGL)源自肾上腺外交感神经或副交感神经节。由于循环中儿茶酚胺水平升高,引起一系列临床表现包括头痛、出汗、心悸和高血压[3],并可导致心、脑、肾等靶器官损害。约10%的PCC/PGL还具有恶性潜能,转移性PCC/PGL的5年生存率较低,约37%[4]。
研究表明超过30%的PCC/PGL与遗传因素相关,然而这一比例在中国人群中较低[5]。目前已确定10余种PCC/PGL致病基因,对应不同的遗传综合征,其中以家族性副神经节瘤综合征、von Hippel-Lindau综合征(VHL综合征)和多发性内分泌腺瘤病2型(multiple endocrine neoplasia type 2,MEN2综合征)等最为常见,致病基因分别为SDHx、VHL和RET[1, 6]。这些患者临床特点为发病年龄早,双侧性、多发性、异位PCC,并可同时合并其他组织部位及器官的肿瘤、发育异常等,部分患者具有明确的家系遗传病史。不同的基因突变表现的综合征不尽相同,研究这些综合征对疾病治疗、随访以及遗传咨询具有重要意义。本研究总结了20余年来我科诊断治疗的遗传相关的PCC/PGL的临床特点、治疗方式的选择,以期提高临床对该类疾病的诊断和治疗能力。
1 资料与方法 1.1 患者选择回顾性收集2000年1月至2022年8月于陆军特色医学中心病理确诊为PCC/PGL的患者218例,纳入发病年龄小于50岁、双侧/多发PCC/PGL、异位PGL、有明确家族史,合并其他部位病变如小脑血管母细胞瘤、甲状腺髓样癌等的患者44例,收集患者及其家族成员的临床资料、实验室检查结果等。43例患者采集外周血液标本进行二代测序检测致病易感基因,共14例患者检测出胚系易感基因突变,另1例患者通过其典型表现临床诊断为VHL综合征。本研究得到陆军特色医学中心伦理委员会审批(医研伦审2018第93号),所有患者及家族成员签署了知情同意书。
1.2 基因测序共送检43例PCC/PGL患者外周血液样本,EDTA抗凝管中低温保存送检。所有标本采用二代测序,其中16例由深圳华大基因检测,检测panel包括:MAX、NF1、SDHAF2、SDHB、SDHC、SDHD、RET、TMEM127、VHL、EPAS1;9例由北京吉因加公司检测,检测panel为实体肿瘤中常见的1 021个基因;18例由广州基迪奥公司检测,为全外显子测序,具体检测方法既往已描述[7-9]。主要步骤包括:分离提取患者血液中白细胞DNA,采用目标区域捕获结合二代高通量测序技术,检测基因外显子及其邻近±10 bp内含子区变异,对包括点突变,20 bp以内的缺失插入突变及外显子水平的拷贝数变异进行分析。胚系变异的分析遵循美国医学遗传学和基因组学学会(American College of Medical Genetics and Genomics,ACMG)指南,只报告致病突变、疑似致病突变及意义未明变异,未报告可能不会增加患病风险的疑似良性变异和良性变异。Sanger测序:确定先证者外周血二代测序检测到的致病性变异和可疑致病性变异,对先证者及疑似基因突变的家系成员采集外周血,对相应位点设计引物PCR扩增,双向测序验证突变位点。所有参检者或监护人已签署知情同意。
2 结果 2.1 遗传性PCC/PGL及其综合征临床特征通过基因检测及临床诊断,共纳入遗传性PCC/PGL先证者15例(34.09%,表 1)。患者发病年龄为(31.7±14.6)岁,肿瘤直径为(5.1±1.7)cm,其中9例为双侧/多发PCC/PGL,2例为单侧肾上腺PCC,4例为腹膜后PGL。
| 序号 | 性别 | 基因 | 基因变异信息 | 首发症状 | 综合征首发诊断 | 初次诊断年龄/岁 | PCC/PGL 情况 |
PCC/PGL 诊断年龄/岁 |
PCC/PGL 直径/cm |
高血压病史 | PCC/PGL 家族史 |
| 1 | 男 | VHL | c.293A>G;p.Y98C | 头痛 | PCC/PGL | 10 | 双侧PCC | 10 | 5.9 | Ⅲ级 | 有 |
| 2 | 男 | VHL | c.500G>A;p.R167Q | 腹痛 | PCC/PGL | 24 | 双侧PCC | 24 | 9.3 | Ⅲ级 | 有 |
| 3 | 女 | VHL | c.239G>T;p.S80I | 体检发现 | PCC/PGL | 29 | 双侧PCC | 29 | 6.1 | - | 有 |
| 4 | 男 | VHL | c.500G>A;p.R167Q | 视物模糊 | 视网膜HB | 21 | 双侧PCC | 22 | 4.0 | - | 有 |
| 5 | 男 | VHL | c.444_457del;p.F148fs | 体检发现 | PCC/PGL | 60 | 单侧PCC | 60 | 3.1 | - | 有 |
| 6 | 女 | VHL | c.500G>A;p.R167Q | 头痛、心悸、多汗 | PCC/PGL | 12 | 双侧PCC | 12 | 6.2 | Ⅱ级 | 有 |
| 7 | 女 | VHL | N/A | 视物模糊 | 视网膜HB | 29 | PCC+PGL | 35 | 3.9 | - | 有 |
| 8 | 男 | RET | c.1901G>C;p.C634S | 头晕、心慌 | PCC/PGL | 19 | 单侧PCC | 19 | 4.3 | Ⅱ级 | 有 |
| 9 | 女 | RET | c.1832G>A;p.C611Y | 头痛、头晕 | PCC/PGL | 42 | 双侧PCC | 42 | 8.0 | Ⅲ级 | 有 |
| 10 | 男 | RET | c.1901G>A;p.C634Y | 腹痛 | PCC/PGL | 36 | 双侧PCC | 36 | 4.9 | - | 有 |
| 11 | 男 | SDHB | c.343C>T;p.R115* | 头痛、视物模糊 | PCC/PGL | 14 | 腹膜后PGL | 14 | 5.0 | Ⅲ级 | 无 |
| 12 | 男 | SDHB | c.541-2A>G | 血压增高 | PCC/PGL | 32 | 腹膜后PGL | 32 | 4.0 | Ⅱ级 | 无 |
| 13 | 女 | SDHB | c.575G>A;p.C192Y | 腹痛 | PCC/PGL | 55 | 腹膜后PGL | 55 | 5.3 | Ⅱ级 | 无 |
| 14 | 男 | SDHB | c.268C>T;p.R90* | 体检发现 | PCC/PGL | 45 | 腹膜后PGL | 45 | 3.9 | Ⅰ级 | 无 |
| 15 | 女 | SDHD | c.337_340del;p.D113fs | 头晕 | PCC/PGL | 40 | 头颈部PGL+腹膜后PGL复发 | 40 | 3.0 | Ⅰ级 | 无 |
| PCC/PGL:嗜铬细胞瘤和副神经节瘤;HB:血管母细胞瘤;PCC:嗜铬细胞瘤;PGL:副神经节瘤;-: 数据缺失 | |||||||||||
2.2 VHL综合征患者的临床与遗传特征
本研究共纳入7名VHL先证者,主要临床特征信息见表 1。先证者发病年龄为(27.4±15.6)岁,PCC/PGL肿瘤直径为(5.5±1.9)cm,其中6例为双侧/多发PCC/PGL。7个家系共确定27例患者及1例无症状携带者。家系1为c.293A>G突变,家系中成员仅有PCC的临床表现,归类为VHL2C。家系2、4、6均为c.500G>A突变,这些家系中同时伴有血管母细胞及胰腺内分泌肿瘤等临床表现,没有出现肾癌,因此为VHL2A。家系3为c.239G>T突变,家系5为c.444_457del突变,这2个家系均有成员确诊肾细胞癌和PCC,归类为VHL2B。家系7的先证者通过明确的病史(视网膜母细胞瘤、PCC/PGL、胰腺及肾囊肿和血管母细胞瘤家族史)确诊为VHL综合征,但拒绝基因监测,根据患者及家系发病特征归为VHL2A(图 1)。
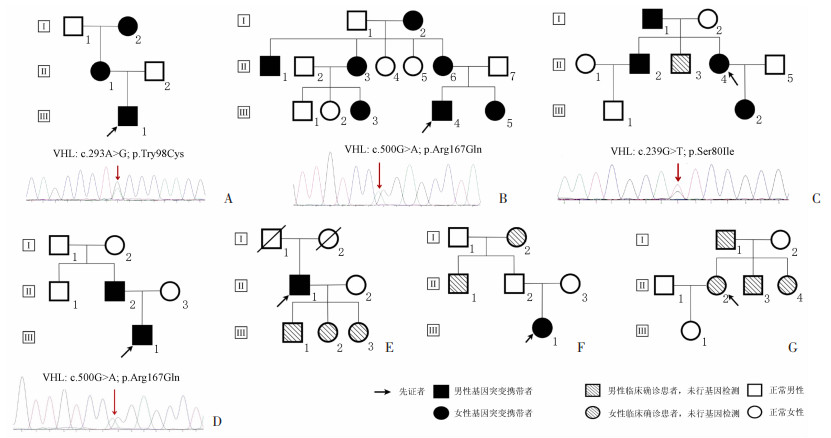
|
| A~G:分别为家系1~7的家系图其中家系1~4的家系图下方为患者的PCR产物Sanger测序结果图 图 1 7个VHL综合征的家系图及其测序结果 |
所有先证者接受手术治疗,具体治疗方式见表 2。先证者3在双侧PCC术后13年发现左侧PCC和右侧肾癌,其哥哥(家系3-Ⅱ-2)左侧肾癌根治切除,右肾多发性肾癌,均接受了舒尼替尼靶向治疗,患者复发肿瘤均明显缩小,目前疾病无明显进展。家系2、3、5在先证者确诊后对其家系进行基因验证及临床检查,发现了多位血管母细胞瘤及PCC等患者并进行手术治疗,其中1例进行了腹腔镜保留双侧肾上腺皮质的双侧嗜铬细胞瘤切除术,随访9年未见复发。
| 先证者 | 突变基因 | PCC/PGL治疗 | 综合征其他相关临床表现的治疗 | |
| 开放/腔镜 | 是否保留部分肾上腺 | |||
| 1 | VHL | 开放 | 是 | 无 |
| 2 | VHL | 腹腔镜 | 否 | 肾囊肿:暂未处理 |
| 3 | VHL | 开放 | 是 | HB、肾肿瘤、胰腺肿瘤:手术切除;肾肿瘤、PCC复发:舒尼替尼 |
| 4 | VHL | 腹腔镜 | 是 | HB:手术切除 |
| 5 | VHL | 腹腔镜 | 是 | HB:手术切除;胰腺及肾囊肿:暂未处理 |
| 6 | VHL | 开放+腹腔镜 | 否 | 胰腺肿瘤:放射性核素治疗 |
| 7 | VHL | 腹腔镜 | 是 | 视网膜HB:激光治疗;胰腺及肾囊肿:暂未处理 |
| 8 | RET | 腹腔镜 | 是 | 预防性甲状腺切除 |
| 9 | RET | 腹腔镜 | 是 | MTC:双侧甲状腺切除 |
| 10 | RET | 腹腔镜 | 是 | MTC:双侧甲状腺切除 |
| 11 | SDHB | 开放 | - | 无 |
| 12 | SDHB | 腹腔镜中转开放 | - | 无 |
| 13 | SDHB | 开放 | - | 无 |
| 14 | SDHB | 腹腔镜 | - | 无 |
| 无 15 |
SDHD | 头颈部PGL+腹膜后PGL复发 | 开放+腹腔镜 | - |
| -:不适用;HB:血管母细胞瘤;MTC:甲状腺髓样癌 | ||||
2.3 MEN2综合征患者的临床与遗传特征
3名先证者均以高血压症状发现PCC/PGL入院治疗,主要临床特征见表 1,先证者发病年龄为(32.3±9.7)岁,肿瘤直径为(5.7±1.6)cm,其中2例为双侧PCC/PGL。3个家系共有7名MEN2患者以及3名无症状携带者。先证者8和10为RET基因c.1901G>C和c.1901G>A突变,先证者9为c.1832G>A突变,3个家系中均有MTC和PCC的临床表现,因此这些突变都与MEN2A综合征相关(图 2)。
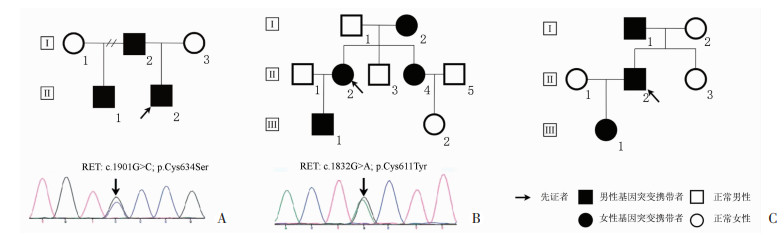
|
| A~C:分别为家系8~10的家系图其中家系8和9的家系图下方为患者的PCR产物Sanger测序结果图 图 2 3个MEN2综合征的家系图及其测序结果 |
有的先证者采取保留肾上腺皮质的嗜铬细胞瘤切除手术(表 2)。按照RET基因突变位点与甲状腺髓样癌(medullary thyroid carcinoma,MTC)的危险性关系,先证者8接受预防性甲状腺切除术及甲状腺素替代治疗。而先证者8的哥哥(家系8-Ⅱ-1)为突变携带者,拒绝采取预防性甲状腺切除,随访中尚未发现降钙素升高。先证者9的妹妹(家系9-Ⅱ-4)在进行右侧肾上腺嗜铬细胞瘤切除术后10年发现甲状腺肿瘤,就诊医院行甲状腺部分切除术。而到进行RET突变监测时,已发现甲状腺髓样癌颈部淋巴结转移。
2.4 家族性PGL综合征患者的临床与遗传特征5例家族性PGL综合征,1例为SDHD框移突变(c.337_340del),表现为家族性PGL1型,4例为SDHB突变,表现为家族性PGL4型,其中2例为无义突变(c.343C>T,c.268C>T),1例为剪接位点突变(c.541-2A>G),1例为错义突变(c.575G>A),这些患者均以腹膜后/头颈部PGL为首发表现,发病年龄为(37.2±13.8)岁,肿瘤直径为(4.2±0.8)cm(表 1)。尽管这些患者都携带胚系突变,但其家系成员均未观察到相关综合征表现。
5例先证者均接受了手术完全切除腹膜后/头颈部肿瘤(表 2),4例携带SDHB突变的患者分别随访了11、5、5和4年,均未发现复发或转移;1例SDHD突变患者为复发性PGL,5年前曾因头颈部PGL在外院手术治疗。
3 讨论本研究为单中心回顾性的研究,通过二代测序以及临床诊断出三类PCC/PGL相关综合征共15例,包括VHL、MEN2以及家族性PGL综合征。在7个VHL综合征家系中共筛查出27例患者及1名无症状携带者,3个MEN2综合征家系共筛查出7例患者及3例无症状携带者,5例患者携带SDHx突变。我们总结了患者的基因型-表型相关性及其治疗方式,其中2例复发性PCC及合并多发性肾癌的VHL综合征患者接受舒尼替尼靶向治疗,疗效明显。
3.1 PCC/PGL的遗传背景及其临床意义过去认为PCC/PGL中10%具有胚系突变,但随着基因检测技术的发展,越来越多的致病基因被发现,目前认为超过30%的患者携带胚系突变,与本研究结果类似,并且30%~40%携带体细胞突变[10]。因此,所有PCC/PGL患者应考虑进行基因检测,特别是PCC/PGL阳性家族史、综合征表现和双侧、多灶性或转移性PCC/PGL[11]。大部分PCC/PGL由特定的致病基因导致,但不同的突变其临床表型及预后有明显差异,这种遗传异质性引起了基础和临床的研究兴趣。随着基因型-表型相关性的完善,有助于改善预后分层[12]、发展精确治疗和个性化治疗[13-14]。
3.2 VHL突变相关的PCC及其综合征VHL基因突变是PCC/PGL最为常见的单基因突变[3]。不同的VHL突变位点引起的VHL综合征不同,根据患者病变所累及的组织器官不同分为1型和2型,2型又可进一步分为2A、2B及2C[15]。根据已建立的基因型-表型相关性,VHL1型常为缺失、插入等突变,VHL2型以错义突变为主。但某些突变导致的表型也有争议,如c.500G>A在国外报道均为VHL1型[16],但在本研究几个家系中均表现为VHL2A型。由于VHL综合征病变具有多发性、复发性、累及多器官的特征,其治疗方法及策略仍存在较大争议。本研究中,先证者3及其哥哥合并多发性肾癌、复发PCC后分别使用舒尼替尼3年和1年,观察到PCC和肾癌明显的缩小并且长期有效[17]。此外,HIF-2α抑制剂贝组替凡(Belzutifan)已成为首个获批用于VHL综合征治疗的药物,为VHL综合征的靶向治疗提供了新选择[18]。
3.3 RET突变相关的PCC及其综合征RET原癌基因位于10号染色体,其胚系突变主要导致以甲状腺和肾上腺病变为主的MEN2综合征[19-20]。根据临床表现可将MEN2分为MEN2A和MEN2B,其中最常见的是MEN2A(95%)[21-22]。不同的突变位点,发生MTC的时间及恶性程度不同,根据美国甲状腺协会(American Thyroid Association,ATA)指南RET突变等级提示, 本研究中的611位点突变发生MTC属于B级突变, 634位点则属于C级,风险等级均较高[23],对这类突变携带者推荐5岁前行预防性甲状腺切除[21]。我国专家共识推荐对于携带者每年随访血清降钙素及影像学检查,并未推荐预防性手术[24]。先证者8在国外留学期间行预防性切除双侧甲状腺,目前健康随访中。先证者9的胞姐,没有认识到其既往右侧PCC病史与甲状腺肿瘤可能的关系,仅行甲状腺肿瘤单纯切除术,导致治疗的延误。
3.4 SDHx突变相关的PCC及其综合征编码琥珀酸脱氢酶4个亚基的SDHx基因(SDHA、SDHB、SDHC、SDHD)以及SDHAF2的胚系突变与家族性PGL有关。SDHx基因的胚系突变约占PCC/PGL患者的20%,其中以SDHB和SDHD最为常见[25]。本研究中5个SDHx突变中3例为截短突变,1例为剪切位点突变,1例为点突变。与VHL和MEN2综合征表现的明显家系性发病不同,SDHx所致的综合征以散发性PCC/PGL为主,这可能与SDHx的低外显率相关[26]。SDHB相关的PCC/PGL常以腹膜后PGL发病,其中约一半的患者进展为转移肿瘤,其5年生存率较低[27]。本研究中4例SDHB患者最长11年随访未发现复发或转移。SDHD的遗传方式较为特殊,具有母系印记特征,女性患者的后代通常不会出现相关症状[28],因此,主要对男性携带者开展针对性随访。
3.5 PCC/PGL的临床治疗PCC/PGL的治疗方式主要为手术治疗,单侧PCC/PGL推荐肾上腺切除,双侧肾上腺嗜铬细胞瘤推荐保留部分正常肾上腺皮质,避免糖皮质激素终生替代[29-30]。体积较大的肾上腺嗜铬细胞瘤保留正常肾上腺皮质有一定手术难度及出血风险。本研究中,先证者2因双侧巨大嗜铬细胞瘤挤压导致肾上腺皮质菲薄、瘤体血供丰富行双侧肾上腺全切除术,术后需要糖皮质激素替代;其妹由于早期进行随访检测,双侧瘤体相对较小,成功接受了保留肾上腺皮质双侧嗜铬细胞瘤切除术,随访9年未见复发。
综上,本研究回顾性总结了VHL、RET以及SDHx所致遗传临床综合征的基因型-表现相关性及治疗经验。本研究加深了我们对PCC/PGL相关的临床综合征发生的基因层面的认识,对临床精准治疗、随访及遗传咨询等方面有重要的指导作用。但本研究也存在一些不足,目前基因测序技术的广泛应用,越来越多的致病基因被发现,但本研究受既往检测基因的限制,部分患者明显具有遗传性特征却没有发现相关基因突变。
| [1] |
NÖLTING S, BECHMANN N, TAIEB D, et al. Personalized management of pheochromocytoma and paraganglioma[J]. Endocr Rev, 2022, 43(2): 199-239. |
| [2] |
LEUNG AA, PASIEKA J L, HYRCZA M D, et al. Epidemiology of pheochromocytoma and paraganglioma: population-based cohort study[J]. Eur J Endocrinol, 2021, 184(1): 19-28. |
| [3] |
MUTH A, CRONA J, GIMM O, et al. Genetic testing and surveillance guidelines in hereditary pheochromocytoma and paraganglioma[J]. J Intern Med, 2019, 285(2): 187-204. |
| [4] |
HAMIDI O, YOUNG W F, GRUBER L, et al. Outcomes of patients with metastatic phaeochromocytoma and paraganglioma: a systematic review and meta-analysis[J]. Clin Endocrinol (Oxf), 2017, 87(5): 440-450. |
| [5] |
JIANG J J, ZHANG J, Pang Y X, et al. Sino-European differences in the genetic landscape and clinical presentation of pheochromocytoma and paraganglioma[J]. J Clin Endocrinol Metab, 2020, 105(10): 3295-3307. |
| [6] |
FISHBEIN L, LESHCHINER I, WALTER V, et al. Comprehensive molecular characterization of pheochromocytoma and paraganglioma[J]. Cancer Cell, 2017, 31(2): 181-193. |
| [7] |
WANG Z, YAN X Z, TANG P, et al. Genetic profiling of hormone-sensitive and castration-resistant prostate cancers and identification of genetic mutations prone to castration-resistant prostate cancer[J]. Prostate Cancer Prostatic Dis, 2023, 26(1): 180-187. |
| [8] |
HUANG Y H, ZHANG C Z, HUANG Q S, et al. Clinicopathologic features, tumor immune microenvironment and genomic landscape of Epstein-Barr virus-associated intrahepatic cholangiocarcinoma[J]. J Hepatol, 2021, 74(4): 838-849. |
| [9] |
LIU Q L, YUAN G, TONG D L, et al. Novel genotype-phenotype correlations in five Chinese families with von Hippel-Lindau disease[J]. Endocr Connect, 2018, 7(7): 870-878. |
| [10] |
WACHTEL H, FISHBEIN L. Genetics of pheochromocytoma and paraganglioma[J]. Curr Opin Endocrinol Diabetes Obes, 2021, 28(3): 283-290. |
| [11] |
JAIN A, BARACCO R, KAPUR G. Pheochromocytoma and paraganglioma—an update on diagnosis, evaluation, and management[J]. Pediatr Nephrol, 2020, 35(4): 581-594. |
| [12] |
EID M, FOUKAL J, SOCHOROVÁ D, et al. Management of pheochromocytomas and paragangliomas: review of current diagnosis and treatment options[J]. Cancer Med, 2023, 12(13): 13942-13957. |
| [13] |
WANG K, CRONA J, BEUSCHLEIN F, et al. Targeted therapies in pheochromocytoma and paraganglioma[J]. J Clin Endocrinol Metab, 2022, 107(11): 2963-2972. |
| [14] |
CHOU A, TOON C, PICKETT J, et al. von Hippel-Lindau syndrome[J]. Front Horm Res, 2013, 41: 30-49. |
| [15] |
GIMENEZ-ROQUEPLO A P, ROBLEDO M, DAHIA P L M. Update on the genetics of paragangliomas[J]. Endocr Relat Cancer, 2023, 30(4): e220373. |
| [16] |
CIOTTI P, GARUTI A, GULLI R, et al. Germline mutations in the von Hippel-Lindau gene in Italian patients[J]. Eur J Med Genet, 2009, 52(5): 311-314. |
| [17] |
YUAN G, LIU Q L, TONG D L, et al. A retrospective case study of sunitinib treatment in three patients with Von Hippel-Lindau disease[J]. Cancer Biol Ther, 2018, 19(9): 766-772. |
| [18] |
DEEKS E D. Belzutifan: first approval[J]. Drugs, 2021, 81(16): 1921-1927. |
| [19] |
TAKAYA K, YOSHIMASA T, ARAI H, et al. Expression of the RET proto-oncogene in normal human tissues, pheochromocytomas, and other tumors of neural crest origin[J]. J Mol Med (Berl), 1996, 74(10): 617-621. |
| [20] |
MATHIESEN J S, EFFRAIMIDIS G, ROSSING M, et al. Multiple endocrine neoplasia type 2: A review[J]. Semin Cancer Biol, 2022, 79: 163-179. |
| [21] |
AMODRU V, TAIEB D, GUERIN C, et al. MEN2-related pheochromocytoma: current state of knowledge, specific characteristics in MEN2B, and perspectives[J]. Endocrine, 2020, 69(3): 496-503. |
| [22] |
WELLS S A Jr, PACINI F, ROBINSON B G, et al. Multiple endocrine neoplasia type 2 and familial medullary thyroid carcinoma: an update[J]. J Clin Endocrinol Metab, 2013, 98(8): 3149-3164. |
| [23] |
HEDAYATI M, ZARIF YEGANEH M, SHEIKHOLESLAMI S, et al. Diversity of mutations in the RET proto-oncogene and its oncogenic mechanism in medullary thyroid cancer[J]. Crit Rev Clin Lab Sci, 2016, 53(4): 217-227. |
| [24] |
王宇, 田文, 嵇庆海, 等. 甲状腺髓样癌诊断与治疗中国专家共识(2020版)[J]. 中国实用外科杂志, 2020, 40(9): 1012-1020. WANG Y, TIAN W, JI Q H, et al. Expert consensus on the diagnosis and treatment of medullary thyroid carcinoma (2020 edition)[J]. Chin J Pract Surg, 2020, 40(9): 1012-1020. |
| [25] |
BEN AIM L, PIGNY P, CASTRO-VEGA L J, et al. Targeted next-generation sequencing detects rare genetic events in pheochromocytoma and paraganglioma[J]. J Med Genet, 2019, 56(8): 513-520. |
| [26] |
BUFFET A, BURNICHON N, FAVIER J, et al. An overview of 20 years of genetic studies in pheochromocytoma and paraganglioma[J]. Best Pract Res Clin Endocrinol Metab, 2020, 34(2): 101416. |
| [27] |
BURNICHON N, ROHMER V, AMAR L, et al. The succinate dehydrogenase genetic testing in a large prospective series of patients with paragangliomas[J]. J Clin Endocrinol Metab, 2009, 94(8): 2817-2827. |
| [28] |
BAYSAL B E, RUBINSTEIN W S, TASCHNER P E. Phenotypic dichotomy in mitochondrial complex Ⅱ genetic disorders[J]. J Mol Med, 2001, 79(9): 495-503. |
| [29] |
BITEMAN B R, RANDALL J A, BRODY F. Laparoscopic bilateral cortical-sparing adrenalectomy for pheochromocytoma[J]. Surg Endosc, 2016, 30(12): 5622-5623. |
| [30] |
ROSSITTI H M, SÖDERKVIST P, GIMM O. Extent of surgery for phaeochromocytomas in the genomic era[J]. Br J Surg, 2018, 105(2): e84-e98. |




