幼年特发性关节炎(juvenile idiopathic arthritis,JIA)不是一种单一的疾病,包括所有在16岁以前起病并持续6周以上不明原因的关节炎。JIA是儿童期最常见的慢性风湿性疾病,可以造成多种残疾[1]。因此,探讨其发病机制对JIA患儿的治疗和预后至关重要。
目前,JIA的发病可能与不同的遗传和环境因素对免疫原性机制的影响有关,其中感染、应激和创伤被认为是最重要的病理因素,被这些因素诱导的T淋巴细胞和巨噬细胞分泌的细胞因子导致关节炎症和骨破坏[2]。Th17细胞诱导炎症细胞因子IL-1、IL-6和TNF-α,导致关节炎症。此外,Th17细胞分泌的IL-17刺激破骨细胞产生支持细胞并表达核因子-κB受体活化因子配体(receptor activator of nuclear factor-κB ligand,RANKL),加重骨破坏[3-4]。Treg细胞对Th17细胞具有免疫抑制功能,可以抑制炎症细胞因子的表达,减轻炎症并恢复骨量[3]。因此,抑制Th17细胞的分化并促进Treg细胞的分化可能会降低JIA的关节炎症和骨破坏[5]。
近年来,研究表明RANKL和骨保护素(osteopro-tegerin,OPG)在骨骼代谢和免疫系统中发挥着关键作用[6]。RANKL是破骨细胞生成所必需的细胞因子,主要由成骨细胞和T淋巴细胞分泌。破骨细胞前体表达核因子-κB受体活化因子(receptor activator of nuclear factor-κB,RANK),而RANK是一种RANKL的受体,通过细胞间的相互作用识别RANKL,并在有巨噬细胞集落刺激因子(macrophage colony-stimulating factor,M-CSF)的情况下分化成破骨细胞,同时,RANKL-RANK结合也可以激活NF-κB途径。OPG是一种主要由成骨细胞产生的RANKL诱饵受体,通过抑制RANKL-RANK相互作用,防止破骨细胞形成并抑制NF-κB途径[7-8]。RANKL和OPG之间缺乏平衡可能导致过度的骨破坏[9]。有研究报道,在JIA所有亚型的患儿血清中,RANKL/OPG的比例均升高[10]。这可能是导致JIA患儿关节炎症和骨破坏的一个重要原因。
维生素D是一种类固醇激素,负责调节钙磷代谢,维持健康的骨骼矿化[11]。1, 25(OH)2D3是维生素D的生物活性形式,可以与维生素D受体(vitamin D receptor,VDR)结合,发挥其基因组效应。被激活的VDR直接与目标基因及其周围的特定DNA序列结合,导致转录的激活或抑制[12]。维生素D在调节先天性免疫和适应性免疫方面也有重要作用,主要是由于VDR几乎在免疫细胞中都有表达。1, 25(OH)2D3可以通过结合Th17细胞的VDR,直接抑制炎症细胞因子IL-17和RANKL的产生。而且,1, 25(OH)2D3还通过与FoxP3(forkhead box P3)启动子区域结合增加FoxP3的表达,并诱导Treg细胞的分化[13]。1, 25(OH)2D3也被报道在体外细胞实验中促进OPG的表达[14]。然而,1, 25(OH)2D3能否通过降低RANKL/OPG比例缓解关节炎症和骨破坏尚不清楚。
研究表明,JIA患儿存在明显的维生素D缺乏[15-16],JIA患儿较高的疾病活动度与较低的血清维生素D水平之间存在明显的联系[17-18],提示维生素D在JIA疾病过程中可能起着关键作用。然而,由于JIA患者使用多种药物,包括甲氨蝶呤、糖皮质激素等,所以很难在患儿体内确定维生素D缺乏与发病机制的联系。胶原诱导的关节炎(collagen-induced arthritis,CIA)是一个经典的自身免疫性关节炎的动物模型,符合人类慢性关节滑膜炎的疾病特征。因此,本研究借助CIA动物模型探讨1, 25(OH)2D3对JIA发病机制的作用,以期为JIA患儿提供新的治疗方案提供实验依据。
1 材料与方法 1.1 材料 1.1.1 动物7~8周龄的DBA/1J雄性小鼠(体质量20~22 g)购自中国维通利华公司。小鼠被饲养在重庆医科大学附属儿童医院的SPF级别动物房(温度20~25 ℃;湿度50%~60%;光-暗循环周期12 h ∶12 h),小鼠可以自由获得灭菌的食物和水。在整个实验过程中,尽量减少动物的痛苦。所有的动物实验获得重庆医科大学附属儿童医院伦理委员会的批准(CHCMU-IACUC20220629009)。
1.1.2 主要试剂免疫级牛Ⅱ型胶原蛋白(Cat.20022)、完全弗氏佐剂(Cat.7001)、不完全弗氏佐剂(Cat.7002)均购自美国Chondrex公司;1, 25(OH)2D3(Cas.32222-06-3)购自美国MCE公司;1, 25(OH)2D3 ELISA试剂盒购自中国江莱生物公司,IL-6 ELISA试剂盒购自中国四正柏公司,IL-1β、TNF-α ELISA试剂盒购自中国Abclonal公司;HE染色试剂盒购自中国索莱宝公司;DMEM试剂盒、胎牛血清购自美国Gibco公司;细胞刺激剂、固定剂、打孔剂、固定活性染料FVD、FITC-CD4抗体、PE-CY7-IL-17A抗体、PE-CD25抗体、APC-Foxp3抗体均购自美国eBioscience公司;OPG抗体购自美国Abcam公司,RANKL抗体购自中国Abclonal公司,VDR抗体购自美国CST公司,NF-κB抗体购自中国Affinity公司,Vinculin抗体购自中国武汉三鹰公司。
1.2 方法 1.2.1 动物模型30只DBA/1J小鼠均分为3组:对照组(CON)、模型组(CIA)和感染后1, 25(OH)2D3干预组(VD)。将CIA组和VD组的小鼠建立CIA动物模型:免疫级牛Ⅱ型胶原蛋白和等量的完全弗氏佐剂利用匀浆器充分混合,在冰盒中生成乳剂(标准是将一滴乳剂滴在水面上,乳剂不扩散)。实验第1天,在无菌条件下在每只小鼠尾根部皮内注射100 μL乳剂进行初次免疫。然后将免疫级牛Ⅱ型胶原蛋白和等量的不完全弗氏佐剂混合生成乳剂,用于第21天的加强免疫,其方法细节与初次免疫相同。
1.2.2 1, 25(OH)2D3干预从第0天开始,对VD组小鼠腹腔注射10 μg/kg的1, 25(OH)2D3[19],每3天注射1次,持续7周。CON组和CIA组小鼠腹腔注射等量的生理盐水。小鼠在第50天被安乐死。
1.2.3 CIA模型评估从第21天开始,每3天用游标卡尺测量小鼠后足爪的肿胀程度。2只后足爪分别测量3次取平均值,然后再将两爪的厚度取平均值进行记录。同时,对小鼠的临床关节炎进行评分,具体如下:0=正常;1=踝关节或者跗骨有红斑或轻度肿胀;2=从踝关节到跗骨有红斑或轻度肿胀;3=从踝关节到跖骨关节有红斑和中度肿胀;4=包括踝关节、足部和脚趾出现红斑及重度肿胀,或肢体强直[20]。每只足爪单独评分,4只足爪的分数相加就是每只小鼠的得分,最高分是16分,最低分是0分。临床关节炎评分由2位独立的研究人员进行评估。
1.2.4 脾脏指数和腹股沟淋巴结指数的测定小鼠安乐死后分离脾脏和腹股沟淋巴结。脾脏指数和腹股沟淋巴结指数按以下公式计算:脾脏指数=脾脏质量(mg)/小鼠体质量(10 g);腹股沟淋巴结指数=腹股沟淋巴结(mg)/小鼠体质量(10 g)。
1.2.5 Micro-CT检测小鼠被安乐死后,立即收集左后爪的样本,用4%多聚甲醛进行固定后,尽快前往重庆医科大学附属口腔医院进行Micro-CT扫描成像。然后,用Micro-CT系统(vivaCT40, SCANCO Medical AG, 瑞士)对样本进行三维重建,观察骨破坏情况,并测量后爪踝关节的骨矿物质密度(bone mineral density, BMD)和骨体积分数(BV/TV)。
1.2.6 苏木精-伊红(HE)染色小鼠安乐死后,收集膝关节并去除关节周围的皮肤。随后,用4%的多聚甲醛固定关节36 h,然后用15%的EDTA脱钙液37 ℃恒温脱钙3周,每周更换2次脱钙液。在常规脱水和石蜡包埋后,对关节进行切片,用HE染色观察膝关节的形态和炎症细胞分布。使用显微镜(Eclipse 55i, Nikon Corporation, 日本)对HE染色的切片进行扫描和拍照。根据组织学滑膜炎评分(histological synovitis score,HSS)的评分标准,对HE染色进行客观的评分[21]。
1.2.7 流式细胞术测定脾脏指数后从脾脏中提取T淋巴细胞。Th17细胞染色方法如下:用细胞刺激剂刺激T淋巴细胞4 h,然后用洗涤液洗净细胞,在避光条件下用FITC-CD4抗体和固定活力染料对细胞进行染色30 min。然后再将细胞洗净,常规固定打孔后,在避光条件下用PE-CY7-IL-17A抗体染色30 min。最后,用BD FACS CelestaTM细胞分析仪采集样品,用FlowJo分析数据。Treg细胞染色与Th17细胞的方法略有不同。Treg细胞不需要刺激,用FITC-CD4抗体、PE-CD25抗体、固定活力染料进行细胞固定打孔前的染色,APC-Foxp3抗体进行细胞固定打孔后的染色。
1.2.8 ELISA检测收集每只小鼠的全血血液。血液在室温下自然凝固1 h,离心后提取血清。根据ELISA试剂盒的方法检测血清1, 25(OH)2D3和细胞因子IL-1β、IL-6和TNF-α的水平。
1.2.9 Western blot检测关节蛋白表达收集小鼠踝关节去除多余的毛发、脂肪等组织。称取适量的踝关节组织放入研钵中。轻轻研磨组织,不断加入液氮,直到组织被研磨成无颗粒的粉末。然后在研钵中加入适量的含有蛋白酶抑制剂和磷酸酶抑制剂的RIPA裂解缓冲液。研磨回常温后,将RIPA裂解缓冲液收集到1.5 mL EP管中,在冰上继续摇动裂解30 min。之后离心取上清,加入蛋白上样液后100 ℃煮沸10 min。将蛋白质进行常规电泳、转膜、5%脱脂奶粉封闭后,加入稀释好的一抗抗体4 ℃孵育过夜。第2天TBST洗膜后室温下孵育二抗1 h,然后显影,显影结果使用Image J软件进行半定量分析。
1.3 统计学分析采用GraphPad Prism 8软件进行分析。数据以x±s表示。两组间差异采用独立样本t检验,多组间差异采用单因素方差分析。P<0.05表示差异具有统计学意义。
2 结果 2.1 1, 25(OH)2D3对CIA模型小鼠的治疗作用为了研究1, 25(OH)2D3在CIA模型中的预防和治疗效果,在初次免疫前1 d开始使用1, 25(OH)2D3治疗(图 1A)。VD组小鼠都出现了关节炎症状,表明1, 25(OH)2D3并不能降低CIA模型的发病率。CIA组的小鼠出现明显的关节肿胀和红斑,而VD组小鼠的关节症状较CIA组明显减轻(图 1B)。在第50天,CIA组和VD组的脚掌厚度均高于CON组;与CIA组相比,VD组的脚掌厚度变薄,关节炎评分明显减少(P均 < 0.05,图 1C)。同时,在第50天,CIA组小鼠的脾脏和腹股沟淋巴结存在明显的肿胀(图 1D),而VD组小鼠经过1, 25(OH)2D3治疗后,脾脏和腹股沟淋巴结淋巴结肿胀程度较CIA组明显减轻(P均 < 0.05,图 1E)。

|
|
a:P < 0.05,与CON组比较;b:P < 0.05,与CIA组比较 A:CIA模型的建立和1, 25(OH)2D3的干预过程;B:各组小鼠第50天后足爪肿胀情况 C:各组小鼠后足爪厚度以及关节炎评分的变化情况;D:各组小鼠第50天脾脏和腹股沟淋巴结的肿大情况;E:各组脾脏指数(上)和腹股沟淋巴结指数(下)的差异 图 1 1, 25(OH)2D3在CIA模型中的治疗效果(n=10,x±s) |
2.2 1, 25(OH)2D3减少CIA模型小鼠关节组织损伤和骨破坏
HE染色结果显示,CIA组小鼠的膝关节表现为明显的滑膜组织增生,有广泛的炎症细胞浸润,关节间隙因滑膜组织的增生而明显变窄,而VD组的膝关节呈现轻度的组织学损害(图 2A)。Micro-CT的结果显示,VD组的骨质破坏程度较CIA组明显减轻(图 2B)。对HE结果进行病理评分,与CIA组相比,VD组的膝关节HSS评分降低(P < 0.05,图 2C)。分析Micro-CT结果,VD组的BMD较CIA组升高(P < 0.05,图 2D);CIA组和VD组的BV/TV都较CON组降低,但VD组的BV/TV较CIA组明显升高(P < 0.05,图 2E)。
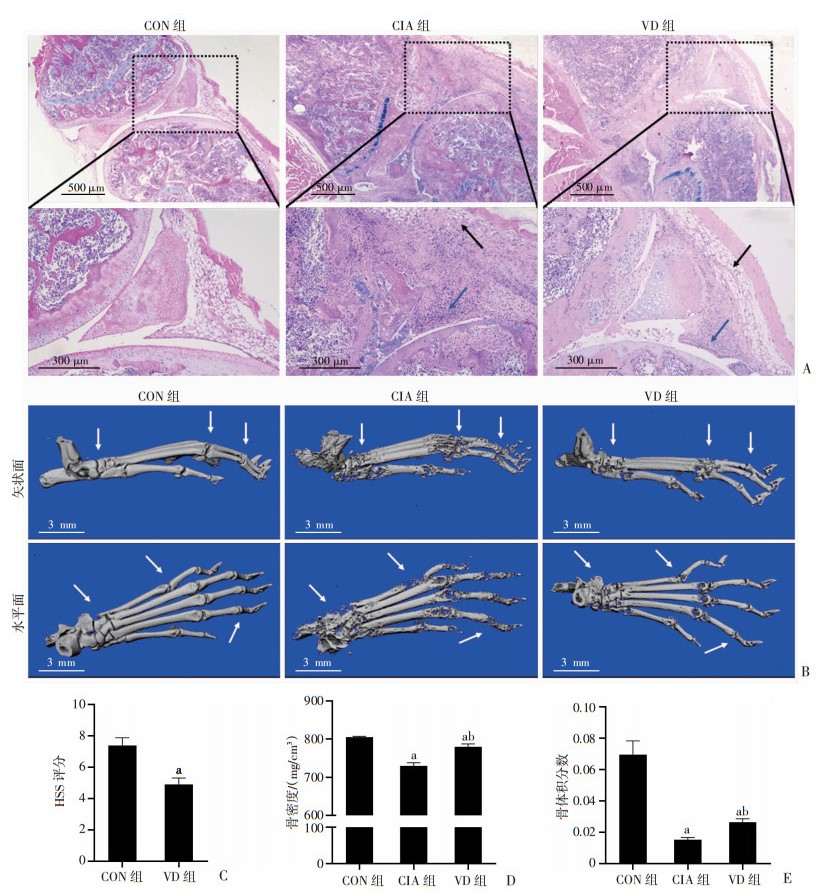
|
| A:HE染色观察小鼠膝关节滑膜增生和炎症浸润情况黑色箭头示因增生的滑膜组织被挤压变形的脂肪垫;蓝色箭头示炎症细胞浸润;B:Micro-CT扫描和三维重建观察关节形态白色箭头从左到右依次为踝关节、跖趾关节和趾间关节;C:HSS评分评估1, 25(OH)2D3对滑膜增生和炎症浸润的抑制作用(n=7,x±s);D、E:BMD和BV/TV评价后足爪的骨破坏情况(CON组n=3, CIA和VD组n=6,x±s);a:P < 0.05,与CON组比较;b:P < 0.05,与CIA组比较 图 2 各组小鼠膝关节的病理学变化和影像学表现 |
2.3 1, 25(OH)2D3降低CIA模型的炎症细胞因子表达
ELISA检测结果显示,CIA组的血清1, 25(OH)2D3水平较CON组明显降低(P < 0.05,图 3A),VD组的血清1, 25(OH)2D3水平虽然较CIA组有所恢复,但仍然低于CON组(P < 0.05,图 3A)。与CIA组相比,经过1, 25(OH)2D3治疗的VD组炎症细胞因子IL-1β、IL-6和TNF-α水平明显下降(P < 0.05,图 3B~D)。

|
|
a:P < 0.05,与CON组比较;b:P < 0.05,与CIA组比较 A:血清1, 25(OH)2D3水平的差异(n=8);B~D:各组炎症细胞因子IL-1β、IL-6和TNF-α水平的差异(n=6) 图 3 ELISA检测各组小鼠血清1, 25(OH)2D3和炎症细胞因子的水平(x±s) |
2.4 1, 25(OH)2D3治疗使CIA模型的Th17/Treg比率下降
流式细胞术检测脾脏CD4+T细胞中Th17细胞和Treg细胞的表达情况(图 4A、B),与CIA组相比,VD组CD4+T淋巴细胞中IL-17A+细胞的比例下降(P < 0.05,图 4C);而VD组的CD4+T淋巴细胞表达的CD25+Foxp3+细胞明显多于CIA组(P < 0.05,图 4D)。经统计,VD组的TH17/Treg比率低于CIA组(P < 0.05,图 4E);VD组与CON组的Th17/Treg比例差异无统计学意义(P=0.184,图 4E)。
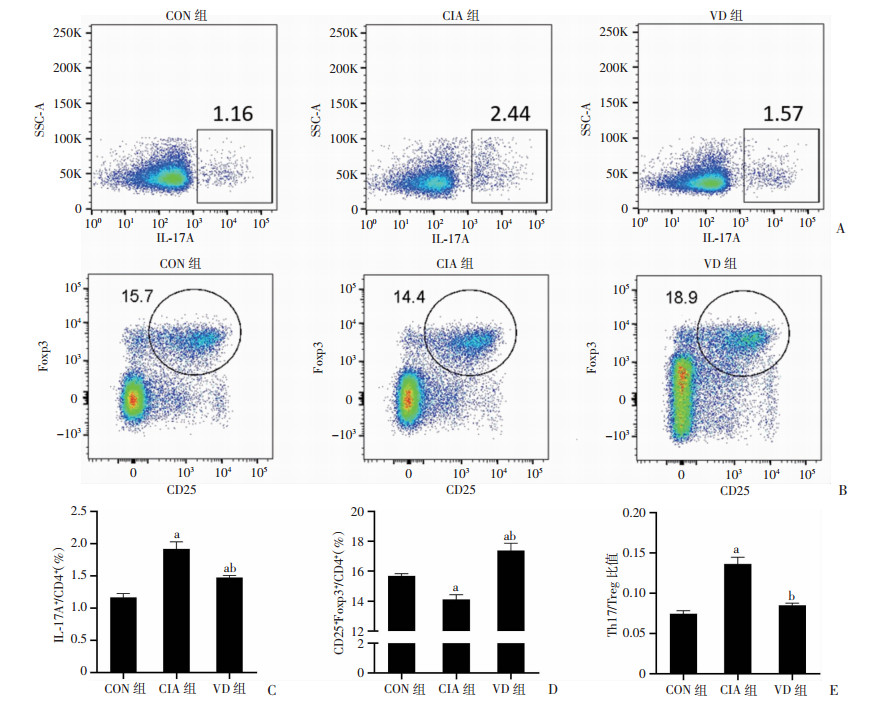
|
|
a:P < 0.05,与CON组比较;b:P < 0.05,与CIA组比较 A、B:流式细胞术检测Th17细胞和Treg细胞在各组中的表达情况;C、D:各组Th17细胞和Treg细胞比例的差异(n=7,x±s);E:各组Th17/Treg比值的差异(n=7,x±s) 图 4 流式细胞术检测各组小鼠脾脏淋巴细胞中Th17细胞和Treg细胞比例 |
2.5 1, 25(OH)2D3通过调节OPG/RANKL轴抑制NF-KB通路
Western blot结果见图 5A,CIA组和VD组VDR的表达均较CON组明显增加(P < 0.05,图 5B);与CIA组比较,VD组的VDR表达明显升高(P < 0.05,图 5B),NF-κB水平明显降低(P < 0.05,图 5C),RANKL表达水平明显降低(P < 0.05,图 5D)。VD组和CIA组的OPG水平均较CON组低(P < 0.05,图 5E),与CIA组比较,VD组OPG水平明显升高(P < 0.05,图 5E),RANKL/OPG比值明显降低(P < 0.05,图 5F)。
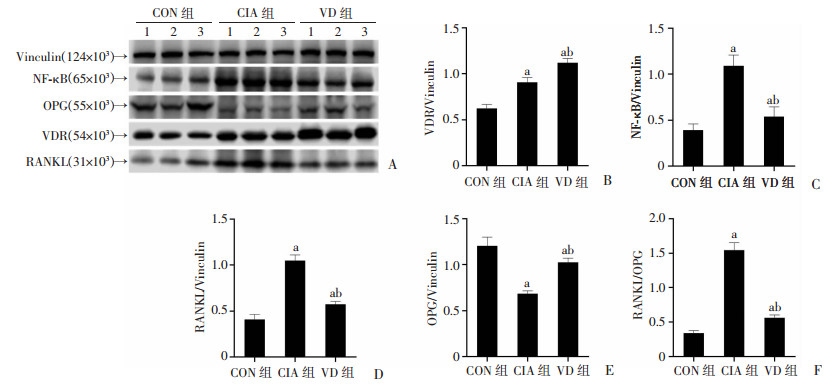
|
|
a:P < 0.05,与CON组比较;b:P < 0.05,与CIA组比较 A:踝关节各蛋白水平的表达;B~E:各组VDR、NF-κB、RANKL和OPG蛋白水平的差异(n=6,x±s);F:各组RANKL/OPG比值的差异(n=6,x±s) 图 5 Western blot检测各组小鼠踝关节蛋白质的表达 |
3 讨论
JIA是一组异质性疾病,其特点是在16岁以前发生的不明原因的关节炎。它是儿童时期最常见的慢性风湿性疾病,可导致长期残疾[1]。JIA的发病机制仍不清楚,先天性免疫和适应性免疫相关因素在疾病过程中起着非常重要的作用[22]。本研究探讨了1, 25(OH)2D3在CIA模型中的可能治疗机制。CIA模型是为研究慢性关节滑膜炎建立的动物模型,主要用于类风湿性关节炎(rheumatoid arthritis,RA)的研究,但也有报道作为JIA研究的动物模型[23-25]。此外,MARTINI等[26]最近的一项研究表明,JIA与成人类风湿关节炎之间存在着连续性,例如,全身型JIA(sJIA)与成人发病的Still’s病(adult onset Still’s disease,AOSD)是同一种疾病,与附着点炎症相关关节炎(enthesitis-related arthritis, ERA)与成人脊柱关节炎(spondyloarthritis, SpA)相似,RF阴性的多关节型JIA[pJIA(RF-)]类似于RA(RF-),pJIA(RF+)类似于RA(RF+),它们有相同的疾病特征和预后。而且,JIA的滑膜病理与成人RA的滑膜病理相似。因此,本研究利用CIA模型探讨1, 25(OH)2D3对JIA患者的作用机制。
3.1 1, 25(OH)2D3对JIA的预防及治疗作用维生素D不仅能调节钙磷代谢,维持健康的矿化骨骼,还能调节先天性和适应性免疫[11, 13]。本课题组以前的研究发现,JIA患者的血清25(OH)2D3水平降低[16]。本研究也发现CIA模型中血清1, 25(OH)2D3明显降低,虽然在补充1, 25(OH)2D3后,VD组的血清1, 25(OH)2D3水平得到提升,但并没有恢复到对照组的正常水平,也可能是1, 25(OH)2D3没有降低CIA模型发病率的原因。然而,VD组小鼠血清1, 25(OH)2D3的恢复显著降低了CIA模型的关节炎症、骨破坏、临床关节炎评分和病理评分等。这与NANDI等[17]和SENGLER等[18]的研究结果一致。本研究表明,1, 25(OH)2D3不能预防CIA的发病率,但可能通过发挥免疫调节作用减轻CIA模型的疾病活动程度。将该结果结合临床可以推断,对于有风湿病(特别是关节疾病)家族史的儿童,无需服用1, 25(OH)2D3来预防JIA的发生。但是,对于JIA患儿,可以通过服用1, 25(OH)2D3缓解疾病的严重程度,同时联合其他药物治疗JIA。不过,1, 25(OH)2D3的治疗剂量仍有待研究。
3.2 1, 25(OH)2D3通过作用于免疫细胞抑制炎症由于免疫细胞Th17细胞和单核巨噬细胞的激活,炎症细胞因子TNF-α、IL-6和IL-1在JIA患儿中过度表达[27]。这些炎症细胞因子的过度表达可激活NF-κB途径,加重炎症[28]。VDR广泛存在于所有免疫细胞中,1, 25(OH)2D3通过激活VDR对单核巨噬细胞和Th17细胞表现出抗炎活性,可以抑制TNF-α、IL-6和IL-1的表达,进一步抑制NF-κB途径。1, 25(OH)2D3还能刺激Treg细胞的分化,Treg细胞可进一步抑制Th17细胞的分化以减轻炎症[13]。本研究显示,在1, 25(OH)2D3治疗后,VD组的Th17细胞比例下降,Treg细胞的比例上升。随着血清1, 25(OH)2D3的恢复,VD组的血清炎症细胞因子如TNF-α、IL-6和IL-1β减少,同时关节炎症也明显改善。这些结果提示,1, 25(OH)2D3可以通过抑制Th17/Treg比例,进一步减少炎症细胞因子的表达来改善关节炎症。
3.3 1, 25(OH)2D3通过作用于成骨细胞抑制炎症和骨破坏RANKL/RANK/OPG轴在骨代谢和免疫系统中起着关键作用。成骨细胞分泌的RANKL与破骨细胞前体上的RANKL受体RANK相结合,在M-CSF存在的情况下促进破骨细胞前体发育为成熟的破骨细胞。OPG是RANKL的可溶性诱饵受体,主要由成骨细胞产生,通过竞争性抑制RANKL-RANK的相互作用进一步抑制破骨细胞的形成和骨破坏[7-8, 29]。成熟的破骨细胞高度表达RANK,当RANKL与RANK结合后,TNF受体相关蛋白6(TNF receptor associated factor 6,TRAF6)被招募并激活核因子κB抑制蛋白(inhibitor of NF-κB,IκB)激酶,促进IκB降解,导致NF-κB释放和激活,然后NF-κB易位到细胞核中并直接激活基因表达[29-30],导致炎症的产生。诱饵受体OPG也会抑制该途径。1, 25(OH)2D3激活其受体VDR以发挥各项生物学效应,被激活的VDR作用于成骨细胞,通过降低RANKL/OPG比率来介导骨的抗吸收作用并增加骨量[12]。然而,1, 25(OH)2D3是否可以通过降低RANKL/OPG比率来抑制骨破坏和缓解关节炎症,在JIA患儿及CIA动物模型中尚未见报道。本研究证明,1, 25(OH)2D3能够通过激活VDR,促进CIA模型踝关节的成骨细胞分泌OPG,并抑制成骨细胞分泌RANKL,通过降低RANKL/OPG比例,进一步抑制破骨细胞的成熟和破骨细胞NF-κB通路的活化,最终缓解关节炎症和骨破坏。
3.4 1, 25(OH)2D3对其受体VDR的作用本研究还发现CIA组和VD组的VDR表达都有升高,与FERNANDEZ等[31]的研究一致。可能是随着炎症的发展,免疫细胞的数量增加,这导致了VDR的表达升高。但是经过1, 25(OH)2D3治疗后,VD组的VDR表达明显要高于CIA组,可能是由于1, 25(OH)2D3治疗进一步增加免疫细胞的数量,并促进VDR的表达,这有待我们后续研究。但目前可以肯定的是,相比CIA组,VD组较高水平的1, 25(OH)2D3和VDR,降低了炎症因子水平、NF-κB蛋白水平、Th17/Treg比例和RANKL/OPG比例等。表明1, 25(OH)2D3不仅能激活VDR,而且在炎症状态下可促进其受体VDR的表达,并进一步缓解CIA模型的关节炎症,降低病理评分和骨质破坏等。
总之,本研究发现1, 25(OH)2D3与关节炎症之间存在着密切的联系,关节炎的发生会导致1, 25(OH)2D3的降低,而补充1, 25(OH)2D3治疗后,1, 25(OH)2D3通过调节Th17/Treg比例和RANKL/OPG轴,缓解了CIA模型的关节滑膜炎症和骨破坏程度。1, 25(OH)2D3有望作为一种免疫调节剂用于治疗JIA,但JIA患者补充1, 25(OH)2D3的安全值和有效剂量仍值得讨论。后续将进一步研究维生素D相关基因与JIA发病机制的关系。
| [1] |
PRAKKEN B, ALBANI S, MARTINI A. Juvenile idiopathic arthritis[J]. Lancet, 2011, 377(9783): 2138-2149. |
| [2] |
BARUT K, ADROVIC A, ŞAHIN S, et al. Juvenile idiopathic arthritis[J]. Balkan Med J, 2017, 34(2): 90-101. |
| [3] |
HUANG F, WONG P, LI J L, et al. Osteoimmunology: The correlation between osteoclasts and the Th17/Treg balance in osteoporosis[J]. J Cell Mol Med, 2022, 26(13): 3591-3597. |
| [4] |
SATO K, SUEMATSU A, OKAMOTO K, et al. Th17 functions as an osteoclastogenic helper T cell subset that links T cell activation and bone destruction[J]. J Exp Med, 2006, 203(12): 2673-2682. |
| [5] |
FAN Z D, CAO Q, HUANG N, et al. MicroRNA-125b regulates Th17/Treg cell differentiation and is associated with juvenile idiopathic arthritis[J]. World J Pediatr, 2020, 16(1): 99-110. |
| [6] |
ONO T, HAYASHI M, SASAKI F, et al. RANKL biology: bone metabolism, the immune system, and beyond[J]. Inflamm Regen, 2020, 40: 2. |
| [7] |
UDAGAWA N, KOIDE M, NAKAMURA M, et al. Osteoclast differentiation by RANKL and OPG signaling pathways[J]. J Bone Miner Metab, 2021, 39(1): 19-26. |
| [8] |
TAKAYANAGI H. Osteoimmunology and the effects of the immune system on bone[J]. Nat Rev Rheumatol, 2009, 5(12): 667-676. |
| [9] |
BOYCE B F, XING L P. Functions of RANKL/RANK/OPG in bone modeling and remodeling[J]. Arch Biochem Biophys, 2008, 473(2): 139-146. |
| [10] |
SARMA P K, MISRA R, AGGARWAL A. Elevated serum receptor activator of NFκB ligand (RANKL), osteoprotegerin (OPG), matrix metalloproteinase (MMP)3, and ProMMP1 in patients with juvenile idiopathic arthritis[J]. Clin Rheumatol, 2008, 27(3): 289-294. |
| [11] |
CHAROENNGAM N. Vitamin D and rheumatic diseases: a review of clinical evidence[J]. Int J Mol Sci, 2021, 22(19): 10659. |
| [12] |
CHRISTAKOS S, DHAWAN P, VERSTUYF A, et al. Vitamin D: metabolism, molecular mechanism of action, and pleiotropic effects[J]. Physiol Rev, 2016, 96(1): 365-408. |
| [13] |
MARTENS P, GYSEMANS C, VERSTUYF A, et al. Vitamin D's effect on immune function[J]. Nutrients, 2020, 12(5): 1248. |
| [14] |
FENG X K, LV C Y, WANG F, et al. Modulatory effect of 1, 25-dihydroxyvitamin D3 on IL1β-induced RANKL, OPG, TNFα, and IL-6 expression in human rheumatoid synoviocyte MH7A[J]. Clin Dev Immunol, 2013, 2013: 1-8. |
| [15] |
KONDRATYEVA E I, ODINAEVA N D, KLIMOV L Y, et al. Vitamin D status among children with juvenile idiopathic arthritis: a multicenter prospective, non-randomized, comparative study[J]. Front Pediatr, 2022, 10: 915943. |
| [16] |
TANG T, ZHANG Y, LUO C, et al. Adjunctive vitamin D for the treatment of active juvenile idiopathic arthritis: an open-label, prospective, randomized controlled trial[J]. Exp Ther Med, 2019, 18(6): 4921-4926. |
| [17] |
NANDI M, MULLICK M A S, NANDY A, et al. Evaluation of vitamin D profile in juvenile idiopathic arthritis[J]. Mod Rheumatol, 2022, 32(4): 792-796. |
| [18] |
SENGLER C, ZINK J, KLOTSCHE J, et al. Vitamin D deficiency is associated with higher disease activity and the risk for uveitis in juvenile idiopathic arthritis—data from a German inception cohort[J]. Arthritis Res Ther, 2018, 20(1): 276. |
| [19] |
ZHOU L, WANG J L, LI J R, et al. 1, 25-dihydroxyvitamin D3 ameliorates collagen-induced arthritis via suppression of Th17 cells through miR-124 mediated inhibition of IL-6 signaling[J]. Front Immunol, 2019, 10: 178. |
| [20] |
WANG Z J, HUANG W H, REN F F, et al. Characteristics of ang-(1-7)/mas-mediated amelioration of joint inflammation and cardiac complications in mice with collagen-induced arthritis[J]. Front Immunol, 2021, 12: 655614. |
| [21] |
FENG N B, LIANG L, FAN M T, et al. Treating autoimmune inflammatory diseases with an siERN1-nanoprodrug that mediates macrophage polarization and blocks toll-like receptor signaling[J]. ACS Nano, 2021, 15(10): 15874-15891. |
| [22] |
VAN NIEUWENHOVE E, LAGOU V, VAN EYCK L, et al. Machine learning identifies an immunological pattern associated with multiple juvenile idiopathic arthritis subtypes[J]. Ann Rheum Dis, 2019, 78(5): 617-628. |
| [23] |
POUTOGLIDOU F, POURZITAKI C, MANTHOU M E, et al. Infliximab and tocilizumab reduce anxiety-like behaviour and improve cognitive performance in a juvenile collagen-induced arthritis rat model[J]. Inflammation, 2022, 45(1): 445-459. |
| [24] |
POUTOGLIDOU F, POURZITAKI C, MANTHOU M E, et al. The inhibitory effect of tocilizumab on systemic bone loss and tendon inflammation in a juvenile collagen-induced arthritis rat model[J]. Connect Tissue Res, 2022, 63(6): 577-589. |
| [25] |
LORENZO N, CANTERA D, BARBERÁ A, et al. APL-2, an altered peptide ligand derived from heat-shock protein 60, induces interleukin-10 in peripheral blood mononuclear cell derived from juvenile idiopathic arthritis patients and downregulates the inflammatory response in collagen-induced arthritis model[J]. Clin Exp Med, 2015, 15(1): 31-39. |
| [26] |
MARTINI A, LOVELL D J, ALBANI S, et al. Juvenile idiopathic arthritis[J]. Nat Rev Dis Primers, 2022, 8: 5. |
| [27] |
AESCHLIMANN F A, CHONG S L, LYONS T W, et al. Risk of serious infections associated with biologic agents in juvenile idiopathic arthritis: a systematic review and meta-analyses[J]. J Pediatr, 2019, 204: 162-171.e3. |
| [28] |
STEEVE K T, MARC P, SANDRINE T, et al. IL-6, RANKL, TNF-alpha/IL-1: interrelations in bone resorption pathophysiology[J]. Cytokine Growth Factor Rev, 2004, 15(1): 49-60. |
| [29] |
WADA T, NAKASHIMA T, HIROSHI N, et al. RANKL-RANK signaling in osteoclastogenesis and bone disease[J]. Trends Mol Med, 2006, 12(1): 17-25. |
| [30] |
HONG G J, ZHOU L, SHI X G, et al. Bajijiasu abrogates osteoclast differentiation via the suppression of RANKL signaling pathways through NF-κB and NFAT[J]. Int J Mol Sci, 2017, 18(1): 203. |
| [31] |
FERNANDEZ LAHORE G, RAPOSO B, LAGERQUIST M, et al. Vitamin D3 receptor polymorphisms regulate T cells and T cell-dependent inflammatory diseases[J]. Proc Natl Acad Sci USA, 2020, 117(40): 24986-24997. |




