2. 610083 成都,中国人民解放军西部战区总医院康复医学科;
3. 200434 上海,同济大学附属上海市第四人民医院康复医学科
2. Department of Rehabilitation Medicine, General Hospital of Western Theater Command, Chengdu, Sichuan Province, 610083;
3. Department of Rehabilitation Medicine, Shanghai Fourth People's Hospital, School of Medicine, Tongji University, Shanghai, 200434, China
炎症反应是中枢神经系统(central nervous system,CNS)退行性病变和创伤性损伤的重要病理特点[1]。小胶质细胞作为CNS常驻的巨噬细胞,占所有CNS特异性细胞的5%~12%,在CNS炎症反应中起主要作用[2-3]。当感染、创伤或缺血性卒中等疾病发生后小胶质细胞迅速激活,最终极化为M1或M2两种功能相反的细胞群[4]。M1表型小胶质细胞释放促炎细胞因子加剧神经损伤;M2表型小胶质细胞则通过分泌抗炎细胞因子促进损伤修复,发挥神经保护作用[5]。因此调节小胶质细胞M1/M2极化,可能是治疗CNS炎症反应的潜在策略[6-7]。
丁酸钠(sodium butyrate,NaB)是内源性丁酸的钠盐形式,由益生菌在结肠中发酵膳食纤维形成[8]。随着肠-脑轴理论研究深入,NaB逐渐被发现能跨越血脑屏障作用于CNS,在脑卒中、癫痫、帕金森等动物模型实验研究中均能起到良好的治疗成效,其机制可能与病理过程中的炎症反应被抑制有关[9-12]。目前有关NaB在CNS的抗炎机制研究较少,NaB是否通过调节小胶质细胞M1/M2极化发挥抗炎作用的机制尚未完全清楚。本研究通过观察NaB对脂多糖(lipopolysaccharide,LPS)诱导BV2细胞表型极化的调节作用,从TLR4/NF-κB信号通路探讨其可能的抗炎机制,探索肠-脑轴理论中肠道菌群代谢物在调控CNS炎症性疾病的价值。
1 材料与方法 1.1 实验材料 1.1.1 细胞培养与分组小鼠BV2小胶质细胞(CL-0439)购自武汉普诺赛生命科技有限公司。采用DMEM培养基,加入10%胎牛血清和1%双抗;置于37 ℃、5% CO2培养箱中培养。细胞生长至对数期进行1 ∶3传代或铺板[13]。本实验分为4组:①对照(Control)组,正常完全培养基培养,不做任何处理;②LPS组,BV2细胞培养至对数期后,以100 ng/mL的LPS处理24 h;③LPS+NaB低剂量(LPS+NaB-L)组,依据CCK-8实验结果和既往研究,0.125 mmol/L NaB预处理过夜(17 h)后再以100 ng/mL的LPS继续孵育24 h[14-16];④LPS+NaB高剂量(LPS+NaB-H)组,0.25 mmol/L NaB预处理过夜(17 h)后再以100 ng/mL的LPS继续孵育24 h。
1.1.2 主要试剂NaB(B5887)和LPS(L2880)购自Sigma公司;DMEM培养基、胎牛血清和双抗购自Gibco公司;全蛋白提取试剂盒(BC3710)和核浆蛋白抽提试剂盒(R0050)购自北京索莱宝科技有限公司;CCK-8试剂盒购自Beyotime公司;NO试剂盒购自南京建成生物工程研究所;IL-1β(E-EL-M0037c)、TNF-α(E-EL-M3063)、IL-10(E-EL-M0046c)ELISA试剂盒购自Elabscience公司;PrimeScriptTM RT Master Mix Kit和SYBR® Primix Ex TagTM Kit购自日本TaKaRa公司;引物由生工生物工程(上海)股份有限公司合成;CD206兔多克隆抗体(ab64693)和iNOS兔单克隆抗体(ab178945)购自Abcam公司;Alexa Fluor 488标记的山羊抗兔(GB25303)和抗荧光淬灭封片剂(G1401)购自Servicebio公司;TLR4鼠单克隆抗体(66350-1-Ig)购自Proteintech公司;NF-κB(P65)兔多克隆抗体(GTX107678)购自GeneTex公司;磷酸化IKB-α兔单克隆抗体(AP0707)购自ABclonal公司;IKB-α鼠单克隆抗体(4814S)购自Cell Signaling Technology公司;PCNA抗体(200947-2E1)购自成都正能生物技术有限责任公司。
1.2 方法 1.2.1 CCK-8法筛选药物浓度取对数生长期的BV2细胞制备细胞悬液(5×104 /mL),按100 μL/孔接种于96孔板。设置对照组(仅加入培养液)和不同浓度NaB组(0、0.125、0.250、0.500、1.000 mmol/L)筛选药物浓度范围。设置对照组和不同浓度NaB组以及NaB与LPS联合作用(NaB预处理过夜,再使用100 ng/mL LPS作用24 h)测定药物对炎症刺激后BV2细胞活力的影响,每组5个复孔。所有干预结束后,按照CCK-8试剂盒说明书操作,计算细胞活力。
1.2.2 GRIESS法检测各组细胞上清液中NO水平细胞悬液制备同1.2.1,接种于6孔板,每孔2 mL。按分组给予药物处理,结束后收集各组细胞培养上清,4 ℃、2 000 r/min离心10 min。根据NO试剂盒说明书于550 nm处测定各孔光密度值[D(550)],计算各组细胞NO分泌水平。
NO含量=[实验组D(550)值-空白组D(550)值)/(NO标准品组D(550)值-空白组D(550)值]×标准品浓度×稀释倍数
1.2.3 ELISA检测BV2细胞上清液IL-1β、TNF-α和IL-10分泌水平细胞上清收集方法同1.2.2。按照ELISA试剂盒说明书进行操作,绘制标准曲线,计算各组细胞IL-1β、TNF-α和IL-10的分泌水平。
1.2.4 RT-qPCR法检测iNOS和CD206 mRNA的表达细胞悬液制备同1.2.1,每孔2 mL,贴壁后按分组给予药物处理。干预完毕后弃上清,PBS洗涤,按每孔1 mL TRIzol提取细胞总RNA,分析检测RNA纯度与浓度。根据TaKaRa的试剂盒说明书操作,以逆转录合成的cDNA为模板进行反转录和PCR反应,预变性95 ℃ 30 s,PCR反应95 ℃ 5 s, 60 ℃ 1 min共进行40个循环。以GAPDH为参照,用2-ΔΔCt法计算目的基因mRNA的相对表达量。引物序列:iNOS上游5'-GGCTTGCCCCTGGAAGTTT-3',下游5'-TGCAAGT-GAAATCCGATGTGG-3';CD206上游5'-TTCAGCTATT-GGACGCGAGG-3',下游5'-GAATCTGACACCCAGCGG-AA-3'; GAPDH上游5'-GGTTGTCTCCTGCGACTTCA-3',下游5'-TGGTCCAGGGTTTCTTACTCC-3'。
1.2.5 免疫细胞化学染色法检测iNOS和CD206的荧光强度细胞悬液制备同1.2.1,6孔板底部放置细胞爬片,每孔2 mL,贴壁按细胞分组给予药物处理。干预完毕后弃上清,PBS洗涤,4%多聚甲醛室温固定;破膜工作液室温孵育20 min;3%BSA室温封闭30 min;孵育抗CD206(1 ∶200)和iNOS(1 ∶250)抗体置于湿盒内4 ℃过夜;用Alexa Fluor 488标记的山羊抗兔(1 ∶400) 室温孵育50 min;DAPI复染细胞核;封片;镜检拍照;细胞核呈蓝色,CD206、iNOS呈绿色;用Image J计算平均荧光强度,反映BV2小胶质细胞表型极化情况。
1.2.6 Western blot检测BV2小胶质细胞各蛋白的相对表达收集各组细胞,按蛋白提取试剂盒说明书分别提取总蛋白、分离胞浆蛋白和胞核蛋白,采用BCA法测定蛋白浓度。制胶后按等量总蛋白上样,电泳、转膜、封闭后加入一抗(TLR4、NF-κB p65、IKB-α、p-IKB-α、GAPDH、PCNA)于4 ℃孵育过夜,室温孵育二抗1 h,TBST洗涤后,使用ECL显影液进行蛋白印迹曝光,Image J软件分析蛋白灰度值。
1.3 统计学分析所有实验至少重复3次,采用GraphPad Prism 9.0软件进行统计分析。数据以x±s表示,2组间差异比较采用LSD-t检验,多组间差异比较采用单因素方差分析。以P < 0.05表示差异有统计学意义。
2 结果 2.1 NaB对LPS诱导的BV-2细胞活力的影响无论是NaB单独处理还是NaB与LPS(100 ng/mL) 联合处理,CCK-8结果均显示BV2细胞的活力先上升,后下降。NaB单独处理的CCK-8结果显示:当NaB作用浓度达到0.500 mmol/L时细胞活力受到明显抑制,差异有统计学意义(P < 0.05,图 1);当作用浓度达到1.000 mmol/L时,细胞活力明显降低,约为正常组的2/3。NaB与LPS联合处理的CCK-8结果显示:0.125和0.250 mmol/L剂量的NaB能显著提高BV2细胞活力(P < 0.05,图 1)。因此,0.125、0.250 mmol/L分别作为NaB低剂量和高剂量用于后续实验。
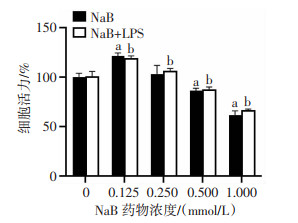
|
| a: P < 0.05,与NaB 0 mmol/L比较;b: P < 0.05,与NaB+LPS 0 mmol/L比较 图 1 CCK-8法检测不同浓度NaB以及联合LPS对BV2细胞活力的影响(n=5, x±s) |
2.2 NaB对LPS诱导的BV2细胞NO、IL-1β、TNF-α和IL-10的影响
与对照组相比,LPS刺激后NO、IL-1β和TNF-α含量显著增加(P < 0.05,图 2A~C);IL-10含量显著降低(P < 0.05,图 2D)。与LPS模型组相比,高、低剂量NaB组NO、IL-1β和TNF-α含量减少,IL-10含量增加,差异有统计学意义(P < 0.05,图 2)。表明NaB可抑制LPS诱导的BV2细胞神经炎症反应,且呈剂量依赖性地抑制NO、IL-1β和TNF-α分泌,促进IL-10分泌。
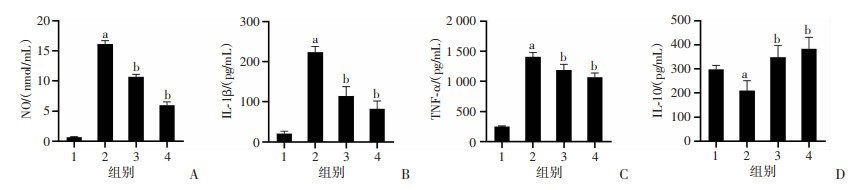
|
|
1:Control;2:LPS;3:LPS+NaB-L;4:LPS+NaB-H;a: P < 0.05,与Control组比较;b: P < 0.05,与LPS组比较 A: GRIESS法检测NO分泌水平;B: ELISA检测IL-1β分泌水平; C: ELISA检测TNF-α分泌水平;D: ELISA检测IL-10分泌水平 图 2 GRIESS法和ELISA分别检测各组BV2细胞NO、IL-1β、TNF-α和IL-10分泌水平(n=3, x±s) |
2.3 NaB对LPS诱导的BV2细胞M1/M2表型极化的影响
为了确定NaB抑制BV2细胞炎症反应是否与表型极化有关,使用RT-qPCR检测BV2细胞M1表型标志物iNOS和M2表型标志物CD206的mRNA的表达,使用免疫荧光细胞化学染色法观察iNOS和CD206蛋白的表达。RT-qPCR结果表明,与对照组相比,LPS刺激后iNOS mRNA表达显著升高(P < 0.05,图 3A),CD206 mRNA表达显著下降(P < 0.05,图 3B);高、低剂量NaB组与LPS模型组相比,iNOS mRNA表达显著降低,差异有统计学意义(P < 0.05,图 3A),CD206 mRNA表达显著上升,差异有统计学意义(P < 0.05,图 3B)。免疫荧光结果显示,与正常对照组相比,LPS干预组iNOS蛋白表达明显上升,差异有统计学意义(P < 0.05,图 4A、B),CD206蛋白表达下降,差异有统计学意义(P < 0.05,图 4C、D)。而高、低剂量NaB组与LPS干预组相比iNOS蛋白表达明显下调,差异有统计学意义(P < 0.05,图 4A、B),CD206蛋白表达明显上升,差异有统计学意义(P < 0.05,图 4C、D)。这些结果均表明NaB可促进LPS诱导的BV2细胞由M1表型向M2表型转化。
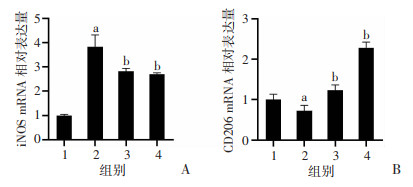
|
| 1:Control;2:LPS;3:LPS+NaB-L;4:LPS+NaB-H;a: P < 0.05,与Control组比较;b: P < 0.05,与LPS组比较 图 3 RT-qPCR检测各组BV2细胞iNOS(A)和CD206(B)mRNA表达水平(n=3, x±s) |
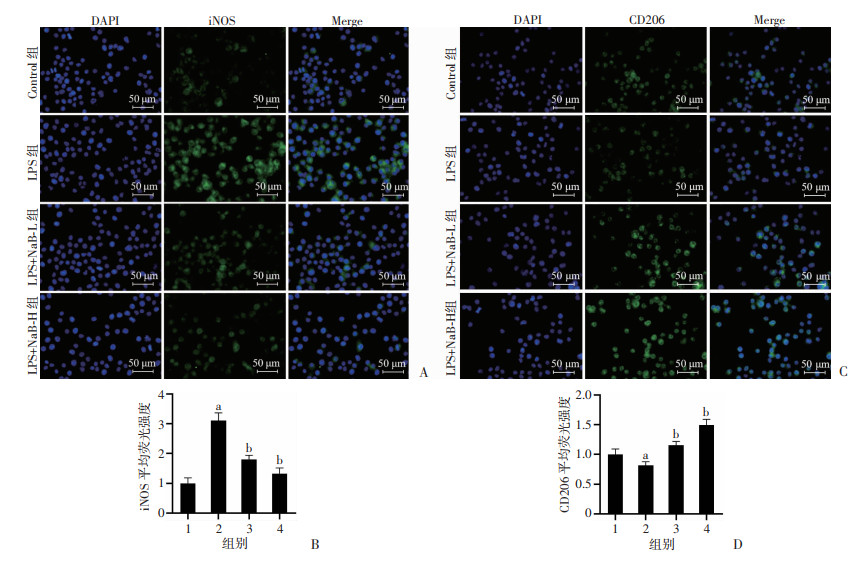
|
|
1:Control;2:LPS;3:LPS+NaB-L;4:LPS+NaB-H;a: P < 0.05,与Control组比较; b: P < 0.05,与LPS组比较 A: 免疫荧光检测iNOS蛋白表达;B: 半定量分析iNOS蛋白平均荧光强度;C: 免疫荧光检测CD206蛋白表达;D: 半定量分析CD206蛋白平均荧光强度 图 4 免疫荧光检测各组BV2细胞iNOS和CD206蛋白表达水平(n=3, x±s) |
2.4 NaB对LPS诱导的BV2细胞TLR4/NF-κB信号通路的影响
提取各组细胞全蛋白,采用Western blot检测TLR4、NF-κB p65、IKB-α和p-IKB-α的表达。与Control组相比,LPS刺激后各组TLR4和NF-κB p65的蛋白表达显著上升,差异有统计学意义(P < 0.05,图 5A~C);与LPS组相比,高、低剂量NaB组TLR4表达均受到抑制,差异有统计学意义(P < 0.05,图 5A、B);与LPS组相比,高、低剂量NF-κB p65表达均受到抑制,差异有统计学意义(P < 0.05,图 5A、C)。同时测定了IKB-α蛋白的磷酸化程度,结果显示,与正常对照组相比,LPS刺激后p-IKB-α蛋白表达显著提高,差异有统计学意义(P < 0.05,图 5A、D);与LPS组相比,高、低剂量NaB组抑制了BV2细胞内IKB-α的磷酸化,差异有统计学意义(P < 0.05,图 5A、D)。由此可见,NaB抑制LPS诱导的BV2细胞炎症反应可能是通过TLR4/ NF-κB信号通路实现的。
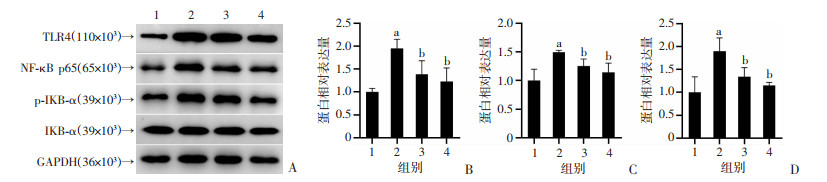
|
|
1:Control;2:LPS;3:LPS+NaB-L;4:LPS+NaB-H;a: P < 0.05,与Control比较;b: P < 0.05,与LPS组比较 A: Western blot检测TLR4、NF-κB p65和p-IKB-α蛋白表达;B~D: 分别为TLR4、NF-κB p65和p-IKB-α蛋白半定量分析 图 5 Western blot检测各组BV2细胞TLR4/NF-κB信号通路蛋白表达(n=3, x±s) |
2.5 NaB对LPS诱导的BV2细胞NF-κB p65核转位的影响
分离胞浆和胞核蛋白,采用Western blot检测NF-κB p65的核转位情况。与Control组相比,LPS刺激后各组NF-κB p65核转位明显增加,差异有统计学意义(P < 0.05);与LPS组相比,高、低剂量NaB组NF-κB p65核蛋白表达明显降低,差异有统计学意义(P < 0.05,图 6)。由此可见,NaB抑制了LPS诱导的BV2细胞NF-κB p65的核转位。
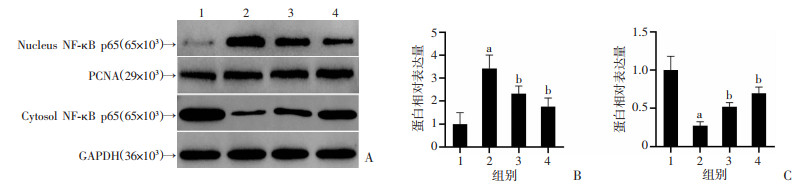
|
|
1:Control;2:LPS;3:LPS+NaB-L;4:LPS+NaB-H;a: P < 0.05,与Control组比较;b: P < 0.05,与LPS组比较 A: Western blot检测胞浆和胞质NF-κB p65蛋白表达;B、C: 分别为胞核和胞浆NF-κB p65蛋白半定量分析 图 6 Western blot检测各组BV2细胞NF-κB p65核转位的水平(n=3, x±s) |
3 讨论
神经炎症对缺血性卒中、创伤性脊髓损伤和阿尔茨海默病等CNS疾病过程的多个阶段的发生和发展具有重要影响[17-18]。过度神经炎症可加剧神经细胞和组织损害,使得病理状况恶化,这些都与神经元损伤程度和功能障碍预后密切相关。因此,长期以来如何控制神经炎症都是CNS退行性病变和创伤性损伤疾病的治疗重点[19]。小胶质细胞作为CNS的常驻免疫细胞,是神经炎症的关键参与者[20]。M1表型小胶质细胞分泌如NO、IL-1β和TNF-α等促炎细胞因子,加剧炎症反应;而M2型可分泌IL-4、IL-10等抗炎细胞因子,减轻神经炎症反应。因此,调控小胶质细胞向M2型转化可能是抑制神经炎症的潜在治疗策略。
胃肠道作为人体内最大的免疫器官,约含1014个细菌,数量与人体细胞总数相当[21]。肠道菌群因此也被认为是“第二基因组”,在机体的病理生理过程中发挥着重要作用[22-24]。随着宏基因组学与代谢组学的发展,肠脑轴作为连接胃肠道和CNS的双向交流通道,其内在机制不断被揭示。研究表明,脑卒中、阿尔茨海默病和多发性硬化等CNS疾病的发生通常伴有肠道菌群失调,而紊乱的肠道菌群又参与疾病的炎症反应,加重原发性损伤[25-27]。通过药物或粪菌移植等方式重塑紊乱的肠道菌群则可改善上述的疾病转归,其恢复程度可能与肠道菌群重塑后短链脂肪酸的含量相关[16, 28-30]。此外,YU等[31]发现胸段完全性脊髓损伤患者肠道产短链脂肪酸的拟杆菌门水平降低。在脊髓损伤小鼠粪便中发现的丁酸含量较假手术组下降了58.6%,而粪菌移植后丁酸含量上调了46.7%,较其他短链脂肪酸的含量变化最大,且与运动功能的恢复程度呈正相关[32]。这些研究提示NaB可能是胃肠道与CNS“串话”的关键介质,直接穿过血脑屏障调节CNS的发育和功能[11, 33]。但NaB能否作用于CNS的小胶质细胞发挥抗炎作用尚不清楚。
本研究首先使用CCK-8筛选NaB药物浓度范围,以确定用于BV2细胞的适宜浓度。CCK-8结果显示,0.125 mmol/L的NaB增加了BV2细胞活力,这可能归因于NaB作为去乙酰化酶抑制剂上调了BV2细胞存活和增殖相关的基因,或促进了BV2细胞自噬以加速其重组再生提高了细胞活力[34-35]。LPS来源于革兰阴性菌,是炎症和免疫反应的强刺激剂,同时LPS诱导的BV2细胞是研究小胶质细胞M1/M2表型转化的常用细胞模型[36]。本研究通过LPS刺激BV2细胞建立神经炎症模型,证实NaB显著降低了BV2细胞NO、IL-1β和TNF-α的分泌水平,增加了IL-10的分泌水平。基因的变化往往伴随着相应的蛋白变化,本研究结果表明,NaB可抑制M1表型标志物iNOS蛋白和基因的表达,增加M2型标志物CD206蛋白和基因的表达,促进LPS诱导的BV2细胞由M1表型向M2表型转化。其中iNOS作为BV2细胞内NO合成酶与NO的分泌密切相关,正常的生理条件下NO是CNS重要的第二信使,在神经系统的细胞内通讯和细胞内信号传导中起着至关重要的作用;而过量的NO生成会直接导致轴突变性,激活环氧合酶来加剧CNS疾病的神经炎症[4]。因此,NaB的抗炎作用可能与LPS诱导后的BV2细胞M1/M2的表型调控相关。
研究表明,LPS诱导激活Toll样受体(TLR4),其实质上是激活NF-κB信号通路,加快了炎症基因的转录[37]。正常状态下NF-κB处于非活性形式,与细胞质内的抑制剂IKB-α结合形成二聚体;而受到炎症刺激后,IKB-α蛋白发生磷酸化和降解,释放出NF-κB转移至细胞核内,参与IL-1β、IL-6和TNF-α等几种炎症因子的表达。同时,这些炎症因子又参与调节TLR-4/NF-κB信号通路,从而形成反馈环,共同参与神经炎症的病理学[38]。实验结果表明,LPS刺激BV2细胞后TLR4、NF-κB的转录水平、IKB-α蛋白的磷酸化水平均显著上升;同时促进了BV2细胞NF-κB p65核转位,激活NF-κB下游炎症通路。而NaB能够显著抑制IKB-α蛋白的磷酸化,降低TLR4和NF-κB的转录水平,抑制LPS诱导的BV2细胞NF-κB p65核转位,以此实现对NF-κB下游信号通路的抑制。
综上所述,NaB能促进LPS诱导的BV2细胞由M1表型向M2表型极化,抑制细胞炎症因子释放,减轻神经炎症反应,其具体分子机制可能与TLR4/NF-κB信号通路被抑制有关。表明NaB在细胞水平上具有神经保护作用,对BV2细胞介导的神经炎症具有潜在价值;该研究丰富了肠-脑轴理论研究中肠道代谢物调控CNS疾病的理论依据,为肠道菌群代谢产物治疗CNS疾病的深入研究和临床应用提供参考。但本研究仍具有一定的局限性,如仅在细胞层面探讨NaB的抗炎作用,尚未明确NaB在体内实验中是否也能通过调控小胶质细胞表型极化来发挥抗炎功效,以及NaB对CNS其他神经细胞是否也具有一致的抗炎作用。未来将在动物体内进一步探索NaB对神经炎症的调控作用和机制。
| [1] |
WANG X L, CHEN F, SHI H, et al. Oxymatrine inhibits neuroinflammation by regulating M1/M2 polarization in N9 microglia through the TLR4/NF-κB pathway[J]. Int Immunopharmacol, 2021, 100: 108139. |
| [2] |
NAYAK D, ROTH T L, MCGAVERN D B. Microglia development and function[J]. Annu Rev Immunol, 2014, 32: 367-402. |
| [3] |
SANJAY, PARK M, LEE H J. Roles of fatty acids in microglial polarization: evidence from in vitro and in vivo studies on neurodegenerative diseases[J]. Int J Mol Sci, 2022, 23(13): 7300. |
| [4] |
LANG G P, LI C, HAN Y Y. Rutin pretreatment promotes microglial M1 to M2 phenotype polarization[J]. Neural Regen Res, 2021, 16(12): 2499-2504. |
| [5] |
ZHANG H, LU M Y, ZHANG X F, et al. Isosteviol sodium protects against ischemic stroke by modulating microglia/macrophage polarization via disruption of GAS5/miR-146a-5p sponge[J]. Sci Rep, 2019, 9(1): 12221. |
| [6] |
GAO Y Y, TAO T, WU D, et al. MFG-E8 attenuates inflammation in subarachnoid hemorrhage by driving microglial M2 polarization[J]. Exp Neurol, 2021, 336: 113532. |
| [7] |
HU H, LU X, HUANG L, et al. Castor1 overexpression regulates microglia M1/M2 polarization via inhibiting mTOR pathway[J]. Metab Brain Dis, 2022, 38(2): 699-708. |
| [8] |
ROSHANRAVAN N, ALAMDARI N M, JAFARABADI M A, et al. Effects of oral butyrate and inulin supplementation on inflammation-induced pyroptosis pathway in type 2 diabetes: a randomized, double-blind, placebo-controlled trial[J]. Cytokine, 2020, 131: 155101. |
| [9] |
BLACHER E, LEVY M, TATIROVSKY E, et al. Microbiome-modulated metabolites at the interface of host immunity[J]. J Immunol, 2017, 198(2): 572-580. |
| [10] |
HOU Y C, LI X Q, LIU C, et al. Neuroprotective effects of short-chain fatty acids in MPTP induced mice model of Parkinson's disease[J]. Exp Gerontol, 2021, 150: 111376. |
| [11] |
ROOKS M G, GARRETT W S. Gut microbiota, metabolites and host immunity[J]. Nat Rev Immunol, 2016, 16(6): 341-352. |
| [12] |
ZHOU Z H, XU N B, MATEI N, et al. Sodium butyrate attenuated neuronal apoptosis via GPR41/Gβγ/PI3K/Akt pathway after MCAO in rats[J]. J Cereb Blood Flow Metab, 2021, 41(2): 267-281. |
| [13] |
IM H, JU I G, KIM J H, et al. Trichosanthis Semen and zingiberis rhizoma mixture ameliorates lipopolysaccharide-induced memory dysfunction by inhibiting neuroinflammation[J]. Int J Mol Sci, 2022, 23(22): 14015. |
| [14] |
HUUSKONEN J, SUURONEN T, NUUTINEN T, et al. Regulation of microglial inflammatory response by sodium butyrate and short-chain fatty acids[J]. Br J Pharmacol, 2004, 141(5): 874-880. |
| [15] |
王正东, 黄娜, 陈婧娴, 等. 丁酸钠抑制氟中毒可诱导小胶质细胞活化及炎症因子表达增多[J]. 中国组织工程研究, 2021, 25(7): 1075-1080. WANG Z D, HUANG N, CHEN J X, et al. Inhibitory effects of sodium butyrate on microglial activation and expression of inflammatory factors induced by fluorosis[J]. Chin J Tissue Eng Res, 2021, 25(7): 1075-1080. |
| [16] |
HE N, SHEN G R, JIN X Q, et al. Resveratrol suppresses microglial activation and promotes functional recovery of traumatic spinal cord via improving intestinal microbiota[J]. Pharmacol Res, 2022, 183: 106377. |
| [17] |
MENG H L, LI X X, CHEN Y T, et al. Neuronal soluble fas ligand drives M1-microglia polarization after cerebral ischemia[J]. CNS Neurosci Ther, 2016, 22(9): 771-781. |
| [18] |
杨二万, 田志成, 张卓媛, 等. PSD-95/nNOS/CAPON复合体在重复轻型颅脑损伤致神经退行性变中的作用[J]. 空军军医大学学报, 2022(8): 957-962. YANG E W, TIAN Z C, ZHANG Z Y, et al. Role of PSD-95/nNOS/CAPON complex in neurodegeneration induced by repeated mild traumatic brain injury[J]. J Air Force Med Univ, 2022(8): 957-962. |
| [19] |
VOET S, SRINIVASAN S, LAMKANFI M, et al. Inflammasomes in neuroinflammatory and neurodegenerative diseases[J]. EMBO Mol Med, 2019, 11(6): e10248. |
| [20] |
井紫薇, 樊钊, 李光耀, 等. miR-125a-5p通过靶向HIF1AN调控HIF-1α参与小胶质细胞活化[J]. 空军军医大学学报, 2023(4): 311-316, 322. JING Z W, FAN Z, LI G Y, et al. miR-125a-5p is involved in microglial activation by regulating HIF-1αthrough targeting HIF1AN[J]. J Air Force Med Univ, 2023(4): 311-316, 322. |
| [21] |
BOESCH M, BATY F, ROTHSCHILD S I, et al. Tumour neoantigen mimicry by microbial species in cancer immunotherapy[J]. Br J Cancer, 2021, 125(3): 313-323. |
| [22] |
LIU B Y, CHEN B W, YI J, et al. Liuwei Dihuang Decoction alleviates cognitive dysfunction in mice with D-galactose-induced aging by regulating lipid metabolism and oxidative stress via the microbiota-gut-brain axis[J]. Front Neurosci, 2022, 16: 949298. |
| [23] |
PENG J E, LU X R, XIE K L, et al. Dynamic alterations in the gut microbiota of collagen-induced arthritis rats following the prolonged administration of total glucosides of paeony[J]. Front Cell Infect Microbiol, 2019, 9: 204. |
| [24] |
QIN J J, LI R Q, RAES J, et al. A human gut microbial gene catalogue established by metagenomic sequencing[J]. Nature, 2010, 464(7285): 59-65. |
| [25] |
BORSOM E M, CONN K, KEEFE C R, et al. Predicting neurodegenerative disease using prepathology gut microbiota composition: a longitudinal study in mice modeling Alzheimer's disease pathologies[J]. Microbiol Spectr, 2023, e0345822. |
| [26] |
LIAN Z S, XU Y, WANG C, et al. Gut microbiota-derived melatonin from Puerariae Lobatae Radix-resistant starch supplementation attenuates ischemic stroke injury via a positive microbial co-occurrence pattern[J]. Pharmacol Res, 2023, 190: 106714. |
| [27] |
THIRION F, SELLEBJERG F, FAN Y, et al. The gut microbiota in multiple sclerosis varies with disease activity[J]. Genome Med, 2023, 15(1): 1. |
| [28] |
LIU J F, ZHANG T H, WANG Y Y, et al. Baicalin ameliorates neuropathology in repeated cerebral ischemia-reperfusion injury model mice by remodeling the gut microbiota[J]. Aging (Albany NY), 2020, 12(4): 3791-3806. |
| [29] |
ZHANG P P, ZHANG X J, HUANG Y X, et al. Atorvastatin alleviates microglia-mediated neuroinflammation via modulating the microbial composition and the intestinal barrier function in ischemic stroke mice[J]. Free Radic Biol Med, 2021, 162: 104-117. |
| [30] |
ZHAO W B, WANG J H, LATTA M, et al. Rhizoma gastrodiae water extract modulates the gut microbiota and pathological changes of P-TauThr231 to protect against cognitive impairment in mice[J]. Front Pharmacol, 2022, 13: 903659. |
| [31] |
YU B B, QIU H D, CHENG S P, et al. Profile of gut microbiota in patients with traumatic thoracic spinal cord injury and its clinical implications: a case-control study in a rehabilitation setting[J]. Bioengineered, 2021, 12(1): 4489-4499. |
| [32] |
JING Y L, YU Y, BAI F, et al. Effect of fecal microbiota transplantation on neurological restoration in a spinal cord injury mouse model: involvement of brain-gut axis[J]. Microbiome, 2021, 9(1): 59. |
| [33] |
DALILE B, VAN OUDENHOVE L, VERVLIET B, et al. The role of short-chain fatty acids in microbiota-gut-brain communication[J]. Nat Rev Gastroenterol Hepatol, 2019, 16(8): 461-478. |
| [34] |
LUO S L, LI Z Y, MAO L Z, et al. Sodium butyrate induces autophagy in colorectal cancer cells through LKB1/AMPK signaling[J]. J Physiol Biochem, 2019, 75(1): 53-63. |
| [35] |
PARK J, THOMAS S, MUNSTER P N. Epigenetic modulation with histone deacetylase inhibitors in combination with immunotherapy[J]. Epigenomics, 2015, 7(4): 641-652. |
| [36] |
LI J P, DAI X P, ZHOU L Y, et al. Edaravone plays protective effects on LPS-induced microglia by switching M1/M2 phenotypes and regulating NLRP3 inflammasome activation[J]. Front Pharmacol, 2021, 12: 691773. |
| [37] |
JANPAIJIT S, LERTPATIPANPONG P, SILLAPACHAIYA-PORN C, et al. Anti-neuroinflammatory effects of Cleistocalyx nervosum var. paniala berry-seed extract in BV-2 microglial cells via inhibition of MAPKs/NF-κB signaling pathway[J]. Heliyon, 2022, 8(11): e11869. |
| [38] |
NAPETSCHNIG J, WU H. Molecular basis of NF-kappaB signaling[J]. Annu Rev Biophys, 2013, 42: 443-468. |




