随着社会人口老龄化程度进一步加深、群众健身运动意识增强,以跟腱断裂、前交叉韧带损伤、肩袖损伤为代表的肌腱病发病率逐渐增高[1-2]。肌腱病主要表现为疼痛、功能受限、运动能力下降,常需要手术治疗,严重影响患者的生活质量[3-4]。机械拉伸应力被认为是导致肌腱病的重要外界因素之一。解剖上,肌腱组织主要承受循环拉伸应力[5]。病理学研究证实,肌腱过度、重复的轴向拉伸使用导致了肌腱细胞的过度凋亡[6-7]。然而,机械拉伸应力如何介导肌腱细胞凋亡,目前尚不清楚。Piezo1是新近发现的机械敏感离子通道蛋白[8-9]。Piezo1参与细胞对外部机械刺激包括压缩、拉伸、重力、流体剪切的反应,可通过增强钙离子(Ca2+)内流和改变细胞内钙信号,帮助细胞将机械信号转化为生物信号,进而参与调节发育、肿瘤发生、骨重塑等多种细胞生命进程[10-11]。Piezo1广泛分布于全身多个组织,且已被证实在肌腱组织中表达[12-13]。多项研究表明,Piezo1可以介导过度机械应力导致的细胞凋亡[14-17],因此本研究推测机械拉伸应力诱导肌腱细胞凋亡可能由Piezo1介导。
为验证假设,本研究分离小鼠肌腱细胞并进行培养,使用细胞牵张拉伸应力加载系统刺激肌腱细胞检测细胞凋亡水平,并检测机械拉伸应力作用下的肌腱细胞中Piezo1的表达和激活状态。而后利用Piezo1激动剂、抑制剂和Piezo1敲低病毒阐明机械拉伸应力诱导肌腱细胞凋亡的机制,验证Piezo1对机械拉伸应力诱导肌腱细胞凋亡的影响,有助于更好地理解肌腱病中Piezo1、机械拉伸应力和肌腱细胞凋亡之间的关系,为肌腱病治疗提供新的靶点。
1 材料与方法 1.1 实验动物8周龄雄性C57小鼠共20只,体质量22~26 g,由陆军军医大学实验动物中心提供。动物实验伦理批准由陆军军医大学实验动物福利伦理委员会提供(AMUWE20210782)。
1.2 小鼠肌腱细胞提取的分离培养小鼠肌腱细胞的分离培养根据参考文献[18]进行。小鼠腹腔注射过量戊巴比妥钠(150 mg/kg)处死。肌腱组织在无菌条件下分离,用眼科剪剪成约1 mm3的碎片。组织用0.4%Ⅰ型胶原酶和0.01%透明质酸酶V型在37 ℃下消化90 min。用70 μm细胞过滤器去除组织碎片,400×g离心5 min,弃上清。用含有DMEM/F-12培养基(中国普诺赛公司)和10%胎牛血清(中国四季青公司)、1%青霉素/链霉素双抗(中国碧云天公司)的完全培养基重新悬浮沉淀物。细胞在含5% CO2的37 ℃细胞培养箱中培养。每3天更换1次培养基,当融合度达到80%~90%时传代,第3代肌腱细胞被用于后续实验。
1.3 机械拉伸应力干预肌腱细胞接种于Bioflex拉伸6孔板(美国Flexcell公司),细胞融合率达到80%~90%时,使用Flex-Cell 5000张力系统(美国Flexcell公司)诱导机械拉伸。机械拉伸的参数选择为0.5 Hz,拉伸形变量5%~20%[19]。拉伸36 h后,收集肌腱细胞用于后续测试。
1.4 Piezo1的激动剂、抑制剂干预肌腱细胞分为20%拉伸组、20%拉伸+Yoda1组、20%拉伸+GsMTx4组,使用DMSO配置0.5 μmol/L的Piezo1激动剂Yoda1 (美国MCE公司)而后添加于肌腱细胞中以激活Piezo1,使用DMSO配置0.1 μmol/L的Piezo1抑制剂GsMTx4 (美国MCE公司)添加于肌腱细胞中以抑制Piezo1。20%拉伸组添加DMSO处理。
1.5 慢病毒及siRNA干扰Piezo1及Calpain2表达肌腱细胞分为20%拉伸组、20%拉伸+ Lv-Piezo1组及20%拉伸+Lv-Ctrl组,Piezo1 shRNA慢病毒表达载体Lv-Piezo1及对照慢病毒载体Lv-ctrl购于上海和元生物公司。肌腱细胞采用无血清培养基培养24 h,分别加入Lv-Piezo1或Lv-ctrl,感染复数(multipe of infection,MOI)为20,然后在肌腱细胞中加入新鲜培养基。肌腱细胞分为20%拉伸组、20%拉伸+si-Calpain2组、20%拉伸+si-Ctrl组。siRNA-Calpain2及siRNA-Ctrl购自美国Santa Cruz公司。siRNA敲除实验根据说明书进行标准操作,Lipofectamine 2000 (美国Invitrogen公司)用于siRNA的转染。
1.6 流式细胞仪检测细胞凋亡用0.05%EDTA胰蛋白酶(美国HyClone公司)消化肌腱细胞。随后,使用Annexin V-PE/7-AAD凋亡检测试剂盒(中国碧云天公司)进行标准染色。用流式细胞仪进行检测。Annexin V-PE +/7-AAD-和Annexin V-PE +/7-AAD +细胞被认为是凋亡细胞。计数凋亡细胞发生比例。
1.7 线粒体膜电位(mitochondria membrane potential,MMP)测定采用MitoTracker Red Chloromethyl-X-rosamine(CMXRos)试剂盒(中国碧云天公司)检测肌腱细胞的线粒体膜电位。根据试剂制造商的说明书配置MitoTracker工作溶液,在37 ℃黑暗环境中孵育30 min。细胞核用Hoechst 33342(中国碧云天公司)进行染色。用荧光显微镜(德国ZEISS公司)观察荧光强度。
1.8 钙离子内流检测细胞内钙离子浓度用Cal-520钙离子荧光探针(中国百萤生物公司)测定。肌腱细胞置于含有0.02% Pluronic F-127 (中国索莱宝公司)和1 mmol/L Probenecid (中国索莱宝公司)的Hanks平衡盐溶液中,在37 ℃的黑暗环境中,使用5 μmol/L的Cal-520孵育1 h,然后用PBS清洗3次。细胞核用Hoechst 33342(中国碧云天公司)进行染色。用荧光显微镜(德国ZEISS公司)观察荧光强度。
1.9 Western blot实验使用RIPA裂解缓冲液(中国碧云天公司)裂解肌腱细胞,用BCA测定试剂盒(中国碧云天公司)测定蛋白浓度。在裂解液中加入1/5体积的加载缓冲液,然后将样品置于沸水中10 min。蛋白质通过SDS-PAGE分离并转移到PVDF膜上。用5%脱脂牛奶阻断PVDF膜1 h,添加一抗置于4 ℃孵育过夜。一抗包括兔抗小鼠Calpain2(中国Proteintech公司)、BAX(中国Proteintech公司)、cleaved-Caspase3(美国Abcam公司)、Piezo1(中国Proteintech公司)和β-actin(中国Proteintech公司)。用TBST清洗PVDF膜,然后用二抗孵育1 h。二抗为山羊抗兔IgG(H+L)HRP(中国Absin公司)。目的蛋白表达采用ChemiDoc成像系统(美国Bio-Rad公司)检测,所有结果使用β-actin进行归一化处理。
1.10 统计学分析每个实验至少重复3次。使用GraphPad Prism 9.0软件进行统计分析。数据均以x±s表示。两组比较采用t检验。采用单因素方差分析和Bonferroni事后检验(post-hoc test)对多个组间的比较进行评估。P < 0.05为差异有统计学意义。
2 结果 2.1 机械拉伸应力可以诱导肌腱细胞凋亡使用Flexcell-5000张力系统对小鼠肌腱细胞施加逐渐递增的拉伸应力。流式结果显示,肌腱细胞凋亡百分比随着拉伸程度的增加而显著增加,在拉伸20%凋亡水平高于其余拉力参数下的凋亡水平(P < 0.05,图 1A、C)。MMP测定结果显示,随着拉伸程度的增加,MMP强度逐渐下降(P < 0.05,图 1B、D)。这些结果表明机械拉伸应力可以诱导肌腱细胞的凋亡。20%的拉伸诱导细胞凋亡最为明显,被用于后续实验。
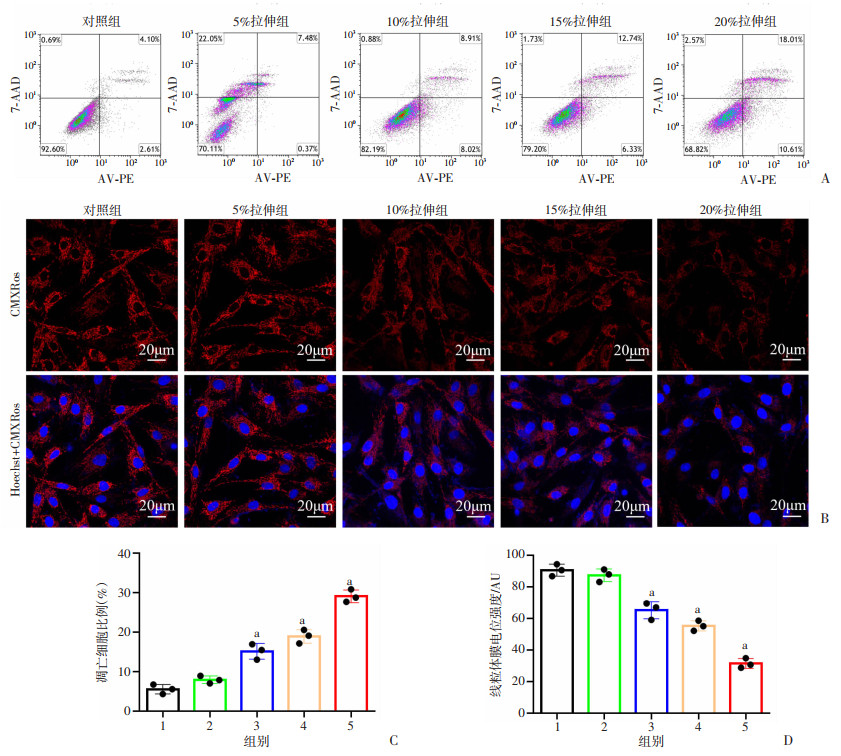
|
| A:肌腱细胞凋亡的流式细胞图;B:肌腱细胞MMP的CMXRos荧光染色观察CMXRos呈红色,核呈蓝色;C:凋亡肌腱细胞比例统计分析;D:MMP平均荧光强度的统计分析1: 对照组;2:5%拉伸组;3:10%拉伸组;4:15%拉伸组;5:20%拉伸组;a: P < 0.05,与对照组比较 图 1 机械拉伸应力对体外培养的肌腱细胞凋亡的影响(n=3) |
2.2 机械拉伸应力可以激活肌腱细胞的Piezo1表达
Western blot结果显示,机械拉伸应力作用下,肌腱细胞中Piezo1蛋白的表达水平上调(P < 0.05,图 2A、B)。钙离子荧光探针检测结果显示,机械拉伸应力促进了肌腱细胞中钙离子内流(P < 0.05,图 2C、D)。结果表明,机械拉伸应力可以激活体外培养的肌腱细胞中的Piezo1的表达。
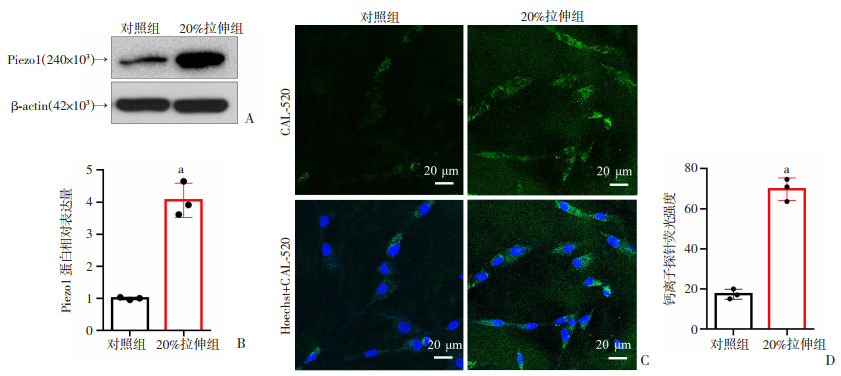
|
| A、B:Western blot检测机械拉伸应力下肌腱细胞中Piezo1表达及统计结果;C、D:CAL-520染色检测Ca2+内流及统计分析绿色:Cal-520;蓝色:核;a: P < 0.05,与对照组比较 图 2 机械拉伸应力对肌腱细胞中Piezo1表达的影响(n=3) |
2.3 机械拉伸应力通过Piezo1激活调控肌腱细胞的凋亡
为进一步探讨Piezo1在肌腱细胞凋亡中的作用机制,分别在机械拉伸应力下的肌腱细胞中添加0.5 μmol/L Yoda1和0.1 μmol/L GsMTx4。流式细胞仪分析显示,Yoda1可以增强肌腱细胞凋亡,GsMTx4则减轻肌腱细胞凋亡(P < 0.05,图 3A、B)。MMP免疫荧光染色结果显示,Yoda1加剧了机械拉伸应力刺激下MMP强度的降低,而GsMTx4导致MMP强度增强(P < 0.05,图 3C、D)。结果表明,机械拉伸应力下Piezo1的激活状态与肌腱细胞凋亡有关。

|
| A、B:Yoda1及GsMTx4作用下肌腱细胞凋亡的流式细胞图及统计分析;C、D:Yoda1及GsMTx4作用下肌腱细胞MMP的CMXRos荧光染色观察及统计分析红色: CMXRos,蓝色: 核;a: P < 0.05,与20%拉伸组比较;b: P < 0.05,与20%拉伸+Yoda1组比较;1:20%拉伸组;2:20%拉伸+LV-Piezo1组;3:20%拉伸+Lv-Ctrl组 图 3 Yoda1及GsMTx4对机械拉伸应力诱导的肌腱细胞凋亡的影响(n=3) |
2.4 敲除Piezo1可以减少机械拉伸应力下肌腱细胞的凋亡
为进一步证实Piezo1在机械拉伸应力诱导的肌腱细胞凋亡中的作用,使用Lv-Piezo1敲低Piezo1的表达。结果显示20%拉伸+Lv-Piezo1组的肌腱细胞凋亡率低于20%拉伸+Lv-Ctrl组和20%拉伸应力组(P < 0.05,图 4A、B),敲除Piezo1可以缓解机械拉伸应力导致的肌腱细胞中MMP强度的降低(P < 0.05,图 4C、D)。结果进一步表明,Piezo1介导了机械拉伸应力刺激下肌腱细胞的凋亡。
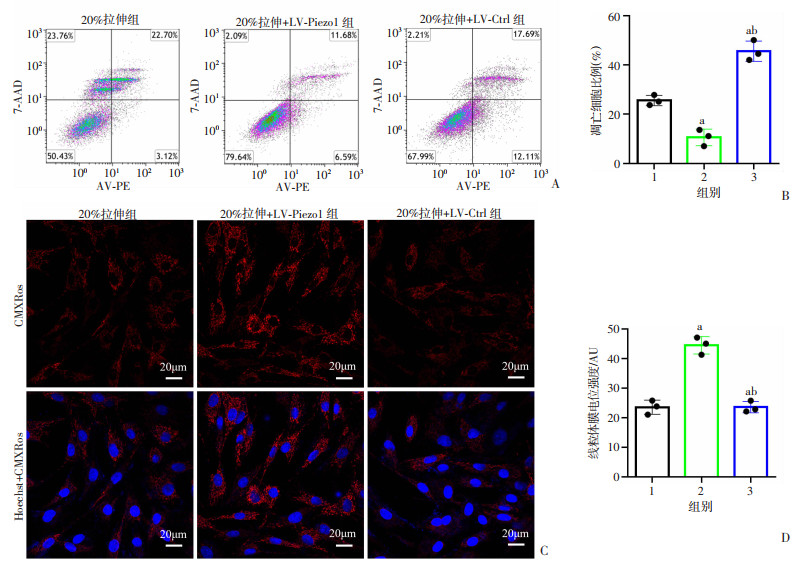
|
| A、B:肌腱细胞凋亡的流式细胞图及统计分析;C、D:肌腱细胞MMP的CMXRos荧光染色观察及统计分析红色:CMRos;蓝色:核;a: P < 0.05,与20%拉伸组比较;b: P < 0.05,与20%拉伸+Lv-Piezo1组比较;1:20%拉伸组;2:20%拉伸+LV-Piezo1组;3:20%拉伸+Lv-Ctrl组 图 4 敲除Piezo1对机械拉伸应力诱导的肌腱细胞凋亡的影响(n=3) |
2.5 Piezo1促进肌腱细胞凋亡涉及Calpain2/BAX/Caspase3的激活
探讨Piezo1介导肌腱细胞凋亡的下游机制。Piezo1激活的钙离子信号通路可诱导下游钙离子的活化,其与细胞凋亡密切相关。Western blot结果显示,机械拉伸应力处理后Calpain2及下游BAX、cleaved-Caspase3的表达均升高,Lv-Piezo1处理后则下降(P < 0.05,图 5)。
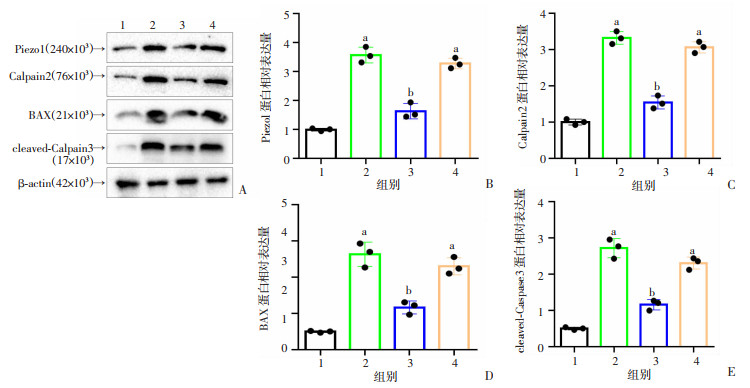
|
| A: Western blot检测肌腱细胞Piezo1、Calpain2、BAX、cleave-Caspase3表达;B~E:各蛋白表达的统计分析a: P < 0.05,与对照组比较;b: P < 0.05,与20%拉伸组比较;1:对照组;2:20%拉伸组;3:20%拉伸+LV-Piezo1组;4:20%拉伸+Lv-Ctrl组 图 5 Piezo1对肌腱细胞凋亡相关蛋白表达的影响(n=3) |
2.6 敲低Calpain2下调BAX/Caspase3表达,抑制机械应力导致的肌腱细胞凋亡
使用si-Calpain2干扰机械拉伸应力下肌腱细胞中的Calpain2表达。Western blot结果显示,si-Calpain2处理后,BAX和cleaved-Caspase3的表达下调(P < 0.05,图 6A~C)。si-Calpain2处理后肌腱细胞凋亡受到抑制(P < 0.05,图 6D~G)。上述结果表明,机械拉伸应力通过激活Piezo1和Calpain2/BAX/Caspase3通路促进肌腱细胞凋亡。
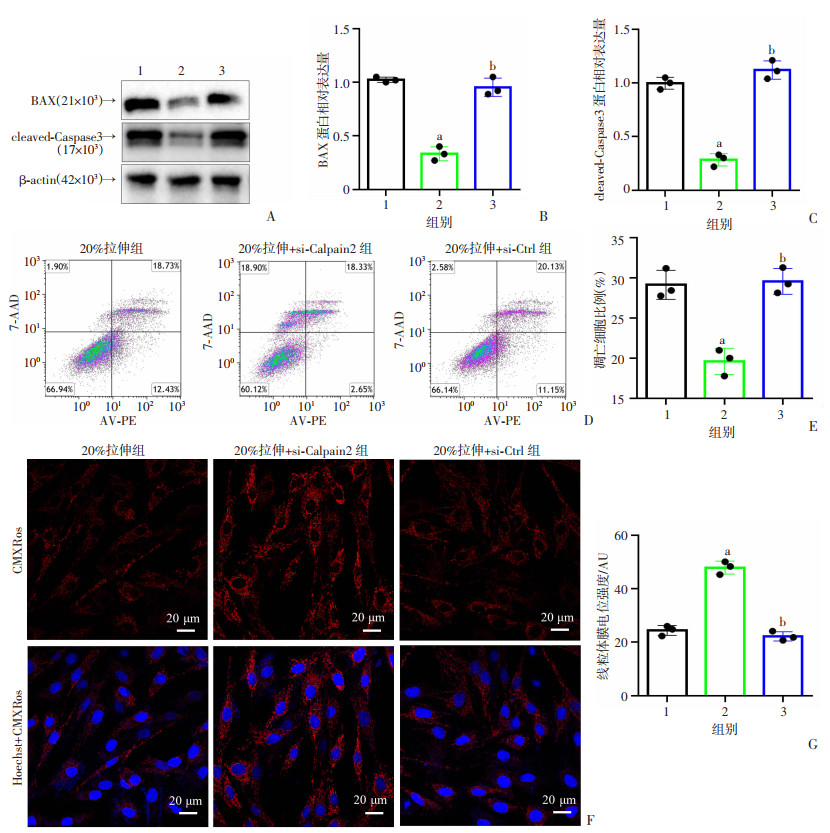
|
| A~C:Western blot检测肌腱细胞BAX、cleaved-Caspase3表达及统计分析;D、E:肌腱细胞凋亡的流式细胞图及统计分析;F、G:肌腱细胞MMP的CMXRos荧光染色观察及统计分析红色: CMXRos蓝色:核;a: P < 0.05,与20%拉伸组比较;b: P < 0.05,与20%拉伸+si-Calpain2组比较;1:20%拉伸组;2:20%拉伸+si-Calpain2组;3:20%拉伸+si-Ctrl组 图 6 敲低Calpain2对BAX/Caspase3表达和机械应力导致的肌腱细胞凋亡的影响(n=3, x±s) |
3 讨论
过度机械拉伸诱导肌腱细胞凋亡是肌腱病的诱发因素之一[19]。然而,机械拉伸促进肌腱细胞凋亡的机制尚不清楚。本研究探讨机械敏感离子通道蛋白Piezo1在机械拉伸诱导肌腱细胞凋亡中的作用,并探讨其可能的机制。本研究发现在体外培养的肌腱细胞中,机械拉伸应力引起了明显的肌腱细胞凋亡,伴Piezo1表达上调和Piezo1通道的激活。Yoda1进一步促进肌腱细胞凋亡,GsMTx4和慢病毒敲除Piezo1则抑制肌腱细胞凋亡。Piezo1可以激活下游Calpain2/BAX/Caspase3通路促进肌腱细胞凋亡。本研究揭示Piezo1在机械拉伸应力介导的肌腱细胞凋亡的作用,可能有助于未来肌腱病的临床诊疗。
Piezo1是机械敏感离子通道蛋白,可将细胞外机械刺激转化为细胞内信号。Piezo1参与软骨细胞、Ⅱ型肺泡细胞和肿瘤细胞等多种细胞的机械拉伸诱导凋亡[20-22]。因此,本研究探索Piezo1在肌腱细胞中的表达以及Piezo1是否介导了机械拉伸诱导的肌腱细胞凋亡。发现拉伸应力作用下,Piezo1在肌腱细胞中表达。通过使用Piezo1特异性激活剂Yoda1[23],发现Piezo1激活增强了机械拉伸应力诱导的肌腱细胞凋亡。机械敏性阳离子通道阻断剂GsMTx4可抑制机械拉伸应力诱导的肌腱细胞凋亡。然而,GsMTx4并不是一种特异的Piezo1抑制剂,因为它也会阻碍TRPC1和TRPC3等其他机械敏感阳离子通道的激活[24]。因此,通过Lv-Piezo1转染实现Piezo1的敲除,并发现Piezo1敲除抑制了机械拉伸应力诱导的肌腱细胞凋亡。这些结果证明Piezo1激活是机械拉伸应力诱导肌腱细胞凋亡的关键环节。
进一步研究由Piezo1激活刺激的下游细胞内信号。Piezo1激活通过促进Ca2+内流和改变后续细胞内钙信号,帮助细胞将机械信号转化为生物信号,从而引发一系列细胞生物学过程[25-26]。Ca2+在真核生物信号转导中作为第二信使发挥核心作用。细胞内游离Ca2+浓度维持在较细胞外液低的水平。而Ca2+超载与所有3种凋亡途径相关,即内在凋亡途径(线粒体途径)、外在凋亡途径(死亡受体途径)和内质网途径[27-28]。Calpain是特殊的Ca2+激活的非溶酶体半胱氨酸蛋白酶,与Ca2+介导的凋亡密切相关,可通过激活BAX在内的凋亡因子,启动Caspase级联反应,加速细胞凋亡[29-32]。钙蛋白酶的活性受到细胞内Ca2+浓度的严格调控。Calpain与机械力刺激的细胞凋亡密切相关,且Calpain可在肌腱组织中表达[33]。传统的Calpain有两种亚型:Calpain1(μ-calpain)需要微摩尔级别Ca2+来激活,Calpain2(m-calpain)需要毫摩尔级别Ca2+来激活[34]。据报道,Piezo1可以通过升高的Ca2+内流激活Calpain2并介导机械信号诱发的细胞凋亡[35-36]。本研究结果发现,机械拉伸应力增强了Calpain2的表达,沉默Calpain2可以逆转Yoda1和机械拉伸应力刺激的肌腱细胞凋亡,这表明Piezo1通过Ca2+内流介导的Calpain2激活促进了肌腱细胞凋亡。为了研究Calpain2激活的下游效应,我们探索了可被Calpain2切割的BAX的表达,其可参与诱导线粒体凋亡通路[37]。结果发现,机械拉伸应力增强了BAX和cleaved-Caspase3的表达,而敲除Piezo1抑制了BAX和cleaved-Caspase3的增高。沉默Calpain2可抑制BAX和cleaved-Caspase3的表达,并抑制肌腱细胞凋亡。以上证据证明,Piezo1通过Calpain2/BAX/Caspase3途径促进肌腱细胞凋亡。
本研究亦存在局限之处:①本研究中体外施加的循环拉伸应力无法完全模拟体内的肌腱细胞受力情况,因此实验中拉伸应力刺激导致的肌腱细胞凋亡与肌腱病病理情况下肌腱细胞的凋亡并不对等;②本研究未对高水平的拉伸应力导致的肌腱细胞凋亡情况进行探究。在下一步的研究中,将结合动物实验进行Piezo1的敲低实验,以进一步明确Piezo1在肌腱病中的作用及致病机制。
综上所述,本研究探讨Piezo1在机械拉伸应力刺激肌腱细胞中的作用,验证机械拉伸应力可以通过Piezo1激活下游Calpain2/BAX/Caspase3轴来启动肌腱细胞凋亡。敲除Piezo1可以缓解肌腱细胞凋亡。Piezo1有望成为治疗肌腱病的潜在治疗靶点。
| [1] |
LIPMAN K, WANG C C, TING K, et al. Tendinopathy: injury, repair, and current exploration[J]. Drug Des Devel Ther, 2018, 12: 591-603. |
| [2] |
SCOTT A, BACKMAN L J, SPEED C. Tendinopathy: update on pathophysiology[J]. J Orthop Sports Phys Ther, 2015, 45(11): 833-841. |
| [3] |
RILEY G. Tendinopathy: from basic science to treatment[J]. Nat Clin Pract Rheumatol, 2008, 4(2): 82-89. |
| [4] |
DEAN B J F, DAKIN S G, MILLAR N L, et al. Review: emerging concepts in the pathogenesis of tendinopathy[J]. Surg, 2017, 15(6): 349-354. |
| [5] |
WANG J H C, IOSIFIDIS M I, FU F H. Biomechanical basis for tendinopathy[J]. Clin Orthop Relat Res, 2006, 443: 320-332. |
| [6] |
SCOTT A, KHAN K M, HEER J, et al. High strain mechanical loading rapidly induces tendon apoptosis: an ex vivo rat tibialis anterior model[J]. Br J Sports Med, 2005, 39(5): e25. |
| [7] |
JIANG C Y, SHAO L, WANG Q J, et al. Repetitive mechanical stretching modulates transforming growth factor-β induced collagen synthesis and apoptosis in human patellar tendon fibroblasts[J]. Biochem Cell Biol, 2012, 90(5): 667-674. |
| [8] |
SAVADIPOUR A, PALMER D, ELY E V, et al. The role of PIEZO ion channels in the musculoskeletal system[J]. Am J Physiol Cell Physiol, 2023, 324(3): C728-C740. |
| [9] |
COSTE B, MATHUR J, SCHMIDT M, et al. Piezo1 and Piezo2 are essential components of distinct mechanically activated cation channels[J]. Science, 2010, 330(6000): 55-60. |
| [10] |
QIN L, HE T L, CHEN S, et al. Roles of mechanosensitive channel Piezo1/2 proteins in skeleton and other tissues[J]. Bone Res, 2021, 9(1): 44. |
| [11] |
TANG H R, ZENG R Q, HE E D, et al. Piezo-type mechanosensitive ion channel component 1 (Piezo1): a promising therapeutic target and its modulators[J]. J Med Chem, 2022, 65(9): 6441-6453. |
| [12] |
NAKAMICHI R, MA S, NONOYAMA T, et al. The mechanosensitive ion channel PIEZO1 is expressed in tendons and regulates physical performance[J]. Sci Transl Med, 2022, 14(647): eabj5557. |
| [13] |
PASSINI F S, JAEGER P K, SAAB A S, et al. Shear-stress sensing by PIEZO1 regulates tendon stiffness in rodents and influences jumping performance in humans[J]. Nat Biomed Eng, 2021, 5(12): 1457-1471. |
| [14] |
WANG B J, KE W C, WANG K, et al. Mechanosensitive ion channel Piezo1 activated by matrix stiffness regulates oxidative stress-induced senescence and apoptosis in human intervertebral disc degeneration[J]. Oxid Med Cell Longev, 2021, 2021: 8884922. |
| [15] |
SUN Y, LENG P, GUO P C, et al. G protein coupled estrogen receptor attenuates mechanical stress-mediated apoptosis of chondrocyte in osteoarthritis via suppression of Piezo1[J]. Mol Med, 2021, 27(1): 96. |
| [16] |
SHI S, KANG X J, ZHOU Z, et al. Excessive mechanical stress-induced intervertebral disc degeneration is related to Piezo1 overexpression triggering the imbalance of autophagy /apoptosis in human nucleus pulpous[J]. Arthritis Res Ther, 2022, 24(1): 119. |
| [17] |
SONG Y, CHEN J F, ZHANG C, et al. Mechanosensitive channel Piezo1 induces cell apoptosis in pancreatic cancer by ultrasound with microbubbles[J]. Science, 2022, 25(2): 103733. |
| [18] |
CHEN C, MAO W F, WU Y F. The effects of hypoxia-reo xygenation in mouse digital flexor tendon-derived cells[J]. Oxid Med Cell Longev, 2020, 2020: 7305392. |
| [19] |
WU S, LU Q J, WANG N L, et al. Cyclic stretch induced-retinal pigment epithelial cell apoptosis and cytokine changes[J]. BMC Ophthalmol, 2017, 17(1): 208. |
| [20] |
CHEN F, SUN M T, PENG F S, et al. Compressive stress induces spinal vertebral growth plate chondrocytes apoptosis via Piezo1[J]. J Orthop Res, 2023. |
| [21] |
LIANG G P, XU J, CAO L L, et al. Piezo1 induced apoptosis of type Ⅱ pneumocytes during ARDS[J]. Respir Res, 2019, 20(1): 118. |
| [22] |
HOPE J M, LOPEZ-CAVESTANY M, WANG W J, et al. Activation of Piezo1 sensitizes cells to TRAIL-mediated apoptosis through mitochondrial outer membrane permeability[J]. Cell Death Dis, 2019, 10(11): 837. |
| [23] |
BOTELLO-SMITH W M, JIANG W J, ZHANG H, et al. A mechanism for the activation of the mechanosensitive Piezo1 channel by the small molecule Yoda1[J]. Nat Commun, 2019, 10(1): 4503. |
| [24] |
LOPEZ J R, URYASH A, FAURY G, et al. Contribution of TRPC channels to intracellular Ca2+ dyshomeostasis in smooth muscle from mdx mice[J]. Front Physiol, 2020, 11: 126. |
| [25] |
WANG S Y, LI W W, ZHANG P F, et al. Mechanical overloading induces GPX4-regulated chondrocyte ferroptosis in osteoarthritis via Piezo1 channel facilitated calcium influx[J]. J Adv Res, 2022, 41: 63-75. |
| [26] |
XIE Y H, CHEN D M, JIANG K J, et al. Hair shaft miniaturization causes stem cell depletion through mechanosensory signals mediated by a Piezo1-calcium-TNF-α axis[J]. Cell Stem Cell, 2022, 29(1): 70-85.e6. |
| [27] |
MARCHI S, PATERGNANI S, MISSIROLI S, et al. Mitochondrial and endoplasmic reticulum calcium homeostasis and cell death[J]. Cell Calcium, 2018, 69: 62-72. |
| [28] |
MATTSON M P, CHAN S L. Calcium orchestrates apoptosis[J]. Nat Cell Biol, 2003, 5(12): 1041-1043. |
| [29] |
QIU L L, PAN W, LUO D, et al. Dysregulation of BDNF/TrkB signaling mediated by NMDAR/Ca2+/calpain might contribute to postoperative cognitive dysfunction in aging mice[J]. J Neuroinflammation, 2020, 17(1): 23. |
| [30] |
ALTZNAUER F, CONUS S, CAVALLI A, et al. Calpain-1 regulates bax and subsequent smac-dependent caspase-3 activation in neutrophil apoptosis[J]. J Biol Chem, 2004, 279(7): 5947-5957. |
| [31] |
MADER J S, MOOKHERJEE N, HANCOCK R E W, et al. The human host defense peptide LL-37 induces apoptosis in a calpain- and apoptosis-inducing factor-dependent manner involving Bax activity[J]. Mol Cancer Res, 2009, 7(5): 689-702. |
| [32] |
WANG Y Y, ZHANG H, MA T, et al. Piezo1 mediates neuron oxygen-glucose deprivation/reoxygenation injury via Ca2+/calp ain signaling[J]. Biochem Biophys Res Commun, 2019, 513(1): 147-153. |
| [33] |
RUOSS S, KINDT P, OBERHOLZER L, et al. Inhibition of calpain delays early muscle atrophy after rotator cuff tendon release in sheep[J]. Physiol Rep, 2018, 6(21): e13833. |
| [34] |
GOLL D E, THOMPSON V F, LI H Q, et al. The calpain system[J]. Physiol Rev, 2003, 83(3): 731-801. |
| [35] |
TIJORE A, YAO M X, WANG Y H, et al. Selective killing of transformed cells by mechanical stretch[J]. Biomaterials, 2021, 275: 120866. |
| [36] |
TIJORE A, YANG B, SHEETZ M. Cancer cells can be killed mechanically or with combinations of cytoskeletal inhibitors[J]. Front Pharmacol, 2022, 13: 955595. |
| [37] |
OZAKI T, YAMASHITA T, ISHIGURO S I. Mitochondrial m-calpain plays a role in the release of truncated apoptosis-inducing factor from the mitochondria[J]. Biochim Biophys Acta BBA Mol Cell Res, 2009, 1793(12): 1848-1859. |




