2. 400010 重庆,重庆医科大学附属第二医院骨科
2. Department of Orthopedics, the Second Affiliated Hospital of Chongqing Medical University, Chongqing, 400010, China
骨关节炎(osteoarthritis,OA)是一种多发于中老年人群的关节疾病,常发病于膝、脊柱、髋、踝等负重大、活动多的关节,严重危害中老年人的身心健康[1-3]。OA的病理特点为关节软骨变性破坏,其中软骨细胞损伤和细胞外基质(extracellular matrix, ECM)的进行性降解是主要的病理特征[4-5]。软骨细胞外基质主要由蛋白多糖和胶原组成,其中Ⅱ型胶原(collagen Ⅱ, ColⅡ)是维持软骨组织完整性和刺激软骨细胞生长和再分化的主要功能蛋白[6]。研究表明Ⅱ型胶原表达水平的下调会加速骨关节炎的进程,因此,维持Ⅱ型胶原的正常表达对于预防和治疗骨关节炎至关重要[7-8]。
细胞自噬是一种普遍存在的细胞生存机制,通过将细胞内需要水解的细胞质大分子和衰老细胞器输送到溶酶体进行降解和循环,以维持细胞的正常稳态[9]。已有研究表明,在骨关节炎患者的损伤软骨组织中,自噬水平下调,ULK1、LC3等自噬标志物的表达降低,同时软骨细胞凋亡增加,说明自噬水平与骨关节炎的发生和发展密切相关[10]。同时,自噬作为真核细胞的一种自我修复的保护机制,正常激活可以一定程度上促进软骨合成代谢,缓解细胞焦亡,为软骨细胞的生长提供有益的微环境,缓解骨关节炎的进程[11]。
研究报道ATG5是自噬过程中的一个关键基因,它与ATG12/16L、LC3等自噬相关蛋白共同参与自噬小体的延伸,推动自噬的进程[12]。研究发现,软骨细胞特异性敲除ATG5基因会导致软骨细胞活力下降,增殖速度减慢,更多的软骨细胞死亡,细胞外基质中蛋白多糖和胶原的分解增加,Ⅱ型胶原的表达下调[13]。这些结果表明,ATG5通过调节软骨细胞的代谢和细胞外基质的合成在软骨细胞中发挥着重要的生理功能。本研究旨在探讨ATG5是否可以调控Ⅱ型胶原的表达,以及该调控过程与细胞自噬的关系,更好地理解骨关节炎的发病机制,有望为骨关节炎的临床诊疗提供一定的理论依据。
1 材料与方法 1.1 主要材料重组腺病毒Ad-siATG5及pcDNA-ATG5质粒由本实验室前期构建[14]。RPMI1640、DMEM高糖培养基、胎牛血清购自Gibco;抗体:GAPDH、CollagenⅡ、LC3B、ATG5购自武汉三鹰生物技术有限公司(Proteintech);自噬激动剂和抑制剂:雷帕霉素(Rapamycin,Rapa)(Solarbio)、巴佛洛霉素A1 (Bafilomycin A1,BafA1)(Selleck)、SYBR qPCR mix(Vazyme)、PVDF膜(Millipore)、Trizol(Thermo Scientific)、八连管(Thermo Scientific)、RIPA裂解液(强)(Beyotime)、DH5α感受态细胞(TaKaRa)、逆转录RT Master Mix (MCE)、质粒提取试剂盒(Omega)、mRFP-GFP-LC3自噬双标腺病毒(汉恒生物)、双荧光素酶报告检测试剂盒Dual-Luciferase® Reporter Assay System(Promega)。
1.2 方法 1.2.1 ATG5和COL2A1相关性的数据库分析使用Gene Expression Omnibus数据库(GEO database,https://www.ncbi.nlm.nih.gov/geo/)中的GSE10024[15]和GSE183954[16]表达矩阵数据。这些数据包含13例来自正常软骨组织样本的表达值信息。进一步分析ATG5和COL2A1的mRNA表达值之间的相关性,探究它们之间的可能关联。使用Graphpad Prism 9软件对数据进行统计分析,计算它们之间的相关系数和显著性水平。
1.2.2 细胞培养人软骨细胞C28/I2由美国纽约大学医学院刘传聚教授惠赠,293T人胚肾细胞由本实验室保存。将C28/I2细胞培养在含10%胎牛血清的培养基中,置于温度为37 ℃、5%CO2培养箱中培养,待细胞生长至85%密度时进行传代培养,用于后续实验。
1.2.3 免疫荧光C28/I2细胞贴壁生长后约85%密度时,加入胰酶消化并将细胞接种至细胞爬片,待细胞贴壁后加入Rapa作用6 h、BafA1作用24 h后加入4%多聚甲醛固定细胞,依次进行0.5% TritonX-100通透10 min,ddH2O水洗,COL2一抗4 ℃过夜(1 ∶200),ddH2O水洗,荧光二抗室温避光孵育4 h,ddH2O水洗,DAPI避光孵育5min,抗荧光衰减封片剂封片后,共聚焦显微镜下拍摄结果[17-21]。
1.2.4 自噬双荧光病毒实验C28/I2细胞贴壁生长后约85%密度时,加入胰酶消化并将细胞接种至细胞爬片,待细胞贴壁后加入自噬双标腺病毒(mRFP- GFP-LC3)感染C28/I2细胞6 h后换液,24 h后显微镜下观察到红绿荧光说明病毒感染成功,观察不同处理后LC3-GFP荧光强度,当自噬溶酶体形成后,酸性环境使GFP荧光淬灭,而mRFP荧光不受影响,自噬溶酶体呈现红色荧光。将LC3-GFP与mRFP荧光强度的比值进行统计分析,反映LC3进入自噬溶酶体的水平。
细胞分组如下。①Rapa激活软骨细胞自噬验证:Rapa激活软骨细胞自噬分为0、6、12 h组。加入Rapa (25 μmol/L)分别作用于C28/I2细胞0、6、12 h时观察LC3-GFP荧光强度[17]。②BafA1抑制软骨细胞自噬验证:BafA1抑制软骨细胞自噬分为0、12、24、36、48 h组。加入BafA1(500 nmol/L)分别作用于C28/I2细胞0、12、24、36、48 h时观察LC3-GFP荧光强度[17]。③过表达ATG5激活软骨细胞自噬:过表达ATG5与自噬激活剂、抑制剂共处理分为NC组(对照组)、pcDNA-ATG5组、pcDNA-ATG5+Rapa组、pcDNA-ATG5+BafA1组。用pcDNA-ATG5质粒转染细胞,6 h更换完全培养基后加入Rapa(25 μmol/L)处理6 h、BafA1(500 nmol/L) 处理24 h后观察LC3-GFP荧光强度[17]。④敲低ATG5抑制软骨细胞自噬:Ad-siATG5与自噬激活剂、抑制剂共处理分为NC组(对照组)、Ad-siATG5组、Ad-siATG5+ Rapa组、Ad-siATG5+BafA1组。用Ad-siATG5腺病毒感染细胞,24 h后显微镜下观察到荧光说明病毒感染成功,加入Rapa(25 μmol/L)处理6 h、BafA1(500 nmol/L) 处理24 h后观察LC3-GFP荧光强度[17]。
1.2.5 pGL3-COL2A1启动子重组质粒的构建在NCBI查询人COL2A1基因启动子序列(Gene ID:1280),根据COL2A1基因启动子区-1267→+285区间的编码序列设计引物,扩增COL2A1基因启动子,目的片段大小约为1 500 bp,琼脂糖凝胶电泳鉴定片段大小后切胶回收。将pGL3-basic载体质粒进行双酶切(MluⅠ、BgIⅡ),酶切后的pGL3-basic载体质粒为4 818 bp,将上述回收的PCR产物片段(1 500 bp)连接入线性化载体,转化涂板后挑取单克隆菌落,加LB培养基37 ℃摇床培养12~16 h,提取质粒送北京擎科生物科技有限公司进行测序验证。
1.2.6 Western blot检测相关蛋白表达接种C28/I2细胞于6孔板中,待细胞长满约85%密度时,按1.2.4细胞分组作相应处理,RIPA裂解液提取细胞蛋白,SDS-PAGE胶分离,300 mA恒流,103/min转移目的蛋白至PVDF膜,5%脱脂奶粉室温封闭2 h,anti-GAPDH(1 ∶7 500),其余一抗(1 ∶1 000)4 ℃过夜,TBST洗膜,孵育二抗羊抗兔(1 ∶10 000)室温2 h,TBST洗膜,ECL显影。
1.2.7 qPCR检测C28/I2细胞接种于6孔板中,待密度约85%时转染pcDNA-ATG5质粒,48 h后加TRIzol裂解细胞提取RNA,将RNA参照试剂盒说明书逆转录为cDNA,进行qPCR实验。COL2正义链:5'-TGGACGATCAGGCGAAACC-3',反义链:5'-GCTGCG-GATGCTCTCAATCT-3';GAPDH正义链:5'-GGAGCG-AGATCCCTCCAAAAT-3',反义链:5'-GGCTGTTGTCA-TACTTCTCATGG-3'。
1.2.8 荧光素酶活性检测293T细胞接种于12孔板,待细胞贴壁生长约70%密度时使用PEI进行转染,设置4组,每组3个复孔,分别为阴性对照组(pGL3-basic质粒:500 ng);阳性对照组(pGL3-control质粒:500 ng);COL2A1组(pGL3-COL2A1质粒:500 ng);ATG5+COL2A1组(pGL3-COL2A1质粒、pcDNA-ATG5质粒各500 ng); ATG5+BafA1+COL2A1组(质粒用量同ATG5+COL2A1组,转染后加入BafA1处理细胞24 h)。所有实验组和对照组细胞转染24 h后,按照试剂盒说明加入裂解液室入温裂解10 min,离心20 s(12 000 r/min),吸取上清液至新的EP管中,避光下依次加入LAR Ⅱ和Stop & Glo® Reagent使用Promega GloMax® Luminometer单管发光检测仪进行检测,得到的RLUs为荧光比值,反映样品荧光素酶的活性,即启动子的活性。
1.3 统计学分析数据处理软件为GraphPad Prism 9。计量资料表示为x±s,采用独立样本t检验及单因素方差分析的方法,P < 0.05为差异有统计学意义。所有实验独立重复3次。
2 结果 2.1 人软骨组织样本中ATG5和COL2A1表达呈正相关GEO数据库相关性分析结果显示,在13例人软骨组织样本中ATG5和COL2A1的mRNA表达水平呈现正相关(r2=0.623 2,P < 0.05)。
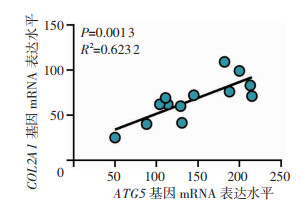
|
| 图 1 人正常软骨组织样本中ATG5和COL2A1基因表达值相关性分析 |
2.2 软骨细胞中ATG5上调COL2A1的表达水平
为了探究ATG5是否调控Ⅱ型胶原的表达,在C28/I2细胞中转染pcDNA-ATG5过表达质粒,免疫荧光结果显示相较于对照组(NC),过表达ATG5后COL2荧光强度明显升高(P < 0.01),敲低ATG5表达后COL2荧光强度显著下降(P < 0.01,图 2A、B)。Western blot结果显示过表达ATG5成功,且显著促进COL2的表达(图 2C、D);腺病毒Ad-siATG5成功感染C28/I2细胞且敲低ATG5的表达后,相较于对照组(NC),COL2的表达水平也随之下降(图 2E、F)。
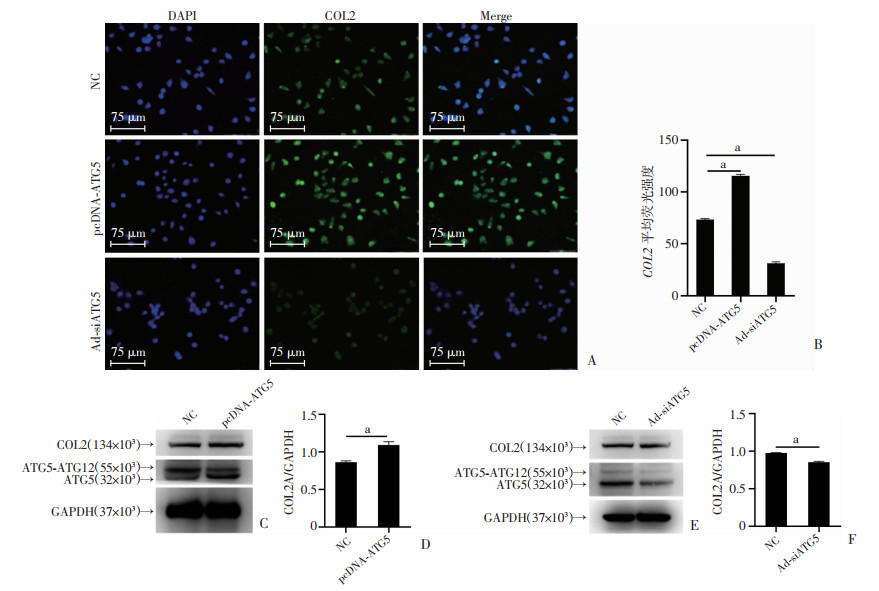
|
| A:免疫荧光检测C28/I2细胞中转染pcDNA-ATG5质粒及Ad-siATG5腺病毒后COL2的表达水平;B: COL2荧光强度的定量分析;C:Western blot检测C28/I2细胞转染pcDNA-ATG5质粒后COL2的表达水平;D:COL2表达水平的定量分析;E: Western blot检测C28/I2细胞转染Ad-siATG5腺病毒后COL2的表达水平;F:COL2表达水平的定量分析;a: P < 0.01 图 2 ATG5调控COL2A1的表达水平 |
2.3 软骨细胞中激活自噬后COL2表达水平上升
为了探究ATG5对COL2表达的调控作用与细胞自噬的关系,利用mRFP-GFP-LC3自噬双标腺病毒对自噬流进行定量分析,结果显示在加入Rapa处理6 h和12 h后,LC3-GFP荧光均发生淬灭,自噬小体和溶酶体融合成为自噬溶酶体,自噬激活(P < 0.01,图 3A、B)。Western blot结果显示COL2、LC3Ⅱ/LC3Ⅰ表达水平随Rapa激活自噬的作用时间延长同步升高(P < 0.01,图 3C)。免疫荧光结果再次证实,与对照组(NC)相比,Rapa处理6 h激活自噬后,COL2的荧光强度显著增强(P < 0.01,图 3D、E)。
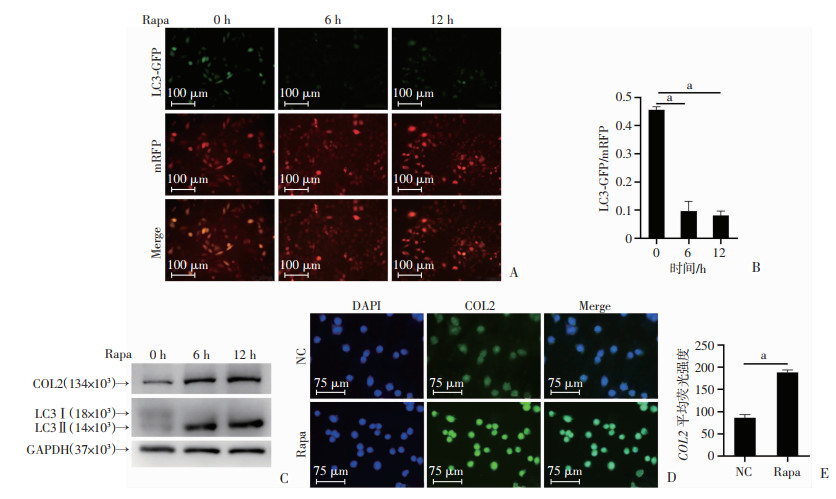
|
| A:自噬双荧光病毒实验检测Rapa刺激C28/I2细胞6、12 h后LC3-GFP荧光强度;B:LC3-GFP/mRFP相对荧光强度定量分析;C:Western blot检测Rapa刺激C28/I2细胞6、12 h后COL2、LC3的表达水平;D: 免疫荧光检测Rapa刺激C28/I2细胞6 h后COL2的表达水平;E: COL2荧光强度的定量分析;a: P < 0.01 图 3 自噬激活剂Rapa处理软骨细胞后COL2的表达水平 |
2.4 软骨细胞中抑制自噬后COL2表达水平下降
利用mRFP-GFP-LC3自噬双标腺病毒对自噬流进行追踪,在加入自噬抑制剂Baf A1处理12 h和24 h后,LC3-GFP荧光显著增强,提示自噬抑制(P < 0.01,图 4A、B)。进一步在C28/I2细胞中加入自噬抑制剂Baf A1处理不同时间后,Western blot检测显示随Baf A1处理时间延长,自噬逐渐被抑制,COL2表达水平同步降低(图 4C)。免疫荧光结果显示,与对照组(NC)相比,在加入Baf A1抑制自噬后,COL2的荧光强度明显减弱(P < 0.01,图 4D、E)。
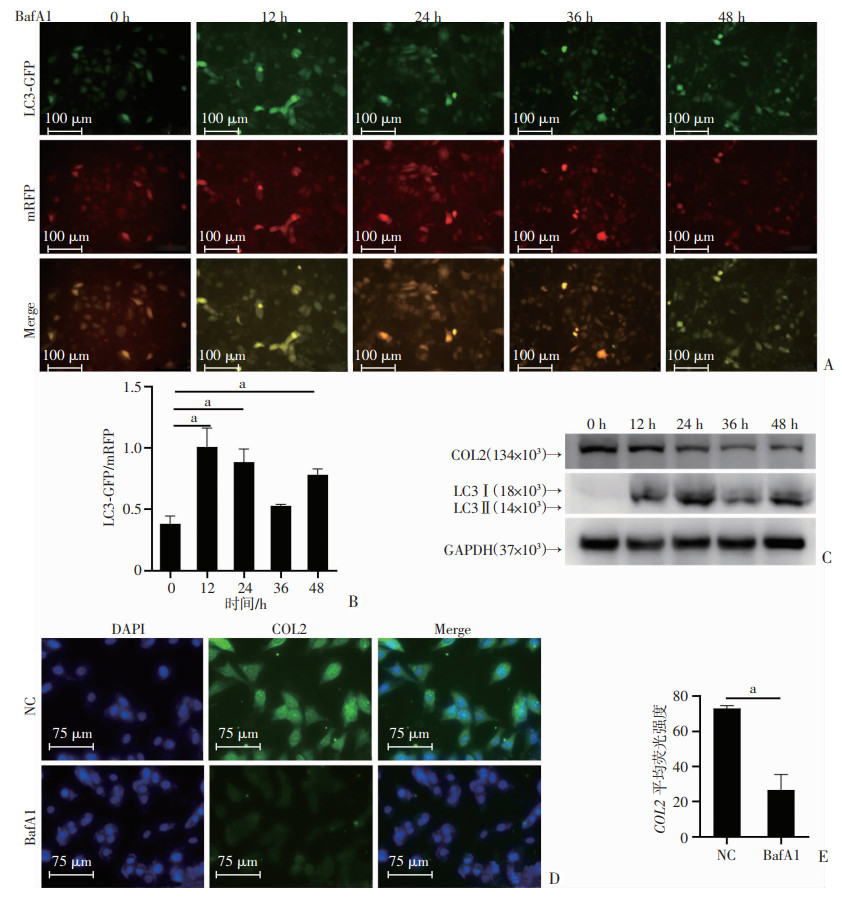
|
| A:自噬双荧光病毒实验检测BafA1刺激C28/I2细胞12、24、36、48 h后LC3-GFP荧光强度;B:LC3-GFP/mRFP相对荧光强度定量分析;C:Western blot检测BafA1刺激C28/I2细胞12、24、36、48 h后COL2、LC3的表达水平;D: 免疫荧光检测BafA1刺激C28/I2细胞24 h后COL2的表达水平;E: COL2荧光强度的定量分析;a: P < 0.01 图 4 自噬抑制剂BafA1处理软骨细胞后COL2的表达水平 |
2.5 软骨细胞中过表达ATG5上调COL2的转录与表达依赖于细胞自噬
为了进一步探究ATG5对COL2转录与表达的调控与自噬的关系,成功构建了人COL2A1启动子质粒并验证其具有转录活性。双荧光素酶实验结果显示,共转染pcDNA-ATG5过表达质粒和COL2A1启动子质粒组的荧光强度显著高于单独转染COL2A1启动子质粒组(P < 0.01),表明过表达ATG5明显上调COL2A1启动子的转录,而加入BafA1抑制自噬后COL2A1转录活性下降(P < 0.01,图 5A)。qPCR结果显示,转染pcDNA-ATG5过表达质粒后上调COL2的mRNA水平(P < 0.01),加入BafA1抑制细胞自噬的同时,进一步抑制了ATG5过表达对COL2的上调作用(P < 0.05,图 5B),说明ATG5上调COL2A1的转录和mRNA表达依赖于细胞自噬。
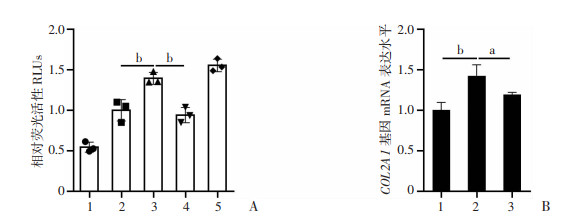
|
| A: 双荧光素酶实验1:pGL3-basic;2:COL2A1 promoter;3:pcDNA-ATG5+COL2A1 promoter;4:pcDNA-ATG5+BafA1+COL2A1 promoter;5:pGL3-control;B:qPCR检测过表达ATG5及联合BafA1处理后COL2的mRNA表达水平1:NC;2:pcDNA-ATG5;3:pcDNA-ATG5+BafA1;a:P < 0.05, b: P < 0.01 图 5 ATG5促进人COL2A1启动子转录活性的双荧光素酶活性实验 |
利用mRFP-GFP-LC3自噬双标腺病毒追踪自噬流,结果显示过表达ATG5后LC3-GFP荧光发生淬灭(P < 0.01),提示自噬激活,Rapa进一步使绿色荧光发生淬灭(P < 0.05),说明Rapa促进过表达ATG5激活的自噬;而自噬抑制剂BafA1联合pcDNA-ATG5处理组相较于过表达ATG5组,绿色荧光增强,提示BafA1通过抑制溶酶体功能抑制自噬,进而抑制过表达ATG5激活的自噬(P < 0.01,图 6A、B)。Western blot结果显示,相较于NC组,过表达ATG5能够明显上调COL2和LC3Ⅱ/LC3Ⅰ的表达(P < 0.01);Rapa进一步促进过表达ATG5上调的COL2和LC3Ⅱ/LC3Ⅰ的表达(P < 0.05);而自噬抑制剂BafA1则抑制ATG5上调的COL2、LC3Ⅱ/LC3Ⅰ的表达(P < 0.01,图 6C、D)。
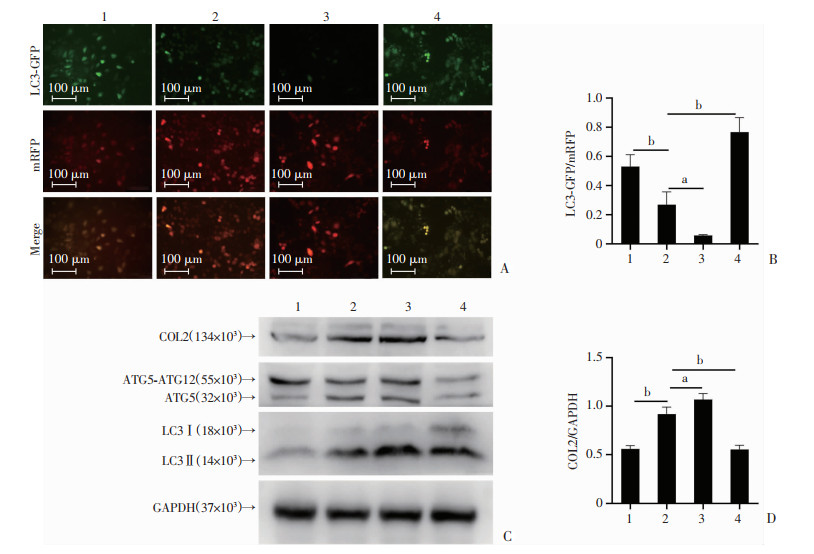
|
|
1: NC; 2: pcDNA-ATG5; 3: pcDNA-ATG5+Rapa; 4: pcDNA-ATG5+BafA1;a:P < 0.05, b:P < 0.01 A:自噬双荧光病毒实验检测过表达ATG5后LC3的荧光水平;B: LC3-GFP/mRFP相对荧光强度定量分析;C:Western blot检测过表达ATG5及联合Rapa处理后COL2、LC3的表达水平;D: COL2表达水平的定量分析 图 6 人软骨细胞C28/I2中过表达ATG5增强自噬并上调COL2表达 |
2.6 软骨细胞中敲低ATG5的表达抑制自噬进而下调COL2的表达
细胞感染自噬双标腺病毒后,敲低ATG5的表达水平使自噬小体的延伸及LC3聚集受阻,LC3-GFP绿色荧光减弱(P < 0.05),自噬流受阻;Ad-siATG5联合Rapa,相较于NC对照组和siATG5单处理组,LC3-GFP绿色荧光淬灭(P < 0.05),自噬部分激活;siATG5联合自噬抑制剂BafA1处理组相较于单独siATG5处理组荧光差异不显著(图 7A、B)。Western blot结果显示,Ad-siATG5重组腺病毒敲低ATG5的表达水平后,相较于NC组,敲低ATG5(siATG5)能够明显抑制ATG5、COL2和LC3Ⅱ/LC3Ⅰ的表达;Rapa联合Ad-siATG5处理时上调ATG5表达,同时上调COL2和LC3Ⅱ/LC3Ⅰ的表达(P < 0.01);BafA1+ Ad-siATG5处理后,在抑制ATG5表达的同时下调COL2的表达(P < 0.01,图 7C、D)。
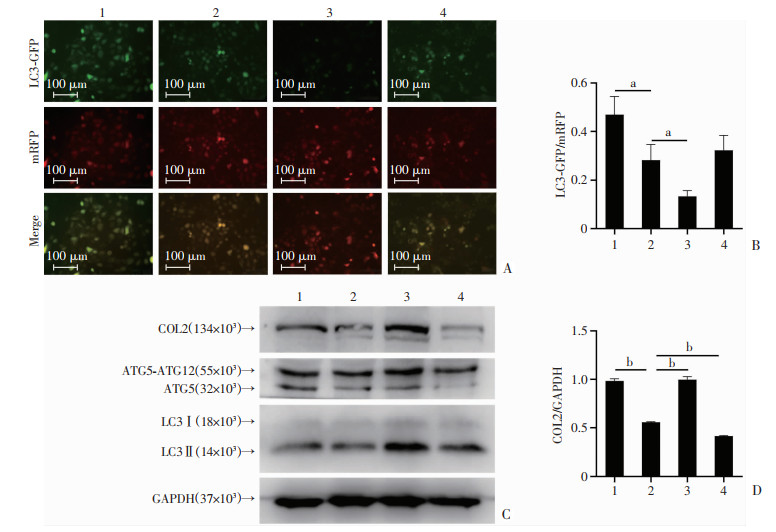
|
|
1: NC; 2: Ad-siATG5; 3: Ad-siATG5+Rapa; 4: Ad-siATG5+BafA1;a: P < 0.05,b: P < 0.01 A:自噬双荧光病毒实验检测敲低ATG5后LC3的荧光水平;B: LC3-GFP/mRFP相对荧光强度定量分析;C:Western blot检测敲低ATG5及联合BafA1处理后COL2、LC3的表达水平;D: COL2表达水平的定量分析 图 7 人软骨细胞C28/I2中敲低ATG5的表达抑制自噬并下调COL2表达 |
3 讨论
骨关节炎在全球范围内的患者超过2.4亿人,具有一定的致残率,目前的治疗手段主要是非甾体抗炎药或关节内注射透明质酸,但只能起到抗炎止痛的作用,因软骨再生较为困难,目前尚无一种具有明确治疗效果的药物[1, 22-23]。本文所研究的ATG5是自噬过程中不可或缺的一个关键基因,ATG5与ATG12-ATG16L结合,参与自噬小体的形成及先天抗病毒免疫应答的负调控、淋巴细胞发育和增殖、脂肪细胞分化和凋亡等多种生物学过程[9, 24]。有研究表明,细胞自噬能够影响软骨细胞中Ⅱ型胶原的形成、胞外分泌、成熟等过程[25]。
本文旨在研究自噬相关蛋白ATG5对软骨细胞中Ⅱ型胶原基因表达的调控作用。首先我们通过GEO数据库中的芯片数据发现ATG5的表达与COL2A1存在正相关,提示ATG5可能调控COL2A1的表达水平。为了进一步证实这一分析结果,本研究采用免疫荧光和Western blot等技术,在软骨细胞中分别过表达ATG5和抑制ATG5的表达,逐一观察其对COL2A1表达的影响。实验结果显示在软骨细胞中过表达ATG5能够上调COL2的表达水平,反之抑制ATG5的表达使COL2表达水平下调。此外,自噬双荧光和免疫印迹等实验进一步证实自噬激活可以上调COL2的表达,而自噬的抑制则下调COL2的表达。此外,已有研究表明ATG5能够调控NF-кB、p53等转录因子的活性,其中ATG5会与p65结合抑制NF-кB介导的炎症反应,当ATG5表达下调,软骨细胞的早期自噬被抑制,自噬小体的生成受阻,LC3无法聚集和进入自噬溶酶体,溶酶体无法水解细胞内衰老的细胞器或局部细胞质,进而激活NF-кB,细胞内IL-1β、IL-6、TNF-ɑ等致炎因子水平上升[26-27]。同时,ATG5表达下调可以通过调控BMP、Wnt等其他信号通路减少Ⅱ型胶原和蛋白多糖的合成,上调多种基质降解金属酶的表达,进而引发骨关节炎[26, 28-29]。本实验进一步证实ATG5上调COL2A1的转录与表达依赖于细胞自噬;同时,我们发现敲低ATG5抑制细胞自噬和COL2A1的表达,Rapa可以上调siATG5抑制的自噬与COL2A1表达,提示ATG5调控自噬和COL2A1表达的途径并非特异性调节途径,软骨细胞中还存在其他独立于ATG5的替代途径参与调节自噬和COL2A1的表达。再次证实了自噬的发生可以通过独立于ATG5的替代途径补偿产生,与内质网应激共同组成真核细胞的保护机制,调控细胞的增殖、分化、凋亡、生长等生物学功能[30]。文献报道这一补偿途径可能涉及ULK1的磷酸化和LC3修饰的缺失[31-32]。
Ⅱ型胶原是软骨细胞外基质中占比最多的胶原蛋白,最初在软骨细胞内合成Ⅱ型前胶原(procollagen Ⅱ,PC Ⅱ),在高尔基体经分泌小泡包被,经过与质膜的融合分泌至细胞外,再通过聚合、二硫键等共价交联成胶原纤维的骨架,再结合蛋白聚糖等成分使软骨具有一定的弹性,起到缓冲、维持软骨组织完整性的作用[33]。已有研究表明,敲除ATG5会导致Caspase介导的软骨细胞死亡,引发更严重的骨关节炎[34]。软骨细胞自噬会在一定程度上通过控制ECM中Ⅱ型胶原的分泌水平来调节骨生长,IL-18处理软骨细胞后,软骨细胞自噬下调,Ⅱ型胶原和蛋白聚糖表达水平下降,这与我们的结论一致[35]。
综合本研究实验结果,ATG5对于软骨细胞中Ⅱ型胶原的表达起到了积极的促进作用;ATG5调控Ⅱ型胶原的表达依赖于细胞自噬;软骨合成过程中胶原的合成、分泌及成熟可能与自噬相关,具体机制还有待进一步探讨和验证。
| [1] |
HAN S. Osteoarthritis year in review 2022: biology[J]. Osteoarthr Cartilage, 2022, 30(12): 1575-1582. |
| [2] |
FUJⅡ Y, LIU L, YAGASAKI L, et al. Cartilage homeostasis and osteoarthritis[J]. Int J Mol Sci, 2022, 23(11): 6316. |
| [3] |
FAVERO M, BELLUZZI E, ORTOLAN A, et al. Erosive hand osteoarthritis: latest findings and outlook[J]. Nat Rev Rheumatol, 2022, 18(3): 171-183. |
| [4] |
RAHMATI M, NALESSO G, MOBASHERI A, et al. Aging and osteoarthritis: central role of the extracellular matrix[J]. Ageing Res Rev, 2017, 40: 20-30. |
| [5] |
LU H W, JIA C, WU D Y, et al. Fibroblast growth factor 21 (FGF21) alleviates senescence, apoptosis, and extracellular matrix degradation in osteoarthritis via the SIRT1-mTOR signaling pathway[J]. Cell Death Dis, 2021, 12(10): 865. |
| [6] |
CARBALLO C B, NAKAGAWA Y, SEKIYA I, et al. Basic science of articular cartilage[J]. Clin Sports Med, 2017, 36(3): 413-425. |
| [7] |
CHARLIER E, DEROYER C, CIREGIA F, et al. Chondrocyte dedifferentiation and osteoarthritis (OA)[J]. Biochem Pharmacol, 2019, 165: 49-65. |
| [8] |
GUILAK F, NIMS R J, DICKS A, et al. Osteoarthritis as a disease of the cartilage pericellular matrix[J]. Matrix Biol, 2018, 71/72: 40-50. |
| [9] |
GALLUZZI L, GREEN D R. Autophagy-independent functions of the autophagy machinery[J]. Cell, 2019, 177(7): 1682-1699. |
| [10] |
MUSUMECI G, CASTROGIOVANNI P, TROVATO F M, et al. Biomarkers of chondrocyte apoptosis and autophagy in osteoarthritis[J]. Int J Mol Sci, 2015, 16(9): 20560-20575. |
| [11] |
CARAMES B, HASEGAWA A, TANIGUCHI N, et al. Autophagy activation by rapamycin reduces severity of experimental osteoarthritis[J]. Ann Rheum Dis, 2012, 71(4): 575-581. |
| [12] |
LEVINE B, KROEMER G. Biological functions of autophagy genes: a disease perspective[J]. Cell, 2019, 176(1/2): 11-42. |
| [13] |
TSUJIMOTO R, YURUBE T, TAKEOKA Y, et al. Involvement of autophagy in the maintenance of rat intervertebral disc homeostasis: an in-vitro and in-vivo RNA interference study of Atg5[J]. Osteoarthr Cartilage, 2022, 30(3): 481-493. |
| [14] |
PAN Y M, YANG Y Y, FAN M T, et al. Progranulin regulation of autophagy contributes to its chondroprotective effect in osteoarthritis[J]. Genes Dis, 2022. |
| [15] |
ANDREAS K, LVBKE C, HÄUPL T, et al. Key regulatory molecules of cartilage destruction in rheumatoid arthritis: an in vitro study[J]. Arthritis Res Ther, 2008, 10(1): R9. |
| [16] |
KAWATA M, TERAMURA T, ORDOUKHANIAN P, et al. Krüppel-like factor-4 and Krüppel-like factor-2 are important regulators of joint tissue cells and protect against tissue destruction and inflammation in osteoarthritis[J]. Ann Rheum Dis, 2022, annrheumdis-annrheu2021-221867. |
| [17] |
李星月, 尹丹旸, 范梦恬, 等. IRE1α缺陷通过上调内质网钙稳态蛋白降低软骨细胞的自噬功功能[J]. 南方医科大学学报, 2022, 42(6): 785-793. LI X Y, YIN D Y, FAN M T, et al. IRE1α deficiency impairs autophagy in chondrocytes by upregulating calcium homeostasis endoplasmic reticulum protein[J]. J South Med Univ, 2022, 42(6): 785-793. |
| [18] |
LI Q, YIN Y T, ZHENG Y Q, et al. Inhibition of autophagy promoted high glucose/ROS-mediated apoptosis in ADSCs[J]. Stem Cell Res Ther, 2018, 9(1): 289. |
| [19] |
XU L J, CHEN R C, MA X Y, et al. Scutellarin protects against myocardial ischemia-reperfusion injury by suppressing NLRP3 inflammasome activation[J]. Phytomedicine, 2020, 68: 153169. |
| [20] |
SHI Y N, GU C X, ZHAO T T, et al. Combination therapy with rapamycin and low dose imatinib in pulmonary hypertension[J]. Front Pharmacol, 2021, 12: 758763. |
| [21] |
TAN H W S, ANJUM B, SHEN H M, et al. Lysosomal inhibition attenuates peroxisomal gene transcription via suppression of PPARA and PPARGC1A levels[J]. Autophagy, 2019, 15(8): 1455-1459. |
| [22] |
DEYLE G D, ALLEN C S, ALLISON S C, et al. Physical therapy versus glucocorticoid injection for osteoarthritis of the knee[J]. N Engl J Med, 2020, 382(15): 1420-1429. |
| [23] |
任昊喆, 牟婧, 赵子璇, 等. 细胞外信号调节蛋白激酶在颞下颌关节骨关节炎髁突软骨退变中的作用[J]. 空军军医大学学报, 2023(6): 490-495. REN H Z, MOU J, ZHAO Z X, et al. Effect of extracellular signal-regulated kinase on condylar cartilage degeneration of temporomandibular joint osteoarthritis[J]. J Air Force Med Univ, 2023(6): 490-495. |
| [24] |
BURGER E, ARAUJO A, LÓPEZ-YGLESIAS A, et al. Loss of paneth cell autophagy causes acute susceptibility to Toxoplasma gondii-mediated inflammation[J]. Cell Host Microbe, 2018, 23(2): 177-190. |
| [25] |
HEO D N, KIM H J, LEE D, et al. Comparison of polysaccharides in articular cartilage regeneration associated with chondrogenic and autophagy-related gene expression[J]. Int J Biol Macromol, 2020, 146: 922-930. |
| [26] |
PENG X, WANG Y T, LI H Y, et al. ATG5-mediated autophagy suppresses NF-κB signaling to limit epithelial inflammatory response to kidney injury[J]. Cell Death Dis, 2019, 10(4): 253. |
| [27] |
KIM J, CHEE W Y, YABUTA N, et al. Atg5-mediated autophagy controls apoptosis/anoikis via p53/Rb pathway in naked mole-rat fibroblasts[J]. Biochem Biophys Res Commun, 2020, 528(1): 146-153. |
| [28] |
DEVIS-JAUREGUI L, ERITJA N, DAVIS M L, et al. Autophagy in the physiological endometrium and cancer[J]. Autophagy, 2021, 17(5): 1077-1095. |
| [29] |
LEPETSOS P, PAPAVASSILIOU K A, PAPAVASSILIOU A G. Redox and NF-κB signaling in osteoarthritis[J]. Free Radic Biol Med, 2019, 132: 90-100. |
| [30] |
ZHENG W, XIE W W, YIN D Y, et al. ATG5 and ATG7 induced autophagy interplays with UPR via PERK signaling[J]. Cell Commun Signal, 2019, 17(1): 42. |
| [31] |
URBANSKA K, ORZECHOWSKI A. The secrets of alternative autophagy[J]. Cells, 2021, 10(11): 3241. |
| [32] |
QIAO C M, SUN M F, JIA X B, et al. Sodium butyrate causes α-synuclein degradation by an Atg5-dependent and PI3K/Akt/mTOR-related autophagy pathway[J]. Exp Cell Res, 2020, 387(1): 111772. |
| [33] |
XIA C J, WANG P E, FANG L, et al. Activation of β-catenin in Col2-expressing chondrocytes leads to osteoarthritis-like defects in hip joint[J]. J Cell Physiol, 2019, 234(10): 18535-18543. |
| [34] |
BOUDERLIQUE T, VUPPALAPATI K K, NEWTON P T, et al. Targeted deletion of Atg5 in chondrocytes promotes age-related osteoarthritis[J]. Ann Rheum Dis, 2016, 75(3): 627-631. |
| [35] |
BAO J P, CHEN Z G, XU L H, et al. Rapamycin protects chondrocytes against IL-18-induced apoptosis and ameliorates rat osteoarthritis[J]. Aging, 2020, 12(6): 5152-5167. |




