2. 400016 重庆,重庆医科大学生命科学研究院;
3. 400016 重庆,重庆医科大学感染性疾病分子生物学教育部重点实验室
2. Institute of Life Sciences, Chongqing Medical University, Chongqing, 400016, China;
3. Key Laboratory of Molecular Biology on Infectious Diseases, Chongqing Medical University, Chongqing, 400016, China
子宫内膜癌(endometrial cancer, EC)是女性生殖系统常见的恶性肿瘤之一,也是女性第6大常见癌症,其发病率和病死率呈逐年上升趋势[1],2021年估计有65 620例新发病例和超过12 590例死亡病例,严重威胁着女性健康[2-3]。由于EC患者早期多有异常阴道出血的典型临床表现,因此大多数患者在确诊时处于国际妇产科联盟(Federation International of Gynecology and Obstetrics, FIGO)分期系统Ⅰ期,预后良好,5年总生存率(overall survival, OS)约为80%[4-5]。然而,即使是早期的EC患者也会出现治疗后复发和转移,严重影响患者的生存和预后。随着医疗诊断技术和筛查手段的快速发展[6],EC患者中远处器官转移的检出率明显升高,但由于临床上缺乏客观评价方法和对转移性EC认识的不足,转移性EC的病死率仍居高不下。研究显示,伴有远处转移的EC患者预后通常较差,5年生存率低于20%[7-8]。
既往对EC预后的判断及治疗方案的选择主要基于经典的临床分期、组织分化及其他预后相关危险因素,但对于远处转移性EC的预后评估仍不明确[9]。国内外关于远处转移性EC的相关报道较少,未见用于预测远处转移性EC的预后模型。因此,本研究基于美国综合国立癌症研究所监测、流行病学和最终结果(the Surveillance, Epidemiology, and End Results, SEER)数据库,首次建立了远处转移性EC的生存预测模型,旨在更准确地预测远处转移性EC患者的预后,有助于临床医生更好地筛选出高危人群制定合适的诊疗方案。
1 资料与方法 1.1 一般资料本研究纳入了2010-2017年共1 807例诊断为远处转移的EC患者,并提取了基本的临床病理资料和治疗方法等信息。使用SEER * stat软件从SEER数据库中获取患者数据,并将伴有骨转移/脑转移/肝转移/肺转移的EC定义为远处转移性EC。纳入标准:①术后病理确诊为EC;②在2010-2017年确诊的患者;③远处转移(包括骨转移、脑转移、肝转移、肺转移)。排除标准:①年龄<18岁;②种族和肿瘤分级未知;③手术和淋巴结清扫资料缺失;④随访信息缺失;⑤多原发肿瘤。同时,本研究收集了21例于2013年10月至2019年12月收治于重庆医科大学附属第一医院妇科并确诊为远处转移性EC患者的临床资料用于外部验证,外部数据集的纳入与排除标准同上。本研究获得SEER数据库的访问权限与使用许可,同时在回顾性收集重医附一院病历系统中的数据时,对所有患者的个人信息进行匿名化处理,并获得重庆医科大学附属第一医院伦理委员会的批准(K2023-266)。
1.2 研究变量在本研究中,提取的临床病理变量包括:年龄、种族、婚姻状态、肿瘤大小、肿瘤分级、组织学类型、手术、淋巴结切除、放疗及化疗。其中,年龄和肿瘤大小采用X-tile软件确定最佳截断值,并依据截断值进行分组。此外,根据ICD-O-3的形态学编码将组织学类型分为:子宫内膜样腺癌(endometrial endometrioid adenocarcinoma, EEA)、浆液性子宫内膜样腺癌(serous endometrioid adenocarcinoma, SEA)和其他类型EC[10-11]。肿瘤分级定义为:Ⅰ(高分化)、Ⅱ(中分化)、Ⅲ/Ⅳ(低分化或未分化)。
1.3 统计学分析采用SPSS 25.0和R语言4.2.1软件进行统计学分析。计数资料以频数(%)表示,组间比较采用χ2检验或Fisher精确概率法;有序分类变量通过秩和检验进行组间比较。在多因素Cox回归分析的基础上筛选出独立预后因素,并基于这些预测因素构建列线图模型。采用C指数、ROC曲线及AUC值衡量预测模型的区分度及诊断效能;采用校准曲线和决策曲线分析对模型的校准度和临床适用性进行评价。P<0.05认为差异具有统计学意义。
2 结果 2.1 根据X-tile确定远处转移性EC患者年龄及肿瘤大小的最佳截断值依据X-tile确定年龄的最佳截断值为68、77岁,并将患者按<68、68~77、>77岁进行分组(图 1A~C);确定肿瘤大小的最佳截断值为8.1和11.7 cm,将患者按<8.1、8.1~11.7、>11.7 cm进行分组(图 1D~F)。
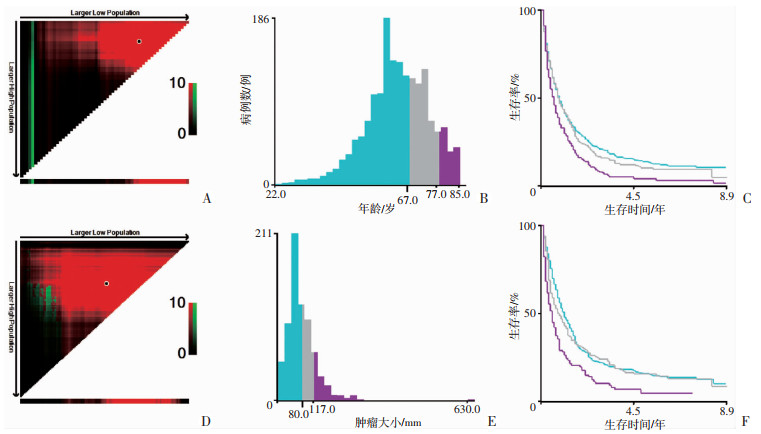
|
| 图 1 X-tile软件分析年龄(A~C)及肿瘤大小(D~F)的最佳截断值 |
2.2 流行病学与临床病理特征
根据纳入和排除标准,从SEER数据库中回顾性纳入2010-2017年1 807例远处转移性EC患者,并按7∶3的比例随机分为训练队列(n=1 267)和内部验证队列(n=540),患者的基本临床病理资料见表 1。其中,远处转移性EC患者肿瘤分级主要以Ⅲ/Ⅳ级为主,分别占比53.2%和27.0%。组织学亚型以子宫内膜样腺癌为主(59.4%),其次为浆液性子宫内膜样腺癌(18.6%)和其他类型EC(22.0%)。此外,进行手术的患者占56.6%;进行淋巴结切除和辅助治疗(放疗和化疗)的患者分别占27.3%、28.2%和67.8%。
| 变量 | 患者人数 | 训练队列 | 内部验证队列 | P |
| 年龄/岁 | 0.910 | |||
| <68 | 1 098(60.8) | 768(60.6) | 330(61.1) | |
| 68~77 | 460(25.5) | 326(25.7) | 134(24.8) | |
| >77 | 249(13.7) | 173(13.7) | 76(14.1) | |
| 种族 | 0.123 | |||
| 白人 | 1 280(70.9) | 896(70.7) | 384(71.1) | |
| 黑人 | 342(18.9) | 251(19.8) | 91(16.9) | |
| 其他 | 185(10.2) | 120(9.5) | 65(12.0) | |
| 婚姻状态 | 0.897 | |||
| 已婚 | 741(41.0) | 524(41.4) | 217(40.2) | |
| 未婚 | 971(53.7) | 677(53.4) | 294(54.4) | |
| 其他 | 95(5.3) | 66(5.2) | 29(5.4) | |
| 肿瘤大小/cm | 0.417 | |||
| <8.1 | 456(25.2) | 325(25.7) | 131(24.3) | |
| 8.1~11.7 | 151(8.4) | 105(8.3) | 46(8.5) | |
| >11.7 | 1 07(5.9) | 79(6.2) | 28(5.2) | |
| 未知 | 1 093(60.5) | 758(59.8) | 335(62.0) | |
| 分级/级 | 0.114 | |||
| Ⅰ | 127(7.0) | 94(7.4) | 33(6.2) | |
| Ⅱ | 232(12.8) | 147(11.6) | 85(15.7) | |
| Ⅲ | 961(53.2) | 672(53.1) | 289(53.5) | |
| Ⅳ | 487(27.0) | 354(27.9) | 133(24.6) | |
| 组织学类型 | 0.994 | |||
| EEA | 1 074(59.4) | 753(59.4) | 321(59.4) | |
| SEA | 337(18.6) | 237(18.7) | 100(18.5) | |
| 其他 | 396(22.0) | 277(21.9) | 119(22.1) | |
| 手术 | 0.495 | |||
| 未手术 | 785(43.4) | 557(44.0) | 228(42.2) | |
| 手术 | 1 022(56.6) | 710(56.0) | 312(57.8) | |
| 淋巴结切除 | 0.539 | |||
| 未切除 | 1 314(72.7) | 916(72.3) | 398(73.7) | |
| 切除 | 493(27.3) | 351(27.7) | 142(26.3) | |
| 放疗 | ||||
| 未放疗 | 1 297(71.8) | 897(70.8) | 400(74.1) | 0.157 |
| 放疗 | 510(28.2) | 370(29.2) | 140(25.9) | |
| 化疗 | 0.630 | |||
| 未化疗 | 581(32.2) | 403(31.8) | 178(33.0) | |
| 化疗 | 1 226(67.8) | 864(68.2) | 362(67.0) |
2.3 单因素与多因素Cox回归分析
在单因素分析中,年龄、种族、婚姻状态、肿瘤大小、肿瘤分级、组织学类型、手术、淋巴结切除和化疗与远处转移性EC患者预后相关;将P<0.05的所有变量纳入多因素Cox回归模型中,结果显示,其他种族人群(HR=0.879)、肿瘤> 11.7 cm(HR=1.459)、其他组织学亚型(HR=1.260)、肿瘤分级Ⅳ级(HR=2.288)、手术治疗(HR=0.480)和化疗(HR=0.423)为患者OS的独立影响因素(P<0.05,表 2)。
| 变量 | 人数 | 单因素分析 | 多因素分析 | ||
| P | HR(95% CI) | P | |||
| 年龄/岁 | <0.001 | ||||
| <68 | 768 | Ref | |||
| 68~77 | 326 | 0.957(0.846~1.083) | 0.488 | ||
| >77 | 173 | 1.021(0.875~1.192) | 0.792 | ||
| 种族 | <0.001 | ||||
| 白人 | 896 | Ref | |||
| 黑人 | 251 | 1.020(0.882~1.127) | 0.957 | ||
| 其他 | 120 | 0.879(0.780~0.991) | 0.035 | ||
| 婚姻状态 | 0.026 | ||||
| 已婚 | 524 | Ref | |||
| 未婚 | 677 | 1.004(0.899~1.120) | 0.947 | ||
| 其他 | 66 | 0.935(0.736~1.188) | 0.585 | ||
| 肿瘤大小/cm | <0.001 | ||||
| <8.1 | 325 | Ref | |||
| 8.1~11.7 | 105 | 1.174(0.959~1.438) | 0.119 | ||
| >11.7 | 79 | 1.459(1.164~1.830) | 0.001 | ||
| 未知 | 758 | 1.043(0.917~1.186) | 0.524 | ||
| 分级/级 | <0.001 | ||||
| Ⅰ | 94 | Ref | |||
| Ⅱ | 147 | 1.486(1.133~1.951) | 0.004 | ||
| Ⅲ | 672 | 2.424(1.901~3.089) | <0.001 | ||
| Ⅳ | 354 | 2.288(1.771~2.957) | <0.001 | ||
| 组织学类型 | <0.001 | ||||
| EEA | 753 | Ref | |||
| SEA | 237 | 0.936(0.810~1.081) | 0.369 | ||
| 其他 | 277 | 1.260(1.103~1.439) | <0.001 | ||
| 手术 | <0.001 | ||||
| 未手术 | 557 | Ref | |||
| 手术 | 710 | 0.480(0.422~0.547) | <0.001 | ||
| 淋巴结切除 | <0.001 | ||||
| 未切除 | 916 | Ref | |||
| 切除 | 351 | 0.951(0.826~1.094) | 0.482 | ||
| 放疗 | 0.840 | ||||
| 未放疗 | 897 | - | - | ||
| 放疗 | 370 | - | - | ||
| 化疗 | <0.001 | ||||
| 未化疗 | 403 | Ref | |||
| 化疗 | 864 | 0.423(0.378~0.475) | <0.001 | ||
| Ref:参考值 | |||||
2.4 列线图的建立与内部验证
依据多因素分析确定的独立预后因素,构建患者1、3、5年的OS列线图模型(图 2)。该模型在训练队列中的C指数为0.711(95% CI:0.695~0.727);在内部验证队列中的C指数为0.744(95% CI:0.721~0.768)。此外,ROC曲线显示OS列线图具有良好的准确性和区分性(图 3);校准曲线显示预测概率与实际概率一致性较好(图 4);与此同时,DCA结果显示本模型具有正净获益,提示本研究构建的模型具有良好的临床应用潜能(图 5)。
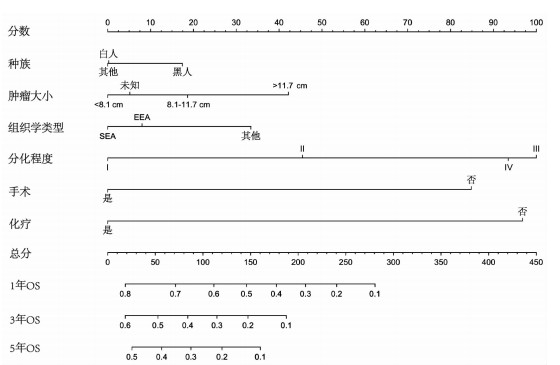
|
| 图 2 预测远处转移性EC患者1、3、5年总生存率的列线图 |
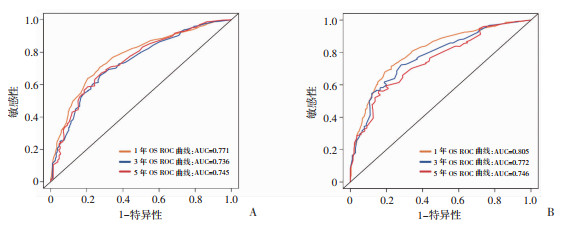
|
| A:训练队列中,远处转移性EC患者1、3、5年的ROC曲线及AUC值;B:内部验证队列中,远处转移性EC患者1、3、5年的ROC曲线及AUC值 图 3 列线图模型的ROC曲线及AUC值 |
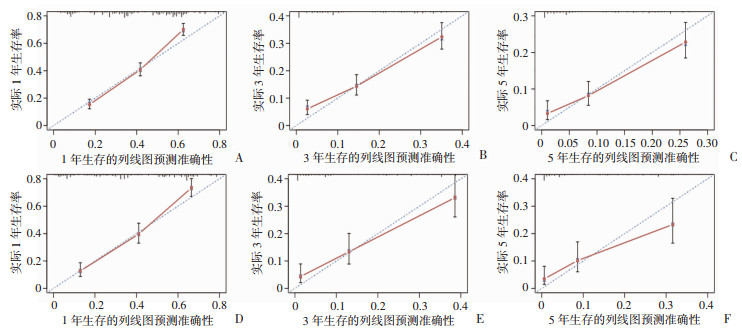
|
| A~C:训练队列中,远处转移性EC患者1、3、5年总生存率的校准曲线;D~F:内部验证队列中,远处转移性EC患者1、3、5年总生存率的校准曲线 图 4 列线图模型的校准曲线 |
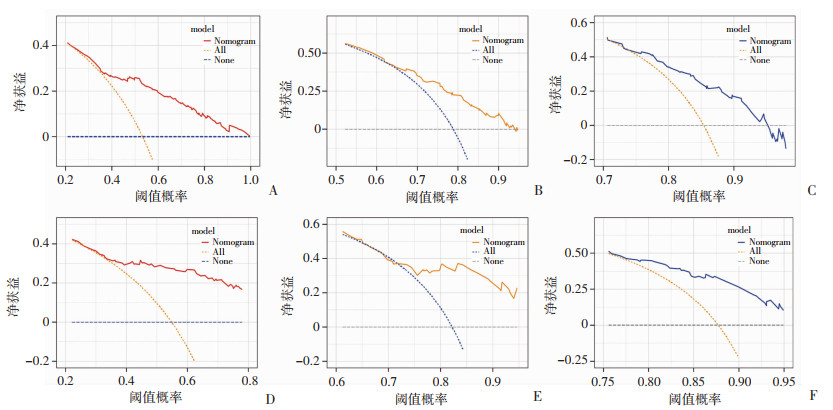
|
| A~C:训练队列中,预测远处转移性EC患者1、3、5年生存模型的DCA曲线;D~F:内部验证队列中,预测远处转移性EC患者1、3、5年生存模型的DCA曲线 图 5 列线图模型的临床决策曲线 |
2.5 预测模型的外部验证
回顾性收集本院远处转移性EC患者共21例。其中,年龄<68岁患者有17例(81.0%);组织学类型为EEA和SEA的患者最多,占整个队列人数的76.2%;所有患者的肿瘤大小<8.1 cm;肿瘤分级为Ⅲ级的患者最多,有12例(57.1%),见表 3。此外,列线图模型在外部验证队列中的C指数为0.711(95% CI:0.562~0.860),提示该模型在外部数据集中仍然具有良好的预测准确度。1、3、5年的AUC值分别为0.921、0.724和0.724,进一步证实预测模型具有区分不同患者生存预后的能力及良好的精度(图 6)。
| 变量 | 外部验证队列 |
| 年龄/岁 | |
| <68 | 17(81.0) |
| 68~77 | 4(19.0) |
| >77 | 0 |
| 种族 | |
| 白人 | 0 |
| 黑人 | 0 |
| 其他 | 21(100.0) |
| 婚姻状态 | |
| 已婚 | 20(95.2) |
| 未婚 | 0 |
| 其他 | 1(4.8) |
| 肿瘤大小/cm | |
| <8.1 | 21(100.0) |
| 8.1~11.7 | 0 |
| >11.7 | 0 |
| 未知 | 0 |
| 分级 | |
| Ⅰ | 0 |
| Ⅱ | 9(42.9) |
| Ⅲ | 12(57.1) |
| Ⅳ | 0 |
| 组织学类型 | |
| EEA | 8(38.1) |
| SEA | 8(38.1) |
| 其他 | 5(23.8) |
| 手术 | |
| 未手术 | 0 |
| 手术 | 21(100.0) |
| 淋巴结切除 | |
| 未切除 | 0 |
| 切除 | 21(100.0) |
| 放疗 | |
| 未放疗 | 12(57.1) |
| 放疗 | 9(42.9) |
| 化疗 | |
| 未化疗 | 1(4.8) |
| 化疗 | 20(95.2) |
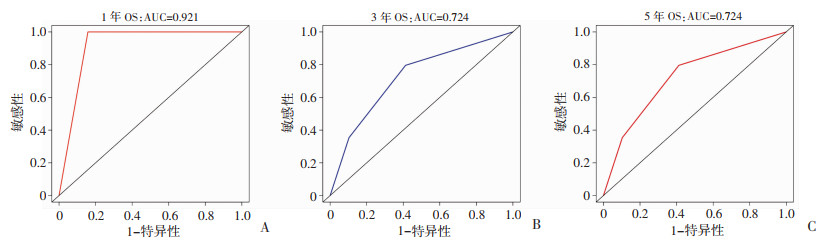
|
| A~C:OS列线图在外部验证队列中预测远处转移性EC患者1、3、5年总生存率的ROC曲线及AUC值 图 6 外部验证组患者ROC曲线及AUC值 |
3 讨论
EC作为一种局限性疾病,患者常在临床早期被确诊,经过及时的治疗,预后较好,5年生存率可达95%[12]。复发和转移是导致其死亡的主要原因,根据SEER数据库的相关研究显示,远处转移的发生率为9%,而伴有远处器官转移的EC患者5年生存率仅为17.3%。临床上主要依据肿瘤分期和危险因素决定EC患者的治疗策略,对不同的患者采取合适的治疗方案至关重要。
EC不同的转移模式是影响患者生存率的重要因素。已有研究报道肺部是Ⅳ期EC患者最常见的远处转移部位,其次是肝脏、骨骼和脑[13-14]。一项回顾性研究显示:远处(肝脏和肺部)转移是EC的主要死亡原因[15]。尽管转移性EC患者的预后极差,但由于器官远处转移的发病率低,导致该病的研究数据极为有限,鲜有研究报道转移性EC的预后相关危险因素及预测模型。因此,本研究基于SEER数据库,通过全面分析癌症患者的流行病学状况、临床病理特征以及治疗随访数据,以揭示远处转移性EC的相关预后因素。年龄与肿瘤的发生发展关系密切,有研究显示绝经后的老年EC患者预后较差,导致这一结局的主要原因除了激素水平变化外,还可能与患者合并基础性疾病、诊断时FIGO分期较晚有关[16]。本研究发现年龄并非远处转移性EC患者的独立预后因素,这与先前的许多报道不一致,可能是由于之前的研究多集中于探讨所有的EC患者,而本研究只关注发生远处转移的患者人群,这需要通过进一步的研究证实本研究的发现。透明细胞癌是一种罕见的侵袭性EC亚型,具有复发率较高、预后较差等特点[17-18]。本研究显示,包括透明细胞癌在内的其他组织学亚型的总生存率显著低于EEA和SEA亚型,与LIU等[8]报道的结果一致。种族与EC的发生有着紧密的联系,一项基于人群的大型回顾性研究指出,在Ⅰ和ⅢA-B期EC患者中,非裔美国女性的死亡风险明显高于白人女性,而亚裔女性的死亡风险则低于白人女性[19],这与本研究结果相符。此外,本研究发现肿瘤分级Ⅲ/Ⅳ级在远处转移性EC占比高达80%,且与患者不良预后显著相关。因此,临床上对于肿瘤分级为Ⅲ/Ⅳ级的患者应采取更为积极的治疗,并进行有效的全程科学化管理具有重要意义。对于远处转移性EC患者而言,危险因素及预后的精准判断是至关重要的,决定了患者治疗方案的选择。目前,针对复发或转移的EC患者多采用包括手术、化疗、靶向治疗等在内的多学科系统化治疗[20];由于该病发病率低,当前尚无标准的治疗方案。有研究应用列线图模型对晚期EC患者生存预后进行探究,结果显示,与单纯手术治疗相比,术后经过积极化疗的患者生存结局更好,与本研究结果相符[21]。因此,对伴有远处转移的高危EC患者,可以考虑给予更积极的治疗,包括新辅助化疗和术后化疗[22];此外,有针对性地探索远处转移性EC患者的治疗模式,以期改善患者预后,未来期待有更多的相关研究为癌症分类以及治疗方式的选择提供证据支持。
本研究对远处转移性EC患者进行大样本研究,以揭示其临床特征及影响预后的危险因素。在本研究中,为了更好地区分生存率,采用X-tile软件确定患者年龄及肿瘤大小的最佳截断值。通过多因素Cox回归模型分析,发现肿瘤大小超过11.7 cm、其他组织学亚型(包括透明细胞癌等)和较高的肿瘤分级是远处转移性EC的独立危险因素;另一方面,包括亚洲人/太平洋岛民等在内的种族,接受手术治疗和化疗是远处转移性EC的独立保护因素。进一步构建评估远处转移性EC OS列线图模型,由种族、肿瘤大小、组织学分类、肿瘤分级、手术和化疗6项变量组成。随后,对构建的模型进行验证;在训练队列和内部验证队列中,模型的C指数分别为0.711(95% CI:0.695~0.727)和0.744(95% CI:0.721~0.768),提示模型具有较高的区分度。研究结果显示,ROC曲线下面积(AUC)较高,表明该模型在预测精度和预后评估等方面具有较好的应用前景。同时,校准曲线与标准参考曲线重合程度良好,表明该模型的预测准确度较高。通过临床决策曲线进一步评价模型的临床应用价值,提示本模型具有较高的临床净获益和广泛的阈概率取值范围。最后,通过本院数据对模型进行外部验证,证实了预测模型的有效性和潜在适用性。因此,本研究构建了可靠且易于使用的评分系统,临床医师可以通过加权风险变量分值,对远处转移性EC患者预后进行准确有效的预测。
本研究亦存在一些不足之处。首先,构建的预后模型是基于公共数据库(SEER)建立的,虽经过内部验证及小规模外部数据验证,但仍需要进一步评估其外部应用能力及外推性。其次,由于SEER数据库未能提供放疗、化疗以及靶向治疗的治疗方案和详细记录,且数据库缺乏淋巴脉管间隙浸润(lymph vascular space invasion, LVSI)、Ki-67、P53、错配修复(mismatchrepair, MMR)蛋白表达等重要信息,限制了本模型的进一步深入探究;最后,本研究是一个回顾性队列研究,证据等级相对较低,今后需要进一步通过前瞻性及多中心临床试验进行验证。
综上所述,本研究确定了远处转移性EC患者OS的独立预测因素,并建立了能够直观准确地预测个体生存预后的列线图模型,通过预测生存时间指导临床医师采取合适的手段对患者进行个性化治疗。
| [1] |
MORICE P, LEARY A, CREUTZBERG C, et al. Endometrial cancer[J]. Lancet, 2016, 387(10023): 1094-1108. |
| [2] |
SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2018[J]. CA Cancer J Clin, 2018, 68(1): 7-30. |
| [3] |
LIU J H, CUI G L, YE J, et al. Comprehensive analysis of the prognostic signature of mutation-derived genome instability-related lncRNAs for patients with endometrial cancer[J]. Front Cell Dev Biol, 2022, 10: 753957. |
| [4] |
COLOMBO N, CREUTZBERG C, AMANT F, et al. ESMO-ESGO-ESTRO consensus conference on endometrial cancer: diagnosis, treatment and follow-up[J]. Radiother Oncol, 2015, 117(3): 559-581. |
| [5] |
OULDAMER L, BENDIFALLAH S, BODY G, et al. Predicting poor prognosis recurrence in women with endometrial cancer: a nomogram developed by the FRANCOGYN study group[J]. Br J Cancer, 2016, 115(11): 1296-1303. |
| [6] |
郑云峰, 杨帆, 郭泽庚. 同源重组修复蛋白Rad51在癌症中的作用[J]. 生命的化学, 2022, 42(10): 1874-1880. ZHENG Y F, YANG F, GUO Z G. Roles of homologous recombination repair protein Rad51 in cancer[J]. Chem Life, 2022, 42(10): 1874-1880. |
| [7] |
MAO W P, WEI S M, YANG H, et al. Clinicopathological study of organ metastasis in endometrial cancer[J]. Future Oncol, 2020, 16(10): 525-540. |
| [8] |
LIU Y, CHI S Q, ZHOU X, et al. Prognostic value of distant metastatic sites in stage Ⅳ endometrial cancer: a SEER database study of 2948 women[J]. Int J Gynaecol Obstet, 2020, 149(1): 16-23. |
| [9] |
秦巧, 蔡晶, 蔡俐琼. 早期子宫内膜癌的预后预测和临床应用进展[J]. 河南医学研究, 2022, 31(23): 4407-4412. QIN Q, CAI J, CAI L Q. Advances in prognostic prediction in early endometrial cancer and their clinical applications[J]. Henan Med Res, 2022, 31(23): 4407-4412. |
| [10] |
YAN G W, LI Y B, DU Y M, et al. Survival nomogram for endometrial cancer with lung metastasis: a SEER databaseanalysis[J]. Front Oncol, 2022, 12: 978140. |
| [11] |
HU H J, WANG Z, ZHANG M F, et al. Clinicopathological characteristics and prognosis in endometrial cancer with bone metastasis: a SEER-based study of 584 women[J]. Front Oncol, 2021, 11: 694718. |
| [12] |
AMANT F, MOERMAN P, NEVEN P, et al. Endometrial cancer[J]. Lancet, 2005, 366(9484): 491-505. |
| [13] |
ETO T, SAITO T, KASAMATSU T, et al. Clinicopathological prognostic factors and the role of cytoreduction in surgical stage Ⅳb endometrial cancer: a retrospective multi-institutional analysis of 248 patients in Japan[J]. Gynecol Oncol, 2012, 127(2): 338-344. |
| [14] |
GEE M S, ATRI M, BANDOS A I, et al. Identification of distant metastatic disease in uterine cervical and endometrial cancers with FDG PET/CT: analysis from the ACRIN 6671/GOG 0233 multicenter trial[J]. Radiology, 2018, 287(1): 176-184. |
| [15] |
BARLIN J N, WYSHAM W Z, FERDA A M, et al. Location of disease in patients who Die from endometrial cancer[J]. Int J Gynecol Cancer, 2012, 1. |
| [16] |
ABDOL MANAP N, NG B K, PHON S E, et al. Endometrial cancer in pre-menopausal women and younger: risk factors and outcome[J]. Int J Environ Res Public Health, 2022, 19(15): 9059. |
| [17] |
CIRISANO F D, ROBBOY S J, DODGE R K, et al. The outcome of stage Ⅰ-Ⅱ clinically and surgically staged papillary serous and clear cell endometrial cancers when compared with endometrioid carcinoma[J]. Gynecol Oncol, 2000, 77(1): 55-65. |
| [18] |
XU Y Q, HANNA R K, ELSHAIKH M A. Adjuvant therapy of uterine clear cell carcinoma: a review[J]. Arch Gynecol Obstet, 2016, 293(3): 485-492. |
| [19] |
Horne ZD, Teterichko SR, Glaser SM, et al. Race-driven survival differential in women diagnosed with endometrial cancers in the USA[J]. Int J Gynecol Cancer, 2020, 30(12): 1893-1901. |
| [20] |
OAKNIN A, TINKER A V, GILBERT L, et al. Clinical activity and safety of the anti-programmed death 1 monoclonal antibody dostarlimab for patients with recurrent or advanced mismatch repair-deficient endometrial cancer[J]. JAMA Oncol, 2020, 6(11): 1766. |
| [21] |
SONG Z X, WANG Y Z, ZHOU Y Z, et al. A novel predictive tool for determining the risk of early death from stage Ⅳ endometrial carcinoma: a large cohort study[J]. Front Oncol, 2020, 10: 620240. |
| [22] |
TOBIAS C J, CHEN L, MELAMED A, et al. Association of neoadjuvant chemotherapy with overall survival in women with metastatic endometrial cancer[J]. JAMA Netw Open, 2020, 3(12): e2028612. |




