2. 400038 重庆, 陆军军医大学(第三军医大学)第一附属医院: 感染科;
3. 400038 重庆, 陆军军医大学(第三军医大学)第一附属医院: 呼吸内科
2. Department of Infectious Diseases, First Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400038, China;
3. Department of Respiratory Medicine, First Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400038, China
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)特征是持续的气流限制和呼吸系统症状[1-2],病因复杂,其本质是炎症反应,其中吸烟、感染、空气污染等起着重要作用[1, 3]。建立符合临床标准的COPD动物模型是开展研究的必要条件。早期COPD动物模型绝大部分采用对小鼠进行单一的烟草烟雾(cigarette smoke,CS)暴露方式造模[4],时间通常不少于24周[5],实验周期长,干扰因素多;少部分采用单一脂多糖(lipopolysaccharide,LPS)气管内注射造模[6],过分强调炎症反应忽略了主要病因,这些方法都不符合COPD的多因素致病的特征。最新研究提倡采用更加贴合COPD病因的LPS+CS联合诱导的方式对小鼠进行造模[7]。然而采用这种造模方式的绝大部分研究过分强调实验的短周期性,采用1个月的实验周期[7-8],虽然从实验结果观察也产生了较多典型的炎症和病理改变,但是没有从病理结构到肺功能全面分析模型是否符合临床标准,临床诊断以肺功能FEV1/FVC%<70%为金标准,病史、诱因等为辅助诊断依据。既往研究者尽管进行了肺功能的检测,但是没有采用反映小气道阻力的关键性指标FEV0.1/FVC%或者肺功能检测结果远高于临床FEV1/FVC%<70%的诊断标准,不符合临床实际,而不符合临床标准的模型又会极大地影响实验结果的可靠性。因此,本实验拟采用LPS+CS联合诱导进行造模,结合国内外研究结果综合考虑将周期延长至12周[9],造模后对小鼠呼吸系统从结构到功能进行全面评估,以期成功建立更符合临床标准的动物模型,为后续的实验打下基础。
1 材料与方法 1.1 实验动物及分组7周龄雄性C57BL/6小鼠,体质量18~22 g,购自陆军军医大学小鼠动物房,饲养1周以适应环境。小鼠置于25 ℃的恒温环境中,暗/光周期为12 h,并可自由进食鼠粮和水。取30只小鼠分为2组,每组15只(确保每个检测内容小鼠均为5只)。对照组:适龄小鼠存放在SPF级动物房独立的鼠笼中,小鼠可以正常自由活动保证食水;模型组(LPS+CS):将小鼠按照造模方法按时在气管内注射LPS后暴露于烟雾中。
1.2 造模使用LPS(Sigma-Aldrich,L2880)+CS方式造模[7, 10-12]。在第1天和第14天使用LPS(2 mg/kg)气管内给药,给药当天不给予烟熏。其余每天将小鼠置于50 cm×35 cm×30 cm的有机玻璃盒,暴露于烟草烟雾(焦油量11 mg,烟气烟碱量1.1 mg,烟气CO 12 mg,产自中国重庆烟草工业有限公司)2次/d(10支,60 min),连续12周[9, 13]。至第12周采集肺组织、肺泡灌洗液(bronchoalveolar lavage fluid,BALF)、外周血进行进一步处理和分析。
1.3 HE染色造模完成后,麻醉并进行灌注,取小鼠肺组织,置于4%中性福尔马林溶液中固定。石蜡包埋切片,HE染色。切片用乙醇脱水,干燥后用中性树脂密封。采用病理图像采集与分析系统,观察和记录小鼠肺组织的病理变化。
1.4 Masson染色对肺组织石蜡切片进行Masson三色染色后,观察肺实质和呼吸道的纤维蛋白沉淀情况,用于对比肺部病理变化,评估纤维化严重程度[14-16]。
1.5 肺组织病理评估在每个视野正中心画十字交叉线,计算与交叉线相交的肺泡间隔数(Ns)和每个视野内肺泡数(Na),同时测量十字线总长(L)和每个视野面积(S)。根据以下公式计算肺组织平均线性截距(mean linear intercept,MLI)和平均肺泡数(mean alveolar number,MAN)[17-20]。
1.6 外周血血浆收集将小鼠麻醉后,暴露小鼠心脏,使用1 mL胰岛素注射器从小鼠右心室收集血液,离心(4 ℃,3 000 r/min,30 min)后保存于-80 ℃冰箱冻存用作下一步分析。
1.7 肺泡灌洗液收集小鼠麻醉后暴露气管,使用手术缝合线将小鼠气管插管固定在气管内,而后,使用1 mL注射器汲取1 mL冷藏PBS(4 ℃)注入肺部反复冲洗3次。收集的肺泡灌洗液置于离心管离心(4 ℃,3 000 r/min,30 min),上清液保存在-80 ℃冰箱[21]。
1.8 ELISA检测炎症因子使用小鼠酶联免疫分析试剂盒,根据制造商使用说明操作,用酶标仪在450 nm波长下测定光密度值[D(450)],通过标准曲线计算肺泡灌洗液和外周血血浆中IFN-γ、IL-12、TNF-α、IL-6含量。
1.9 肺功能检测小鼠用戊巴比妥钠麻醉,然后行气管切开,使用配套的小鼠气管插管插入气管约1 cm, 而后将麻醉小鼠通过气管插管紧密连接到机械呼吸机(FlexiVent;SCIREQ,加拿大魁北克省蒙特利尔),使用FlexiVent FX-Mouse NPFE模式对小鼠进行3个周期的循环肺功能检测,取平均值后以FEV0.1/FVC%作为肺功能结果[22-23]。
1.10 统计学分析实验数据使用GraphPad Prism 7软件进行统计学处理,计量资料以x±s表示,2组数据比较采用独立样本t检验,分类资料采用相关性分析和线性回归分析。P < 0.05为差异有统计学意义。
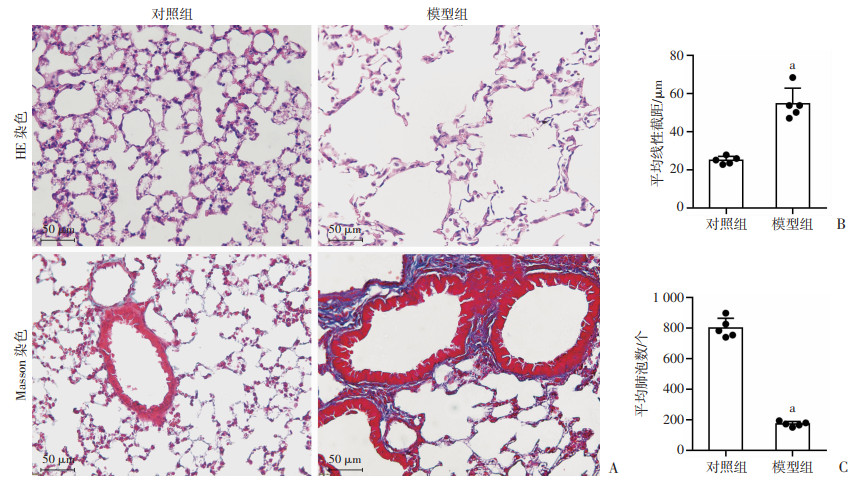
2 结果 2.1 模型组小鼠肺组织显示典型COPD病理改变肺部切片HE染色显示,经过LPS+CS暴露的模型组小鼠肺泡结构紊乱,肺泡膈变薄或断裂,肺泡腔扩大或融合,形成较多肺大泡,肺泡腔内还可见炎症细胞;而对照组小鼠的肺组织中没有见到类似病理改变,小鼠肺部结构整齐,肺泡结构明显(图 1A)。对2组小鼠肺组织切片分别进行病理评分后发现,模型组的平均肺泡截距明显大于对照组(P < 0.05),而每个视野的平均肺泡数则明显少于对照组(P < 0.05,图 1B、C)。Masson染色结果显示,模型组小鼠的肺组织中肺间质和小支气管周围组织纤维化明显,支气管上皮明显增厚,而在对照组中未发现类似的现象(图 1A)。
|
|
a:P < 0.05,与对照组比较 A:小鼠肺组织HE和Masson染色结果;B:2组小鼠病理切片肺泡平均线性截距;C:2组小鼠病理切片平均肺泡数 图 1 2组小鼠肺组织病理学观察和定量分析(n=5,x±s) |
2.2 模型组小鼠血浆和BALF中炎症因子显著增加
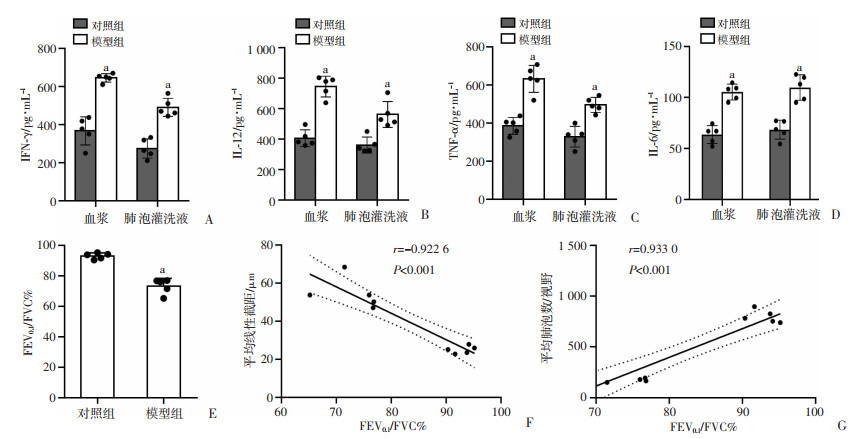
对外周血血浆和肺泡灌洗液上清液中的IFN-γ、IL-12、TNF-α、IL-6进行定量检测,统计结果显示与对照组相比,模型组外周血促炎炎症因子[IFN-γ(P < 0.05)、IL-12(P < 0.05)、TNF-α(P < 0.05)、IL-6(P < 0.05)]和肺泡灌洗液中促炎炎症因子[IFN-γ(P < 0.05)、IL-12(P < 0.05)、TNF-α(P < 0.01)、IL-6(P < 0.05)]均增加,与对照组比较差异均有统计学意义(图 2A~D)。
2.3 模型组小鼠肺功能显著下降造模成功后分别对2组小鼠进行肺功能检测,结果显示:与对照组相比,模型组的肺功能严重受损,FEV0.1/FVC%结果显示两组肺功能表现存在显著差异(图 2E)。将肺功能FEV0.1/FVC%的数据、平均线性截距(MLI)和平均肺泡数(MAN)分别进行线性相关性分析,发现两组数据与FEV0.1/FVC%均有强相关性(P < 0.01),其中平均线性截距和FEV0.1/FVC%呈显著负相关(r=-0.922 6,P < 0.001,图 2F),而平均肺泡数和FEV0.1/FVC%呈显著正相关(r=0.933 0,P < 0.001,图 2G)。
|
|
a:P < 0.05,与对照组比较 A:2组小鼠血浆和肺泡灌洗液IFN-γ统计分析;B: 2组小鼠血浆和肺泡灌洗液IL-12统计分析;C:2组小鼠血浆和肺泡灌洗液TNF-α统计分析;D:2组小鼠血浆和肺泡灌洗液IL-6统计分析;E:对照组和模型组小鼠肺功能分析;F: 肺泡平均线性截距与FEV0.1/FVC%相关性分析;G: 平均肺泡数与FEV0.1/FVC%相关性分析 图 2 2组小鼠肺泡灌洗液和血浆中炎症因子与肺功能变化差异(n=5,x±s) |
3 讨论
慢性阻塞性肺病是世界上第四大死亡原因,现在已成为日益重要的公共卫生挑战[24-25]。许多人因COPD遭受几十年的痛苦并因疾病本身或其并发症过早死亡[26]。因此,开展对COPD疾病病因机制和治疗的研究显得格外重要,而动物模型在COPD研究中发挥着不可取代的作用,所以建立符合临床标准的动物模型具有重大意义。
小鼠具有成本低廉、容易饲养、繁殖率高、世代周期短、结构和细胞功能与人类相近等优势,因此成为制作COPD模型的理想实验动物。早期的研究认为单一CS暴露是研究COPD最合适的造模方法[4-5, 20, 27-28],但是单一因素的干预并不符合COPD多因素致病的机制,并且造模周期过长,过长的周期也会带来更多的不稳定因素,增加实验难度,降低了可靠性,采用单一LPS造模亦不符合COPD的病因特征。因此,缩短造模周期和增加更多干预因素成为值得研究的问题。越来越多的研究提示采用多因素联合方式诱导COPD模型,其中应用最多的便是通过LPS+CS实现联合造模[7, 10-12]。虽然既往也有研究使用LPS+CS进行造模,但是绝大部分过分追求短周期,并没有从结构到功能提供一个完整的符合临床标准的模型,实验更多侧重于病理分析[10-11],忽略了肺功能检测,而肺功能检测(FEV1/FVC%)恰恰是COPD临床诊断的金标准,少数研究在对小鼠进行肺功能检测时仅仅检测呼气时间(Te)、放松时间(Tr)、吸气流量峰值(PIF)、呼气流量峰值(PEF)等非关键数据[20],或者由于造模时间偏短导致FEV0.1/FVC%>80%,不符合临床COPD诊断标准(FEV1/FVC%<70%)[13]。因此,需要在强调缩短建模周期的同时适当地延长造模时间,从而更有效地建立符合临床标准的模型。
本研究对LPS+CS暴露的小鼠进行肺组织病理切片并观察,结果发现肺泡膈变薄,肺泡腔扩大、破裂等典型的COPD病理改变,与单纯烟熏24周以及其他方法造模得到的病理结果相似[4-5]。在对肺组织的病理评估中,本研究使用平均肺泡数和平均肺泡截距对小鼠肺部病理改变进行量化分析,平均肺泡数更直观地反映了肺泡的损失情况,两组的显著差异也预示着模型组小鼠肺功能会产生较大损失;LPS+CS联合造模12周得到的平均肺泡截距与单一CS暴露造模24周的结果近似[5, 18, 20],数值处于同一区间,但是单独使用LPS进行12周造模的小鼠肺部病理切片平均肺泡截距明显更小[29],显然LPS+CS联合造模的方式效率更高。本研究还发现,与CS暴露小鼠相比,LPS+CS暴露小鼠气道周围的胶原沉积更早增加,表明CS + LPS可能通过促进炎症而诱导更严重的气道重塑。虽然被广泛接受的CS暴露24周的方法会导致明显的胶原沉积[20],但在本研究中,LPS+CS暴露12周后小气道周围胶原水平明显升高。
COPD是氧化应激和慢性炎症诱导肺泡凋亡和衰老的结果[3],因此,本研究通过对肺泡灌洗液和外周血血浆中IFN-γ、IL-12、TNF-α、IL-6含量进行测量,评估小鼠肺部和全身的炎症情况。虽然采用不同的试剂盒进行测量得到的数值不尽相同,但是本研究得到了和采用其他方式造模具有相似趋势的结果,这些结果均反映全身和局部炎症反应的增强。
以上结果毫无疑问反映了小鼠通过LPS+CS联合造模后肺部出现COPD病理和炎症改变,相关实验提示也许相对较短的时间就可以在肺组织内找到COPD相似的病理改变[10-11],但是局部的病理改变不能等同于功能的显著改变,在COPD诊断中,肺功能是金指标,而FEV1/FVC%是关键指标。FEV1/FVC%<70%代表气流受限,结合小鼠与人类呼吸频率的换算关系以及其他实验的经验,小鼠肺功能采用FEV0.1/FVC%用于评估[22, 30-31],因此,本研究选择使用FEV0.1/FVC%对两组小鼠进行肺功能检测。既往单一CS研究也有肺功能检测,但是没有选用FEV0.1/FVC%这一指标[4-5, 27-28];单一LPS造模后尽管FEV0.1/FVC%<70%[32],但使用LPS造模本身存在着不可忽视的弊端:①LPS在动物实验中可用来模拟细菌感染引发的急性炎症反应[33],而COPD的病因是复杂多样的,采用单一的方式不符合病因,且感染并不是COPD的最主要病因,因此模型建立的可靠性真实性不足;②短时间内使用LPS在呼吸系统研究中通常用来模拟细菌感染的急性肺损伤和慢性阻塞性肺疾病急性加重期(acute exacerbation of chronic obstructive pulmonary disease,AECOPD)[34],使用LPS诱导COPD模型可以理解为小鼠AECOPD模型,此时的肺功能结果无法真实反映肺功能的改变;本实验结果显示经过LPS+CS联合诱导12周造模后小鼠肺功能FEV0.1/FVC%处于70%左右,而采用相同方式造模10周时FEV0.1/FVC%虽然也有变化,但是数值普遍处于80%以上[13],显然造模诱导时间在10~12周之间肺功能下降较为明显。综上,LPS+CS联合诱导延长至12周得到的模型更加符合临床标准。
本研究也有一定的局限性:造模周期仅仅参考国外研究的时间[9, 13, 29],没有选取多个实验节点动态观察评估造模情况,如果能进行多个时间节点的结果比较可能会更有价值。
总之,本研究系统地比较了正常小鼠和LPS+CS暴露后小鼠的肺部病理改变、炎症情况和肺功能变化,证明LPS+CS联合诱导的方法在12周时间可以成功建立符合临床标准的小鼠COPD模型,比单一烟熏或者单一LPS造模简单可控有效,更加适合COPD的动物研究,为后续的实验提供了良好、可靠的基础。
| [1] |
CHRISTENSON S A, SMITH B M, BAFADHEL M, et al. Chronic obstructive pulmonary disease[J]. Lancet, 2022, 399(10342): 2227-2242. |
| [2] |
SORIANO J B, POLVERINO F, COSIO B G. What is early COPD and why is it important?[J]. Eur Respir J, 2018, 52(6): 1801448. |
| [3] |
RABE K F, WATZ H. Chronic obstructive pulmonary disease[J]. Lancet, 2017, 389(10082): 1931-1940. |
| [4] |
YOSHIDA M, MINAGAWA S, ARAYA J, et al. Involvement of cigarette smoke-induced epithelial cell ferroptosis in COPD pathogenesis[J]. Nat Commun, 2019, 10(1): 3145. |
| [5] |
MOTZ G T, EPPERT B L, WESSELKAMPER S C, et al. Chronic cigarette smoke exposure generates pathogenic T cells capable of driving COPD-like disease in Rag2-/- mice[J]. Am J Respir Crit Care Med, 2010, 181(11): 1223-1233. |
| [6] |
KOBAYASHI S, FUJINAWA R, OTA F, et al. A single dose of lipopolysaccharide into mice with emphysema mimics human chronic obstructive pulmonary disease exacerbation as assessed by micro-computed tomography[J]. Am J Respir Cell Mol Biol, 2013, 49(6): 971-977. |
| [7] |
CHEN J L, YANG X, ZHANG W Y, et al. Therapeutic effects of resveratrol in a mouse model of LPS and cigarette smoke-induced COPD[J]. Inflammation, 2016, 39(6): 1949-1959. |
| [8] |
YANG D Q, XU D, WANG T, et al. Mitoquinone ameliorates cigarette smoke-induced airway inflammation and mucus hypersecretion in mice[J]. Int Immunopharmacol, 2021, 90: 107149. |
| [9] |
KUBO H, ASAI K, KOJIMA K, et al. Astaxanthin suppresses cigarette smoke-induced emphysema through Nrf2 activation in mice[J]. Mar Drugs, 2019, 17(12): 673. |
| [10] |
CHENG Q M, FANG L J, FENG D D, et al. Memantine ameliorates pulmonary inflammation in a mice model of COPD induced by cigarette smoke combined with LPS[J]. Biomed Pharmacother, 2019, 109: 2005-2013. |
| [11] |
LEE K M, RENNE R A, HARBO S J, et al. 3-week inhalation exposure to cigarette smoke and/or lipopolysaccharide in AKR/J mice[J]. Inhal Toxicol, 2007, 19(1): 23-35. |
| [12] |
WANG L, PELGRIM C E, PERALTA MARZAL L N, et al. Changes in intestinal homeostasis and immunity in a cigarette smoke- and LPS-induced murine model for COPD: the lung-gut axis[J]. Am J Physiol Lung Cell Mol Physiol, 2022, 323(3): L266-L280. |
| [13] |
SHU J Z, LI D F, OUYANG H P, et al. Comparison and evaluation of two different methods to establish the cigarette smoke exposure mouse model of COPD[J]. Sci Rep, 2017, 7(1): 15454. |
| [14] |
DONG L Y, WANG Y, ZHENG T T, et al. Hypoxic hUCMSC-derived extracellular vesicles attenuate allergic airway inflammation and airway remodeling in chronic asthma mice[J]. Stem Cell Res Ther, 2021, 12(1): 4. |
| [15] |
SUZUKI M, IKARI J, ANAZAWA R, et al. PAD4 deficiency improves bleomycin-induced neutrophil extracellular traps and fibrosis in mouse lung[J]. Am J Respir Cell Mol Biol, 2020, 63(6): 806-818. |
| [16] |
ZHANG Y P, LI W B, WANG W L, et al. siRNA against plasminogen activator inhibitor-1 ameliorates bleomycin-induced lung fibrosis in rats[J]. Acta Pharmacol Sin, 2012, 33(7): 897-908. |
| [17] |
LVTHJE L, RAUPACH T, MICHELS H, et al. Exercise intolerance and systemic manifestations of pulmonary emphysema in a mouse model[J]. Respir Res, 2009, 10(1): 7. |
| [18] |
NAVARRO S, REDDY R, LEE J, et al. Inhaled resveratrol treatments slow ageing-related degenerative changes in mouse lung[J]. Thorax, 2017, 72(5): 451-459. |
| [19] |
WU H, MA H M, WANG L M, et al. Regulation of lung epithelial cell senescence in smoking-induced COPD/emphysema by microR-125a-5p via Sp1 mediation of SIRT1/HIF-1a[J]. Int J Biol Sci, 2022, 18(2): 661-674. |
| [20] |
YANG Y, DI T T, ZHANG Z X, et al. Dynamic evolution of emphysema and airway remodeling in two mouse models of COPD[J]. BMC Pulm Med, 2021, 21(1): 134. |
| [21] |
LEFRANÇAIS E, MALLAVIA B, ZHUO H J, et al. Maladaptive role of neutrophil extracellular traps in pathogen-induced lung injury[J]. JCI Insight, 2018, 3(3): e98178. |
| [22] |
GOEL K, SCHWEITZER K S, SERBAN K A, et al. Pharmacological sphingosine-1 phosphate receptor 1 targeting in cigarette smoke-induced emphysema in mice[J]. Am J Physiol Lung Cell Mol Physiol, 2022, 322(6): L794-L803. |
| [23] |
SERRÉ J, TANJEKO A T, MATHYSSEN C, et al. Enhanced lung inflammatory response in whole-body compared to nose-only cigarette smoke-exposed mice[J]. Respir Res, 2021, 22(1): 86. |
| [24] |
LIM S, LAM D C L, MUTTALIF A R, et al. Impact of chronic obstructive pulmonary disease (COPD) in the Asia-Pacific region: the EPIC Asia population-based survey[J]. Asia Pac Fam Med, 2015, 14(1): 4. |
| [25] |
LÓPEZ-CAMPOS J L, TAN W, SORIANO J B. Global burden of COPD[J]. Respirology, 2016, 21(1): 14-23. |
| [26] |
HALPIN D M G, CRINER G J, PAPI A, et al. Global initiative for the diagnosis, management, and prevention of chronic obstructive lung disease. the 2020 GOLD science committee report on COVID-19 and chronic obstructive pulmonary disease[J]. Am J Respir Crit Care Med, 2021, 203(1): 24-36. |
| [27] |
TAM A, CHURG A, WRIGHT J L, et al. Sex differences in airway remodeling in a mouse model of chronic obstructive pulmonary disease[J]. Am J Respir Crit Care Med, 2016, 193(8): 825-834. |
| [28] |
GENSCHMER K R, RUSSELL D W, LAL C, et al. Activated PMN exosomes: pathogenic entities causing matrix destruction and disease in the lung[J]. Cell, 2019, 176(1/2): 113-126. |
| [29] |
BAARSMA H A, BOS S, MEURS H, et al. Pharmacological inhibition of GSK-3 in a Guinea pig model of LPS-induced pulmonary inflammation: Ⅰ. Effects on lung remodeling and pathology[J]. Respir Res, 2013, 14(1): 113. |
| [30] |
BONNARDEL E, PREVEL R, CAMPAGNAC M, et al. Determination of reliable lung function parameters in intubated mice[J]. Respir Res, 2019, 20(1): 211. |
| [31] |
JOSHI R, HEINZ A, FAN Q, et al. Role for Cela1 in postnatal lung remodeling and alpha-1 antitrypsin-deficient emphysema[J]. Am J Respir Cell Mol Biol, 2018, 59(2): 167-178. |
| [32] |
ZHANG F B, GUO F F, LIU Y, et al. Shema oral liquid ameliorates the severity of LPS-induced COPD via regulating DNMT1[J]. Front Pharmacol, 2022, 13: 903593. |
| [33] |
NOVA Z, SKOVIEROVA H, CALKOVSKA A. Alveolar-capillary membrane-related pulmonary cells as a target in endotoxin-induced acute lung injury[J]. Int J Mol Sci, 2019, 20(4): 831. |
| [34] |
LU C, ZHANG X M, MA C Y, et al. Nontypeable Haemophilus influenzae DNA stimulates type Ⅰ interferon expression via STING signaling pathway[J]. Biochim Biophys Acta Mol Cell Res, 2018, 1865(4): 665-673. |





