2. 400054 重庆,重庆理工大学药学与生物工程学院
2. College of Pharmacy and Bioengineering, Chongqing University of Technology, Chongqing, 400054, China
心血管疾病(cardiovascular disease, CVD)的发病率和致残率高,是全球死亡的主要原因[1-2]。动脉粥样硬化(atherosclerosis, AS)则是心血管疾病的主要病理基础和重要环节[3]。除了广泛认知的致病因素高血脂外,内皮功能障碍被认为是AS发病的又一重要因素,并且一直伴随AS的发展[4]。内皮功能障碍会释放炎症因子IL-6、TNF-α,促进白细胞与内皮细胞黏附并移位到内皮下,其中单核细胞在内皮下分化为巨噬细胞,巨噬细胞吞噬大量脂质进一步形成泡沫细胞,逐步形成粥样斑块,持续的脂质和泡沫细胞累积,动脉粥样斑块进一步发展,导致动脉管腔逐渐狭窄,甚至斑块破裂,引起动脉阻塞,最终引发一系列心血管严重并发症[5-6]。目前治疗AS仍以降脂药物他汀类为主,通过降低胆固醇水平来实现其降脂作用,但是部分患者使用他汀类药物后会出现肝毒性和肌毒性等不良反应[7-8];尤其是在他汀类降脂药物广泛使用的情况下,AS发病率仍居高不下,表明亟须寻找新的AS防治药物。人参是古老的中药之一[9]。人参皂苷CK(compound K)是人参的有效代谢产物,具有抗炎、抗肿瘤、治疗糖尿病和抗AS作用[10-13],但其水溶性较差,影响药物吸收[14]。为了改善人参皂苷CK的水溶性,提高其成药性,课题组前期研究中自主合成了一系列衍生物,通过体外活性筛选发现人参皂苷CK衍生物CK201水溶性显著提高且能有效抑制泡沫细胞的形成[15],目前CK201已获得国内外多项专利[16-20]。但是CK201是否具有AS防治作用尚未明确。本研究使用ApoE-/-敲基因小鼠和人脐静脉内皮细胞HUVECs,观察人参皂苷衍生物CK201的AS防治作用,初步探索其作用机制及安全性,以期获得一个既具有良好AS防治作用,又具有一定安全性的人参皂苷衍生物,为进一步开发CK201提供理论依据。
1 材料与方法 1.1 主要试剂与仪器阿托伐他汀钙购自上海赛默飞世尔科技有限公司(纯度:>95%);人参皂苷CK购自成都瑞芬思生物科技有限公司(纯度:>98%);CK201由课题组制备(分子量:874,纯度:>98%);棕榈酸购自北京百灵威科技有限公司;BCECF-AM荧光探针染料、GAPDH小鼠单克隆抗体、IL-6小鼠单克隆抗体和TNF-α兔多克隆抗体购自上海碧云天生物技术有限公司;高脂饲料购自睿迪生物科技有限公司。迈瑞兽用全自动血液细胞分析仪型号为BC-2800vet;全自动生化分析仪型号为Chemray 240、Chemray 800(深圳雷杜生命科技公司);石蜡切片机型号为HistoCore BIOCUT;冷冻切片机型号为Leica CM1950;显影仪型号为GelView 6000 Pro。
1.2 实验细胞和动物人脐静脉内皮细胞HUVECs和人单核细胞THP-1来源美国ATCC公司。本研究符合陆军军医大学实验动物福利伦理委员会制定的伦理学标准(AMUWEC20203377)。6周龄雄性ApoE-/-小鼠30只,体质量为20~23 g,购自成都药康生物科技有限公司, 实验动物生产许可证号为SCXY(川)2020-034,使用许可证号为SYXK(渝)2017-0002。小鼠均在陆军军医大学动物实验中心SPF级动物房饲养以及给药处理,室内温度为(22±2)℃,湿度为50%~70%,昼夜交替时间为12 h/12 h。
1.3 方法 1.3.1 实验动物分组6周龄雄性ApoE-/-小鼠30只,基因鉴定合格后,于陆军军医大学动物实验中心SPF级动物房适应饲养1周后,通过完全随机分组法分为5组(n=6)。①溶剂对照组:普通维持饲料喂养,灌胃溶剂(30%丙二醇+70%生理盐水);②模型组:高脂饲料喂养,灌胃溶剂(30%丙二醇+70%生理盐水);③CK组:高脂饲料喂养,灌胃人参皂苷CK溶液(3 mg/kg);④阿托伐他汀钙组:高脂饲料喂养,灌胃阿托伐他汀钙溶液(3 mg/kg);⑤CK201组:高脂饲料喂养,灌胃人参皂苷CK衍生物CK201溶液(3 mg/kg)。每次给药前称取小鼠体质量,根据体质量计算给药体积,连续给药12周,每周6次。小鼠于样本采集前禁食12 h,采集全血,随后行安乐死。解剖小鼠,取主动脉血管,用于油红O染色,统计斑块面积;取肝脏固定,用于HE染色和油红O染色观察肝脏病变情况。
1.3.2 油红O染色取ApoE-/-小鼠主动脉,剥离脂肪组织和筋膜,纵切主动脉,内膜面朝上,用油红O染液染色20 min,弃去染液,75%乙醇洗去多余油红O染液,显微镜下采集图片。分析斑块面积与主动脉血管总面积之比;进一步分析斑块抑制率,用(模型组斑块面积之比-各组斑块面积之比)/模型组斑块面积之比表示。
取ApoE-/-小鼠肝脏,4%多聚甲醛固定24 h,蔗糖溶液梯度脱水24 h,将组织置于包埋剂中冷冻凝固,待冷冻切片机降温至-20 ℃后,将肝脏组织切为10 μm薄片,粘贴于载玻片上,室温放置1 h,蒸馏水洗去包埋剂,滴加油红O染液染色8 min,随后用PBS洗去多余染色剂,再用75%乙醇分化,蒸馏水清洗,待切片稍干后,甘油明胶封片,显微镜下采集图片。
1.3.3 HE染色取ApoE-/-小鼠肝脏,经4%多聚甲醛固定24 h,梯度脱水,二甲苯透明,石蜡包埋,随后使用石蜡切片机将组织切为5 μm薄片。将切片粘贴于载玻片上,烤片过夜,梯度复水,用苏木精染色10 min,自来水反蓝,伊红(水溶)染色1 min,自来水适当冲洗,梯度脱水,二甲苯透明,中性树胶封片,显微镜下采集图片。
1.3.4 血脂及生化指标检测使用全自动生化分析仪Chemray 240和Chemray 800检测ApoE-/-小鼠血浆中总胆固醇(TC)、甘油三酯(TG)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、尿素氮(BUN)、肌酐(Cr)和尿酸(UA)含量。使用迈瑞兽用全自动血液细胞分析仪分析ApoE-/-小鼠血常规:白细胞、中性粒细胞、红细胞数量,血红蛋白、血小板含量。
1.3.5 Western blot检测ApoE-/-小鼠腹主动脉炎症因子IL-6、TNF-α表达取ApoE-/-小鼠腹主动脉,0 ℃加入适当裂解液研磨裂解20 min,离心(10 000 r/min,4 ℃,10 min)取上清。用BCA试剂盒检测总蛋白浓度,将浓度调至2 μg/μL,加入蛋白上样缓冲液,金属浴100 ℃变性10 min。冷却至室温后,上样SDS凝胶电泳,转膜,封闭,PBST洗3次。用一抗稀释液按照比例稀释TNF-α兔多克隆抗体(1 ∶200),IL-6小鼠单克隆抗体(1 ∶500),GADPH小鼠单克隆抗体(1 ∶2 000),4 ℃孵育过夜。PBST洗去多余一抗后,加入相应二抗,室温孵育1 h,PBST洗3次,在现配制的显影液中孵育5 min,显影,采集目标蛋白灰度值图片。
1.3.6 Western blot检测HUVECs细胞炎症因子IL-6、TNF-α表达将HUVECs细胞以5×105个/mL的密度接种于6孔板中,2 mL/孔,培养过夜。弃去旧培养基,空白对照组、模型组加入空白完全培养基,另外3个组分别加入CK201(3、10、30 μmol/L),培养24 h。除空白对照组外,其余组加入100 μmol/L的棕榈酸(palmitic acid, PA),培养24 h。弃细胞完全培养基,用PBS洗2次,加入细胞裂解液,冰上裂解10 min,离心(10 000 r/min,4 ℃,10 min),取上清。后续总蛋白浓度检测及Western blot实验方法同于1.3.5。
1.3.7 THP-1细胞与HUVECs细胞黏附实验将HUVECs细胞以8×104个/mL的密度接种于24孔板中,培养过夜。弃去旧培养基,空白对照组、模型组加入空白完全培养基,另外3个组分别加入CK201(3、10、30 μmol/L)培养24 h。除对照组外,其余组加入100 μmol/L的PA培养24 h。向细胞密度为2×105个/mL的THP-1中加入2 μmol/L BCECF-AM荧光探针,避光孵育30 min,离心(常温,1 200 r/min,5 min),去上清,加入完全培养基重悬THP-1。弃去上述HUVECs细胞原培养基,加入孵育过BCECF-AM荧光探针的THP-1细胞悬液,共孵育1 h,然后PBS洗5次。倒置荧光显微镜下采集图片。
1.3.8 HUVECs细胞划痕愈合实验将HUVECs细胞以2×105个/mL的密度接种于24孔板中培养过夜。弃去旧培养基,空白对照组、模型组加入空白完全培养基,另外3个组分别加入CK201(3、10、30 μmol/L) 培养24 h。弃去原培养基后划痕,用灭菌PBS洗去脱落细胞,在倒置显微镜下采集细胞划痕图片。弃去PBS,对照组加入空白培养基,模型组加入PA(100 μmol/L),各实验组分别加入对应浓度的CK201和PA(100 μmol/L)培养24 h。弃去原培养基,灭菌PBS洗去漂浮细胞,在倒置显微镜下采集图片。
1.4 统计学分析所有实验结果使用Graghpad Prism 8.0软件进行统计学分析,计量资料以x±s表示。多组间比较用单因素方差分析,检验水准α=0.05。
2 结果 2.1 CK201对ApoE-/-小鼠主动脉粥样硬化斑块形成的影响小鼠主动脉粥样硬化斑块油红O染色显示,与溶剂对照组比较,模型组斑块面积显著增加(P<0.05);与模型组比较,CK组、阿托伐他汀钙组和CK201组均有效抑制ApoE-/-小鼠主动脉斑块的形成(P<0.05),主动脉粥样硬化斑块抑制率分别为35.9%、26.6%、62.4%;与阳性药物阿托伐他汀钙组比较,CK201组能更显著地抑制主动脉粥样硬化斑块的形成(P<0.05,图 1)。实验结果表明CK201能显著抑制主动脉粥样硬化斑块形成作用,且效果优于临床使用的一线药物阿托伐他汀钙。
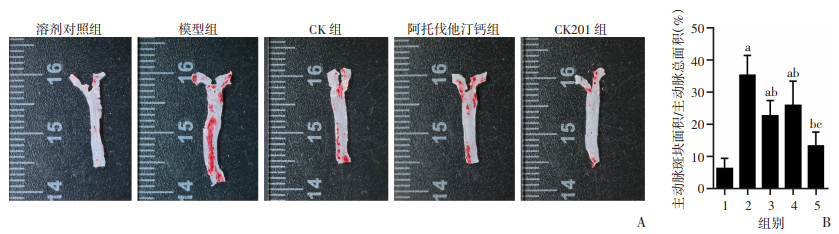
|
| A: 各组ApoE-/-小鼠主动脉斑块油红O染色;B: 各组ApoE-/-小鼠主动脉斑块面积/主动脉总面积a: P<0.05,与溶剂对照组比较;b: P<0.05,与模型组比较;c:P<0.05,与阿托伐他汀钙组比较;1:溶剂对照组;2:模型组;3:CK组;4:阿托伐他汀钙组;5:CK201组 图 1 CK201对ApoE-/-小鼠主动脉粥样硬化斑块形成的影响(n=6) |
2.2 CK201对ApoE-/-小鼠肝脏组织脂质堆积的影响
为了评估CK201对小鼠肝脏组织脂质堆积的影响,对肝脏组织HE染色和油红O染色的病理切片进行分析。肝脏组织切片HE染色结果显示,与溶剂对照组比较,模型组肝组织出现明显脂肪样变;与模型组比较,各组肝组织脂肪样变明显减少,其中CK201组肝组织脂肪样变的减少比CK组和阿托伐他汀钙组更显著(图 2A)。肝脏组织切片油红O染色结果显示,与溶剂对照组比较,模型组肝组织出现显著脂质沉积(P<0.05);与模型组比较,原型药物CK组、阳性药物阿托伐他汀钙组和CK201组肝脏脂质堆积均减少(P<0.05),其中CK201组脂质沉积最少(P<0.05,图 2B、C)。
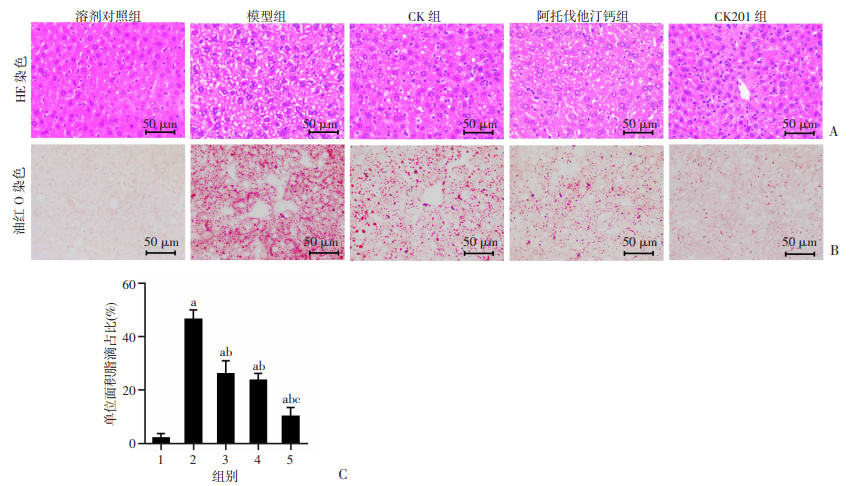
|
| A:ApoE-/-小鼠肝脏组织病理切片HE染色;B:ApoE-/-小鼠肝脏组织病理切片油红O染色;C:ApoE-/-小鼠肝脏组织病理切片油红O染色单位面积脂滴占比a: P<0.05,与溶剂对照组比较;b: P<0.05,与模型组比较;c: P<0.05,与阿托伐他汀钙组比较;1:溶剂对照组;2:模型组;3:CK组;4:阿托伐他汀钙组;5:CK201组 图 2 CK201对ApoE-/-小鼠肝脏组织脂质堆积的影响(n=6) |
2.3 CK201对ApoE-/-小鼠血脂的影响
ApoE-/-小鼠血浆TC、TG检测结果显示:与溶剂对照组比较,模型组小鼠血浆中TC、TG升高(P<0.05);与模型组相比,阿托伐他汀钙、CK和CK201组ApoE-/-小鼠血浆中的TC水平均降低,对TG没有明显调节作用(P<0.05,图 3)。结果表明,CK201具有降低小鼠血浆总胆固醇含量的作用,且作用效果与阿托伐他汀钙相当。
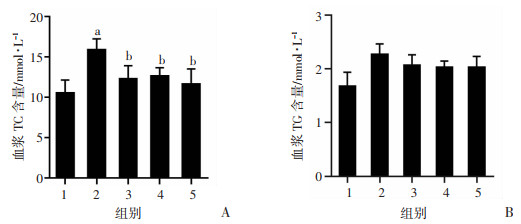
|
| A:ApoE-/-小鼠血浆TC含量;B:ApoE-/-小鼠血浆TG含量a: P<0.05,与溶剂对照组比较;b: P<0.05,与模型组比较;1:溶剂对照组;2:模型组;3:CK组;4:阿托伐他汀钙组;5:CK201组 图 3 CK201对ApoE-/-小鼠血脂的影响(n=6) |
2.4 Western blot检测ApoE-/-小鼠腹主动脉炎症因子IL-6、TNF-α表达
ApoE-/-小鼠腹主动脉IL-6、TNF-α的Western blot检测结果显示,与溶剂对照组比较,模型组小鼠腹主动脉IL-6、TNF-α表达显著增加(P<0.05);与模型组比较,阿托伐他汀钙、CK和CK201组IL-6、TNF-α的表达均降低(P<0.05);与阿托伐他汀钙比较,CK201能更有效抑制IL-6、TNF-α的表达(图 4)。结果表明,CK201能显著抑制主动脉炎症因子IL-6、TNF-α的表达。
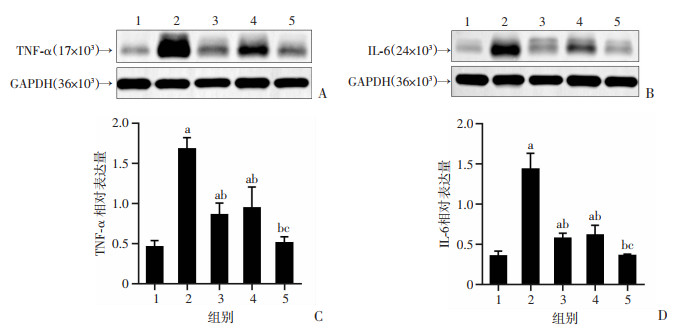
|
| A:Western blot检测ApoE-/-小鼠腹主动脉中TNF-α表达;B:Western blot检测ApoE-/-小鼠腹主动脉中IL-6表达;C:TNF-α相对表达量(TNF-α/GAPDH);D:IL-6相对表达量(IL-6/GAPDH) a: P < 0.05, 与溶剂对照组比较;b: P < 0.05,与模型组比较;c:P < 0.05,与阿托伐他汀钙组比较;1:溶剂对照组;2:模型组;3:CK组;4:阿托伐他汀钙组;5:CK201组 图 4 CK201对ApoE-/-小鼠主动脉根IL-6和TNF-α表达的影响(n=6) |
2.5 CK201对HUVECs细胞募集THP-1细胞的影响
HUVECs细胞募集THP-1细胞实验结果显示,与空白对照组相比,模型组HUVECs内皮细胞与THP-1单核细胞的黏附显著增加(P < 0.05);与模型组比较,CK201低、中、高剂量呈浓度依赖性降低HUVECs内皮细胞与THP-1单核细胞的黏附(P < 0.05,图 5), 表明CK201可有效抑制HUVECs细胞募集THP-1细胞。
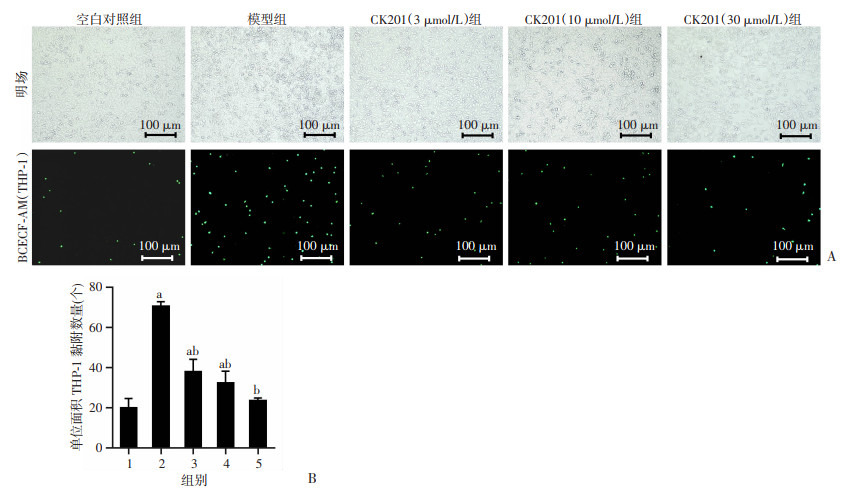
|
| A: 荧光染料BCECF-AM染色THP-1,观察其对内皮细胞HUVECs的黏附;B:THP-1细胞对HUVECs细胞的黏附量a:P<0.05,与空白对照组比较;b:P<0.05,与模型组比较;1:空白对照组;2:模型组(100 μmol/L PA刺激);3~5:分别为CK201(3 μmol/L)、CK201(10 μmol/L)、CK201(30 μmol/L)组 图 5 CK201对HUVECs细胞募集单核细胞THP-1的影响(n=3) |
2.6 CK201对HUVECs细胞迁移能力的影响
HUVECs划痕愈合实验结果显示,与空白对照组相比,模型组愈合面积显著减少(P<0.05);与模型组比较,CK201低、中、高剂量组可呈浓度依赖性的增加内皮细胞的愈合面积(P<0.05,图 6)。结果表明,CK201能有效增强HUVECs细胞迁移能力。
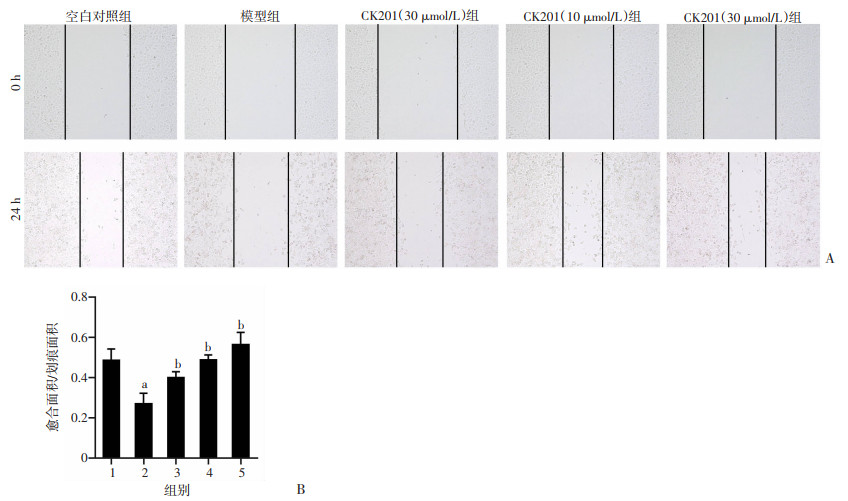
|
| A:HUVECs细胞划痕后0 h和24 h空白区域面积;B:HUVECs细胞划痕后24 h愈合面积与划痕面积的比值a:P<0.05,与空白对照组比较;b:P<0.05,与模型组比较;1:空白对照组;2:模型组(100 μmol/L PA刺激);3~5:分别为CK201(3 μmol/L)、CK201(10 μmol/L)、CK201(30 μmol/L)组 图 6 CK201对HUVECs细胞迁移能力的影响(n=3) |
2.7 Western blot检测HUVECs细胞炎症因子TNF-α、IL-6表达
Western blot检测HUVECs细胞TNF-α、IL-6表达,结果显示,与空白对照组比较,模型组TNF-α和IL-6表达水平均升高(P<0.05);与模型组比较,CK201低、中、高剂量均降低了TNF-α的表达(P<0.05);CK201高剂量可显著降低IL-6的表达(P<0.05,图 7)。结果表明,CK201可抑制HUVECs细胞炎症因子TNF-α和IL-6的表达。
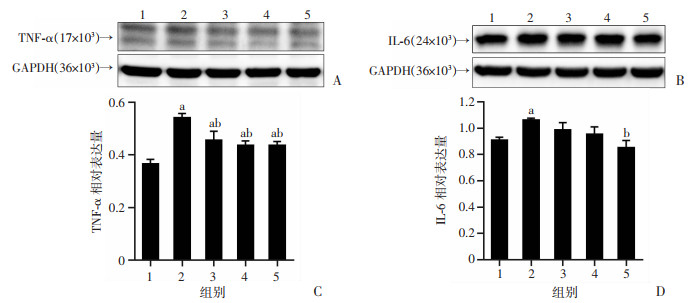
|
| A:Western blot检测HUVECs细胞中TNF-α表达;B:Western blot检测HUVECs细胞中IL-6表达;C:TNF-α相对表达量(TNF-α/GAPDH);D:IL-6相对表达量(IL-6/GAPDH) a:P<0.05,与空白对照组比较;b:P<0.05,与模型组比较;1:空白对照组;2:模型组(100 μmol/L PA刺激);3~5:分别为CK201(3 μmol/L)、CK201(10 μmol/L)、CK201(30 μmol/L)组 图 7 CK201对HUVECs细胞中IL-6和TNF-α表达的影响(n=3) |
2.8 CK201对ApoE-/-小鼠肝功能、肾功能和血常规的影响
小鼠血浆中AST和ALT含量检测结果显示,各组指标无异常(图 8A、B)。小鼠血浆中尿素氮结果显示,各组指标无显著异常(图 8C)。各组血液白细胞、中性粒细胞、红细胞数量和血红蛋白结果都在正常值范围内(图 8F~I)。肝功能和血常规结果提示CK201不会导致高脂饲料喂养的ApoE-/-小鼠肝脏和外周血指标异常。
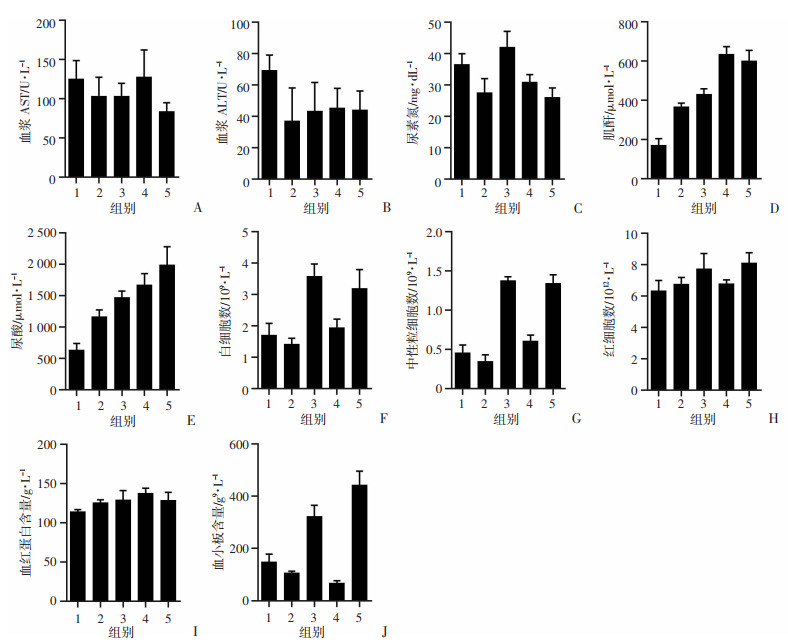
|
| A:ApoE-/-小鼠血浆AST含量;B:ApoE-/-小鼠血浆ACT含量;C:ApoE-/-小鼠血浆尿素氮含量;D:ApoE-/-小鼠血浆肌酐含量;E:ApoE-/-小鼠血浆尿酸含量;F:ApoE-/-小鼠血液白细胞数量;G:ApoE-/-小鼠血液中性粒细胞数量;H:ApoE-/-小鼠血液红细胞数量;I:ApoE-/-小鼠血液血红蛋白含量;J:ApoE-/-小鼠血液血小板含量1:溶剂对照组;2:模型组;3:CK组;4:阿托伐他汀钙组;5:CK201组 图 8 CK201对ApoE-/-小鼠的初步安全性评价(n=6) |
3 讨论
AS是一种慢性炎症疾病,是最基础和最危险的心血管疾病[21]。AS的特征是动脉血管壁内的慢性炎症和脂质堆积导致动脉血管堵塞,甚至阻断血液流向其他动脉,最终导致心脏病和缺血性卒中等AS性心血管疾病的发生[3]。AS的发病机制涉及炎症反应、脂质浸润、内皮功能损伤等。目前临床治疗AS的首选药物仍是胆固醇合成限速酶3-羟基-3-甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂他汀类降脂药物[22]。但研究发现服用他汀类药物后,患者会出现肌肉疼痛、关节炎、横纹肌溶解和肝毒性等不良反应,甚至给患者带来生命威胁,而且在广泛使用他汀类药物后,AS导致的心血管疾病发病率依旧很高[7-8]。因此亟待开发不良反应更少、抗AS效果更好的药物。本课题组前期研究中发现自主合成化合物CK201能抑制泡沫细胞的形成[15],泡沫细胞是形成AS的关键,提示CK201可能具有AS防治作用,本研究进一步阐明了CK201具有抗AS作用,且初步探讨了其作用机制。
3.1 CK201具有显著的抗AS作用本研究通过体内整体动物实验来评价CK201抗AS作用。AS斑块是判定其防治作用的重要指标,本研究使用高脂饲料喂养ApoE-/-小鼠12周,发现小鼠主动脉出现明显AS斑块,斑块面积占血管总面积的(35.17±6.22)%;同时口服3 mg/kg原型化合物CK、阳性药物阿托伐他汀钙和自主合成化合物CK201,AS斑块面积均显著下降,斑块抑制率分别是35.9%、26.6%、62.4%。以上结果证明CK201能有效抑制AS斑块的形成,优于阳性药物阿托伐他汀钙及其原型化合物CK。肝脏是脂肪主要代谢场所,而过度的脂质堆积在肝细胞则会引起脂肪肝病变,通过肝脏病理学切片HE和油红O染色考察了在3 mg/kg的剂量下CK201对小鼠肝脏脂质堆积的影响,发现CK201并未影响肝细胞正常形态,并且与阳性药物阿托伐他汀钙相比,CK201能显著地抑制肝脏脂肪堆积。提示CK201具有防治脂肪肝的潜在作用。
3.2 CK201抗AS作用机制高血脂是导致AS发生发展的重要因素,降脂疗法是目前治疗AS的主要方式,血脂检测结果显示,CK201具有与阿托伐他汀钙相当的降TC的作用,课题组前期研究结果提示可能与LXRα-ABCA1信号通路相关[13, 15]。但是CK201抑制斑块形成的作用却显著强于阿托伐他汀钙,提示除降脂外,CK201可能通过其他作用机制抑制斑块形成。研究表明内皮是血管壁上的单层细胞,具有维持多器官健康和动态平衡的关键作用[5];而内皮功能损伤是AS的早期事件,当内皮细胞暴露在游离脂肪酸、胆固醇结晶、炎症刺激和血流变化等危险因素中被激活,使内皮细胞通透性增加,并释放白细胞介素IL-6和肿瘤坏死因子TNF-α等炎症因子,募集单核细胞附着在活化的内皮细胞上,接着穿过动脉壁,引发局部炎症,同时更多的脂质也会穿过内皮细胞进入动脉内壁,形成脂质堆积[5, 23]。内皮功能障碍的加重还是斑块不稳定而破裂的因素之一[24]。在本研究中,通过评估CK201对主动脉炎症因子IL-6、TNF-α表达的影响,CK201对人脐静脉内皮细胞HUVECs迁移能力、募集单核细胞的作用和炎症因子IL-6、TNF-α表达的影响,进一步探索CK201防治AS的作用机制。本实验结果表明CK201可显著抑制主动脉IL-6、TNF-α的表达,提示CK201可通过抑制主动脉炎症反应减少斑块的生成。PA可诱导内皮细胞的脂毒性[25],引起内皮细胞损伤。在PA刺激下,测定HUVECs细胞中炎症因子的表达,发现PA可以诱导IL-6、TNF-α蛋白表达,经过CK201处理后,HUVECs细胞的IL-6、TNF-α表达均下降,表明CK201可抑制HUVECs细胞的炎症反应;且发现CK201能有效减少单核细胞THP-1对PA刺激的HUVECs细胞的黏附;通过体外模拟血管内皮损伤修复过程,划痕处理单层HUVECs细胞,发现在PA刺激下HUVECs细胞迁移能力显著下降,而通过CK201的干预,能明显改善PA刺激的HUVECs细胞迁移能力,证明CK201可促进内皮细胞迁移。以上实验结果表明CK201可通过抑制内皮细胞炎症反应和单核细胞与内皮细胞的黏附,促进内皮细胞迁移,抑制内皮功能损伤,起到保护内皮作用。
3.3 CK201对ApoE-/-小鼠肝脏和血液系统无显著影响肝脏是药物代谢的主要场所,化合物CK201本身或其代谢产物对肝脏可能具有未知毒性,而血浆中AST和ALT水平是评价肝脏功能的直接指标,本研究发现CK201未导致小鼠血浆中AST和ALT水平异常,表明以3 mg/kg的CK201处理ApoE-/-小鼠12周不会导致小鼠肝功能异常。血常规检测发现小鼠口服CK201后,外周血中白细胞、中性粒细胞、红细胞和血红蛋白水平并未异常,提示CK201不会导致小鼠外周血液异常。以上结果提示CK201对ApoE-/-小鼠肝脏和血液系统无显著影响。
综上所述,本研究发现人参皂苷衍生物CK201可显著降低ApoE-/-小鼠主动脉粥样硬化斑块形成,明显优于目前临床使用药物阿托伐他汀钙。与阿托伐他汀钙相比,CK201还能有效地减少ApoE-/-小鼠肝脏脂质堆积。经初步机制探索发现,CK201对AS防治作用可能与降低血浆TC、保护内皮细胞、抑制主动脉血管炎症反应有关。尽管本研究对CK201的具体分子机制尚未进行系统性研究,但研究结果提示其通过下调饱和脂肪酸触发的内皮细胞炎症反应从而抑制动脉粥样硬化斑块的形成。研究表明饱和脂肪酸能触发TLR4(toll like receptor 4)介导的炎症反应[26],CK201下调内皮细胞炎症反应可能与TLR4信号通路有关,课题组将开展进一步的研究。
| [1] |
VIRANI SALIM S, ALVARO A, APARICIO HUGO J, et al. Heart disease and stroke statistics—2021 update: a report from the American Heart Association[J]. Circulation, 2021, 143(8): e254-e743. |
| [2] |
ZHAO D, LIU J, WANG M, et al. Epidemiology of cardiovascular disease in China: current features and implications[J]. Nat Rev Cardiol, 2019, 16(4): 203-212. |
| [3] |
LIBBY P, BURING J E, BADIMON L, et al. Atherosclerosis[J]. Nat Rev Dis Primers, 2019, 5(1): 56. |
| [4] |
GUTIERREZ E, FLAMMER A J, LERMAN L O, et al. Endothelial dysfunction over the course of coronary artery disease[J]. Eur Heart J, 2013, 34(41): 3175-3181. |
| [5] |
XU S W, ILYAS I, LITTLE P J, et al. Endothelial dysfunction in atherosclerotic cardiovascular diseases and beyond: from mechanism to pharmacotherapies[J]. Pharmacol Rev, 2021, 73(3): 924-967. |
| [6] |
GLASS C K, WITZTUM J L. Atherosclerosis. the road ahead[J]. Cell, 2001, 104(4): 503-516. |
| [7] |
LU B, SUN L, SERAYDARIAN M, et al. Effect of SLCO1B1 T521C on statin-related myotoxicity with use of lovastatin and atorvastatin[J]. Clin Pharmacol Ther, 2021, 110(3): 733-740. |
| [8] |
ZHANG H P, WU J N, ZHANG Z L, et al. Association of atorvastatin with the risk of hepatotoxicity: a pilot prescription sequence symmetry analysis[J]. Ther Clin Risk Manag, 2019, 15: 803-810. |
| [9] |
BAI L T, GAO J L, WEI F, et al. Therapeutic potential of ginsenosides as an adjuvant treatment for diabetes[J]. Front Pharmacol, 2018, 9: 423. |
| [10] |
CHEN J Y, WANG Q T, WU H X, et al. The ginsenoside metabolite compound K exerts its anti-inflammatory activity by down-regulating memory B cell in adjuvant-induced arthritis[J]. Pharm Biol, 2016, 54(7): 1280-1288. |
| [11] |
CHEN H F, WU L X, LI X F, et al. Ginsenoside compound K inhibits growth of lung cancer cells via HIF-1α-mediated glucose metabolism[J]. Cell Mol Biol (Noisy-le-grand), 2019, 65(4): 48-52. |
| [12] |
SHAO X T, LI N, ZHAN J Z, et al. Protective effect of compound K on diabetic rats[J]. Nat Prod Commun, 2015, 10(2): 243-245. |
| [13] |
ZHOU L, ZHENG Y, LI Z Y, et al. Compound K attenuates the development of atherosclerosis in ApoE (-/-) mice via LXRα activation[J]. Int J Mol Sci, 2016, 17(7): 1054. |
| [14] |
ZHANG Y W, TONG D Y, CHE D B, et al. Ascorbyl palmitate/d-α-tocopheryl polyethylene glycol 1000 succinate monoester mixed micelles for prolonged circulation and targeted delivery of compound K for antilung cancer therapy in vitro and in vivo[J]. Int J Nanomedicine, 2017, 12: 605-614. |
| [15] |
HUANG Y, LIU H M, ZHANG Y X, et al. Synthesis and biological evaluation of ginsenoside compound K derivatives as a novel class of LXRα activator[J]. Molecules, 2017, 22(7): 1232. |
| [16] |
李晓辉, 贾乙, 黄琰. 二醇型人参皂苷衍生物及其制备方法和应用: ZL201610828140.7[P]. 2018-07-17. LI X H, JIA Y, HUANG Y. Panaxdiol-type Ginsenoside derivative, preparation method therefor and use thereof: ZL 201610828140.7[P]. 2018-07-17. |
| [17] |
LI X H, JIA Y, HUANG Y. Panaxdiol-type Ginsenoside derivative, preparation method therefor and use thereof: RU 2730495C1[P]. 2020-08-24.
|
| [18] |
LI X H, JIA Y, HUANG Y. Panaxdiol-type Ginsenoside derivative, preparation method therefor and use thereof: US11091511B2[P]. 2021-08-17.
|
| [19] |
李晓辉, 贾乙, 黄琰. パナキシジオール型ギンセノシド誘導体、その製造方法およびその使用: 特願2019-536633[P]. 2021-04-13.
|
| [20] |
LI X H, JIA Y, HUANG Y. Panaxdiol-type Ginsenoside derivative, preparation method therefor and use thereof: IN 388081[P]. 2022-01-31.
|
| [21] |
SIEGEL D, DEVARAJ S, MITRA A, et al. Inflammation, atherosclerosis, and psoriasis[J]. Clinic Rev Allerg Immunol, 2013, 44(2): 194-204. |
| [22] |
ENDO A. A gift from nature: the birth of the statins[J]. Nat Med, 2008, 14(10): 1050-1052. |
| [23] |
CHISTIAKOV D A, MELNICHENKO A A, GRECHKO A V, et al. Potential of anti-inflammatory agents for treatment of atherosclerosis[J]. Exp Mol Pathol, 2018, 104(2): 114-124. |
| [24] |
RAJENDRAN P, RENGARAJAN T, THANGAVEL J, et al. The vascular endothelium and human diseases[J]. Int J Biol Sci, 2013, 9(10): 1057-1069. |
| [25] |
LUO R X, LI L Z, LIU X H, et al. Mesenchymal stem cells alleviate palmitic acid-induced endothelial-to-mesenchymal transition by suppressing endoplasmic reticulum stress[J]. Am J Physiol Endocrinol Metab, 2020, 319(6): E961-E980. |
| [26] |
ROCHA D M, CALDAS A P, OLIVEIRA L L, et al. Saturated fatty acids trigger TLR4-mediated inflammatory response[J]. Atherosclerosis, 2016, 244: 211-215. |




