动脉粥样硬化是全球血管疾病的主要原因[1],其主要特征为脂肪和纤维的积累。随着纤维化和钙化的累积,动脉粥样硬化斑块逐渐形成;稳定的斑块会阻塞管腔,导致组织和器官的灌注不足,而不稳定的斑块则会破裂,进而导致血栓形成[2]。动脉粥样硬化会导致严重的并发症,如缺血性心脏病、缺血性中风等。据统计,2015年,超过1 700万人死于心血管疾病;其中,超过1 400万人死于冠心病和中风[2]。动脉粥样硬化的危险因素众多,如高血脂、吸烟、肥胖、高血压和酗酒等[3]。作为高脂血症主要危险因素之一的低密度脂蛋白胆固醇(low density lipoprotein cholesterol, LDL-C) 被认为是动脉粥样硬化治疗过程中的重要指标[4]。而LDL-C的代谢与前蛋白转化酶枯草杆菌蛋白酶/kexin 9型(proprotein convertase subtilisin/kexin type 9, PCSK9)的活性密不可分。
PCSK9是前蛋白转化蛋白酶家族的第九个成员,它是一组丝氨酸蛋白酶,PCSK9主要通过结合低密度脂蛋白受体(low density lipoprotein receptor, LDLR)参与脂质代谢[5]。在生理条件下,血液循环中的LDL-C与膜上的LDLR结合并进入细胞,从而及时维持血脂的动态平衡。主要产生于肝细胞的PCSK9与LDLR结合后,将介导其进入溶酶体进行降解,阻止LDLR再循环[6]。一旦PCSK9过表达,LDLR被大量降解而无法正常发挥作用,导致血液循环中的LDL-C无法得到有效清除,最终将引起高脂血症。因此,PCSK9可通过调节LDL-C的代谢而间接影响动脉粥样硬化的进程。
尼古丁是日常生活中普遍存在的香烟烟雾的主要成分之一,一直备受研究人员的关注。尼古丁不仅对呼吸道疾病(如肺癌)有很大促进作用,而且对动脉粥样硬化的形成也不可忽视。例如尼古丁通过引起血脂异常、胰岛素抵抗和血管炎症等加快动脉粥样硬化的进程[7]。已有研究发现,香烟烟雾提取物降低了HepG2细胞中LDLR的表达[8],香烟烟雾提取物也通过ROS/NF-κB途径影响HepG2细胞中PCSK9的表达[9]。更有趣的是,ERK通路可能调节PCSK9的表达[10],并且在ERK敲除小鼠中观察到PCSK9的分泌量显著减少[11]。然而,香烟烟雾的成分高达7 000多种,其对脂质代谢的具体影响机制仍有待研究[12]。本研究通过探讨尼古丁对脂质沉积的影响、尼古丁对PCSK9表达的调节及其与Raf/MEK/ERK信号通路之间的联系,为动脉粥样硬化的诊疗提供新的思路。
1 材料与方法 1.1 主要材料尼古丁购自成都Desite科技有限公司。盐酸美加明(mecamylamine hydrochloride,MH,尼古丁抑制剂)购自美国GlpBio公司。PLX4720(Raf抑制剂)、PD0325901(MEK抑制剂)、CC-90003(ERK抑制剂)购自上海TOPSCIENCE有限责任公司。抗-PCSK9抗体购自武汉Proteintech生物科技有限公司。抗GAPDH抗体购自美国Immunoway公司。辣根过氧化物酶(HRP)抗兔IgG购自北京中杉金桥生物科技公司。抗Raf、抗MEK、抗ERK抗体和抗磷酸化Raf(Ser259)、抗磷酸化MEK(Ser217/221)、抗磷化ERK(Thr202/Tyr204)抗体购自美国Cell Signaling Technology公司。TRIzol和SYBR Green购自武汉ABclonal生物科技公司。
1.2 细胞培养和处理分组 1.2.1 细胞培养HepG2细胞在补充了10%胎牛血清(FBS)(中国江苏依科赛生物)的杜氏改良鹰培养基(DMEM)(美国Gibco公司)中培养,并放置于37 ℃含5% CO2的恒温箱中孵育。尼古丁刺激实验:当细胞密度达到70%~80%时,采用含不同浓度尼古丁(0、5、10、20 μmol/L)的完整培养基[13]孵育不同时间(0、24、48 h)。
1.2.2 实验分组细胞分6组:对照(CON)组、尼古丁(NIC)组、尼古丁+尼古丁抑制剂(MH)组、尼古丁+Raf抑制剂(PLX)组、尼古丁+MEK抑制剂(PD)组、尼古丁+ERK抑制剂(CC)组。CON组细胞采用不含尼古丁的完整培养基正常培养;NIC组细胞采用10 μmol/L尼古丁孵育24 h;MH、PLX、PD和CC组分别采用10 μmol/L尼古丁抑制剂MH、1 μmol/L Raf抑制剂(PLX4720)、1 μmol/L MEK抑制剂(PD0325901)和1 μmol/L ERK抑制剂(CC-90003)预处理1 h,然后与10 μmol/L尼古丁一起孵育24 h。
1.3 细胞活性测定细胞计数试剂盒-8(CCK-8)用于检测HepG2细胞的活性。将重悬的细胞稀释至2×104/mL取100 μL注入96孔板中培养24 h。尼古丁刺激实验见1.2。除去上清液后,加入不含FBS的培养基,并向每个孔中加入10 μL CCK-8试剂(上海MCE公司)。在37 ℃、含5% CO2的培养箱中避光培养2~3 h后,在450 nm处测量吸光度。
1.4 划痕实验将105个HepG2细胞植入6孔板中。当细胞密度在完全培养基中达到90%~100%时,使用200 μL移液管尖端绘制直线。用PBS轻轻冲洗后,在没有FBS的情况下预处理MH 1 h,然后在没有FBS的情况下加入10 μmol/L尼古丁并培养24 h。分别在0 h(p)和24 h(q)拍摄并记录划痕宽度。使用Image J软件分析所有划痕宽度。迁移率计算公式为:(p-q)/p。
1.5 油红O染色在用4%多聚甲醛(重庆蒙柏欧生物科技有限公司)固定15 min后,将载玻片浸入油红染液(武汉谷歌生物科技有限公司)8~10 min(覆盖并避光),并用蒸馏水洗涤。用75%酒精分化后,苏木精(武汉谷歌生物科技有限公司)复染3~8 min。用蒸馏水洗涤后,用盐酸酒精分化载玻片1 s,用蒸馏水冲洗,用氨水溶液恢复蓝色,再用蒸馏水冲洗。载玻片用甘油明胶(武汉谷歌生物科技有限公司)封片。显微镜拍照,使用Image J软件分析所有结果,通过计算一个视野中脂滴的面积,反映细胞内中脂质沉积的面积比。
1.6 网络药理学分析运用PubChem数据库和Swiss Target Prediction数据库筛选尼古丁作用靶点。在GeneCards数据库筛选低密度脂蛋白胆固醇的靶点。然后利用Uniprot蛋白标准化数据库对相关靶点进行统一转化。用Venny2.1.0制作靶点的交集基因,导入String数据库以构建蛋白质-蛋白质相互作用(protein-protein interaction networks,PPI)网络图。通过微生信平台对靶点分子进行基因本体(gene ontology,GO)、京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)富集分析,得到相应靶点的生物过程(Biological Process)和通路分析(Pathway Analysis)。最后导入Cytoscape3.7.2软件进行可视化分析。
1.7 蛋白质免疫印迹(Western blot)检测将处理过的细胞从培养基中倒出,并用PBS洗涤3次。将培养皿加入含有蛋白酶抑制剂(1 ∶100)和磷酸酶抑制剂(1 ∶50)(北京索莱宝科技有限公司)的细胞裂解液(RIPA)120 μL(重庆蒙柏欧生物科技有限公司),并在4 ℃的摇床上放置20 min。将刮取的细胞在12 000 r/min、4 ℃离心15 min,然后收集上清液并通过BCA法(上海碧云天生物技术有限公司)测量蛋白质浓度。将20 μg变性蛋白加入到十二烷基硫酸钠聚丙烯酰胺凝胶电泳的每个孔中,然后将蛋白转移到聚偏氟乙烯(PVDF)膜上。用含有0.1%-20吐温(TBS-T)的Tris缓冲盐水洗涤膜,在室温下用5%的脱脂牛奶(北京索莱宝科技有限公司)封闭1 h。用TBS-T洗涤后,将膜与抗PCSK9抗体(1 ∶2 000)、抗GAPDH抗体(1 ∶5 000)、抗Raf抗体(1 ∶1 000)、抗MEK抗体(1 ∶1 000)、抗ERK抗体(1 ∶1 000)和抗磷酸化Raf抗体(1 ∶1 000),抗磷酸化MEK抗体(1 ∶1 000),抗磷化ERK抗体(1 ∶1 000) 一起在4 ℃的摇床上孵育过夜。第2天将TBS-T洗涤后的膜与HRP抗兔IgG(1 ∶5 000) 在室温下孵育1 h。结果采用Fusion软件进行分析。
1.8 RT-qPCR检测根据制造商的要求,用Trizol提取总RNA。RNA的纯度取决于260和280 nm处的吸光度比率。通过Applied Biosystems(美国Thermo Fisher Scientific公司)反转录:37 ℃下2 min、55 ℃下15 min和85 ℃下5 min,将RNA反转录成互补DNA(cDNA)。SYBR Green与目标基因引物和cDNA一起用于Bio-Rad CFX connect实时系统(美国Bio-Rad公司)。qPCR方案为:95 ℃ 3 min,循环1次;随后95 ℃ 5 s,60 ℃ 30 s循环40次。引物序列如下:PCSK9正向5′-GTACC-GGGCGGATGAATACC-3′,反向5′-TGCACATTCTCG-AAGTGT-3′;Raf正向5′-GACTGCCCTACATCTGGAT-CAT-3′,反向5′-GGTTCTCGTTGCCCAAATTGATTT-3′;MEK正向5′-GGAGAGCATTGAGATTGACCAGA-3′,反向5′-CCAAGTTCTCCAGGTCGTTGATT-3′;ERK正向5′-GTGTGCAGATCCAGACCATGAT-3′,反向5′-TGCA-GCCTACGACCATGAT-3′;GAPDH正向5′-GGGAGT-CCACTGGCGTCTTCA-3′,反向5′-GTCCATGAGTCCT-CCACGATACC-3′。使用SYBR Green的荧光值通过2-ΔΔCt方法获得RNA的相对表达量。以甘油醛3-磷酸脱氢酶(GAPDH)的RNA表达量作为内参。
1.9 免疫荧光检测干燥后,将载玻片在盖玻片中间画一个圆圈,加入50 μL Triton X-100(德国BioFroxx公司),在室温下孵育20 min,用PBS洗涤5 min,重复3次。在圆圈中加入3%牛血清白蛋白(BSA)(德国BioSroxx公司)均匀覆盖样品,并在室温下密封30 min。轻轻摇动封闭溶液后,将抗PCSK9抗体(1 ∶500)(美国Abcam公司)添加到载玻片中,并将载玻片在4 ℃的湿箱中孵育过夜。将载玻片在摇床上洗涤5 min,重复3次。干燥后,将辣根过氧化物酶(HRP)抗小鼠IgG添加到组织化学试剂盒中以覆盖样品,并将载玻片在室温下孵育50 min,用含有4,6-二氨基-2-苯基吲哚(DAPI)(武汉赛维尔生物科技有限公司)的抗荧光淬灭剂(美国Southern Biotech公司)覆盖它们。在荧光显微镜下观察载玻片并收集图像。DAPI染色的细胞核为蓝色,PCSK9表达为荧光标记的红色。所有结果使用Image J软件进行分析。
1.10 酶联免疫吸附实验(ELISA)根据制造商的说明,使用人前蛋白转化酶枯草杆菌蛋白酶/ kexin 9型(PCSK9)ELISA试剂盒(重庆蒙柏欧生物科技有限公司)检测PCSK9在HepG2细胞裂解上清液中的表达。
1.11 统计学分析使用GraphPad Prism 8.0.2软件进行数据统计分析和绘图。数据以x±s表示,采用单因素方差分析进行多重比较。P < 0.05被认为具有统计学意义。所有统计结果来自3次不同的实验。
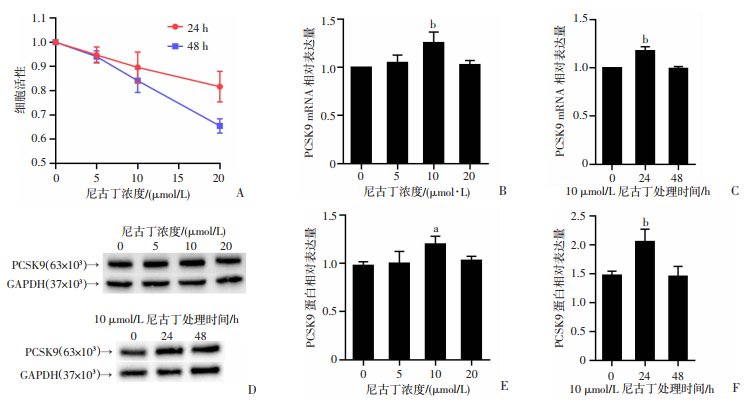
2 结果 2.1 尼古丁刺激对HepG2细胞活性及PCSK9表达的影响CCK-8实验结果表明,当尼古丁浓度<5 μmol/L时,细胞活性高于90%;当尼古丁浓度>5 μmol/L时,细胞活性急剧下降,且孵育48 h比24 h下降更多(图 1A)。RT-qPCR和Western blot结果显示,尼古丁孵育24 h,5、20 μmol/L尼古丁处理后,PCSK9 mRNA和蛋白表达量差异无统计学意义,10 μmol/L尼古丁显著提高PCSK9 mRNA(P < 0.01)和蛋白(P < 0.05)的表达(图 1B、D、E);10 μmol/L尼古丁培养细胞24 h后,PCSK9 mRNA(P < 0.01)和蛋白表达(P < 0.01)增加,而培养48 h后,PCSK9 mRNA和蛋白表达无统计学差异(图 1C、D、F)。提示10 μmol/L尼古丁培养HepG2细胞24 h可作为后续最佳实验条件。
|
|
a:P < 0.05,与0 μmol/L尼古丁组比较;b:P < 0.01,与尼古丁处理0 h组比较 A:CCK-8细胞活性实验;B:不同浓度尼古丁处理24 h后的PCSK9 mRNA表达;C:10 μmol/L尼古丁处理不同时间后的PCSK9 mRNA表达;D:Western blot检测不同浓度尼古丁和尼古丁干预不同时间后的PCSK9蛋白表达;E:不同浓度尼古丁处理24 h后PCSK9蛋白表达的半定量分析;F:10 μmol/L尼古丁处理不同时间后PCSK9蛋白表达的半定量分析 图 1 尼古丁对HepG2细胞活性及PCSK9表达的影响 (n=3,x±s) |
2.2 尼古丁增加HepG2细胞迁移能力,促进脂质沉积
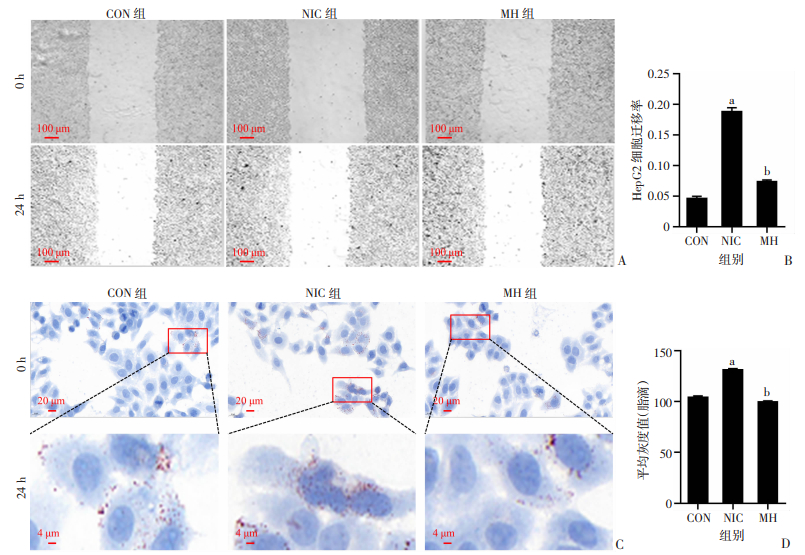
划痕实验结果显示,CON组细胞迁移率 < 5%,NIC组迁移率约18%,MH组迁移率约7%。尼古丁显著增加HepG2细胞24 h的迁移能力(P < 0.01),并且加入尼古丁抑制剂(MH)后,细胞的迁移能力明显减弱(P < 0.01,图 2A、B)。油红O染色用于检测HepG2细胞中的脂质沉积(图 2C)。半定量分析发现,与CON组比较,NIC组的平均灰度值(脂滴)显著增加(P < 0.01);加入MH后,平均灰度值(脂滴)又显著下降(P < 0.01,图 2D)。提示尼古丁提高HepG2细胞迁移能力,并促进脂滴积累。
|
|
a:P < 0.01,与CON组比较;b:P < 0.01,与NIC组比较 A:划痕实验检测细胞迁移能力;B:划痕实验的半定量分析;C:油红O染色检测细胞脂质沉积;D:油红O染色实验的半定量分析 图 2 尼古丁对HepG2细胞迁移能力和脂质沉积的影响 (n=3,x±s) |
2.3 LDL-C和尼古丁靶点的筛选和网络药理学分析
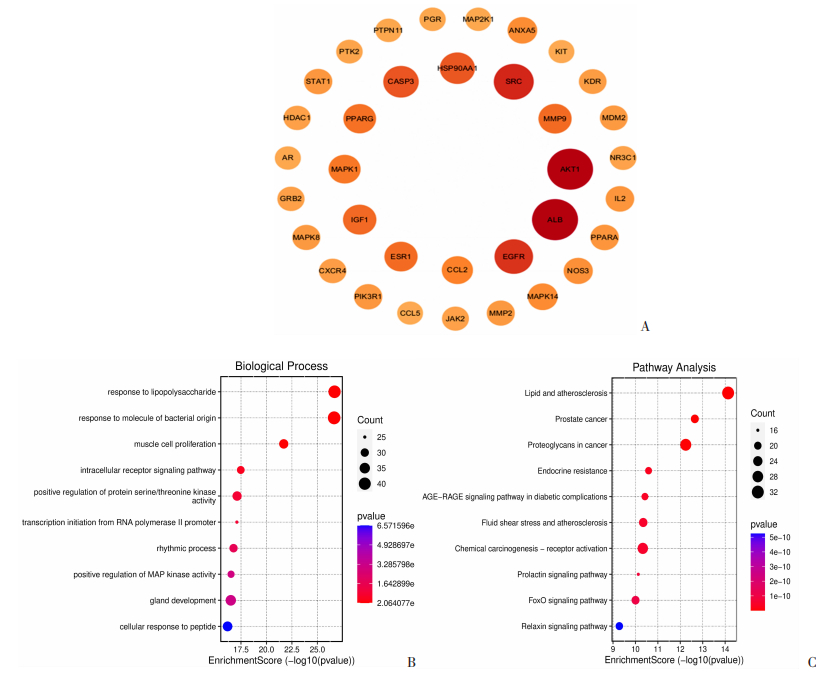
Venny图结果显示:经数据库筛选出尼古丁靶点为380个,LDL-C的靶点为10 322个。其中,二者的共有靶点为257个,占总量的2.5%。对35种最靠前的核心靶点进行网络图筛选,核心靶点用“度”进行量化,包括ALB(度=130)、AKT1(度=129)、SRC(度=103)、EGFR(度=97)、CASP3(度=83)、HSP90AA1 (度=82)、IGF1(度=74)、MMP9(度=73)、ESR1(度=93)、PPARG(度=71)、MAPK1(度=68) 和CCL2(度=64)等(图 3A)。GO生物过程分析显示:富集分数最高的是“对脂多糖的反应”和“对细菌来源分子的反应”;富集分数较低的“MAPK活性的正向调节”在整个生物过程中排第8位(图 3B)。KEGG通路分析显示:“脂质和动脉粥样硬化”的富集分数最高,其后是“前列腺癌”“癌症中的蛋白聚糖”等(图 3C)。
|
| A:尼古丁与低密度脂蛋白胆固醇蛋白质-蛋白质相互作用中靠前的核心靶点;B:尼古丁与低密度脂蛋白胆固醇共有靶点富集分析中的生物过程 横坐标为富集分数,纵坐标为不同GO生物学过程;C:尼古丁与低密度脂蛋白胆固醇共有靶点富集分析中的通路分析 横坐标为富集分数,纵坐标为不同KEGG通路; 图中圆圈的颜色越红、面积越大,表明该基因富集程度越高 图 3 LDL-C和尼古丁靶点的筛选和网络药理学分析 |
2.4 尼古丁可激活Raf/MEK/ERK信号通路
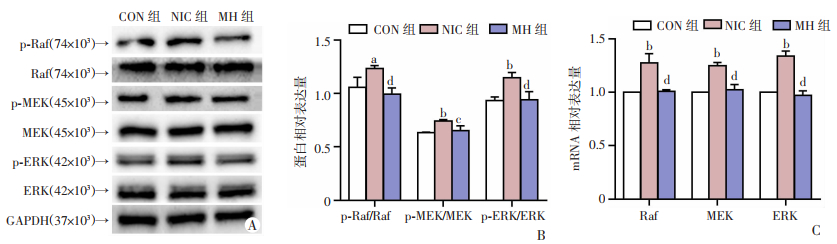
Western blot及半定量分析显示:与CON组比较,NIC组Raf、MEK、ERK的磷酸化蛋白相对表达量均上调(P < 0.05,P < 0.01,P < 0.01)。加入MH后,因尼古丁刺激上调的Raf、MEK、ERK的磷酸化蛋白相对表达量受到抑制(P < 0.01,P < 0.05,P < 0.01,图 4A、B)。RT-qPCR分析显示:与CON组比较,NIC组Raf、MEK、ERK的mRNA表达都增强(P < 0.01),MH则削弱了这种增强作用(P < 0.01,图 4C)。提示尼古丁提高下游Raf、MEK、ERK基因转录水平并激活了Raf、MEK、ERK级联的磷酸化过程。
|
|
a:P < 0.05,b:P < 0.01,与CON组比较;c:P < 0.05,d:P < 0.01,与NIC组比较 A:Western blot检测Raf、MEK、ERK以及磷酸化Raf、MEK、ERK的蛋白表达;B:磷酸化Raf、MEK、ERK的蛋白相对表达量的半定量分析;C:RT-qPCR检测Raf、MEK、ERK基因的mRNA表达 图 4 尼古丁可激活Raf/MEK/ERK信号通路 (n=3,x±s) |
2.5 尼古丁通过Raf/MEK/ERK信号通路调节HepG2细胞中的PCSK9表达
Western blot及其半定量结果显示,NIC组PCSK9的蛋白表达量较之CON组显著升高;而MH组、PLX组、PD组和CC组较之NIC组PCSK9蛋白表达下调(P < 0.01,P < 0.05,P < 0.01,P < 0.05;图 5A、B)。RT-qPCR结果显示,尼古丁使得PCSK9 mRNA表达量较之CON组明显增多(P < 0.01),MH可减少PCSK9 mRNA(P < 0.01,图 5C);相应地,PLX组、PD组和CC组较之NIC组PCSK9 mRNA表达下调(P < 0.01,图 5D)。ELISA结果显示,在尼古丁的刺激下,PCSK9的蛋白表达量较之CON组显著升高(P < 0.05),而MH组、PLX组、PD组和CC组较之NIC组PCSK9蛋白表达下调(P < 0.01,图 5E)。免疫荧光及其半定量结果显示,NIC组PCSK9的蛋白表达量比CON组明显增强(P < 0.01),MH的加入减少了PCSK9的蛋白表达(P < 0.01,图 5F、G)。
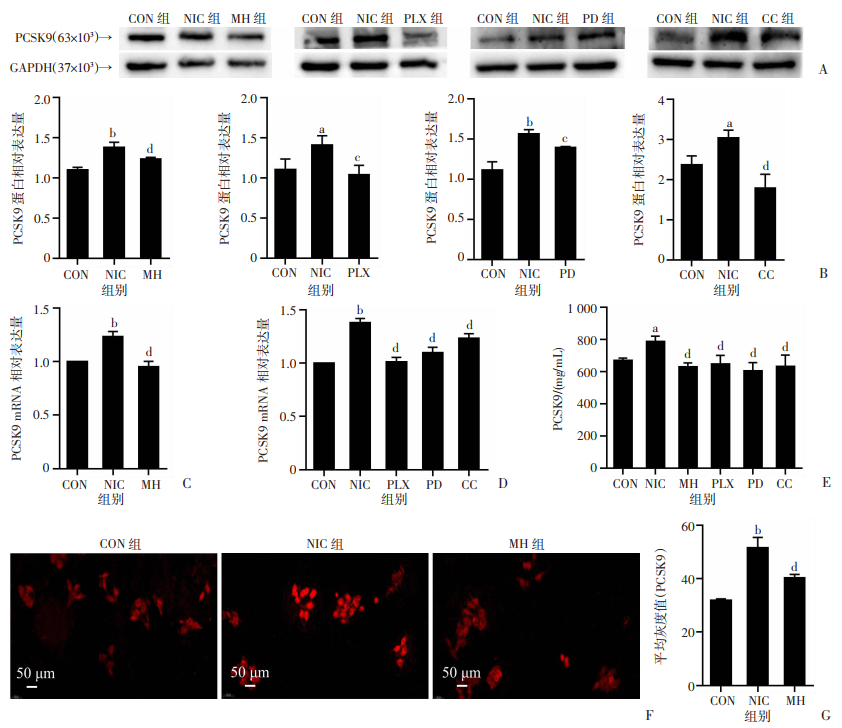
|
|
a:P < 0.05,b:P < 0.01,与CON组比较;c:P < 0.05,d:P < 0.01,与NIC组比较 A:尼古丁刺激并分别加入MH、PLX4720、PD0325901和CC-90003后PCSK9的蛋白表达变化;B:PCSK9的蛋白表达水平的半定量分析;C:RT-qPCR检测PCSK9 mRNA表达;D:RT-qPCR检测PCSK9 mRNA表达;E:ELISA实验检测PCSK9的蛋白表达;F:免疫荧光检测PCSK9的荧光强度;G:免疫荧光实验的半定量分析 图 5 尼古丁对PCSK9表达的调节以及该过程与Raf/MEK/ERK信号通路的关系 (n=3,x±s) |
3 讨论
尼古丁是香烟烟雾中7 000多种化学成分之一[12],影响脂质代谢并加速动脉粥样硬化的形成。体内实验表明,较高浓度的尼古丁会导致大鼠脂肪因子和脂质异常[14],暴露于尼古丁的动脉粥样硬化模型小鼠显示该模型组比正常组动脉粥样硬化斑块形成显著增强[15]。与上述结果一致,本实验发现,尼古丁组脂质沉积显著增加,而尼古丁抑制剂可翻转此效果,表明尼古丁对脂质沉积确有促进作用。PCSK9靶向结合LDLR并于溶酶体内将其降解,血液中LDL-C升高从而间接升高血脂[6]。目前,关于尼古丁和PCSK9的研究较少。已经发现,香烟烟雾提取物可以通过ROS/NF-κB刺激HepG2细胞分泌PCSK9[9]。香烟烟雾提取物也可降低HepG2细胞中LDLR的表达[8]。此外,PCSK9敲除小鼠LDLR表达增加。有趣的是,肝脏是PCSK9产生和尼古丁代谢的主要场所,这可能为二者之间的相互作用提供潜在条件。基于以上原因,推测尼古丁可能促进PCSK9在HepG2中的表达。本实验的结果显示,尼古丁刺激后,PCSK9 mRNA和蛋白表达确实上调,并且在添加尼古丁抑制剂后,PCSK9 mRNA和蛋白表达降低,表明尼古丁可位于PCSK9的上游并对其表达发挥调控作用。
为进一步研究尼古丁对PCSK9表达的影响机制,本实验筛选尼古丁与LDL-C之间的靶点并进行富集分析。二者257个共有靶点中包含MAPK1通路。虽然通路分析中“脂质和动脉粥样硬化”的富集分数最高,但生物过程中富集分数最靠前的却是“对脂多糖的反应”和“对细菌来源分子的反应”,而“MAPK活性的正向调节”仅在整个生物过程中排第8位。这一结果可以借助“炎症”作为桥梁得以解释。无论是用于炎症建模的脂多糖[16]还是细菌来源产物[17],它们对炎症的形成都有极大的影响。动脉粥样硬化的形成本身就是一种慢性炎症[18],而LDL-C造成的高脂血症促进炎症形成[19];此外,已有研究表明,口腔摄入尼古丁可释放大量炎症标志物,如IL-6、TNF-α等[20]。
MAPK通路的激活可促进肿瘤形成[21],而肿瘤形成中常伴有肿瘤细胞的迁移、增殖等[22]。本实验同样发现,尼古丁提高HepG2细胞迁移能力。NIC组的Raf、MEK、ERK的磷酸化水平和转录水平提高,表明尼古丁可处于Raf、MEK、ERK的上游并激活此通路。Raf、MEK、ERK的蛋白同源性分别为:83%、80%、39%,因此ERK的磷酸化激活对通路发挥作用显得尤为重要[21]。结合网络药理学分析结果,推测尼古丁对PCSK9的调控或许与MAPK通路有关。借助Western blot、RT-qPCR和ELISA实验发现,尼古丁刺激引起PCSK9蛋白和mRNA的表达上调,Raf特异性抑制剂、MEK特异性抑制剂和ERK特异性抑制剂可削弱上述效应,表明控制Raf、MEK、ERK的活性有助于调控PCSK9的转录和翻译过程。加之尼古丁可位于上游并激活Raf、MEK、ERK,由此得出结论,尼古丁可借助Raf/MEK/ERK信号通路调节PCSK9在HepG2细胞中的转录和翻译。
综上所述,在HepG2细胞中,尼古丁促进脂质沉积和细胞迁移,尼古丁通过激活MAPK(Raf/MEK/ERK)通路参与调控下游PCSK9的表达,且上调的PCSK9可能是细胞内脂质沉积的重要原因。但本实验仅进行了体外研究,因此,下一步应增加动物实验以增强实验结果的信服力。本课题将为未来进一步研究烟雾成分和血脂代谢提供参考,并为更好地治疗动脉粥样硬化提高可能的方向。
致谢 感谢重庆市重大代谢性疾病转化医学重点实验室肖晓秋教授课题组提供的HepG2细胞。| [1] |
HERRINGTON W, LACEY B, SHERLIKER P, et al. Epidemiology of atherosclerosis and the potential to reduce the global burden of atherothrombotic disease[J]. Circ Res, 2016, 118(4): 535-546. |
| [2] |
LIBBY P, BURING J E, BADIMON L, et al. Atherosclerosis[J]. Nat Rev Dis Primers, 2019, 5(1): 56. |
| [3] |
CZERNIUK M R, SURMA S, ROMAŃCZYK M, et al. Unexpected relationships: periodontal diseases: atherosclerosis-plaque destabilization? from the teeth to a coronary event[J]. Biology, 2022, 11(2): 272. |
| [4] |
HOOGEVEEN R C, BALLANTYNE C M. Residual cardio-vascular risk at low LDL: remnants, lipoprotein(a), and inflammation[J]. Clin Chem, 2021, 67(1): 143-153. |
| [5] |
GLERUP S, SCHULZ R, LAUFS U, et al. Physiological and therapeutic regulation of PCSK9 activity in cardiovascular disease[J]. Basic Res Cardiol, 2017, 112(3): 32. |
| [6] |
SHAPIRO M D, TAVORI H, FAZIO S. PCSK9:from basic science discoveries to clinical trials[J]. Circ Res, 2018, 122(10): 1420-1438. |
| [7] |
LEE J, COOKE J P. Nicotine and pathological angiogenesis[J]. Life Sci, 2012, 91(21/22): 1058-1064. |
| [8] |
MA B T, CHEN Y F, WANG X B, et al. Cigarette smoke exposure impairs lipid metabolism by decreasing low-density lipoprotein receptor expression in hepatocytes[J]. Lipids Health Dis, 2020, 19(1): 88. |
| [9] |
MA B T, WANG X B, ZHANG R, et al. Cigarette smoke extract stimulates PCSK9 production in HepG2 cells via ROS/NF-κB signaling[J]. Mol Med Rep, 2021, 23(5): 331. |
| [10] |
MA C Y, SHI X Y, WU Y R, et al. Berberine attenuates atherosclerotic lesions and hepatic steatosis in ApoE-/- mice by down-regulating PCSK9 via ERK1/2 pathway[J]. Ann Transl Med, 2021, 9(20): 1517. |
| [11] |
DING Z, WANG X, LIU S, et al. NLRP3 inflammasome via IL-1beta regulates PCSK9 secretion[J]. Theranostics, 2020, 10(16): 7100-7110. |
| [12] |
CENTNER A M, BHIDE P G, SALAZAR G. Nicotine insenescence and atherosclerosis[J]. Cells, 2020, 9(4): 1035. |
| [13] |
YARAHMADI A, ZAL F, BOLOUKI A. Protective effects of quercetin on nicotine induced oxidative stress in'HepG2 cells'[J]. Toxicol Mech Methods, 2017, 27(8): 609-614. |
| [14] |
FAHEEM A, REHMAN K, JABEEN K, et al. Nicotine-mediated upregulation of microRNA-141 expression determines adipokine-intervened insulin resistance[J]. Environ Toxicol Pharmacol, 2020, 80: 103506. |
| [15] |
KOGA M, KANAOKA Y, OKAMOTO M, et al. Varenicline aggravates atherosclerotic plaque formation in nicotine-pretreated ApoE knockout mice due to enhanced oxLDL uptake by macrophages through downregulation of ABCA1 and ABCG1 expression[J]. J Pharmacol Sci, 2020, 142(1): 9-15. |
| [16] |
CIESIELSKA A, MATYJEK M, KWIATKOWSKA K. TLR4 and CD14 trafficking and its influence on LPS-induced pro-inflammatory signaling[J]. Cell Mol Life Sci, 2021, 78(4): 1233-1261. |
| [17] |
GRONDMAN I, PIRVU A, RIZA A, et al. Biomarkers of inflammation and the etiology of sepsis[J]. Biochem Soc Trans, 2020, 48(1): 1-14. |
| [18] |
WOLF D, LEY K. Immunity and inflammation in atherosclerosis[J]. Circ Res, 2019, 124(2): 315-327. |
| [19] |
MENSINK F B, LOS J, TEN CATE T J F, et al. Pharmaco-invasive therapy: early implementation of statins and proprotein convertase subtilisin/kexin type 9 inhibitors after acute coronary syndrome[J]. Front Cardiovasc Med, 2022, 9: 1061346. |
| [20] |
SHAIKH S B, TUNG W C, PANG C, et al. Flavor classification/categorization and differential toxicity of oral nicotine pouches (ONPs) in oral gingival epithelial cells and bronchial epithelial cells[J]. Toxics, 2022, 10(11): 660. |
| [21] |
ULLAH R, YIN Q, SNELL A H, et al. RAF-MEK-ERK pathway in cancer evolution and treatment[J]. Semin Cancer Biol, 2022, 85: 123-154. |
| [22] |
CZYZYKOWSKI R, POŁOWINCZAK-PRZYBYŁEK J, POTEMSKI P. Nicotine-induced resistance of non-small cell lung cancer to treatment: possible mechanisms[J]. Postepy Hig Med Dosw (Online), 2016, 70: 186-193. |




