2. 400038 重庆,陆军军医大学(第三军医大学)第一附属医院放射科
2. Department of Radiology, First Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400038, China
侵袭性肺部真菌感染(invasive pulmonary fungal infection,IPFI)是指真菌直接侵犯(非寄生、过敏或毒素中毒)肺或支气管引起的急、慢性组织病理损害所导致的疾病。IPFI一直是免疫功能低下患者的常见并发症,有着高发病率和高病死率[1-2]。目前,IPFI也较多地发生在无传统危险因素的免疫功能正常和免疫功能低下患者中[3-7]。在过去两个世纪里,深部真菌病的发病率急剧上升[8],也成为影响患者预后和生存的重要因素[9]。近年来国内外研究表明IPFI发病率逐年增加,尤其是老年患者的感染率日益上升[10-13]。
IPFI的临床表现无特异性;穿刺活检或痰培养的周期长且阳性率低;血清半乳甘露聚糖检测敏感性低,且常出现假阳性结果[14-16]。影像学是IPFI诊断的重要方法,但影像学对IPFI的影像表现仍缺乏特异性,加之存在基础疾病,其影像表现多种多样且相互重叠[17],真菌感染的影像特征不典型[18-20]。尽管已有很多关于肺部真菌感染的危险因素及临床特征等相关研究[21-23],以及关于患者病死率的预测研究[24],但都各自存在着局限性,如选取的研究因素有限、研究对象类别及数量局限等不足。总之,目前尚缺乏快速有效的早期诊断IPFI的方法。因此,本研究结合临床及影像,使用可视化预测工具-列线图[24-28],拟建立一个临床影像预测模型,该研究结果可能为IPFI的早期诊断提供帮助。
1 资料与方法 1.1 研究对象收集2016年1月1日至2021年9月30日在陆军军医大学第一附属医院老年医学科住院的肺部感染患者的临床资料。纳入标准:①我院老年医学科住院的肺部感染患者;②有完整临床数据和影像学数据的患者;③入院前未确诊IPFI且近期未使用抗真菌药物。排除标准:①艾滋病患者;②肺部寄生虫感染者;③住院时间≤24 h。
诊断标准:侵袭性肺部真菌感染依据《肺真菌病诊断与治疗专家共识》[29]与《侵袭性肺部真菌感染的诊断标准与治疗原则(草案)》[30]进行诊断:①确诊(proven);②临床诊断(probable);③拟诊(possible)。肺部非真菌感染:不符合侵袭性肺部真菌感染诊断标准,未使用抗真菌药物。本研究获陆军军医大学第一附属医院伦理委员会批准[批件号:(B)KY202227]。
1.2 研究设计及数据收集采用病例-对照研究设计方案,采用PASS 15.0进行估计病例-对照(1 ∶1)研究所需的样本量。根据相关文献资料,设定OR=2.91(主要危险因素),P2=0.135,设α=0.05,β=0.10。分析结果显示,所需样本为:病例组和对照组各为111例。考虑纳入病例的信息资料完整性有限,以及验证集病例的需要,因此适当增加部分样本量。
临床数据从电子病历中收集,包括一般信息、临床特征和影像数据。具体包括性别、年龄、基础疾病(糖尿病、COPD、低白蛋白血症、呼吸衰竭、胰腺炎等)、临床表现(咳嗽、发热、腹泻等)、侵入性操作(尿管、胃管、机械通气等)、检验指标(淋巴细胞、中性粒细胞、碱性磷酸酶、肌酐、胆碱酯酶等)及肺部感染的首次胸部CT体征(结节、磨玻璃影、实变、晕征、空气新月征、病灶分布等)、住院时长、用药情况(抗生素、抗真菌药物、激素使用等)及疗效。
1.3 并存疾病定义由经验丰富的主治医师根据相关临床指南确定并存疾病如下:①糖尿病;②慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD);③慢阻肺急性加重(acute exacerbation of chronic obstructive pulmonary disease,AECOPD);④肾功能不全;⑤肠道疾病;⑥呼吸衰竭,包括Ⅰ型、Ⅱ型呼吸衰竭;⑦贫血;⑧低白蛋白血症;⑨营养不良;⑩心血管功能障碍定义为心功能Ⅲ~Ⅳ级。中性粒细胞减少症定义为中性粒细胞绝对计数 < 1.5×109/L。
1.4 CT检查及图像分析 1.4.1 计算机断层扫描采用德国Siemens公司的Sensation 16、Somatom Definition AS 64排螺旋CT机或Somatom Definition Flash双源螺旋CT机扫描。扫描参数:管电压100~120 kV,管电流为自动,螺距为1.2~1.5。部分患者进行增强扫描,增强采用非离子型对比剂碘海醇(含碘300 mg/mL),注射剂量80~100 mL,注射速度3.5~4.0 mL/s,于升主动脉内取约1 cm2大小的圆形感兴趣区(ROI),对比剂开始注射10 s后进行连续轴向扫描,在实时重建图像上当其CT值达到触发阈值(120 HU)后延迟5 s行动脉期扫描,顺延15~20 s行静脉期扫描。重建参数:卷积核=I70 f,肺窗的窗位-450~-600 HU,窗宽1 200~1 500 HU,层间距2 mm,层厚2 mm。
1.4.2 图像分析图像在放射学阅读之前被匿名化和随机化,评估均在数字图像存档系统工作站上进行,均由2位独立的经验丰富胸部放射科诊断医师集中阅读,若2位之间评估不一致,则由具有20年以上经验的高年资放射科诊断医师判读得到最终结果。
评估的肺部病变包括:肺气肿、慢支炎、肺结核、病灶分布、支气管扩张、支气管壁增厚、支气管黏液栓、小结节、大结节、实性结节、亚实性结节、磨玻璃结节、肿块、空洞、空气新月征、晕征、反晕征、磨玻璃影、实变、空气支气管征、胸膜牵连、胸腔积液、纵隔淋巴结肿大[31]。
在本研究中,结节是指界限清楚或不清楚的局灶性肺部阴影,其直径≤3 cm,其中小结节直径<1 cm,大结节直径为1~3 cm。磨玻璃影(ground glass opacity,GGO)定义为肺内密度稍增高,且不掩盖其中肺血管影的局部病变。晕征定义为结节或肿块周围的晕状磨玻璃影,形似日晕。空洞为肺内病变组织发生坏死经引流支气管排出并吸入气体后形成。肺内空洞或空腔内的球形病灶与洞壁之间形成的新月形透亮影称为空气新月征。空气支气管征指含气的支气管在其周围肺组织因疾病而密度增高时得以清晰显示的征象[32]。纵隔淋巴结肿大的定义是一个或多个淋巴结短径≥1 cm[33]。
1.5 预测模型的构建针对训练集样本采用单因素Logistic回归分析、共线性诊断分析及多因素Logistic回归分析筛选IPFI的重要相关因素。结合统计及临床知识选择有意义的指标绘制可视列线图[34]。采用接收者工作曲线(ROC)、ROC曲线下面积(AUC)、一致性指数(index of concordance,C-index)和使用Bootstrap重抽样法验证模型并绘制校准曲线的方法评价模型的预测精度和一致性。采用决策曲线分析(calibration curve,DCA)反映该模型对患者的净收益效果。相关指标进一步在验证集样本中测试,以获得内部样本的进一步验证。
1.6 统计学分析使用SPSS 26.0以及R 4.2.1软件进行相关数据分析。对于具有连续数据的参数,正态分布表示为x±s,偏态分布表示为M(P25,P75),计数资料以绝对频数和相对频率表示,组间比较采用χ2检验。所有统计检验为双侧检验,P<0.05表示差异有统计学意义。
2 结果 2.1 一般特征所有患者来自于陆军军医大学第一附属医院老年医学科,入组共377例,采用随机数字表分为训练集及验证集。训练集264名患者,其中男性168名,女性96名,年龄35~103(74.85±10.54)岁。验证集113名患者,男性73名,女性40名,年龄60~96(76.34±8.64)岁。
本研究使用264个患者的临床信息构建列线图,在本研究中没有实体器官移植、胰腺炎、外周导管使用的患者。训练集中COPD 30.68%,贫血48.11%,糖尿病22.35%,入院后营养不良50.38%,面罩/鼻氧管吸氧67.05%,胆碱酯酶降低(<5 000 U/L)43.18%,不存在胆碱酯酶升高的患者。磨玻璃影征象47.35%,空气支气管征象24.24%,支气管扩张征象17.8%。验证集中COPD 29.2%,贫血46.02%,糖尿病19.47%,入院后营养不良50.44%,面罩/鼻氧管吸氧61.06%,胆碱酯酶降低(<5 000 U/L)43.36%,也不存在胆碱酯酶升高的患者。有磨玻璃影征象的约50.44%,空气支气管征象19.47%,支气管扩张征象13.27%。两组患者临床特征差异无统计学意义,见表 1~3。
| 变量 | 验证集(n=113) | 训练集(n=264) | P |
| 性别 | |||
| 女性 | 40(35.40) | 96(36.36) | 0.858 |
| 男性 | 73(64.60) | 168(63.64) | |
| 感染类别 | |||
| 非真菌感染 | 57(50.44) | 133(50.38) | 0.991 |
| 真菌感染 | 56(49.56) | 131(49.62) | |
| 吸烟 | 51(45.13) | 128(48.48) | 0.550 |
| 长期卧床 | 10(8.85) | 17(6.44) | 0.406 |
| 难治性发热≥3 d | 13(11.50) | 26(9.85) | 0.629 |
| 咳嗽 | 107(94.69) | 244(92.42) | 0.426 |
| 咯血 | 3(2.65) | 13(4.92) | 0.470 |
| 啰音 | 81(71.68) | 205(77.65) | 0.215 |
| 低白蛋白血症 | 87(76.99) | 192(72.72) | 0.387 |
| 贫血 | 52(46.02) | 127(48.11) | 0.710 |
| 糖尿病 | 22(19.47) | 59(22.35) | 0.533 |
| 肠道疾病 | 9(7.96) | 19(7.20) | 0.795 |
| 腹泻 | 10(8.85) | 20(7.58) | 0.675 |
| Ⅰ型呼衰 | 35(30.97) | 70(26.52) | 0.376 |
| Ⅱ型呼衰 | 5(4.42) | 25(9.47) | 0.097 |
| COPD | 33(29.2) | 81(30.68) | 0.775 |
| 心功能不全 | 56(49.56) | 116(43.94) | 0.316 |
| 中性粒细胞减少症 | 3(2.65) | 2(0.76) | 0.325 |
| 营养不良 | 23(20.35) | 62(23.48) | 0.505 |
| 肠内营养 | 36(31.86) | 75(28.41) | 0.501 |
| 肠外营养 | 45(39.82) | 97(36.74) | 0.572 |
| 入院后营养不良 | 57(50.44) | 133(50.38) | 0.991 |
| 胃管 | 9(7.96) | 20(7.58) | 0.897 |
| 尿管 | 17(15.04) | 34(12.88) | 0.573 |
| 中心静脉导管 | 13(11.50) | 15(5.68) | 0.078 |
| 有创机械通气 | 4(3.54) | 5(1.89) | 0.555 |
| 无创正压通气 | 16(14.16) | 30(11.36) | 0.447 |
| 面罩、鼻氧管吸氧 | 69(61.06) | 177(67.05) | 0.264 |
| 入院后输血 | 12(10.62) | 25(9.47) | 0.731 |
| 血管升压药 | 5(4.42) | 10(3.79) | 0.772 |
| 免疫抑制剂的使用 | 4(3.53) | 2(0.76) | 0.126 |
| 入院前抗生素史 | 89(78.76) | 191(72.35) | 0.192 |
| 泼尼松>0.1 mg/(kg·d) | 5(4.42) | 13(4.92) | 0.835 |
| 积累类固醇>200 mg | 6(5.31) | 15(5.68) | 0.885 |
| 住院时长/d | |||
| 0~7 | 17(15.04) | 51(19.32) | 0.602 |
| >7~14 | 47(41.59) | 110(41.67) | |
| >14~21 | 28(24.78) | 55(20.83) | |
| >21~28 | 13(11.50) | 26(9.85) | |
| >28~35 | 2(1.77) | 12(4.55) | |
| >35 | 6(5.31) | 10(3.79) | |
| 入院后用抗生素时长/ d | |||
| ≤7 | 23(20.35) | 61(23.11) | 0.877 |
| >7~14 | 43(38.05) | 105(39.77) | |
| >14~21 | 28(24.78) | 56(21.21) | |
| >21~28 | 12(10.62) | 23(8.71) | |
| >28 | 7(6.19) | 19(7.20) | |
| 年龄/岁 | |||
| <80 | 75(66.37) | 169(64.02) | 0.661 |
| ≥80 | 38(33.63) | 95(35.98) | |
| 变量 | 验证集(n=113) | 训练集(n=264) | P |
| WBC/109·L-1 | |||
| <4 | 6(5.31) | 14(5.30) | 0.674 |
| 4~10 | 77(68.14) | 168(63.64) | |
| >10 | 30(26.55) | 82(31.06) | |
| HGB/g·L-1 | |||
| 30~59 | 2(1.77) | 2(0.76) | 0.845 |
| 60~89 | 10(8.85) | 27(10.23) | |
| 90~110 | 21(18.58) | 56(21.21) | |
| 110~119 | 23(20.35) | 49(18.56) | |
| ≥120 | 57(50.44) | 130(49.24) | |
| 中性粒细胞数/109·L-1 | |||
| <2 | 4(3.54) | 7(2.65) | 0.420 |
| 2~7 | 74(65.49) | 157(59.47) | |
| >7 | 35(30.97) | 100(37.88) | |
| 淋巴细胞数/109·L-1 | |||
| <1 | 45(39.82) | 114(43.18) | 0.641 |
| 1~3.7 | 68(60.18) | 148(56.06) | |
| >3.7 | 0(0.00) | 2(0.76) | |
| 尿素/mmol·L-1 | |||
| <1.7 | 0(0.00) | 4(1.52) | 0.553 |
| 1.7~8.3 | 84(74.34) | 197(74.62) | |
| >8.3 | 29(25.66) | 63(23.86) | |
| 肌酐/μmol·L-1 | |||
| <59 | 24(21.24) | 75(28.41) | 0.345 |
| 59~104 | 70(61.95) | 147(55.68) | |
| >104 | 19(16.81) | 42(15.91) | |
| 碱性磷酸酶/IU·L-1 | |||
| 34~114 | 77(68.14) | 192(72.73) | 0.367 |
| >114 | 36(31.86) | 72(27.27) | |
| 白蛋白/g·L-1 | |||
| <38 | 90(79.65) | 203(76.89) | 0.779 |
| 38~51 | 23(20.35) | 60(22.73) | |
| >51 | 0(0.00) | 1(0.38) | |
| 前白蛋白/g·L-1 | |||
| <0.17 | 87(76.99) | 209(79.17) | 0.638 |
| 0.17~0.42 | 26(23.01) | 55(20.83) | |
| 胆碱酯酶/U·L-1 | |||
| <5 000 | 49(43.36) | 114(43.18) | 0.974 |
| 5 000~12 000 | 64(56.64) | 150(56.82) | |
| 葡萄糖/mmol·L-1 | |||
| <3.9 | 1(0.88) | 6(2.27) | 0.729 |
| 3.9~6.1 | 47(41.59) | 114(43.18) | |
| >6.1 | 65(57.52) | 144(54.55) | |
| 变量 | 验证集(n=113) | 训练集(n=264) | P |
| 肺气肿 | 46(40.71) | 100(37.88) | 0.605 |
| 慢支炎 | 45(39.82) | 105(39.77) | 0.993 |
| 肺结核 | 3(2.65) | 18(6.82) | 0.106 |
| 右肺上叶 | 58(51.33) | 129(48.86) | 0.661 |
| 右肺中叶 | 57(50.44) | 122(46.21) | 0.451 |
| 右肺下叶 | 66(58.41) | 160(60.61) | 0.690 |
| 左肺上叶 | 64(56.64) | 143(54.17) | 0.659 |
| 左肺下叶 | 68(60.18) | 150(56.82) | 0.545 |
| 支气管扩张 | 15(13.27) | 47(17.80) | 0.277 |
| 支气管壁增厚 | 42(37.17) | 80(30.30) | 0.200 |
| 支气管黏液栓 | 9(7.96) | 12(4.55) | 0.185 |
| 小结节 | 103(91.15) | 236(89.39) | 0.604 |
| 大结节 | 54(47.79) | 126(47.73) | 0.991 |
| 实性结节 | 101(89.38) | 235(89.02) | 0.917 |
| 亚实性结节 | 12(10.62) | 35(13.26) | 0.477 |
| 磨玻璃结节 | 20(17.70) | 47(17.80) | 0.981 |
| 肿块 | 15(13.27) | 41(15.53) | 0.573 |
| 空洞 | 12(10.62) | 35(13.26) | 0.477 |
| 空气新月征 | 4(3.54) | 4(1.52) | 0.390 |
| 晕征 | 6(5.31) | 14(5.30) | 0.998 |
| 磨玻璃影 | 57(50.44) | 125(47.35) | 0.582 |
| 实变 | 63(55.75) | 136(51.52) | 0.450 |
| 空气支气管征 | 22(19.47) | 64(24.24) | 0.312 |
| 胸膜牵连 | 65(57.52) | 157(59.47) | 0.694 |
| 胸腔积液 | 48(42.48) | 111(42.05) | 0.938 |
| 纵隔淋巴结肿大 | 38(33.63) | 100(37.88) | 0.433 |
通过对训练集进行一般情况的单因素分析,其结果表明:长期卧床、发热、喘息、咳嗽、黄痰、听诊肺部啰音、低白蛋白血症、贫血、糖尿病、肠道疾病、腹泻、Ⅰ型呼衰、Ⅱ型呼衰、AECOPD、COPD、心功能不全、营养不良、肠内营养、肠外营养、入院后营养不良、胃管、尿管、无创正压通气、面罩或鼻氧管吸氧、入院后输血、入院前有广谱抗生素抗感染史、住院时长、入院后使用抗生素时长为其影响因素,差异有统计学意义(P<0.05),见表 4。检验指标单因素分析提示:血红蛋白(HGB)、血小板计数(PLT)、中性粒细胞数、淋巴细胞数、中性粒细胞百分比、淋巴细胞百分比、肌酐、前白蛋白、胆碱酯酶、葡萄糖对IPFI有一定影响,存在统计学差异(P<0.05), 见表 5。
| 变量 | 非真菌感染组(n=133) | 真菌感染组(n=131) | B | P | OR | 95%CI | |
| 下限 | 上限 | ||||||
| 性别 | |||||||
| 女 | 48(36.09) | 48(36.64) | 0.024 | 0.926 | 1.024 | 0.620 | 1.691 |
| 男 | 85(63.91) | 83(63.36) | |||||
| 长期卧床 | 1(0.75) | 16(12.21) | 2.910 | 0.005 | 18.365 | 2.398 | 140.633 |
| 发热 | 43(32.33) | 77(58.78) | 1.093 | <0.001 | 2.984 | 1.805 | 4.936 |
| 低白蛋白血症 | 75(56.39) | 117(89.31) | 1.866 | <0.001 | 6.463 | 3.368 | 12.401 |
| 贫血 | 39(29.32) | 88(67.18) | 1.596 | <0.001 | 4.933 | 2.927 | 8.312 |
| 糖尿病 | 18(13.53) | 41(31.30) | 1.068 | 0.001 | 2.910 | 1.567 | 5.405 |
| 肠道疾病 | 1(0.75) | 18(13.74) | 3.046 | 0.003 | 21.027 | 2.764 | 159.982 |
| 腹泻 | 3(2.26) | 17(12.98) | 1.866 | 0.004 | 6.462 | 1.846 | 22.620 |
| Ⅰ型呼衰 | 15(11.28) | 55(41.98) | 1.739 | <0.001 | 5.693 | 3.003 | 10.792 |
| Ⅱ型呼衰 | 4(3.01) | 21(16.03) | 1.818 | 0.001 | 6.157 | 2.051 | 18.479 |
| AECOPD | 8(6.02) | 50(38.17) | 2.266 | <0.001 | 9.645 | 4.347 | 21.401 |
| COPD | 22(16.54) | 59(45.04) | 1.419 | <0.001 | 4.134 | 2.332 | 7.329 |
| 心功能不全 | 39(29.32) | 77(58.78) | 1.235 | <0.001 | 3.437 | 2.063 | 5.725 |
| 肠内营养 | 8(6.02) | 67(51.15) | 2.795 | <0.001 | 16.357 | 7.404 | 36.137 |
| 肠外营养 | 24(18.05) | 73(55.73) | 1.743 | <0.001 | 5.716 | 3.264 | 10.012 |
| 入院后营养不良 | 26(19.55) | 107(81.68) | 2.910 | <0.001 | 18.348 | 9.908 | 33.975 |
| 胃管 | 2(1.50) | 18(13.74) | 2.345 | 0.002 | 10.434 | 2.369 | 45.944 |
| 尿管 | 6(4.51) | 28(21.37) | 1.750 | <0.001 | 5.754 | 2.295 | 14.427 |
| 无创正压通气 | 2(1.50) | 28(21.37) | 2.880 | <0.001 | 17.806 | 4.145 | 76.486 |
| 面罩、鼻氧管吸氧 | 68(51.13) | 109(83.21) | 1.555 | <0.001 | 4.736 | 2.677 | 8.378 |
| 院前抗生素史 | 76(57.14) | 115(87.79) | 1.685 | <0.001 | 5.391 | 2.884 | 10.078 |
| 入院后用抗生素时长/d | |||||||
| ≤7 | 34(25.56) | 27(20.61) | <0.001 | ||||
| >7~14 | 78(58.65) | 27(20.61) | -0.830 | 0.015 | 0.436 | 0.223 | 0.851 |
| >14~21 | 18(13.53) | 38(29.01) | 0.978 | 0.011 | 2.658 | 1.250 | 5.655 |
| >21~28 | 2(1.50) | 21(16.03) | 2.582 | 0.001 | 13.222 | 2.846 | 61.422 |
| >28 | 1(0.75) | 18(13.74) | 3.121 | 0.003 | 22.667 | 2.843 | 180.726 |
| 住院时长/d | |||||||
| ≤7 | 28(21.05) | 23(17.56) | <0.001 | ||||
| >7~14 | 83(62.41) | 27(20.61) | -0.926 | 0.010 | 0.396 | 0.196 | 0.799 |
| >14~21 | 17(12.78) | 38(29.01) | 1.001 | 0.014 | 2.721 | 1.229 | 6.023 |
| >21~28 | 2(1.50) | 24(18.32) | 2.682 | 0.001 | 14.609 | 3.118 | 68.440 |
| >28~35 | 2(1.50) | 10(7.63) | 1.806 | 0.028 | 6.087 | 1.210 | 30.613 |
| >35 | 1(0.75) | 9(6.87) | 2.394 | 0.028 | 10.957 | 1.291 | 92.970 |
| 年龄/岁 | |||||||
| <80 | 90(67.67) | 79(60.31) | |||||
| ≥80 | 43(32.33) | 52(39.69) | 0.320 | 0.213 | 1.378 | 0.832 | 2.282 |
| 变量 | 非真菌感染组(n=133) | 真菌感染组(n=131) | B | P | OR | 95%CI | |
| 下限 | 上限 | ||||||
| 肌酐/μmol·L-1 | |||||||
| <59 | 24(18.05) | 51(38.93) | 1.239 | <0.001 | 3.453 | 1.917 | 6.219 |
| 59~104 | 91(68.42) | 56(42.75) | <0.001 | ||||
| >104 | 18(13.53) | 24(18.32) | 0.773 | 0.029 | 2.167 | 1.080 | 4.345 |
| 前白蛋白/g·L-1 | |||||||
| <0.17 | 94(70.68) | 115(87.79) | 1.093 | 0.001 | 2.982 | 1.568 | 5.670 |
| 0.17~0.42 | 39(29.32) | 16(12.21) | |||||
| 胆碱酯酶/U·L-1 | |||||||
| <5 000 | 40(30.08) | 74(56.49) | 1.105 | <0.001 | 3.018 | 1.819 | 5.010 |
| 5 000~12 000 | 93 (69.92) | 57(43.51) | |||||
| 葡萄糖/mmol·L-1 | |||||||
| <3.9 | 3(2.26) | 3(2.29) | 0.318 | 0.704 | 1.375 | 0.266 | 7.109 |
| 3.9~6.1 | 66(49.62) | 48(36.64) | 0.101 | ||||
| >6.1 | 64(48.12) | 80(61.07) | 0.542 | 0.032 | 1.719 | 1.046 | 2.823 |
| 右肺下叶 | 38(28.57) | 122(93.13) | 3.523 | <0.001 | 33.889 | 15.621 | 73.522 |
| 左肺下叶 | 30(22.56) | 120(91.60) | 3.623 | <0.001 | 37.455 | 17.882 | 78.448 |
| 支气管扩张 | 16(12.03) | 31(23.66) | 0.818 | 0.015 | 2.267 | 1.172 | 4.385 |
| 支气管壁增厚 | 57(42.86) | 23(17.56) | -1.259 | <0.001 | 0.284 | 0.161 | 0.500 |
| 磨玻璃结节 | 7(5.26) | 40(30.53) | 2.068 | <0.001 | 7.912 | 3.392 | 18.457 |
| 晕征 | 13(9.77) | 1(0.76) | -2.645 | 0.011 | 0.071 | 0.009 | 0.551 |
| 磨玻璃影 | 29(21.80) | 96(73.28) | 2.286 | <0.001 | 9.836 | 5.591 | 17.306 |
| 空气支气管征 | 20(15.04) | 44(33.59) | 1.050 | 0.001 | 2.857 | 1.571 | 5.196 |
影像特征单因素分析结果提示:右肺上叶、右肺中叶、右肺下叶、左肺上叶、左肺下叶、支气管扩张、支气管壁增厚、亚实性结节、磨玻璃结节、空洞、晕征、磨玻璃影、实变、空气支气管征、胸膜牵连、纵隔淋巴结肿大在IPFI中有一定特征性,差异有统计学意义(P<0.05), 见表 5。
2.2 预测因素的筛查根据单因素分析结果,将可能是IPFI发生的相关因素进行二元Logistic回归多因素分析,其结果显示:贫血(OR:6.41,95CI:1.62~25.43)、糖尿病(OR:6.77,95CI:1.20~38.11)、COPD(OR:12.82,95CI:2.71~60.55)、入院后营养不良(OR:8.78,95CI:2.17~35.55)、胆碱酯酶(OR:7.47,95CI:1.66~33.57)、右肺下叶(OR:11.17,95CI:2.07~60.16)、左肺下叶(OR:16.25,95CI:3.31~79.71)、磨玻璃影(OR:19.22,95CI:4.17~88.48)、空气支气管征(OR:6.44,95CI:1.27~32.68)、支气管扩张(OR:11.58,95CI:1.50~89.25)、支气管壁增厚(OR:0.007,95CI:0.001~0.07),差异均有统计学意义(P<0.05,表 6)。
| 变量 | B | SE | P | OR | 95 CI | |
| 下限 | 上限 | |||||
| 贫血 | 1.858 | 0.703 | 0.008 | 6.411 | 1.616 | 25.435 |
| 糖尿病 | 1.913 | 0.881 | 0.030 | 6.772 | 1.203 | 38.111 |
| COPD | 2.551 | 0.792 | 0.001 | 12.817 | 2.713 | 60.554 |
| 入院后营养不良 | 2.173 | 0.713 | 0.002 | 8.782 | 2.169 | 35.552 |
| 面罩/鼻氧管吸氧 | 1.261 | 0.691 | 0.068 | 3.528 | 0.911 | 13.661 |
| 胆碱酯酶 | 2.012 | 0.766 | 0.009 | 7.475 | 1.665 | 33.568 |
| 支气管扩张 | 2.449 | 1.042 | 0.019 | 11.582 | 1.503 | 89.249 |
| 支气管壁增厚 | -4.917 | 1.154 | <0.001 | 0.007 | 0.001 | 0.070 |
| 磨玻璃影 | 2.956 | 0.779 | <0.001 | 19.217 | 4.174 | 88.477 |
| 空气支气管征 | 1.863 | 0.829 | 0.025 | 6.442 | 1.270 | 32.681 |
| 右肺下叶 | 2.413 | 0.859 | 0.005 | 11.167 | 2.073 | 60.166 |
| 左肺下叶 | 2.788 | 0.811 | 0.001 | 16.248 | 3.312 | 79.710 |
2.3 预测列线图的构建
根据多因素Logistic回归分析后所得的结果,本研究最终将逻辑回归模型中的贫血、糖尿病、COPD、入院后营养不良、面罩/鼻氧管吸氧、胆碱酯酶、右肺下叶、左肺下叶、磨玻璃影、空气支气管征、支气管扩张用于构建列线图(R2=0.830,C-index=0.97,95 CI:0.96~0.99),具体见图 1。
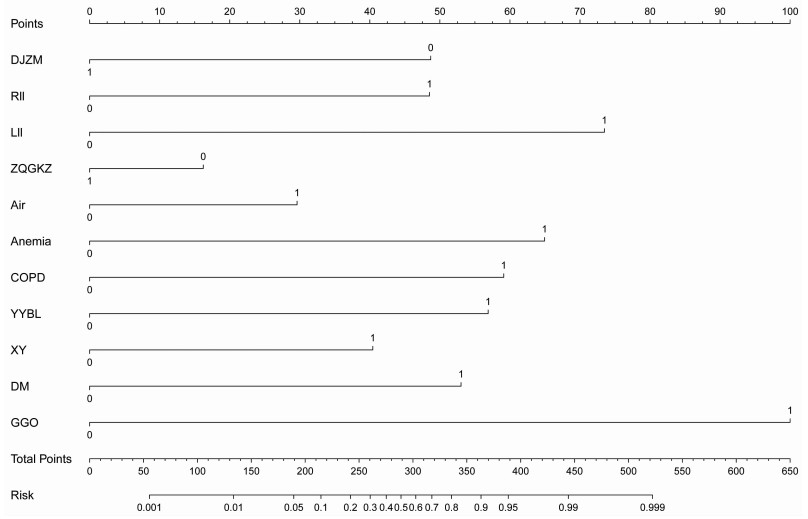
|
| DJZM:胆碱酯酶 1=正常范围,0=小于正常低值;RII=右肺下叶,LII=左肺下叶,ZQGKZ=支气管扩张,Air=空气支气管征,Anemia=贫血,COPD=慢性阻塞性肺炎,YYBL=入院后营养不良,XY=面罩/鼻氧管吸氧,DM=糖尿病,GGO=磨玻璃影 1=有,0=无 图 1 肺部感染患者IPFI风险预测模型列线图 |
2.4 预测模型的评估
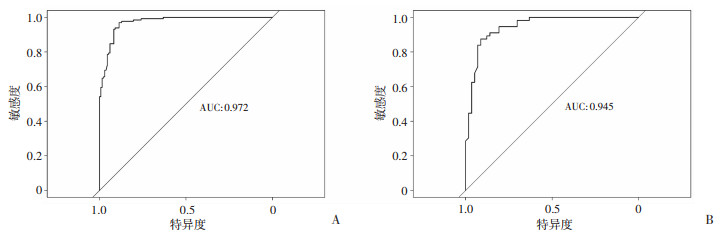
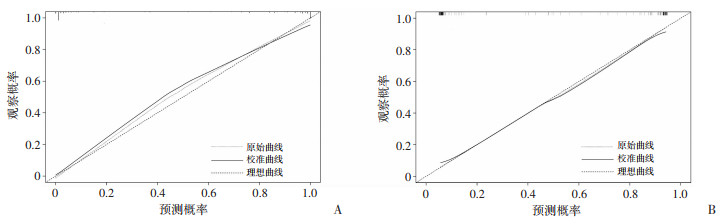
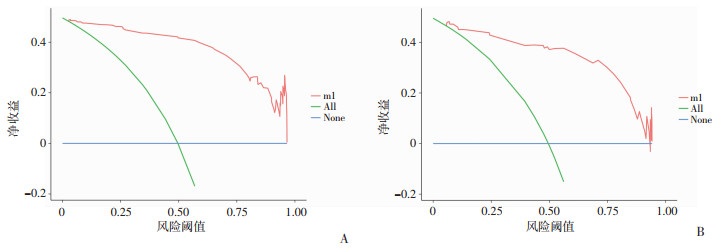
训练集和验证集的AUC分别为0.972(95CI:0.955~0.988)和0.945(95CI:0.905~0.985)(图 2),均表明具有很高的区分度。在训练集内部使用Bootstrap法对数据进行1 000次重复抽样的方法绘制校准曲线,平均绝对误差=0.025,n=264;同法使用验证集对该模型进行验证以绘制校准曲线,平均绝对误差=0.021,n=113,两校准曲线均基本沿45°线分布,接近理想的对角线,显示理论与实际值拟合效果良好(图 3)。训练集和验证模型的DCA曲线(图 4)均显示在阈概率为10%~90%时存在净获益情况,表明该模型具有临床应用价值。
|
| 图 2 预测IPFI模型在训练集(A)和验证集(B)中的ROC曲线 |
|
| 图 3 预测IPFI模型在训练集(A)和验证集(B)中的校准曲线 |
|
| 图 4 预测IPFI模型在训练集(A)和验证集(B)中的决策曲线 |
3 讨论 3.1 构建的IPFI预测模型具有科学性及实用性
在曲霉菌属感染中,痰培养的阳性预测值低(约72%),非血液病患者阳性预测值更低[35]。血清半乳甘露聚糖检测结果假阳性率高,肺部真菌感染的CT征象虽早于血清半乳甘露聚糖阳性[36],但也无特异性。就现状而言,IPFI早期诊断仍具有挑战性但至关重要。
因此,本研究通过二元Logistic回归进行单因素、多因素分析后得出重要相关因子建立临床影像预测模型,且经内部验证的效果佳。最终研究显示:贫血、COPD、糖尿病、入院后营养不良、面罩/鼻氧管吸氧、胆碱酯酶、右肺下叶、左肺下叶、磨玻璃影、空气支气管征、支气管扩张为重要因素。当患者有贫血、COPD、糖尿病、入院后营养不良、面罩/鼻氧管吸氧、胆碱酯酶低于正常值时,考虑IPFI的可能性大。当肺部影像表现为磨玻璃影、空气支气管征时需考虑是否有真菌感染可能。本研究表明当有支气管扩张征象时,考虑非真菌感染的可能性大。当侵袭性肺部真菌感染时,病灶可能大多表现在左肺下叶、右肺下叶,这表明若有病灶表现在该处时,需警惕有无真菌感染。
3.2 肺部感染患者IPFI相关因素分析 3.2.1 临床相关因素分析有关IPFI的危险因素的系统综述[21]表明:多项研究发现手术、全肠外营养、肾脏替代治疗、感染和/或败血症、机械通气、糖尿病与其显著相关。虽然体外循环时间、广谱抗生素的使用、抗真菌药物、输血、中心静脉导管、外周导管、腹泻、急性肾功能衰竭是发生IPFI的重要因素,但其每项仅体现在单个研究中。本研究结果与其有着相似性,但也存在着差异性。例如,本研究中使用抗生素及抗生素使用时长仅在单因素分析中有统计学意义(P<0.05),本研究考虑长期使用抗生素会导致菌群失调,在临床上需重视前期的抗生素使用史及时长。
既往相关研究表明慢性呼吸系统疾病,如COPD,被发现是PFI的重要危险因素[37-39],其与本研究结果相同。WYPYCH等[40]的研究表明肠-肺轴在肠道和呼吸道疾病中具有重要作用,本研究在单因素分析中也显示了肠道疾病、腹泻对肺部真菌感染有一定的影响,这与其有着相似性。我们考虑是肠-肺轴对菌群的影响,慢性炎症导致物理化学性质的改变可能有助于微生物群落中特定物种的生长。但目前缺乏肠道微生物群和肺部微生物群之间转移的直接证据,以及它们在引发肺部或肠道疾病中的具体作用[40]。因此,探索肠-肺轴在IPFI中的作用值得我们深入研究。
人体内的胆碱酯酶(cholinesterase,ChE)分为乙酰胆碱酯酶(acetyl cholinesterase,AChE,也称真胆碱酯酶)和丁酰胆碱酯酶(butyryl cholinesterase,BChE,又称假性胆碱酯酶)。一项评估AChE和BChE在被新型隐球菌感染的大鼠中的作用的研究表明,在实验组中BChE活性在感染后的第10天降低(P<0.05),而AChE活性增加(P<0.05)[41]。关于探讨胶原血管疾病(collagen vascular disease,CVD)患者发生肺囊虫肺炎(pneumocystis pneumonia,PCP)的预后指标的研究表明,血清白蛋白和胆碱酯酶水平较低、气管插管和需要在重症监护室治疗与CVD中患PCP的患者的死亡显著相关。非存活组中血清白蛋白和胆碱酯酶水平低于存活组,差异有统计学意义(P<0.05)。血清白蛋白和胆碱酯酶的降低是CVD患者发生PCP的预测因素[42]。另有研究表明,血清胆碱酯酶水平低(P=0.023)和血清尿素氮水平升高(P=0.024)与真菌性死亡显著相关[23]。我们的结果同样说明该预测指标(低血清胆碱酯酶)有临床意义。我们考虑其可能与炎症联系密切,IPFI与其呈负相关。本研究在进行单因素分析时低白蛋白血症、前白蛋白低也有统计学差异,与前人研究相似。白蛋白代表着营养状况,具有抗氧化、抗炎作用,病情严重时消耗增加,我们考虑两者间更多的是相互作用的关系。
3.2.2 肺部影像特征分析结合既往研究,我们考虑支气管壁增厚、胸膜牵连、实变、纵隔淋巴结肿大征象对于IPFI的意义不大。KLOTH等[43]的研究结果显示IPFI和非肺部真菌感染的影像学表现多有重叠,但尚未明确发现支气管壁增厚与其有明显的相关性,而胸膜牵连多与结核、肿瘤相关,其他相关研究[17, 44-45]均报道与IPFI无明显相关,CHEN等[17]的研究结果表明细菌性肺炎与肺部真菌感染(IFD)中的实变征象无显著差异,相关结果证实无特异性。关于真菌感染后的CT表现的研究注意到有淋巴结肿大(纵隔或肺门淋巴结>1 cm)和胸腔积液征象,但相关研究也并未明确指明其有临床意义[44],本研究的统计结果显示纵隔淋巴结肿大有可能是IPFI有意义的征象,结合前述研究,我们考虑淋巴结肿大也有可能为其他病变或非病变所致。
患者肺部病灶的分布结果表明,病灶多位于双肺下叶。而另一项研究倾向于上叶,这与本研究稍有偏差[44]。但YANG等[45]的研究结果显示其所选人群的CT征象主要为右肺病变,较常见于肺下叶。我们考虑其可能与感染菌群相关,如肺曲霉病多好发于肺上叶。而对于大多数真菌菌种感染,其胸部CT在肺叶分布上尚未见明显特征性。
磨玻璃影、空气支气管征在本研究中有着提示意义。一项关于肺部真菌病和细菌性肺炎的CT表现的对比研究表明磨玻璃影在IFD中比在细菌性肺炎中更常见(60.8 vs 24.5;P<0.05)[17],OBMANN等[44]的研究结果显示GGO是所有霉菌感染的常见CT表现。YANG等[45]发现免疫功能正常的患者更容易出现空气支气管征,这也与JIANG等[46]的研究有着一致性。上述结果与本研究相符,证实了本研究结果有临床意义。
支气管扩张多与反复感染相关,如细菌性肺炎、结核、慢性吸入、免疫缺陷病、肿瘤等疾病导致的支气管征象,相关研究[47-49]多表明支气管征象在细菌、结核等非真菌感染中具有相关性,未见明确研究表明支气管扩张征象在IPFI中具有特征性。本研究也证实了在IPFI中较少出现该征象,当有此征象时需考虑有非真菌感染可能。
3.3 优势及局限性许多关于恶性血液病患者继发肺部真菌感染的临床特征研究,其基本特点都是免疫系统受损,但随着人口老龄化、基础疾病增多、抗生素滥用等问题使IPFI的临床特点不断发生变化,给早期诊断带来了诸多挑战。本研究将临床与影像特征相结合进行广而深的研究,相较于单一特征的多因素分析更全面,本研究所建立的预测模型通过内部验证后显示其可靠性及预测性高,具有临床适用性及临床指导意义。本研究的最终结果均可在入院24 h内得到,可以实现IPFI的早期预测。该模型可以在床旁简单快速地确定高危患者,并能可靠地评估IPFI的风险,及时采取措施可有效降低感染率和病死率。避免了因耗时的真菌培养、有创活检操作及其相关结果的低阳性率带来的诊治延误,有效防止滥用抗真菌药物引起的副反应及耐药性增加。
本研究尚有局限性。T细胞家族是体内免疫功能的基础,尤其是CD4+T细胞在对抗IPFI时具有重要作用。G实验、GM实验作为目前较为重要的检验手段,在临床上有一定指导意义。考虑其在临床上已明确与IPFI有较高相关性,检验费用高且耗时,一些低级别医院尚不能完成,同时缺失值大于20%,故未纳入分析。另外,本研究属于单中心回顾性研究,可能存在就诊患者的选择偏移。尽管内部验证结果显示本研究构建的预测模型具有良好的一致性,但缺乏外部验证,有待进一步评价。根据诊断标准可以明确纳入侵袭性肺部真菌感染,但由于多数缺乏微生物培养结果,无法确定具体种类。对于上述不足之处,我们后续还需进行多中心、前瞻性的研究,扩大样本量,纳入更加准确全面的相关因素。
总而言之,本研究发现贫血、COPD、糖尿病、入院后营养不良、面罩/鼻氧管吸氧、胆碱酯酶、右肺下叶、左肺下叶、磨玻璃影、空气支气管征、支气管扩张是IPFI的相关因素。本研究构建的列线图预测模型具有良好的预测效能,对于IPFI的尽早诊断具有重要意义。
志谢 感谢陆军军医大学第二附属医院林辉教授及陆军军医大学熊鸿燕教授在课题设计以及数据统计等方面的悉心指导| [1] |
MUCHA K, FORONCEWICZ B, ORLOWSKI T, et al. Atypical presentation of invasive pulmonary aspergillosis in a liver transplant recipient[J]. Ann Transplant, 2013, 18: 238-242. |
| [2] |
VON EIFF M, ROOS N, SCHULTEN R, et al. Pulmonary aspergillosis: early diagnosis improves survival[J]. Respiration, 1995, 62(6): 341-347. |
| [3] |
CHAN J F, LAU S K, YUEN K Y, et al. Talaromyces (Penicillium) marneffei infection in non-HIV-infected patients[J]. Emerg Microbes Infect, 2016, 5(3): e19. |
| [4] |
DENNING D W, CHAKRABARTI A. Pulmonary and sinus fungal diseases in non-immunocompromised patients[J]. Lancet Infect Dis, 2017, 17(11): e357-e366. |
| [5] |
LATGE J P, CHAMILOS G. Aspergillus fumigatus and aspergillosis in 2019[J]. Clin Microbiol Rev, 2019, 33(1): e00140-e00118. |
| [6] |
O'HALLORAN J A, POWDERLY W G, SPEC A. Cryptococcosis today: it is not all about HIV infection[J]. Curr Clin Microbiol Rep, 2017, 4(2): 88-95. |
| [7] |
SMITH J A, KAUFFMAN C A. Pulmonary fungal infections[J]. Respirology, 2012, 17(6): 913-926. |
| [8] |
WANG J W, YANG F F, ZHANG C Y, et al. Imaging characteristics of invasive pulmonary fungal infection secondary to hematological diseases and comparison before and after treatment[J]. J Healthc Eng, 2021, 2021: 3736108. |
| [9] |
MA Z Y, WANG X Y, LI C. Strategies of drug delivery for deep fungal infection: a review[J]. Pharm Nanotechnol, 2020, 8(5): 372-390. |
| [10] |
BRETAGNE S, SITBON K, DESNOS-OLLIVIER M, et al. Active surveillance program to increase awareness on invasive fungal diseases: the French RESSIF network (2012 to 2018)[J]. mBio, 2022, 13(3): e0092022. |
| [11] |
LI Z T, LI Y M, CHEN Y J, et al. Trends of pulmonary fungal infections from 2013 to 2019: an AI-based real-world observational study in Guangzhou, China[J]. Emerg Microbes Infect, 2021, 10(1): 450-460. |
| [12] |
BASSETTI M, GIACOBBE D R, VENA A, et al. Incidence and outcome of invasive candidiasis in intensive care units (ICUs) in Europe: results of the EUCANDICU project[J]. Crit Care, 2019, 23(1): 219. |
| [13] |
WANG Q, WANG X W, LI R R. Does population aging reduce environmental pressures from urbanization in 156 countries?[J]. Sci Total Environ, 2022, 848: 157330. |
| [14] |
BROWN M J, MILLER R R, MULLER N L. Acute lung disease in the immunocompromised host: CT and pathologic examination findings[J]. Radiology, 1994, 190(1): 247-254. |
| [15] |
DUARTE R F, SANCHEZ-ORTEGA I, CUESTA I, et al. Serum galactomannan-based early detection of invasive aspergillosis in hematology patients receiving effective antimold prophylaxis[J]. Clin Infect Dis, 2014, 59(12): 1696-1702. |
| [16] |
MARR K A, LAVERDIERE M, GUGEL A, et al. Antifungal therapy decreases sensitivity of the Aspergillus galactomannan enzyme immunoassay[J]. Clin Infect Dis, 2005, 40(12): 1762-1769. |
| [17] |
CHEN W, XIONG X Q, XIE B, et al. Pulmonary invasive fungal disease and bacterial pneumonia: a comparative study with high-resolution CT[J]. Am J Transl Res, 2019, 11(7): 4542-4551. |
| [18] |
GREENE R E, SCHLAMM H T, OESTMANN J W, et al. Imaging findings in acute invasive pulmonary aspergillosis: clinical significance of the halo sign[J]. Clin Infect Dis, 2007, 44(3): 373-379. |
| [19] |
FRANQUET T, MULLER N L, GIMENEZ A, et al. Spectrum of pulmonary aspergillosis: histologic, clinical, and radiologic findings[J]. Radiographics, 2001, 21(4): 825-837. |
| [20] |
BROOK O, GURALNIK L, HARDAK E, et al. Radiological findings of early invasive pulmonary aspergillosis in immune-compromised patients[J]. Hematol Oncol, 2009, 27(2): 102-106. |
| [21] |
MUSKETT H, SHAHIN J, EYRES G, et al. Risk factors for invasive fungal disease in critically ill adult patients: a systematic review[J]. Crit Care, 2011, 15(6): R287. |
| [22] |
AZOULAY E, ROUX A, VINCENT F, et al. A multivariable prediction model for Pneumocystis jirovecii pneumonia in hematology patients with acute respiratory failure[J]. Am J Respir Crit Care Med, 2018, 198(12): 1519-1526. |
| [23] |
IWAMA A, YOSHIDA M, MIWA A, et al. Improved survival from fungaemia in patients with haematological malignancies: analysis of risk factors for death and usefulness of early antifungal therapy[J]. Eur J Haematol, 1993, 51(3): 156-160. |
| [24] |
LI D, LI T J, BAI C S, et al. A predictive nomogram for mortality of cancer patients with invasive candidiasis: a 10-year study in a cancer center of North China[J]. BMC Infect Dis, 2021, 21(1): 76. |
| [25] |
CHEN H, LIU C T, HONG C Q, et al. Nomogram based on nutritional and inflammatory indicators for survival prediction of small cell carcinoma of the esophagus[J]. Nutrition, 2021, 84: 111086. |
| [26] |
LIU H, LI J, GUO J Y, et al. A prediction nomogram for neonatal acute respiratory distress syndrome in late-preterm infants and full-term infants: a retrospective study[J]. eClinicalMedicine, 2022, 50: 101523. |
| [27] |
MU X L, LI Y, HE L, et al. Prognostic nomogram for adenoid cystic carcinoma in different anatomic sites[J]. Head Neck, 2021, 43(1): 48-59. |
| [28] |
ZHANG W, FANG M, DONG D, et al. Development and validation of a CT-based radiomic nomogram for preoperative prediction of early recurrence in advanced gastric cancer[J]. Radiother Oncol, 2020, 145: 13-20. |
| [29] |
中华医学会呼吸病学分会感染学组, 中华结核和呼吸杂志编辑委员会. 肺真菌病诊断和治疗专家共识[J]. 中华结核和呼吸杂志, 2007, 30(11): 821-834. Infection Group of Respiratory Branch of Chinese Medical Association, Editorial Committee of Chinese Journal of Tuberculosis and Respiratory. Expert consensus on diagnosis and treatment of pulmonary mycosis[J]. Chin J Tuberc Respir Dis, 2007, 30(11): 821-834. |
| [30] |
中华内科杂志编辑委员会. 侵袭性肺部真菌感染的诊断标准与治疗原则(草案)[J]. 中华内科杂志, 2006, 45(8): 697-700. Editorial Committee of Chinese Journal of Internal Medicine. Diagnostic criteria and treatment principles of invasive pulmonary fungal infection (draft)[J]. Chin J Intern Med, 2006, 45(8): 697-700. |
| [31] |
WORMANNS D, HAMER O W. Glossary of terms for thoracic imaging: German version of the fleischner society recommendations[J]. Rofo, 2015, 187(8): 638-661. |
| [32] |
HANSELL D M, BANKIER A A, MACMAHON H, et al. Fleischner Society: glossary of terms for thoracic imaging[J]. Radiology, 2008, 246(3): 697-722. |
| [33] |
SHI W Y, ZHOU L X, PENG X Q, et al. HIV-infected patients with opportunistic pulmonary infections misdiagnosed as lung cancers: the clinicoradiologic features and initial application of CT radiomics[J]. J Thorac Dis, 2019, 11(6): 2274-2286. |
| [34] |
PARK S Y. Nomogram: an analogue tool to deliver digital knowledge[J]. J Thorac Cardiovasc Surg, 2018, 155(4): 1793. |
| [35] |
YANG L, SONG J X, WANG Y B, et al. Metagenomic next-generation sequencing for pulmonary fungal infection diagnosis: lung biopsy versus bronchoalveolar lavage fluid[J]. Infect Drug Resist, 2021, 14: 4333-4359. |
| [36] |
WEISSER M, RAUSCH C, DROLL A, et al. Galacto-mannan does not precede major signs on a pulmonary computerized tomographic scan suggestive of invasive aspergillosis in patients with hematological malignancies[J]. Clin Infect Dis, 2005, 41(8): 1143-1149. |
| [37] |
BULPA P, DIVE A, SIBILLE Y. Invasive pulmonary aspergillosis in patients with chronic obstructive pulmonary disease[J]. Eur Respir J, 2007, 30(4): 782-800. |
| [38] |
MAIZ L, NIETO R, CANTON R, et al. Fungi in bronchiectasis: a concise review[J]. Int J Mol Sci, 2018, 19(1): 142. |
| [39] |
SMITH N L, DENNING D W. Underlying conditions in chronic pulmonary aspergillosis including simple aspergilloma[J]. Eur Respir J, 2011, 37(4): 865-872. |
| [40] |
WYPYCH T P, WICKRAMASINGHE L C, MARSLAND B J. The influence of the microbiome on respiratory health[J]. Nat Immunol, 2019, 20(10): 1279-1290. |
| [41] |
DE AZEVEDO M I, FERREIRO L, DA SILVA A S, et al. Cholinesterase of rats experimentally infected by Cryptococcus neoformans: relationship between inflammatory response and pathological findings[J]. Pathol Res Pract, 2015, 211(11): 851-857. |
| [42] |
AOKI Y, IWAMOTO M, KAMATA Y, et al. Prognostic indicators related to death in patients with Pneumocystis pneumonia associated with collagen vascular diseases[J]. Rheumatol Int, 2009, 29(11): 1327-1330. |
| [43] |
KLOTH C, THAISS W M, BECK R, et al. Potential role of CT-textural features for differentiation between viral interstitial pneumonias, Pneumocystis jirovecii pneumonia and diffuse alveolar hemorrhage in early stages of disease: a proof of principle[J]. BMC Med Imaging, 2019, 19(1): 39. |
| [44] |
OBMANN V C, BICKEL F, HOSEK N, et al. Radiological CT patterns and distribution of invasive pulmonary Aspergillus, non-Aspergillus, Cryptococcus and Pneumocystis jirovecii mold infections-A multicenter study[J]. Rofo, 2021, 193(11): 1304-1314. |
| [45] |
YANG D F, YU L H, LUO J H, et al. Characterization of clinical and CT manifestations of pulmonary cryptococcosis with consolidation[J]. Arch Iran Med, 2021, 24(6): 508-511. |
| [46] |
JIANG J, LV Z M, LV F J, et al. Clinical and computed tomography characteristics of solitary pulmonary nodules caused by fungi: a comparative study[J]. Infect Drug Resist, 2022, 15: 6019-6028. |
| [47] |
LEE J H, KIM Y K, KWAG H J, et al. Relationships between high-resolution computed tomography, lung function and bacteriology in stable bronchiectasis[J]. J Korean Med Sci, 2004, 19(1): 62-68. |
| [48] |
RAMAKRISHNAN V R, FERRIL G R, SUH J D, et al. Upper and lower airways associations in patients with chronic rhinosinusitis and bronchiectasis[J]. Int Forum Allergy Rhinol, 2013, 3(11): 921-927. |
| [49] |
WORMANNS D. Radiological imaging of pulmonary tuberculosis[J]. Radiologe, 2012, 52(2): 173-184. |




